1. 서론
피부 노화는 내인성 노화와 자외선(ultraviolet, UV)에 의한 광노화로 구분되며, 특히 UV에 의한 광노화는 피부 주름, 색소 침착, 탄력 저하 등을 유발하는 주요 원인이다. UV 조사는 피부 세포에서 활성산소종(reactive oxygen species, ROS)을 생성하여 산화적 스트레스를 유발한다(Li 등, 2021). 이러한 산화적 스트레스는 미토겐 활성화 단백질 인산화효소(mitogen-activated protein kinases, MAPKs) 경로를 활성화시키고, 이는 활성화 단백질-1(activator protein-1, AP-1) 전사인자를 통해 콜라겐 분해 효소인 기질 금속단백분해효소-1(matrix metalloproteinase-1, MMP-1)의 발현을 증가시킨다(Xue 등, 2022). UV 노출은 또한 프로스타글란딘 E2 (prostaglandin E2, PGE-2) 수준을 빠르게 증가시켜 유전적 변화와 세포 기능 장애를 초래하며, 광노화 과정에서 콜라겐 타입 I(Collagen Type I, COL I)의 감소는 정상 노화보다 더 심하게 나타난다(Xue 등, 2022). 특히 MMP-1은 진피층의 주요 구성 성분인 COL I을 분해하여 피부 탄력 저하와 주름 형성을 초래한다(Lee 등, 2023). 또한 UV는 염증성 사이토카인(cytokine)인 인터루킨(interleukin, IL)-1β, IL-6, 종양괴사인자 알파(tumor necrosis factor-alpha, TNF-α)의 발현을 증가시켜 피부 염증 반응을 유발하고 광노화를 가속화한다(Shin 등, 2021).
자외선에 의한 색소 침착은 멜라닌 생성 과정의 핵심 효소인 티로시나아제(tyrosinase) 활성 증가와 밀접한 관련이 있다. UV 노출은 멜라노사이트(melanocyte)에서 티로시나아제 발현을 증가시켜 L-티로신(L-tyrosine)을 L-3,4-dihydroxyphenylalanine (L-DOPA)로, 다시 도파퀴논(dopaquinone)으로 산화시키는 과정을 촉진하여 과도한 멜라닌 생성을 유도한다(Papaemmanouil 등, 2022). 피부 노화 과정에서 엘라스타아제(elastase)는 피부 결합조직의 엘라스틴(elastin)과 콜라겐(collagen)을 분해하여 피부 탄력 저하를 초래하며, 히알루론산 분해효소(hyaluronidase)는 피부 수분 조절에 핵심적인 역할을 하는 히알루론산(hyaluronic acid, HA)를 분해한다(Papaemmanouil 등, 2022). 이러한 효소들의 조절되지 않은 활성은 주름, 갈색 반점, 과색소침착 등 다양한 피부 질환을 유발한다(Desmiaty 등, 2020).
최근 천연물 유래 항노화 및 미백 소재에 대한 관심이 증가하면서, 다양한 약용식물 추출물의 피부 보호 효과가 연구되고 있다. 특히 항산화 활성이 우수한 폴리페놀(polyphenol) 화합물을 함유한 천연물들이 주목받고 있으며, 이들은 ROS 소거능을 통해 광노화를 억제하고 티로시나아제 활성을 저해하여 미백 효과를 나타낸다(Chaikhong 등, 2022). 천연 폴리페놀은 호메시스(hormesis) 효과를 나타내어 낮은 농도에서는 세포 보호 효과를, 높은 농도에서는 억제 효과를 나타내는 것으로 알려져 있다(Papaemmanouil 등, 2022). 최근 연구에서 Anacardium occidentale와 Garcinia zeylanicum 잎 추출물이 강력한 항산화 활성과 함께 엘라스타아제, 티로시나아제 억제 활성을 나타냈으며(Chaikhong 등, 2022), halophyte 식물 중 Salicornia europaea가 우수한 항엘라스타아제와 항히알루론산 분해효소 활성을 보이는 것으로 보고되었다(Jiratchayamaethasakul 등, 2020).
인삼(Panax ginseng C. A. Meyer)은 오래전부터 한의학에서 사용되어 온 대표적인 약용식물로, 사포닌 계열의 진세노사이드(ginsenoside)를 주요 활성성분으로 함유하고 있다. 인삼의 가공 방법에 따라 백삼, 홍삼, 흑삼 등으로 구분되며, 가공 과정에서 열처리 정도에 따라 진세노사이드 조성과 생리활성이 변화한다(Jin 등, 2015; Shin 등, 2019). 홍삼은 인삼을 증숙과 건조 과정을 거쳐 가공한 것으로, 이 과정에서 Rg3, Rh2, Rk1, Rg5 등의 특이 진세노사이드가 생성되어 백삼보다 향상된 생리활성을 나타낸다(Son 등, 2023). 인삼 가공품은 항산화 활성을 통해 UV로 인한 ROS 생성을 억제하고, MMP 발현을 감소시켜 콜라겐 분해를 억제하며, 염증성 사이토카인 발현을 조절하여 피부 광노화를 억제하는 것으로 알려져 있다(Li 등, 2021).
흑삼(Korean black ginseng, KBG)은 인삼을 9회의 증숙-건조 과정(nine steaming and nine drying)을 반복하여 제조한 것으로, 홍삼보다 더 긴 열처리를 거친다(Sun 등, 2011; Zhang 등, 2024). 이러한 반복적인 증숙 과정에서 탈당화(deglycosylation) 반응이 일어나 백삼이나 홍삼에는 없는 Rg3, Rk1, Rg5, Rh4와 같은 희귀 진세노사이드(rare ginsenoside)가 풍부하게 생성되며(Chen 등, 2020; Jin 등, 2015), Maillard 반응을 통한 갈변 산물도 생성되어 더 강력한 약리학적 효과를 나타낸다(Kim 등, 2016; Metwaly 등, 2019). 최근 연구에 따르면 흑삼 추출물은 과산화수소(hydrogen peroxide, H2O2)로 유도된 산화적 스트레스로부터 인간 각질세포를 보호하며(Ahn 등, 2021), 항산화 및 항염증 효과를 통해 세포 손상을 억제하는 것으로 보고되었다(An 등, 2021; Bak 등, 2014). 특히 발효 흑삼은 인간 섬유아세포(human dermal fibroblast)에서 항주름 효과를 나타냈으며(Pham 등, 2017), 흑삼의 주요 성분인 진세노사이드 Rg5와 Rk1은 멜라닌 생성을 억제하여 피부 미백 효과를 나타내는 것으로 확인되었다(Jin 등, 2018). 또한 흑삼 추출물은 UV-B 조사로 인한 염증 반응을 nc886-PKR 경로 조절을 통해 억제하여 광노화로부터 피부를 보호하는 것으로 보고되었다(Kim 등, 2024).
그러나 지금까지의 흑삼 피부 연구는 주로 특정 진세노사이드 성분의 효과나 개별 효소 억제 활성에 집중되어 있으며, 특히 UV-B에 의한 광노화 방어 연구가 대부분이다. UV-A는 진피층 깊숙이 침투하여 광노화를 유발하는 주요 원인임에도 불구하고, UV-A로 유도된 광노화 모델에서 흑삼 추출물의 보호 효과에 대한 연구는 매우 제한적이다. 또한 피부 노화의 주요 타겟 효소인 티로시나아제, 엘라스타아제, 히알루론산 분해효소에 대한 흑삼의 억제 효과를 종합적으로 평가한 연구는 부족하며, 특히 히알루론산 분해효소에 대한 흑삼의 억제 효과는 거의 보고되지 않았다. 더욱이 세포 기반 실험과 직접적인 효소 억제 활성 평가를 결합한 다중 타겟(multi-target) 접근법을 통해 흑삼의 항광노화 효과를 종합적으로 규명한 연구는 매우 드문 실정이다. 따라서 본 연구에서는 9회 증숙-건조 공정으로 제조된 KBG 추출물의 피부 미백 및 항노화 효과를 평가하기 위해 B16F10 마우스 흑색종 세포와 신생아 피부 유래 인간 진피 섬유아세포(human dermal fibroblast-neonatal, HDF-n) 세포를 이용하여 세포 생존율, 항산화 활성, 멜라닌 생성 억제, MMP-1 발현 저해 효과를 조사하였다. 또한 in vitro 효소 활성 평가를 통해 티로시나아제, 엘라스타아제, 히알루론산 분해효소에 대한 직접적인 억제 효과를 확인하여 KBG 추출물의 기능성 화장품 소재로서의 가능성을 평가하고자 하였다.
2. 재료 및 방법
본 연구에 사용된 6년근 인삼은 2019년 9월 경북 영천 지역에서 수확한 것을 구매하여 사용하였다. 시료의 동정은 국립순천대학교 약학과 유수연 교수가 수행하였으며, 증거 표본(voucher specimen)은 국립순천대학교 약학대학 천연물의약품 연구실에 보관되어 있다. 흑삼 추출물은 다음과 같이 제조하였다. 인삼을 증류수로 세척한 후 70% 에탄올(Sigma-Aldrich, St. Louis, MO, USA)로 표면을 소독하고 실온에서 건조시켰다. 소독된 인삼을 증숙기(steamer)를 이용하여 98-100°C에서 3시간 증숙한 후 60°C 건조기(dry oven)에서 수분함량이 14% 이하가 될 때까지 건조하였다. 이러한 증숙-건조 과정을 9회 반복하여 흑삼으로 전환시킨 후 분쇄기(grinder)로 분말화하였다. 건조된 흑삼 분말 100 g에 증류수 1 L를 가하여 80°C water bath에서 3시간 동안 환류 추출하였다. 추출 완료 후 실온으로 냉각시킨 다음, 400 mesh 체를 통과시켜 1차 여과하고 0.45 μm 멤브레인 필터(Whatman, GE Healthcare, Little Chalfont, UK)로 2차 여과하였다. 최종 추출물의 당도는 디지털 굴절계(digital refractometer, PAL-3, ATAGO, Tokyo, Japan)를 사용하여 측정하였으며 1.7 °Brix를 나타냈다. 추출물의 고형분 함량은 105°C에서 항량이 될 때까지 건조기(OF-12, Jeio Tech, Daejun, Korea)에서 건조시켜 측정한 결과 0.44%(w/v)였다. 실험에 사용된 추출물의 농도는 모두 건조 중량을 기준으로 계산하였다.
총폴리페놀 함량은 Folin-Ciocalteu 방법으로 측정하였다. 추출물 50 μL에 Folin-Ciocalteu 시약(Sigma-Aldrich) 500 μL를 첨가하여 5분간 반응시킨 후, 10% sodium carbonate 용액 500 μL를 가하여 실온 암소에서 1시간 방치하였다. 반응액의 흡광도를 마이크로플레이트 리더기(Sunrise, Tecan, Männedorf, Switzerland)로 760 nm에서 측정하였으며, 갈릭산(gallic acid, Sigma-Aldrich)을 표준물질로 사용하여 mg gallic acid equivalent (GAE)/g dry weight로 표시하였다.
마우스 흑색종 세포주인 B16F10은 American Type Culture Collection(ATCC, Manassas, VA, USA)으로부터, 신생아 피부 유래 인간 진피 섬유아세포인 HDF-n은 Modern Tissue Technologies(Seoul, Korea)로부터 분양받아 사용하였다. 두 세포주 모두 10% fetal bovine serum(FBS, Gibco BRL, Grand Island, NY, USA)과 1% penicillin/streptomycin(100 U/mL penicillin, 100 μg/mL streptomycin, Gibco BRL)이 포함된 Dulbecco’s Modified Eagle’s Medium(DMEM, Gibco BRL)을 사용하여 배양하였다. 세포는 5% CO2, 95% air, 37°C 조건의 CO2 배양기(MCO-170AIC, Sanyo, Osaka, Japan)에서 유지하였다. 세포 생존율은 3-(4,5-dimethylthiazol-2-yl)-2,5-diphenyltetrazolium bromide(MTT) assay를 이용하여 평가하였다. 간략히, 96-well plate에 세포를 분주하고 24시간 배양한 후, 다양한 농도의 KBG 추출물을 처리하였다. 24시간 후, phosphate buffered saline(PBS, Sigma-Aldrich)에 용해시킨 MTT 용액(5 mg/mL, Sigma-Aldrich)을 각 well에 50 μL씩 첨가하고 4시간 동안 추가 배양하였다. MTT 함유 배지를 제거한 후, 생성된 formazan 결정을 dimethyl sulfoxide (DMSO, Sigma-Aldrich) 200 μL로 용해시켰다. 흡광도는 마이크로플레이트 리더기(Sunrise, Tecan)를 사용하여 570 nm에서 측정하였으며, 대조군 대비 백분율로 세포 생존율을 계산하였다.
HDF-n 세포를 이용한 광노화 모델 구축을 위해 100 mm 세포배양접시에 1×106 cells/mL 농도로 분주하여 24시간 전배양하였다. UV-A 조사를 위해 배양액을 제거하고 PBS로 2회 세척한 뒤, 최소량의 PBS를 남긴 상태에서 UV-A lamp(Bio-Rad, Hercules, CA, USA)를 사용하여 8 J/cm2의 선량으로 조사하였다. UV 조사 후 즉시 PBS를 제거하고 5% FBS가 포함된 신선한 DMEM으로 교체한 다음, 다양한 농도의 KBG 추출물(0.1-100 μg/mL)을 처리하여 37°C, 5% CO2 조건에서 24시간 배양하였다. 배양 완료 후 세포를 trypsin-ethylenediaminetetraacetic acid (EDTA, Sigma-Aldrich)로 수확하여 차가운 PBS로 2회 원심세척(1,200 rpm, 5분)하였다. 세포 펠렛(pellet)은 lysis buffer를 첨가하여 초음파 세포파쇄기(Sonics & Materials, Newtown, CT, USA)로 파쇄하였으며, 13,400 ×g, 4°C에서 15분간 원심분리하여 상등액을 획득하였다. 단백질 농도는 bicinchoninic acid(BCA) protein assay kit(Thermo Fisher Scientific, Waltham, MA, USA)를 사용하여 정량하였다.
SOD 유사활성은 pyrogallol 자가산화 억제법을 이용하여 평가하였다. 튜브에 세포 상등액 50 μL와 50 mM Tris-hydrochloride (HCl) 완충액(pH 8.5) 500 μL를 혼합한 후, 7.2 mM pyrogallol 50 μL를 첨가하여 실온(25°C)에서 10분간 반응시켰다. 반응 정지를 위해 1 N HCl 50 μL를 가하여 pyrogallol의 산화를 중단시킨 후, 반응액을 96-well plate(Nunc, Roskilde, Denmark)로 옮겨 마이크로플레이트 리더기(Sunrise, Tecan)를 이용하여 420 nm에서 흡광도를 측정하였다. 표준물질로 L-아스코르브산(ascorbic acid, Sigma-Aldrich)를 사용하였으며, SOD 유사활성은 다음 식에 의해 pyrogallol 자가산화 억제 백분율로 계산하였다.
B16F10 마우스 흑색종 세포를 6-well plate(Nunc)에 2×105 cells/well의 밀도로 분주하여 24시간 전배양하였다. 배양액 교체 후 다양한 농도의 KBG 추출물(5-100 μg/mL)을 처리하여 48시간 추가 배양하였다. 세포 수확을 위해 배지를 제거하고 차가운 PBS로 2회 세척한 후, 1%(w/v) Triton X-100이 포함된 100 mM sodium phosphate buffer(pH 6.8) 100 μL를 첨가하였다. −80°C에서 30분간 동결-융해 과정을 거쳐 세포를 용해시킨 후, 4°C, 13,400 ×g에서 30분간 원심분리하여 상등액을 획득하였다. BCA assay로 단백질을 정량한 후, 100 μg 단백질에 상응하는 세포 용해액에 2 mg/mL L-DOPA(Sigma-Aldrich) 용액 80 μL를 첨가하여 37°C에서 60분간 반응시켰다. 생성된 도파크롬의 양은 마이크로플레이트 리더기(Sunrise, Tecan)를 사용하여 490 nm에서 측정하였으며, 대조군 대비 백분율로 티로시나아제 활성을 산출하였다. 양성대조군으로는 코직산(kojic acid, Sigma-Aldrich)를 사용하였다.
B16F10 세포의 멜라닌 생성 억제 효과는 Hosoi 등의 방법(Hosoi 등, 1985)을 수정하여 평가하였다. 세포를 6-well plate에 2×105 cells/well로 분주하고 24시간 배양한 후, 다양한 농도의 KBG 추출물을 함유한 배지로 교체하여 48시간 처리하였다. 배양 종료 후 배지를 제거하고 PBS로 2회 세척한 다음, 1%(w/v) Triton X-100이 포함된 100 mM sodium phosphate buffer(pH 6.8) 100 μL를 첨가하여 −80°C에서 30분간 동결 처리하였다. 세포 용해액을 4°C, 13,400 ×g에서 30분간 원심분리한 후, 상등액은 제거하고 pellet을 회수하였다. 멜라닌 정량을 위해 pellet에 10% DMSO가 함유된 1 N NaOH 용액 200 μL를 가하고 65°C에서 1시간 동안 용해시켰다. 용해된 멜라닌은 마이크로플레이트 리더기(Sunrise, Tecan)를 사용하여 405 nm에서 흡광도를 측정하였으며, 멜라닌 함량은 대조군 대비 백분율로 표시하였다. 양성대조군으로는 코직산(Sigma-Aldrich)를 사용하였다.
HDF-n 세포를 100 mm 배양접시에 1×106 cells/mL 농도로 분주하여 24시간 전배양하였다. UV-A 조사 전 PBS로 세척하여 배지 성분을 제거한 후, 최소량의 PBS 존재 하에서 UV-A 램프(Bio-Rad)를 이용하여 8 J/cm2의 선량으로 조사하였다. UV 조사 직후 다양한 농도의 KBG 추출물을 처리하여 24시간 배양한 후, 배양 상등액을 수집하였다. MMP-1 정량을 위해 ELISA 방법을 사용하였다. 96-well plate(Nunc)에 배양 상등액 200 μL를 분주하고 4°C에서 overnight coating하였다. 플레이트를 PBS-Tween 20(0.05%)으로 3회 세척한 후, 3% bovine serum albumin(BSA)/PBS로 37°C에서 2시간 blocking 하였다. Mouse monoclonal anti-human MMP-1 antibody(BD Pharmingen, San Diego, CA, USA)를 1:3,000으로 희석하여 100 μL씩 첨가하고 37°C에서 2시간 반응시켰다. 세척 후 anti-mouse IgG-alkaline phosphatase conjugate(BD Pharmingen)를 1:3,000으로 희석하여 100 μL 첨가하고 37°C에서 2시간 반응시켰다. 최종 세척 후 p-nitrophenyl phosphate substrate tablets(Sigma-Aldrich)를 diethanolamine buffer에 용해한 기질용액 100 μL를 첨가하여 실온에서 15분간 발색시킨 다음, 1 N HCl 50 μL로 반응을 정지시키고 마이크로플레이트 리더기(Sunrise, Tecan)로 405 nm에서 흡광도를 측정하였다.
티로시나아제의 직접적인 저해 활성은 Yagi 등의 방법(Yagi 등, 1987)을 수정하여 평가하였다. 96-well plate(Nunc)에 0.175 M sodium phosphate buffer(pH 6.8) 50 μL, 10 mM L-DOPA 기질용액 20 μL, 다양한 농도의 KBG 추출물 10 μL를 순차적으로 첨가하였다. Mushroom 티로시나아제(110 U/mL, Sigma-Aldrich) 20 μL를 첨가하여 25°C에서 2분간 반응시킨 후, 생성된 도파크롬을 마이크로플레이트 리더기(Sunrise, Tecan)로 475 nm에서 측정하였다. 양성대조군으로는 코직산(Sigma-Aldrich)를 사용하였다. 티로시나아제 저해율(%)은 다음 식으로 산출하였다.
엘라스타아제 저해 활성은 Cannell 등의 방법(Cannell 등, 1988)을 변형하여 측정하였다. 96-well plate(Nunc)에 다양한 농도의 KBG 추출물 50 μL와 50 mM Tris-HCl buffer(pH 8.6)에 용해한 돼지 췌장 엘라스타아제(porcine pancreatic elastase, PPE, 2.5 U/mL, Sigma-Aldrich) 50 μL를 혼합하여 37°C에서 10분간 전반응시켰다. 기질로 N-succinyl-(Ala)3-p-nitroanilide (0.5 mg/mL, Sigma-Aldrich)를 50 mM Tris-HCl buffer(pH 8.6)에 용해하여 100 μL 첨가한 후, 37°C에서 20분간 반응시켰다. 엘라스타아제에 의해 기질로부터 유리된 p-nitroanilide의 생성량은 마이크로플레이트 리더기(Sunrise, Tecan)를 사용하여 410 nm에서 측정하였다. 양성대조군으로는 우루솔산(ursolic acid, Sigma-Aldrich)를 사용하였다. 엘라스타아제 저해율(%)은 다음 식으로 계산하였다.
히알루론산 분해효소 저해 활성은 잔존하는 히알루론산을 정량하는 탁도법으로 측정하였다. 96-well plate에 20 mM sodium phosphate buffer(pH 7.0, 77 mM NaCl, 0.01% BSA 함유)에 용해한 히알루론산 분해효소(5 U/mL, Sigma-Aldrich) 125 μL와 다양한 농도의 KBG 추출물을 첨가한 후, 동일 buffer로 최종 부피를 250 μL로 조정하였다. 37°C에서 10분간 전반응시킨 후, 300 mM sodium phosphate buffer(pH 5.35)에 용해한 0.03%(w/v) 히알루론산 기질용액 250 μL를 첨가하여 37°C에서 45분간 반응시켰다. 반응 정지를 위해 반응액 125 μL에 산성 알부민 용액(24 mM sodium acetate, 79 mM acetic acid, 0.1% BSA, pH 3.75) 625 μL를 첨가하고 실온에서 10분간 방치하였다. 형성된 히알루론산-알부민 복합체의 탁도를 마이크로플레이트 리더기(Sunrise, Tecan)로 600 nm에서 측정하였다. 양성대조군으로는 올레아놀산(oleanolic acid, Sigma-Aldrich) 50 μg/mL을 사용하였다. 히알루론산 분해효소 저해율(%)은 다음 식으로 계산하였다.
3. 결과 및 고찰
본 연구에서 사용된 KBG 열수 추출물의 총폴리페놀 함량은 5.24±0.8 mg GAE/g dry weight로 나타났다. 이 값은 열수 추출법으로 제조된 흑삼의 문헌값 범위(3-10 mg GAE/g)와 일치하였으며(Choudhry 등, 2019; Ramadhania 등, 2023), 에탄올 추출(13.29 mg GAE/g)보다는 낮았으나 이는 물 추출의 일반적인 특성을 반영한다. 본 연구에 사용된 KBG 추출물은 표준 9회 증숙-건조 공정으로 제조되었으며, 이 공정은 선행 연구들에서 일관된 진세노사이드 프로필을 생성하는 것으로 보고되었다. Jin 등(2015)과 Sun 등(2011)은 동일한 9회 증숙 공정이 희귀 진세노사이드 Rg3, Rg5, Rk1의 높은 함량을 일관되게 생성하며, 주요 진세노사이드 Rb1과 Rg1의 감소를 동반한다고 보고하였다. 본 추출물의 고형분 함량(0.44% w/v)과 당도(1.7 °Brix), 그리고 폴리페놀 함량을 종합할 때, 본 연구에 사용된 KBG 추출물은 표준화된 방법으로 제조되어 재현성을 확보한 것으로 판단된다. 흑삼의 항산화 및 피부 보호 효과는 폴리페놀 화합물과 희귀 진세노사이드의 복합적인 작용에 기인하는 것으로 사료되며, 향후 HPLC 또는 LC-MS를 이용한 상세한 진세노사이드 프로파일링 연구가 추가로 수행될 필요가 있다.
KBG의 피부 보호 효과를 평가하기 위한 적정 농도를 결정하고자 B16F10 마우스 흑색종 세포와 HDF-n 인간 진피 섬유아세포에 대한 MTT assay를 수행하였다(Fig. 1). B16F10 세포의 경우, KBG 0.1-1 mg/mL 농도 범위에서 80% 이상의 세포 생존율을 유지하였으며, 0.8 mg/mL에서 86.9±5.4%의 생존율을 나타냈다. 그러나 농도가 증가함에 따라 세포 생존율이 감소하여 10 mg/mL에서는 51.1±5.36%로 나타났다(Fig. 1A).

HDF-n 세포에서는 B16F10 세포보다 KBG에 대한 감수성이 높게 나타났다. UV를 조사하지 않은 HDF-n 세포의 경우, 0.8 mg/mL에서 82.6±6.06%의 생존율을 보였으나, 1 mg/mL에서는 80.0±5.18%로 감소하였으며, 10 mg/mL에서는 32.8± 5.46%로 급격히 감소하였다(Fig. 1B). UV를 조사한 HDF-n 세포에서도 유사한 농도 의존적 감소 패턴을 보여, KBG의 세포 생존율에 대한 영향이 UV 조사와 무관하게 주로 농도에 의존적임을 확인하였다(Fig. 1C). 이러한 결과를 바탕으로, 세포독성 없이 KBG 추출물의 생리활성을 평가할 수 있는 농도 범위를 설정하였다.
B16F10 세포를 이용한 멜라닌 생성 억제 및 티로시나아제 활성 실험에서는 5-100 μg/mL를, HDF-n 세포를 이용한 항산화 및 MMP-1 억제 실험에서는 0.1-100 μg/mL의 농도를 사용하였다. 또한 in vitro 효소 활성 평가에서는 세포독성과 무관하게 1-100 mg/mL의 넓은 농도 범위를 적용하여 농도 의존적 억제 효과를 확인하고자 하였다.
UV 조사에 의한 피부 손상의 주요 원인은 ROS 생성에 의한 산화적 스트레스이다. 본 연구에서는 HDF-n 세포에 UV-A를 조사하여 광노화 모델을 구축하고, KBG 추출물의 보호 효과를 평가하였다(Fig. 2). 먼저 UV-A 조사량에 따른 HDF-n 세포의 생존율을 확인한 결과, 8 J/cm2에서 97.0±6.36%의 생존율을 유지하여 이 조건을 실험에 사용하였다(Fig. 2A). 이 용량은 인간 피부 섬유아세포 및 각질세포를 이용한 광노화 연구에서 세포 생존율을 유지하면서 산화적 스트레스를 유도하는 표준 조건으로 널리 사용되고 있다(Chaiprasongsuk 등, 2016; Lohakul 등, 2021; Oh 등, 2021). 이 조건에서 UV-A 8 J/cm2 조사 시 SOD-유사활성이 대조군(100.0%) 대비 64.6±0.6%로 유의하게 감소하였다(p<0.001). KBG 추출물 전처리는 UV로 인한 SOD-유사활성 감소를 농도 의존적으로 회복시켰다. 0.1 μg/mL과 0.5 μg/mL에서는 유의한 차이가 없었으나, 1 μg/mL부터 68.4± 1.06%(p<0.05)로 회복되기 시작하여, 5 μg/mL에서 70.5±1.35% (p<0.01), 10 μg/mL에서 72.4±1.85%(p<0.01)로 점진적으로 증가하였다. 특히 50 μg/mL에서 89.5±1.75%(p<0.001), 100 μg/mL에서 93.8±2.65%(p<0.001)로 현저한 보호 효과를 나타냈다. 양성대조군으로 사용한 아스코르브산(1,000 μg/mL)은 77.8± 2.3%의 SOD 유사활성을 나타냈다. 이는 KBG 추출물이 낮은 농도에서도 우수한 항산화 활성을 가짐을 시사한다(Fig. 2B).
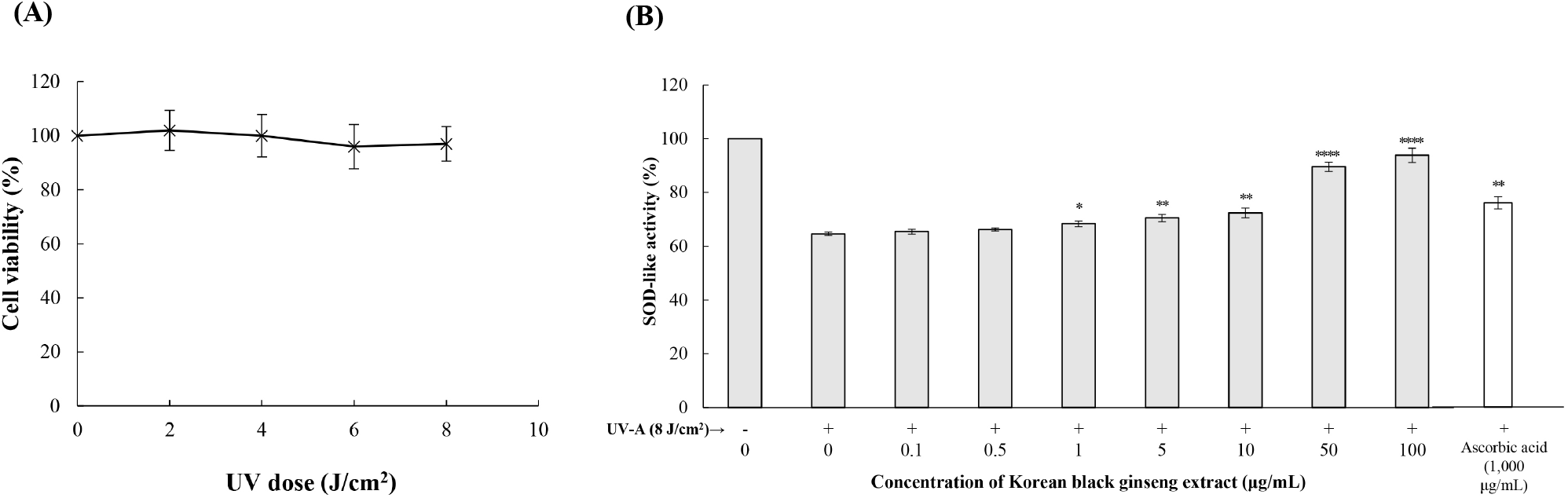
SOD는 세포 내 주요 항산화 효소로서 과산화물 음이온(superoxide anion, O2•−)을 H2O2와 산소 분자로 전환시키는 불균등화 반응을 촉매한다. UV 조사 후 SOD 활성의 급격한 감소는 세포 내 과산화물 음이온의 축적을 초래하며, 이는 연쇄적으로 수산화 라디칼(hydroxyl radical, •OH)과 같은 더 강력한 ROS를 생성하여 DNA 손상, 지질 과산화, 단백질 산화를 유발한다(Altobelli 등, 2020; Yan 등, 2025). 흑삼의 항산화 효과는 여러 연구를 통해 입증되어 왔다. Ramadhania 등은 Aspergillus niger로 발효시킨 흑삼이 H2O2로 유도된 산화적 스트레스로부터 인간 각질세포(HaCaT)를 효과적으로 보호하며, 이는 총폴리페놀 및 플라보노이드 함량 증가와 함께 DPPH 라디칼 소거능이 향상되어 나타난 결과라고 보고하였다(Ramadhania 등, 2023). Ahn 등은 흑삼 추출물이 H2O2로 유도된 산화적 스트레스로부터 인간 각질세포를 효과적으로 보호하며, ROS 생성을 억제하고 항산화 효소 발현을 상향 조절한다고 보고하였다(Ahn 등, 2021). Yun 등은 흑삼 추출물이 우수한 SOD 활성을 나타내며, 2, 2-diphenyl-1-picrylhydrazyl(DPPH) 및 수산화라디칼 소거 활성을 통해 강력한 항산화 효과를 발휘한다고 보고하였다(Yun 등, 2010). Bak 등은 발효 흑삼이 H2O2로 유도된 산화적 스트레스로부터 간세포를 보호하며, SOD 및 카탈라아제(catalase, CAT) 활성을 유의하게 증가시켰다고 보고하였다(Bak 등, 2014). Choudhry 등은 흑삼 추출물이 산화적 스트레스로 인한 간세포 손상을 개선하며, 이는 항산화 효소 시스템의 활성화와 밀접한 관련이 있다고 보고하였다(Choudhry 등, 2019). 이러한 연구 결과들은 본 연구에서 관찰된 SOD 활성 회복과 일맥상통한다.
흑삼의 항산화 효과는 특정 진세노사이드 성분과 밀접한 관련이 있다. Li 등은 흑삼에 풍부한 진세노사이드 Rg5가 산화적 스트레스, 염증, 세포자멸사를 억제한다고 보고하였다(Li 등, 2016). Ge 등은 흑삼에서 추출한 진세노사이드가 항산화 능력을 향상시키고 미토콘드리아 기능을 개선한다고 보고하였다(Ge 등, 2024). 흑삼 추출물의 항산화 효과는 Nrf2(nuclear factor erythroid 2-related factor 2) 신호 전달 경로를 통해서도 발현된다. Xu 등은 흑삼에서 추출한 올리고당이 Keap1/Nrf2 경로를 활성화하여 항산화 효과를 나타낸다고 보고하였다(Xu 등, 2024). Nrf2는 항산화 반응 요소(antioxidant response element, ARE)를 활성화하여 헴 산화효소-1(heme oxygenase-1, HO-1), NAD(P)H:퀴논 산화환원효소 1(NAD(P)H:quinone oxidoreductase 1, NQO1), SOD, CAT 등의 항산화 효소 발현을 유도하는 핵심 전사인자이다. Kim 등은 흑삼의 열수 추출물이 피부 조직 내 항산화 유전자 발현을 증가시켜 상처 치유를 촉진한다고 보고하였다(Kim 등, 2022).
본 연구에서 흑삼 추출물이 나타낸 농도 의존적 SOD 활성 회복은 선행연구에서 보고된 희귀 진세노사이드와 Maillard 반응 산물의 복합적 작용과 관련이 있을 가능성이 있다. 특히 50-100 μg/mL 농도에서 나타난 우수한 효과는 아스코르브산보다 10배 낮은 농도에서도 충분한 항산화 활성을 나타낼 수 있음을 보여주며, 이는 흑삼 추출물이 UV로 인한 산화적 스트레스에 대한 보호 효과를 가짐을 시사한다.
UV 조사는 피부 세포에서 MMP-1 발현을 급격히 증가시켜 콜라겐 분해를 촉진하는 주요 광노화 기전 중 하나이다(Oh 등, 2020b). 본 연구에서는 HDF-n 세포에 UV-A(8 J/cm2)를 조사한 후 시간 경과에 따른 MMP-1 발현 변화를 확인하고, KBG 추출물의 억제 효과를 평가하였다(Fig. 3). UV-A 조사 후 MMP-1 발현은 시간 의존적으로 증가하여 180분에 대조군 대비 2.95±0.15배 증가하였다(Fig. 3A). 특히 60분부터 급격한 증가가 관찰되어(1.80±0.08배) 이 시점을 KBG 추출물의 효과 평가 시점으로 설정하였다. KBG 추출물 전처리는 UV로 유도된 MMP-1 발현을 농도 의존적으로 억제하였다. 5 μg/mL에서 처음으로 유의한 억제 효과가 나타났으며(1.65±0.05배, p<0.05), 10 μg/mL에서는 더욱 현저한 억제 효과를 보였다(1.57±0.09배, p<0.01). 흥미롭게도 50 μg/mL과 100 μg/mL에서는 억제 효과가 다소 감소하는 경향을 보였으나, 여전히 UV 단독 처리군(1.80±0.08배)에 비해서는 낮은 MMP-1 발현을 유지하였다(Fig. 3B).
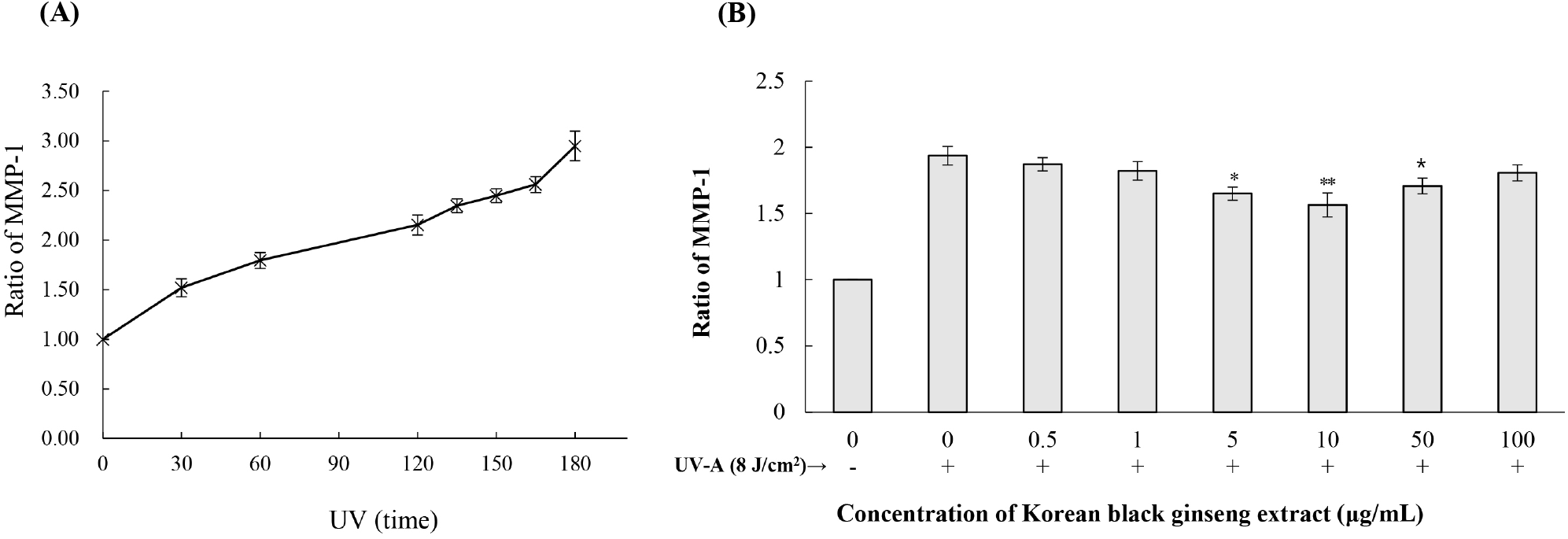
MMP-1은 피부 진피층의 주요 구조 단백질인 제1형 및 제3형 콜라겐을 특이적으로 분해하는 콜라겐 분해효소로, 그 발현 증가는 피부 탄력 저하와 주름 형성의 직접적인 원인이 된다(Shin 등, 2021). UV-A 조사에 의한 MMP-1 발현 증가 메커니즘은 여러 연구를 통해 보고되었다. UV-A는 세포 내 ROS 생성을 유도하고, 이는 MAPK 신호전달 경로의 활성화로 이어진다(Chaiprasongsuk 등, 2017). MAPK 경로는 extracellular signal-regulated kinase(ERK), c-Jun N-terminal kinase(JNK), p38의 세 가지 주요 경로로 구성되며, UV-A 조사는 이들의 인산화를 유도한다(Oh 등, 2020a). 활성화된 MAPK는 AP-1 전사인자를 구성하는 c-Fos와 c-Jun을 인산화한다. 인산화된 c-Fos와 c-Jun은 heterodimer를 형성하여 핵으로 이동하고, MMP-1 유전자의 프로모터 영역에 결합함으로써 전사를 촉진한다(Chaiprasongsuk 등, 2017; Silvers과 Bowden, 2002). HaCaT 세포와 마우스 피부 조직에서 UV-A 조사는 ERK, JNK, p38의 인산화 및 c-Jun, c-Fos의 인산화를 유도하며, 이는 MMP-1 발현 증가와 연관된다(Chaiprasongsuk 등, 2017). 또한 HDF 세포와 HaCaT 세포에서 UV-A는 MAPK 인산화를 통해 AP-1을 활성화시키고 MMP-1 발현을 증가시킨다(Oh 등, 2020a; Xu 등, 2014). 이러한 선행연구 결과들을 고려할 때, 본 연구에서 관찰된 UV-A 조사 후 MMP-1의 시간 의존적 증가는 ROS-MAPK-AP-1 신호전달 경로와 관련이 있을 것으로 추정된다. 향후 Western blot을 통한 ERK, JNK, p38의 인산화 분석 및 AP-1 reporter assay를 통해 이러한 신호전달 경로의 조절을 직접 확인할 필요가 있다.
본 연구에서 관찰된 KBG 추출물의 MMP-1 억제 효과는 흑삼 및 발효 흑삼에 관한 여러 선행 연구 결과와 일치한다. 발효 흑삼(fermented black ginseng, FBG)은 인간 섬유아세포(HS68)에서 MMP-1 발현을 18.41±4.95%에서 27.41±3.96%로 감소시키고 COL I 발현을 117.61±1.51%에서 129.95±4.47%로 증가시키는 것으로 보고되었다(Pham 등, 2017). 또한 발효 흑삼 추출물(FBG extract, FBGE)은 UV-B로 조사된 인간 각질형성세포에서 protein kinase R(PKR)-MAPK 경로를 억제하여 MMP-1과 MMP-9 발현을 감소시킨다(Kim 등, 2024). 이들 결과는 흑삼 추출물의 MMP-1 억제 효과가 MAPK 신호전달 경로 조절과 관련될 가능성을 시사한다.
선행연구에 따르면, 흑삼의 MMP 억제 효과는 진세노사이드 조성과 관련이 있는 것으로 보고되었다. 흑삼은 백삼을 9회 반복 증숙 과정을 거쳐 제조되며, 이 열처리 과정에서 주요 진세노사이드인 Rb1, Rc, Rb2가 Rg3, Rg5, Rk1과 같은 저극성 진세노사이드로 전환된다(Kim 등, 2024; Pham 등, 2017). 이러한 저극성 진세노사이드는 MAPK/AP-1 신호전달 경로를 조절하는 것으로 보고되었다. 진세노사이드 Rg3, Rg5, Rk1을 함유한 복합물은 인간 유방 상피세포에서 JNK 인산화와 AP-1 DNA 결합 활성을 억제하여 COX-2 발현을 감소시킨다(Park 등, 2007). 진세노사이드 Rg5는 LPS로 자극된 미세아교세포에서 MAPK(ERK, JNK, p38)의 인산화와 핵인자 카파 B(nuclear factor kappa B, NF-κB) 및 AP-1 DNA 결합 활성을 억제하여 항염증 효과를 나타낸다(Lee 등, 2013). 피부세포를 대상으로 한 연구에서도 진세노사이드의 MMP 억제 효과가 보고되었다. 진세노사이드 Rg3는 UV-B로 조사된 HaCaT 세포에서 MMP-1과 MMP-9 발현을 억제하며(Lim 등, 2014), Rg3(29.35 mg/g)와 Rk1(35.16 mg/g)이 풍부한 가공 인삼잎은 UV-B로 조사된 무모 생쥐에서 MMP-2와 MMP-9 발현을 억제하고 IL-6와 cyclooxygenase-2(COX-2) 수준을 감소시킨다(Son 등, 2023). 이러한 선행연구 결과들을 종합하면, 본 연구에서 관찰된 KBG 추출물의 MMP-1 억제 효과는 진세노사이드가 MAPK/AP-1 신호전달 경로를 조절함으로써 매개될 것으로 추정된다. 이러한 기전을 명확히 규명하기 위해서는 Western blot을 통한 MAPK(ERK, JNK, p38) 인산화 분석, c-Fos 및 c-Jun 발현 분석, 그리고 MMP-1 promoter activity assay 등의 후속 연구가 필요하다.
본 연구에서 주목할 점은 KBG 추출물이 저농도(5-10 μg/mL)에서 최적의 MMP-1 억제 효과를 보였으며, 고농도에서는 오히려 효과가 감소하는 경향을 보였다는 것이다. 이러한 농도 의존적 패턴은 천연물의 호메시스 효과로 설명할 수 있다. 호메시스는 저농도 자극과 고농도 억제로 특징지어지는 이상성 용량-반응 관계로, 저농도 자극의 크기는 대조군의 130-160% 범위이며, 저농도 자극의 용량 폭은 일반적으로 독성/약리학적 역치로부터 50배 미만이다(Calabrese, 2020). 흑삼 및 인삼 추출물에서 이러한 호메시스 현상은 여러 연구를 통해 확인되었다. 흑삼의 주요 진세노사이드인 Rg5는 생리학적 농도 범위(10−6 M에서 10−18 M)에서 약 300개의 유전자 발현을 조절하며 신경세포에 완만한 보호 효과를 나타내지만, 독성 농도(10−4 M)에서는 차별적으로 발현되는 표적 유전자의 수가 1,670개 이상으로 극적으로 증가하며 세포에 독성을 나타낸다(Panossian 등, 2021). 이러한 호메시스 효과의 생물학적 메커니즘은 식물 유래 폴리페놀의 이중 특성과 관련이 있다. 폴리페놀은 저농도에서 항산화제로 작용하지만 고농도에서는 산화촉진제(pro-oxidant)로 전환될 수 있으며, 이는 금속 환원 전위, 킬레이트 거동, 용해도 특성과 같은 다양한 요인에 의해 조절된다(Bacchetti 등, 2020). 저농도에서는 경미한 산화적 스트레스를 유도하여 세포의 적응 반응과 항산화 방어 시스템을 활성화시키지만, 고농도에서는 과도한 활성산소종 생성을 통해 미토콘드리아 기능 장애와 세포사멸을 유발할 수 있다(Bacchetti 등, 2020). 본 연구에서 관찰된 KBG 추출물의 농도 의존적 이상성 반응은 이러한 호메시스 원리와 일치한다. 본 연구의 세포 생존율 데이터(Fig. 1C)에서도 고농도 KBG 처리 시 세포 생존율이 농도 의존적으로 감소하여(1 mg/mL에서 80.0±5.18%, 10 mg/mL에서 32.8± 5.46%), 고농도에서의 MMP-1 억제 효과 감소가 세포독성과 관련이 있음을 통계적으로 뒷받침한다. 따라서 KBG 추출물의 최적 효과를 얻기 위해서는 호메시스 용량 범위 내에서의 적정 농도 설정이 중요하다.
결론적으로, 본 연구는 KBG 추출물이 UV-A로 유도된 MMP-1 발현을 효과적으로 억제함을 확인하였다. 선행연구 결과들을 고려할 때, 이러한 효과는 흑삼에 함유된 진세노사이드가 MAPK/AP-1 신호전달 경로를 조절함으로써 매개될 가능성이 있으며, 적절한 농도에서 최적의 효과를 나타내는 특성을 보인다.
피부 색소 침착은 광노화의 주요 증상 중 하나로, 멜라닌 생성 조절은 피부 미백과 광노화 억제에 중요한 역할을 한다. 본 연구에서는 B16F10 마우스 흑색종 세포를 이용한 세포 수준의 평가와 무세포 효소 활성 평가를 통해 KBG 추출물의 멜라닌 생성 억제 효과와 티로시나아제 억제 메커니즘을 종합적으로 분석하였다(Fig. 4와 5). B16F10 세포에서 KBG 추출물은 농도 의존적으로 티로시나아제 활성을 억제하였다. 5 μg/mL에서는 유의한 효과가 나타나지 않았으나, 10 μg/mL에서 5.9±1.7%의 억제율을 보이기 시작하여(p<0.05), 50 μg/mL에서 25.0±1.8% (p<0.01), 100 μg/mL에서 40.0±3.35%(p<0.001)의 최대 억제율을 나타냈다. 양성대조군인 코직산(200 μM)은 29.5±1.2%의 억제율을 나타냈다. 멜라닌 함량 측정 결과에서도 유사한 경향이 관찰되었다. 10 μg/mL에서는 대조군 대비 96.1±1.8%의 멜라닌 함량을 보여 유의한 차이가 없었으나, 50 μg/mL에서 82.9±1.1%(p<0.01), 100 μg/mL에서 66.6±4.75%(p<0.001)로 농도 의존적으로 멜라닌 생성이 억제되었다(Fig. 4B). 양성대조군인 코직산(200 μM)은 멜라닌 함량을 28.7±1.5%로 감소시키는 미백 효과를 나타냈다. 무세포 시스템에서 KBG 추출물의 티로시나아제에 대한 직접적인 억제 효과를 확인한 결과, 1 mg/mL부터 100 mg/mL까지 농도 의존적으로 티로시나아제 활성을 억제하였다. 특히 4 mg/mL부터 통계적으로 유의한 억제 효과가 관찰되었으며(2.1±0.3%, p<0.05), 억제율은 농도 증가에 따라 점진적으로 상승하여 100 mg/mL에서 20.3±2.4% (p<0.001)의 최대 억제율을 나타냈다(Fig. 5). 양성대조군인 코직산(10 μM)은 23.2±2.2%의 억제율을 나타냈다. 세포 실험과 무세포 실험 결과를 비교하면 흥미로운 차이가 관찰된다. 세포 내에서는 100 μg/mL에서 40%의 티로시나아제 활성 억제율과 33.4%의 멜라닌 생성 감소율을 보인 반면, 무세포 시스템에서는 100 mg/mL에서 20.3%의 억제율을 나타냈다. 이러한 차이는 세포 내외의 실험 조건 차이, 세포막 투과성, 또는 세포 내 대사 과정의 영향일 가능성이 있다.
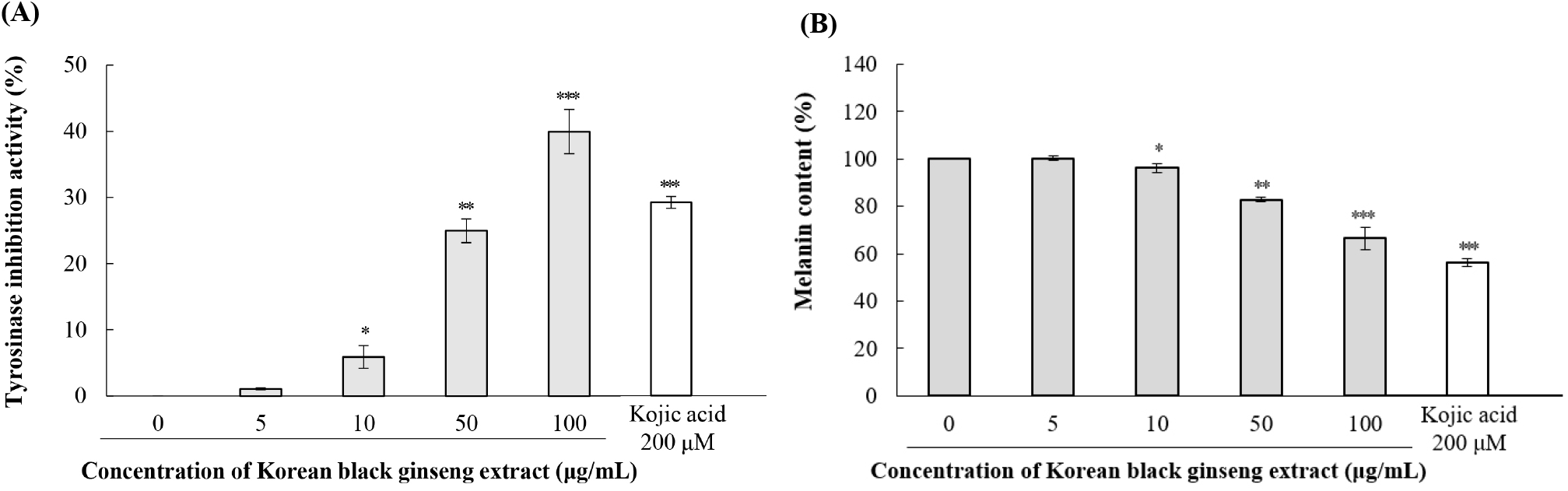
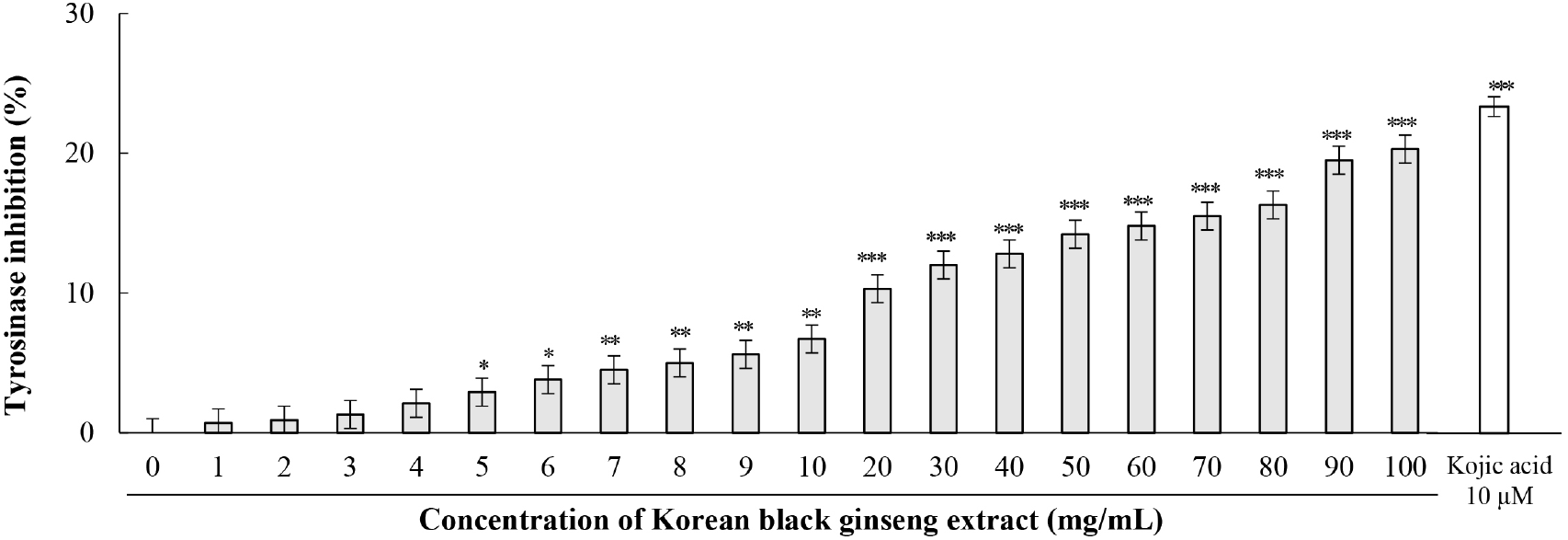
티로시나아제는 멜라닌 생합성의 속도결정단계를 촉매하는 핵심 효소로, 활성 부위에 두 개의 구리 이온(CuA와 CuB)을 함유하는 copper-containing oxidase이다(Jeong 등, 2013; Lee 등, 2015). 티로시나아제는 L-티로신을 L-DOPA로, L-DOPA를 도파퀴논으로 산화시키는 반응을 매개한다(Jin 등, 2014; Liu 등, 2019). L-티로신은 주로 CuA 부위에 결합하고, L-DOPA는 CuA와 CuB 모두에 결합하는 것으로 보고되었다(Lee 등, 2015). 티로시나아제 억제제는 이 효소의 활성 부위에 있는 구리 이온과 킬레이트 결합을 형성하거나, 기질과 경쟁적으로 결합하여 효소 활성을 저해한다(Kabadayı 등, 2024). 티로시나아제 외에도 tyrosinase-related protein(TRP)-1과 TRP-2는 멜라닌 생성 과정에서 중요한 역할을 한다. TRP-1은 5,6-dihydroxyindole-2-carboxylic acid의 산화를 촉매하며, TRP-2는 도파크롬을 5,6-dihydroxyindole-2-carboxylic acid로 전환시킨다(Liu 등, 2019).
흑삼의 티로시나아제 억제 활성은 주로 진세노사이드 성분과 관련이 있는 것으로 보고되었다. 발효흑삼은 B16F10 세포에서 100 μg/mL 농도에서 티로시나아제와 멜라닌 생성을 억제하고, microphthalmia-associated transcription factor(MITF), 티로시나아제, TRP-1의 mRNA 발현을 유의하게 감소시켰다(Ramadhania 등, 2023). 진세노사이드 Rg5와 Rk1은 흑삼의 주요 피부 미백 성분으로 확인되었으며(Jin 등, 2018), 진세노사이드 Rg3는 UV-B로 조사된 인간 각질형성세포에서 멜라닌 생성을 억제하였다(Lim 등, 2014). 또한 진세노사이드 Rg3는 정상 인간 표피 멜라닌세포와 B16F10 세포에서 농도 의존적으로 멜라닌 합성을 억제하였으며, 세포 내 티로시나아제 활성 및 MITF, 티로시나아제, TRP-1의 발현을 감소시켰다(Lee 등, 2015). Protopanaxatriol(PPT)은 α-melanocyte-stimulating hormone (α-MSH)으로 처리된 B16 melanoma 세포에서 농도 의존적으로 세포 내외 멜라닌 함량을 유의하게 감소시켰다(Lee 등, 2019). 이러한 연구 결과들을 고려할 때, 본 연구에서 관찰된 KBG 추출물의 티로시나아제 억제 및 멜라닌 생성 억제 효과는 흑삼에 함유된 진세노사이드가 관여할 가능성이 있다.
본 연구에서 관찰된 KBG 추출물의 멜라닌 생성 억제 효과는 다양한 천연물 유래 미백 소재와 비교할 만한 수준이다. 알부틴(arbutin)과 코직산(kojic acid)은 상업적으로 널리 사용되는 티로시나아제 억제제로(Ho 등, 2023; Zhang 등, 2022), 본 연구의 KBG 추출물도 이들과 유사한 수준의 억제 효과를 나타냈다. 멜라닌 생성은 MITF에 의해 조절되며(Lee 등, 2019; Lin 등, 2014), MITF는 티로시나아제, TRP-1, TRP-2의 전사를 조절하는 핵심 전사인자이다. MITF는 cyclic adenosine monophosphate(cAMP)/protein kinase A(PKA) 신호전달 경로에 의해 활성화되며, cAMP response element-binding protein (CREB)의 인산화를 통해 MITF 발현을 증가시킨다(Jeong 등, 2013; Lin 등, 2014). 따라서 KBG 추출물의 멜라닌 생성 억제는 이러한 신호전달 경로의 조절과 관련이 있을 것으로 추정된다. 이를 검증하기 위해서는 Western blot을 통한 MITF 및 p-CREB 분석, qPCR을 통한 MITF, 티로시나아제, TRP-1, TRP-2 mRNA 발현 분석 등의 추가 연구가 필요하다.
본 연구에서 주목할 점은 KBG 추출물이 세포 내에서 무세포 시스템보다 더 강한 티로시나아제 억제 효과를 나타냈다는 것이다. 이러한 차이는 세포막 투과, 세포 내 대사 과정, 또는 세포 내 신호전달 경로의 조절에 기인할 가능성이 있다. 또한 본 연구에서 KBG 추출물은 100 μg/mL까지 B16F10 세포의 생존율에 영향을 미치지 않았으며(Fig. 1), 이는 화장품 소재로서의 안전성을 시사한다.
결론적으로, 본 연구는 KBG 추출물이 티로시나아제 활성 억제와 멜라닌 생성 억제를 통해 피부 미백 효과를 나타냄을 확인하였다. 선행연구 결과들을 고려할 때, 이러한 효과는 흑삼에 함유된 진세노사이드가 티로시나아제 효소 활성 및 멜라닌 생성 관련 신호전달 경로를 조절함으로써 매개될 것으로 추정된다. 정확한 작용 기전의 규명을 위해서는 관련 신호전달 경로에 대한 추가적인 분자 수준의 연구가 요구된다.
피부 탄력 저하는 광노화의 주요 특징 중 하나로, 엘라스틴 섬유의 분해가 주요 원인이다(Desmiaty 등, 2022). 엘라스타아제는 피부 진피층의 엘라스틴을 분해하는 효소로, 그 활성 증가는 피부 탄력 저하와 주름 형성에 직접적으로 기여한다(Papaemmanouil 등, 2022). 본 연구에서는 KBG 추출물의 돼지 췌장 엘라스타아제에 대한 억제 효과를 평가하였다(Fig. 6). KBG 추출물은 농도 의존적으로 엘라스타아제 활성을 억제하였다. 1-3 mg/mL의 저농도에서는 유의한 억제 효과가 나타나지 않았으나, 4 mg/mL부터 통계적으로 유의한 억제 효과가 관찰되기 시작하였다(3.3±0.5%, p<0.05). 억제율은 농도 증가에 따라 점진적으로 상승하여 10 mg/mL에서 27.4±1.2%(p<0.001), 100 mg/mL에서 32.8±1.5%(p<0.001)의 최대 억제율을 나타냈다. 흥미롭게도 엘라스타아제 억제 활성은 10 mg/mL에서 급격히 증가하여 27.4%에 도달한 후, 그 이상의 농도에서는 완만한 증가를 보였다. 이는 10 mg/mL 농도에서 이미 상당한 수준의 엘라스타아제 억제가 달성되었음을 시사한다. 양성 대조군으로 사용된 우르솔산(ursolic acid, 200 μg/mL)은 23.0±1.4%의 억제율을 보였는데, KBG 추출물 7 mg/mL의 억제율(22.9%)과 유사한 수준이었다.

엘라스틴은 피부의 탄력과 복원력을 유지하는 핵심 단백질로, 독특한 탄성 반동(elastic recoil) 특성을 가진다(Tohgasaki 등, 2021). 엘라스타아제는 이러한 엘라스틴 섬유를 분해하는 주요 효소이다. 흑삼의 엘라스타아제 억제 활성은 여러 연구에서 보고되었다. 발효 흑삼은 UV-B로 조사된 인간 진피 섬유아세포에서 엘라스타아제 활성을 억제하고, MMP-1과 MMP-9을 감소시키는 동시에 COL I mRNA 발현을 증가시켰다(Ramadhania 등, 2023). 인삼 열매 추출물은 성숙 과정에 따라 엘라스타아제 억제 활성이 증가하였으며, 4년생 인삼 열매에서 가장 높은 활성을 나타냈다(Song 등, 2019). 산양삼(wild-cultivated ginseng) 70% 에탄올 추출물은 200 μg/mL 농도에서 86.74%의 엘라스타아제 억제 활성을 보였다(Kim 등, 2018b).
MMP는 세포외기질(extracellular matrix, ECM) 단백질을 분해하는 효소군으로, 콜라겐, 엘라스틴, 피브로넥틴 등을 분해한다(Pham 등, 2017; Son 등, 2023). MMP-1은 COL I 및 Ⅲ를 절단하고, MMP-2와 MMP-9은 이렇게 절단된 단편들을 추가로 분해한다. UV 조사는 피부에서 MMP-1, −2, −3, −9, −13의 발현과 분비를 증가시킨다(Hong 등, 2017; Hwang 등, 2014). Saccharomyces cerevisiae로 발효된 흑삼은 인간 섬유아세포인 HS68에서 MMP-1 발현을 18.41-27.41% 감소시켰으며, 10 μg/mL 농도에서 MMP-2와 MMP-9 발현을 각각 45.15%와 66.65%로 감소시켰다. 또한 발효 흑삼은 tissue inhibitor of metalloproteinase(TIMP)-2의 발현을 154.55%까지 증가시켰다(Pham 등, 2017). TIMP는 MMPs의 활성을 억제하는 내인성 조절인자로, TIMP와 MMPs의 균형이 ECM의 항상성 유지에 중요하다.
진세노사이드는 흑삼의 주요 활성 성분으로, 다양한 피부 보호 효과를 나타낸다. 진세노사이드 Rg3는 UV-B로 조사된 인간 각질형성세포에서 ERK, JNK, p38 MAPK의 인산화를 억제하였다(Lim 등, 2014). 이러한 MAPK 경로의 억제는 MMPs 발현 감소와 연관되어 있다. 효소 처리된 인삼 추출물과 진세노사이드 F2는 UV-B로 조사된 인간 진피 섬유아세포에서 MMP-1 분비를 감소시키고 제I형 프로콜라겐 생성을 증가시켰다(Hwang 등, 2014). 고온 가열 처리된 Sun ginseng은 인간 진피 섬유아세포에서 MMP-1을 감소시키고 TIMP-1을 증가시켜 제I형 콜라겐 생성을 촉진하였다(Song 등, 2012).
본 연구에서 KBG 추출물은 비교적 높은 농도(mg/mL 수준)에서 엘라스타아제 억제 활성을 나타냈으나, 이는 조추출물(crude extract) 형태로 평가되었기 때문으로 판단된다. 선행 연구에서 발효 공정을 거친 흑삼이나 특정 진세노사이드 성분은 더 낮은 농도에서도 효과를 나타냈다. 발효 과정은 진세노사이드의 구조를 변화시켜 생체이용률을 높이는 것으로 알려져 있다(Lee 등, 2012). 주요 진세노사이드인 Rb1, Rb2, Rc가 Rg3, F2, Rh2 같은 minor 진세노사이드로 전환되면서 약리 활성이 증가한다(Piao 등, 2020).
결론적으로, 본 연구는 KBG 추출물이 엘라스타아제 활성을 농도 의존적으로 억제함을 확인하였다. 선행 연구 결과들을 고려할 때, 이러한 효과는 흑삼에 함유된 진세노사이드가 엘라스타아제 효소 활성을 직접 억제하고, MMPs 발현을 조절하며, TIMP 발현을 증가시키는 것과 관련될 것으로 추정된다. 이러한 기전을 검증하기 위해서는 Western blot 또는 qPCR을 통한 MMPs 및 TIMP 발현 분석이 필요하다.
히알루론산은 피부 진피층에 존재하는 주요 글리코사미노글리칸(glycosaminoglycan, GAG)으로, 자체 부피의 1,000배에 달하는 수분을 보유할 수 있는 강력한 친수성 화합물이다(Yusuf 등, 2021). 히알루론산 분해효소는 히알루론산의 β-1,4-글리코시드(β-1,4-glycosidic bond) 결합을 가수분해하여 히알루론산을 저분자 올리고당으로 분해하는 효소로, 이 효소의 과도한 활성은 피부 수분 손실과 탄력 저하를 초래한다(Lee 등, 2020). 본 연구에서는 KBG 추출물의 히알루론산 분해효소 억제 효과를 평가하였다(Fig. 7).
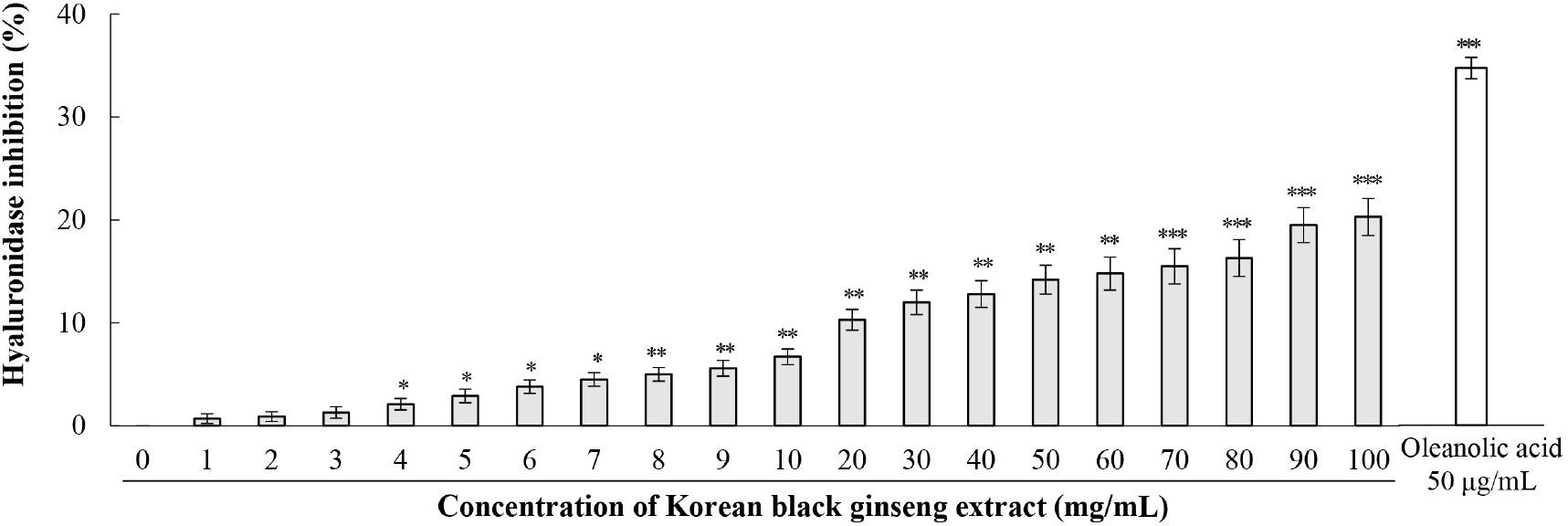
KBG 추출물은 농도 의존적으로 히알루론산 분해효소 활성을 억제하였으나, 엘라스타아제 억제 활성에 비해 상대적으로 낮은 수준을 보였다. 1-3 mg/mL의 저농도에서는 억제 효과가 관찰되지 않았으며, 4 mg/mL부터 통계적으로 유의한 억제가 시작되었다(2.1±0.56%, p<0.05). 억제율은 농도 증가에 따라 점진적으로 상승하여 10 mg/mL에서 6.7±0.76%(p<0.01), 100 mg/mL에서 20.3±1.8%(p<0.001)의 최대 억제율을 나타냈다. 양성대조군인 올레아놀산(50 μg/mL)은 34.3±2.8%의 억제율을 나타냈다. 히알루론산 분해효소 억제 활성은 10 mg/mL까지 비교적 완만한 증가를 보이다가, 그 이상의 농도에서 더 급격한 증가를 나타냈다. 이는 고농도에서 KBG 추출물의 활성 성분들이 히알루론산 분해효소와 더 효과적으로 상호작용함을 시사한다.
히알루론산과 글리코사미노글리칸은 피부 수분과 탄력 유지에 중요한 역할을 하며, 이들을 분해하는 효소들은 피부 노화 과정을 야기한다(Afandi와 Sahudin, 2022). 히알루론산 분해효소는 히알루론산을 분해하여 보호, 재생, 치유 및 수분 공급 기능을 수행하지 못하게 한다(Correia 등, 2022). 특히 자외선은 ROS 형성을 강력하게 유도하며(Desmiaty 등, 2022), 이로 인한 산화 스트레스는 히알루론산 분해효소, 콜라게나아제, 엘라스타아제와 같은 효소의 생성을 증가시킨다(Correia 등, 2022). 플라보노이드와 페놀 화합물의 히알루론산 분해효소 억제 활성은 분자 내 유리 페놀기와 ortho-dihydroxyphenolic 기의 수와 밀접한 관련이 있으며, 히알루론산 분해효소 억제 활성은 총페놀 함량 및 총플라보노이드와 양의 상관관계를 나타낸다(Mohamed 등, 2020). KBG에 함유된 페놀 화합물과 플라보노이드가 이러한 메커니즘을 통해 히알루론산 분해효소를 억제할 것으로 추정된다.
인삼은 Araliaceae과에 속하는 약용식물로, 이 과에 속하는 다른 식물들도 히알루론산 분해효소 억제 활성을 나타내는 것으로 보고되었다. 가시오갈피(Eleutherococcus divaricatus) 열매 추출물은 소 정소 히알루론산 분해효소에 대해 9.06-37.70%의 억제 활성을 보였으며, 특히 급성 백혈병 환자의 인간 혈청 히알루론산 분해효소에 대해서는 76-86%의 높은 억제 활성을 나타냈다(Gębalski 등, 2024). 중국에서 “작은 인삼”으로 불리는 Lycopus lucidus 뿌리도 히알루론산 분해효소 억제 활성을 보였다(Pandey 등, 2022). 이러한 결과는 Araliaceae과 식물들이 공통적으로 히알루론산 분해효소 억제 성분을 함유할 가능성을 시사하며, KBG의 억제 활성도 이러한 식물학적 특성과 연관될 수 있다. 또한 발효 공정은 천연물의 히알루론산 분해효소 억제 활성을 증가시킬 수 있다. Weissella cibaria로 발효된 천문동(Asparagus cochinchinensis) 추출물은 발효 전보다 향상된 히알루론산 분해효소 억제 활성을 나타냈다(Lee 등, 2017).
비록 KBG 추출물의 직접적인 히알루론산 분해효소 억제 활성은 중등도 수준이지만, 인삼 유래 진세노사이드는 피부 수분 유지에 다른 메커니즘으로도 기여할 수 있다. 첫째, 히알루론산 합성 촉진 효과이다. Compound K는 인간 각질형성세포에서 히알루론산 합성효소(hyaluronic acid synthase, HAS)-1과 HAS-2의 발현을 증가시켜 히알루론산 생성을 촉진하였다(Kim 등, 2018a). PPT는 HaCaT 각질형성세포에서 HAS-1, HAS-2, HAS-3의 발현을 모두 증가시켰으며, 이러한 효과는 Src/PKB/NF-κB 및 MAPK 신호 경로를 통해 매개되었다(Lee 등, 2021). 인삼 페놀산 추출물도 UV-B 조사된 무모 마우스 피부에서 HAS-1, HAS-2, HAS-3 유전자 발현을 증가시켜 히알루론산 함량을 회복시켰다(Li 등, 2021). 둘째, 피부 장벽 기능 개선이다. 진세노사이드 Re는 HaCaT 각질형성세포에서 filaggrin(FLG)과 transglutaminase-1(TGM-1)의 발현을 증가시켜 피부 장벽 기능을 개선하였다(Oh 등, 2016). PPT 역시 FLG와 TGM-1 발현을 증가시켰으며, 이는 피부 수분 손실을 억제하는 데 기여한다(Lee 등, 2021). 셋째, 인삼 다당류의 직접적인 보습 효과이다. Ginsan을 포함한 인삼 다당류는 수지상세포의 면역 조절 기능과 더불어 보습 효과를 가질 수 있으며(Kim 등, 2009), 이는 히알루론산 분해효소 억제와는 독립적인 메커니즘으로 피부 수분 유지에 기여할 수 있다.
결론적으로, KBG 추출물은 중등도의 히알루론산 분해효소 억제 활성을 나타내었다. 비록 직접적인 효소 억제 활성이 상대적으로 낮은 수준이지만, 인삼 유래 진세노사이드는 히알루론산 합성 촉진, 피부 장벽 기능 개선, 다당류의 직접적인 보습 효과 등 다양한 메커니즘을 통해 피부 수분 유지와 탄력 개선에 복합적으로 기여할 수 있을 것으로 판단된다.
4. 요약
본 연구에서는 KBG 추출물의 다양한 피부 항노화 활성을 종합적으로 평가하였다. KBG 추출물은 농도 의존적으로 티로시나아제, 엘라스타아제, 히알루론산 분해효소의 활성을 억제하였으며, 각 효소에 대한 억제 효과는 서로 다른 양상을 보였다. 티로시나아제 억제 활성은 100 mg/mL에서 20.3%의 억제율을 나타냈으며, 이는 피부 색소 침착 억제에 기여할 수 있다. 엘라스타아제 억제 활성은 100 mg/mL에서 32.8%의 중등도 억제율을 보였으며, 7 mg/mL에서 양성 대조군인 우르솔산(200 μg/mL)과 유사한 수준의 억제 효과를 나타냈다. 히알루로니다아제 억제 활성은 100 mg/mL에서 20.3%로 상대적으로 낮은 수준이었으나, 피부 수분 유지에 기여할 수 있는 가능성을 보였다. 이러한 효소 억제 활성은 KBG에 함유된 다양한 생리활성 성분들, 특히 페놀 화합물, 플라보노이드, 진세노사이드, 다당류 등에 기인하는 것으로 추정된다. 각 성분들은 효소의 활성 부위와의 상호작용, 금속 이온 킬레이션, 구조적 변화 유도 등 다양한 메커니즘을 통해 효소 활성을 억제하는 것으로 판단된다. 특히 주목할 점은 KBG 추출물이 단일 성분이 아닌 복합 추출물로서, 여러 활성 성분들의 시너지 효과를 통해 다각적인 피부 보호 효과를 나타낼 수 있다는 것이다. 엘라스틴의 분해 억제를 통한 피부 탄력 유지, 멜라닌 생성 억제를 통한 피부 미백 효과, 히알루론산 분해 억제를 통한 수분 보유, 그리고 항산화 효과를 통한 광노화 예방 등이 복합적으로 작용하여 종합적인 항노화 효과를 발휘할 것으로 기대된다. 결론적으로, KBG 추출물은 피부 노화와 관련된 주요 효소들의 활성을 효과적으로 억제하는 것으로 확인되었으며, 특히 엘라스타아제 억제 활성이 가장 우수하였다. 이러한 결과는 KBG 추출물이 주름 개선, 피부 탄력 증진, 미백, 보습 효과를 가진 기능성 화장품 소재로서의 개발 가능성을 시사한다. 향후 KBG 추출물의 활성 성분 분리 정제, 최적 농도 설정, 제형 개발 등의 후속 연구를 통해 실용적인 항노화 화장품 개발이 가능할 것으로 판단된다.










