1. 서론
서구화된 식습관과 과도한 식이 섭취, 그릇된 생활습관으로 인한 현대인의 비만, 당뇨, 고혈압과 같은 성인병과 내분비 기능 이상 질환 및 유전질환 등의 유병률이 해마다 증가하는 추세를 보이고 있다(Bae 등, 2013; Ryu 등, 2017). 된장은 청국장, 간장 등과 마찬가지로 대두를 주원료로 사용하여 제조한 전통 발효식품으로 발효과정에서 생성되는 독특한 맛과 냄새를 지니고 있으며, 유익한 생리활성 물질로 인한 항비만(Bae 등, 2013), 항암(Lim 등, 1999), 고혈압 개선(Mun 등, 2019) 등의 효과에 대해 밝혀지면서 소비자들의 관심 증가가 웰빙 트렌드와 맞물려 건강기능식품으로써 그 중요성이 대두되고 있다(Lee 등, 2009). 특히 된장은 발효과정을 통해 대두에 함유되어 있는 이소플라본과 같은 배당체 성분이 아글리콘(aglycone)으로 전환되어 항산화 활성이 증가될 뿐만 아니라(Ryu 등, 2017), 풍부한 비타민류와 유기산, 미네랄을 함유하고 있으며, 곡류 위주의 식습관을 가지고 있는 우리 민 족에게 중요한 지방과 단백질 공급원이 되어왔다(Lim 등, 2004; Son 등, 2008). 하지만 된장은 발효제품 특성상 메주 또는 염수와 같은 원재료 또는 자연으로부터 유래한 수백 종의 곰팡이, 효모, 세균이 복합적으로 서식하여 발효 및 숙성 과정에서 이들의 대사 작용에 의한 식중독과 같은 식품 안전상의 문제가 부각되고 있으며(Lee 등, 2009), 고농도의 나트륨 섭취가 고혈압, 당뇨와 같은 질병의 원인으로 알려지면서(Chun 등, 2020) 이에 대한 문제점이 대두되고 있다. 된장에서 가장 문제시되는 요소로는 식중독을 유발하는 것으로 알려진 미생물과 이들이 생산하는 독소, 바이오제닉 아민(biogenic amines, BAs), 고함량의 나트륨이 지목되고 있다. 이에 따라 재래 된장과 시판 된장의 미생물 오염과 BAs 함량 실태 조사(Lee 등, 2009), 된장에서의 유해균 증식 억제를 위한 종균 및 다양한 식중독 유발 미생물에 대한 길항작용과 BAs 분해능을 갖는 종균 개발(Lee 등, 2014; Lee 등, 2016), 장류의 나트륨 함량과 염도 저감화를 위한 기준치 개발(Kim 등, 2010; Ryu 등, 2017), 된장의 품질에 영향을 미치는 요인 분석(Shim 등, 2018), 된장의 발효과정에서 소금의 농도가 미생물 분포에 미치는 영향(Chun 등, 2020) 등 된장의 안전상의 문제를 해결하기 위한 다방면의 연구가 수행되고 있으며, 한국식품의약품안전처(Ministry of Food and Drug Safety, MFDS)는 2007년부터 된장을 포함한 모든 시판 장류에서 Bacillus cereus 균 수를 1×104 CFU/g 이하로 제한하는 기준치(Kim 등, 2010; Ryu 등, 2017)를 마련하여 장류의 안전성을 확보하기 위한 방안이 마련되고 있다.
장류는 발효 기간이 길고 제조 공정상 외부에 노출되는 과정에서 유해균의 오염 가능성이 높으며, 미생물 증식에 큰 영향을 미치는 것으로 알려진 온도와 습도 등의 발효환경 제어가 쉽지 않아 일정한 품질을 확보하기 어렵다(Ryu 등, 2016). 전통 방식의 장류 제조는 이러한 안전과 위생적인 문제를 필연적으로 가질 수밖에 없으며, 이러한 문제를 해결하기 위한 방안으로 유해 미생물 증식을 억제하는 효과와 우수한 발효특성을 가진 균주를 선발하는 것이 중요하며(Lee 등, 2014; Lee 등, 2016), 품질 규격화를 위해 발효에 관여하는 미생물이 된장의 특성에 미치는 영향에 대해 이해하는 것이 중요하다. 대부분의 선행연구들은 발효 기간에 따른 된장의 품질 특성(Shim 등, 2018)이나 된장의 소금농도가 미생물 분포에 미치는 영향(Chun 등, 2020) 등에 대해 조사하였으나, 이러한 연구들은 발효 기간에 따른 우점 미생물 분포 변화와 다양한 이화학적 특성 변화의 관계를 분석한 것이 아니므로, 미생물과 된장의 다양한 이화학적 특성 간의 상호관계를 규명하는 데 한계가 있으며, 식품 유해 미생물에 대한 길항 작용과 BAs 분해능을 가진 미생물의 특성에 대해 보고(Lee 등, 2014)된 바 있으나, 실제 된장에서 이들이 우수한 발효 특성을 보이는지에 대한 실증 연구는 제한적이다.
본 연구에서는 종균을 사용하여 제조한 개량 메주로 담은 된장을 1개월 단위로 총 3개월간 시료를 수집하여 발효 기간에 따른 미생물 변화와 된장의 이화학적 특성 간의 상관관계를 분석하여 된장의 품질 표준화를 위한 미생물과 된장의 물리화학적 특성 상호간의 영향을 도출하고자 하였다.
2. 재료 및 방법
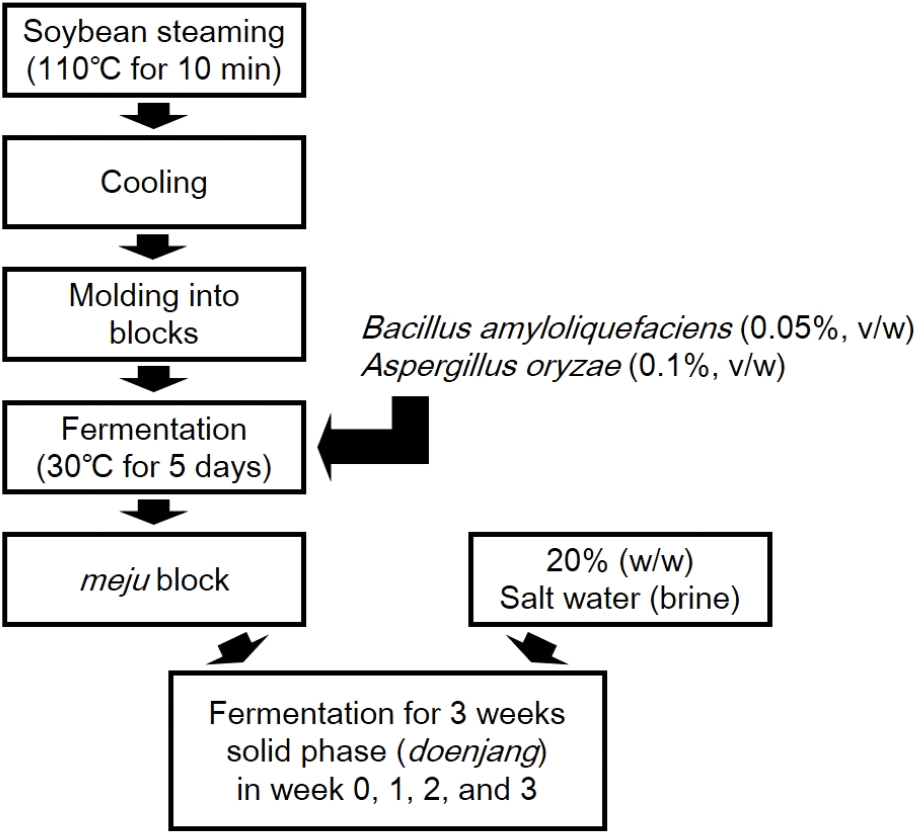
메주를 제조하기 위한 대두와 천일염은 모두 국내산을 사용하였다. 메주 제조를 위한 스타터 균주는 시판 된장으로부터 분리하여 본 연구소에서 보유하고 있는 Aspergillus oryzae 1종과 Bacillus amyloliquefaciens 1종을 사용하였으며, 메주와 된장 제조를 위한 공정도를 Fig. 1에 나타내었다. 된장의 발효는 발효조건을 통제하기 위해 항온항습기(VS-9111H-800, VISION BIONEX, Daejeon, Korea)에서 발효 기간 동안 온도는 30°C, 습도는 70%를 유지하였다. 제조한 메주와 염수를 30:70 비율로 혼합하여 총 50 L 부피의 장담금을 진행하였으며, 총질소(total nitrogen, TN)가 0.7% 이상 도달하였을 때 장 분리를 수행하였다. 장 분리 후 고상 부분 전체를 회수하여 발효 0일 차부터 30일 간격으로 90일 차까지 수집하여 미생물 천이와 이화학적 특성 분석을 위한 된장 시료로 사용하였으며, 모든 이화학적 분석 및 미생물학적 분석은 결과의 재현성과 정확성을 확보하기 위해 5회 반복 수행하였다.
발효 기간에 따라 수집한 된장 시료의 수분함량은 적외선 수분계(FD-720, KETT, Tokyo, Japan)를 사용하여 측정하였다. pH는 시료 10 g에 증류수 100 mL를 혼합 후 원심 분리하여 얻은 상층액을 pH meter(SevenDirect SD20, Mettler Toledo, Greifensee, Switzerland)를 사용하여 측정하였으며, 염도는 Salinity refractometer(ATAGO salinity refractor PAL-106S, ATAGO, Tokyo, Japan)를 사용하여 측정하였다.
아미노태 질소(Amino nitrogen, AN) 함량은 시료 5 g을 자동적정장치(T50 titrator, Mettler Toledo, Greifensee, Switzerland)를 사용하여 분석하였으며, pH가 8.4가 될 때까지 소모된 0.1 N NaOH의 양을 아미노태 질소 함량으로 결정하였다(Choi 등, 2017).
시료 5 g에 증류수 45 mL를 혼합한 후 30분간 sonication한 후 0.45 μm syringe filter(Sartorius, Göttingen, Germany)로 여과한 시료를 HPLC(1260 Infinity III, Agilent, Santa Clara, CA, USA)를 이용하여 유리당과 유기산 분석에 사용하였다. 검출기로는 Refractive index detector(RID, Agilent), Ultraviolet diode array detector(UV-DAD, Agilent)가 사용되었으며, column은 Aminex HPX-87P(7.8×300 mm, Hercules, CA, USA)가 사용되었다. 이동상은 0.009 N H2SO4로 설정하고 유속은 0.6 mL/min으로 유지하였다. Column 온도는 40°C로 유지하였으며, injection volume은 10 μL로 설정하였다.
발효 기간에 따른 된장 시료의 DNA를 추출하기 위한 kit로는 Dneasy PowerFood Microbial Kit(Qiagen, Hilden, Germany)를 사용하였으며, 사용자 매뉴얼에 따라 추출하였다. 추출한 DNA의 정확한 dsDNA 농도를 측정하기 위해 Qubit 4 fluorometer (Invitrogen, Carlsbad, CA, USA)를 이용하여 분석하였으며, 순도(purity)를 분석하기 위해 Nanodrop One UV-Vis Spectrophotometer(Thermofisher, Waltham, MA, USA)를 이용하여 Abs260 nm / Abs280 nm, Abs260 nm / Abs230 nm ratio를 측정하였다.
된장으로부터 추출한 DNA의 16S rDNA 유전자 library는 16S metagenomic sequencing library preparation guide(Illumina, 2013)에 따라 제작하였다. 16S rDNA 유전자 내의 V3-V4 region을 증폭하기 위한 primer로 16S forward primer(5'-TCG TCG GCA GCG TCA GAT GTG TAT AAG AGA CAG CCT ACG GGN GGC WGC AG-3')와 16S reverse primer(5'-GTC TCG TGG GCT CGG AGA TGT GTA TAA GAG ACA GGA CTA CHV GGG TAT CT A ATC C-3', N; A or C or G or T, W; A or T, H; A or C or T, V; A or C or G)를 사용하였다. PCR guideline에 따라 주형 DNA 2.5 μL(5 ng/ μL)와 각 forward와 reverse primer 5 μL, 중합효소 kit(KAPA HiFi HotStart ReadyMix, Roche, Basel, Switzerland) 12.5 μL를 혼합하여 25 cycle의 PCR을 수행하였으며, PCR 후 80% ethanol과 AMPure XP bead를 이용하여 증폭 산물 외의 불순물을 제거하였다. 시료별 read를 구분하기 위한 index로 Illumina Nextera XT index v2 kit(Illumina, San Diego, CA, USA)를 선택하여 각 library 말단에 index tagging을 위한 8 cycle의 2차 PCR을 수행하였으며, 증폭 산물 외의 불순물을 제거하기 위해 80% ethanol과 AMPure XP bead를 이용하여 bead purification과 amplicon target size selection을 수행하였다. 각 library의 dsDNA 농도 측정에는 Qubit 4 fluorometer (Invitrogen), 순도 분석에는 Nanodrop One UV-Vis Spectrophotometer (Thermofisher)를 사용하였으며, 1%(w/v) agarose gel 전기영동을 수행하여 증폭 산물의 크기(base pair)를 분석하였다. 각 library를 10 mM Tris-HCl buffer pH 8.5를 이용하여 4 nM로 동일하게 희석한 후 혼합하여 최종 된장 시료의 미생물 분석을 위한 16S rDNA 유전자 library를 제작하였다.
각 된장 시료로부터 추출한 DNA로부터 16S rDNA 유전자 library를 제작하였으며, 16S rDNA 유전자의 염기서열을 분석하기 위해 Illumina MiSeq platform(Illumina)을 사용하였다. 염기서열 분석 kit로는 MiSeq reagent kit v3(Illumina)을 사용하였으며, paired-end 방식의 염기서열 분석을 수행하였다. MiSeq 장비로부터 얻은 염기서열 정보를 포함하는 raw fastq file은 EzBioCloud 16S-Based Microbiome taxonomic profiling (MTP, CJ Bioscience Inc., Seoul, Korea) pipeline에 업로드하였으며(Yoon 등, 2017), 염기서열에 따른 미생물 분류를 위한 database로는 PKSSU v4.0이 사용되었다. MTP browser의 trimming process를 통해 low quality, non-target, chimeric amplicon을 제거하였으며, 97%의 염기서열 유사성을 기준으로 OTUs(Operational Taxonomic Units) picking을 수행하였다.
된장의 발효 기간에 따른 이화학적 특성과 미생물 천이에 따른 분포 사이의 상관관계 분석을 위한 방법으로 Pearson coefficient(r)와 Spearman coefficient(rs)(Schober 등, 2018)를 산출하였으며, 독립변수들 간의 상관관계 시각화와 네트워크 분석을 위한 프로그램으로 NodeXL basic(1.0.1.238, Social Media Research Foundation, Belmont, CA, USA) 유의수준 p<0.05를 기준으로 변수 간의 상관관계 유의성을 검정하였다.
3. 결과 및 고찰
종균을 사용하여 제조한 된장의 발효 기간에 따른 이화학적 특성 변화를 Table 1에 나타내었다. 장 분리 후 발효 0일 차부터 90일 차까지 pH, 수분함량, glucose 함량이 추세적으로 감소하는 것으로 나타났으며, 염도와 아미노태 질소 함량은 증가하는 것으로 나타났다. 아미노태 질소 함량은 발효 60일 차에 328.48 mg%로 나타나 된장의 품질 기준인 300 mg%를 충족하는 것으로 나타났다(Byun 등, 2014; Lee 등, 2022). pH는 발효 0일 차에 6.19에서 발효 30일부터 90일까지는 5.88-5.91수준으로 거의 변화하지 않았다. 이전의 연구결과(Shim 등, 2018)에서는 발효 6개월 차까지는 pH가 감소하였으나 이후 pH가 유지된다고 보고하여 본 연구결과와 유사하였다. 본 연구결과에서는 lactic acid와 acetic acid 함량이 각각 60일과 30일까지는 증가하다 이후 소폭 감소하여 pH의 감소는 발효 중 미생물에 의한 유기산 생성에 의한 것으로 예상되며(Shim 등, 2018), 염도의 증가는 발효 기간에 따른 된장의 수분함량 감소에 의한 것으로 판단된다. 아미노태 질소 함량은 된장 발효 정도를 나타내는 지표 중 하나로 발효 기간에 따른 아미노태 질소 함량의 추세적인 증가는 이전의 연구결과(Choi 등, 2017)와 유사하였으며, 이는 Bacillus 속 미생물이 분비하는 단백질 분해효소에 의한 것으로 판단된다(Shim 등, 2016). Fructose의 함량은 발효 60일 차 이후에 감소하였는데 이는 된장에서 우점하는 미생물인 Bacillus가 생장을 위한 탄소원으로 glucose를 가장 선호(Stülke과 Hillen, 2000)하며, Enterococcus의 lactic acid 대량생산을 위한 탄소원으로 가장 적합하다고 보고한 바 있어(Wee 등, 2004), 모든 발효 기간에 가장 우점하는 Bacillus와 Enterococcus 두 미생물에 의해 glucose가 탄소원으로 소비되어 특정 농도 이하로 감소한 후 fructose를 탄소원으로 사용하기 때문인 것으로 추정된다.
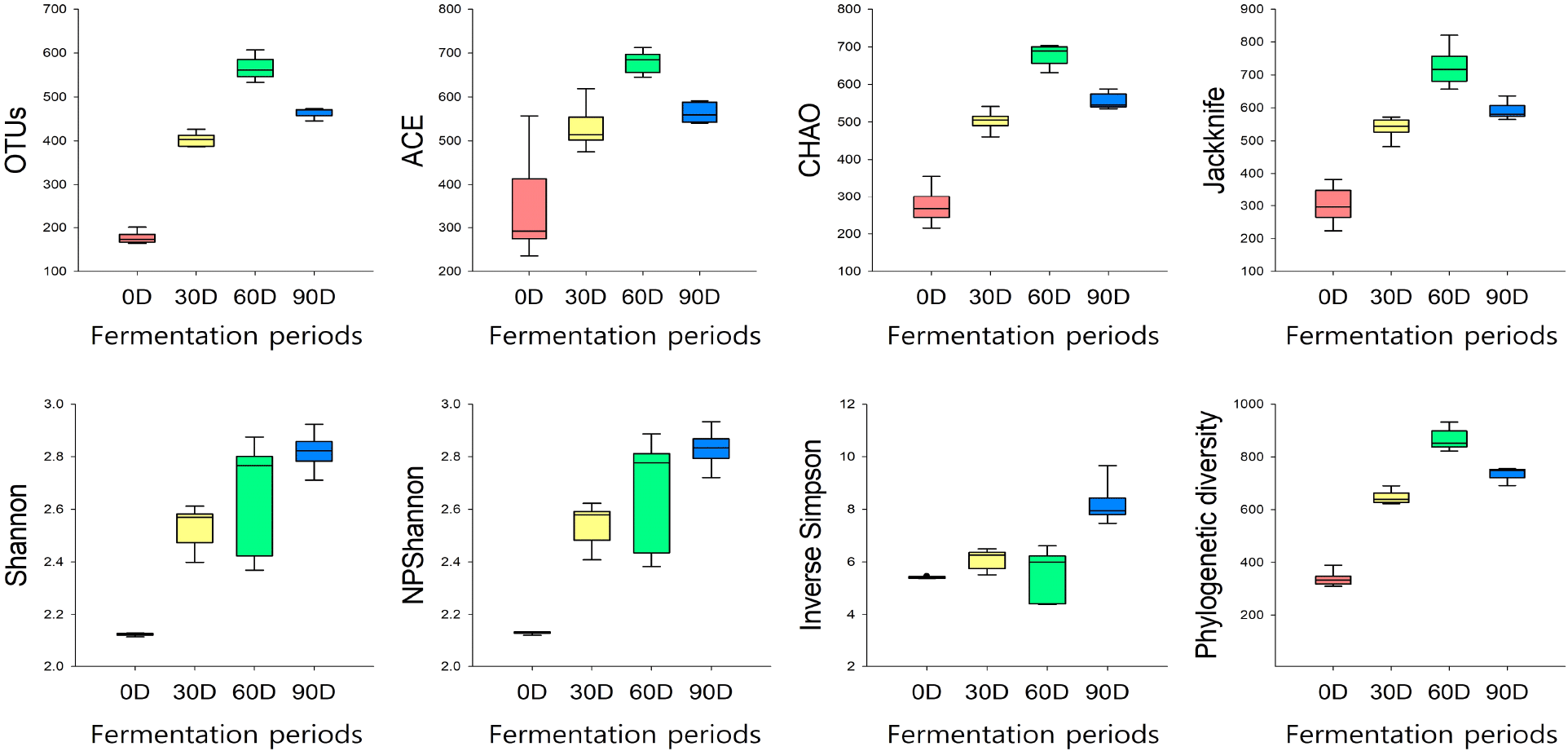
된장의 발효 0일 차부터 90일까지의 발효 기간에 따른 alpha-diversity 지수를 분석한 결과 종 추정치(OTUs), 종 풍부도(ACE, CHAO, Jackknife), 종 균등도(Shannon, NPShannon), 종 다양성 지수(Inverse Simpson, Phylogenetic diversity)가 추세적으로 증가하는 것으로 나타났다(Fig. 2). 간장 등의 콩 발효식품의 발효 기간에 따른 alpha-diversity 변화를 분석한 이전의 연구결과에 의하면 alpha-diversity 지수가 발효 기간에 따라 일방향의 추세를 나타내지 않고 증감하는 것으로 나타났으나(Chai 등, 2022; Jeong 등, 2023; Jung 등, 2016), 발효식품에서 미생물 분포와 대사산물 함량의 변화는 pH, 염도 등의 이화학적인 요인 또는 원재료의 함량, 식품 유형 및 외부 환경의 요인에 영향을 받는 것으로 알려져 있으며(Ha 등, 2022; Jung 등, 2016; Lee 등, 2022; Lee 등, 2023; Lee 등, 2024), 특히 페놀성 화합물, 플라보노이드, 이소플라본과 같은 기능성 물질(Lee 등, 2023), 아미노산 및 BAs 함량에도 영향을 미치는 것으로 알려져(Lee 등, 2022) 있어 된장의 품질 규격화를 위해서는 다양한 외부 환경, 이화학적 특성 및 미생물 분포와 미생물이 생산하는 대사산물과의 상관관계를 규명하기 위한 종합적인 연구가 필수적으로 수행되어야 할 것으로 판단된다.
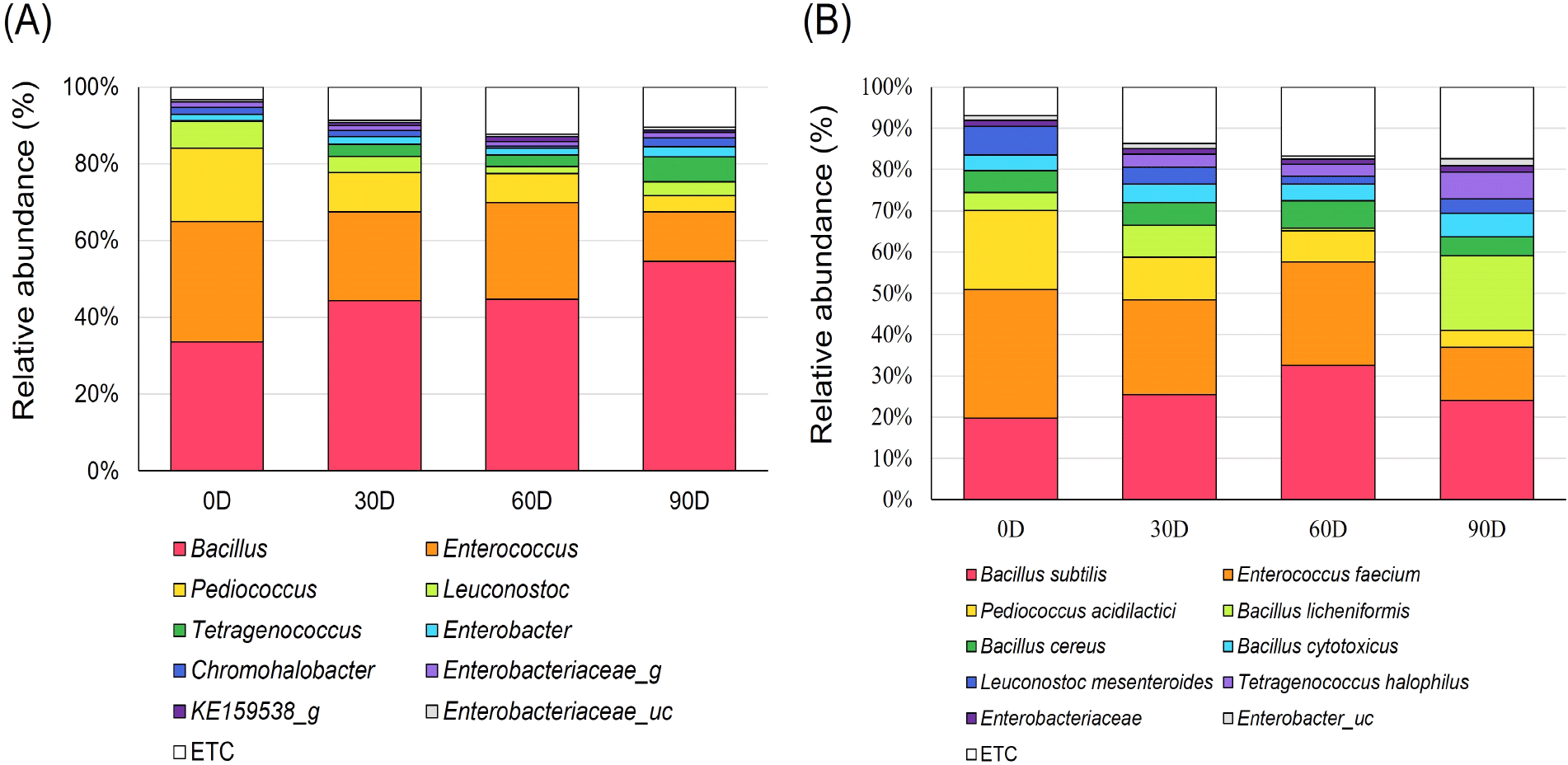
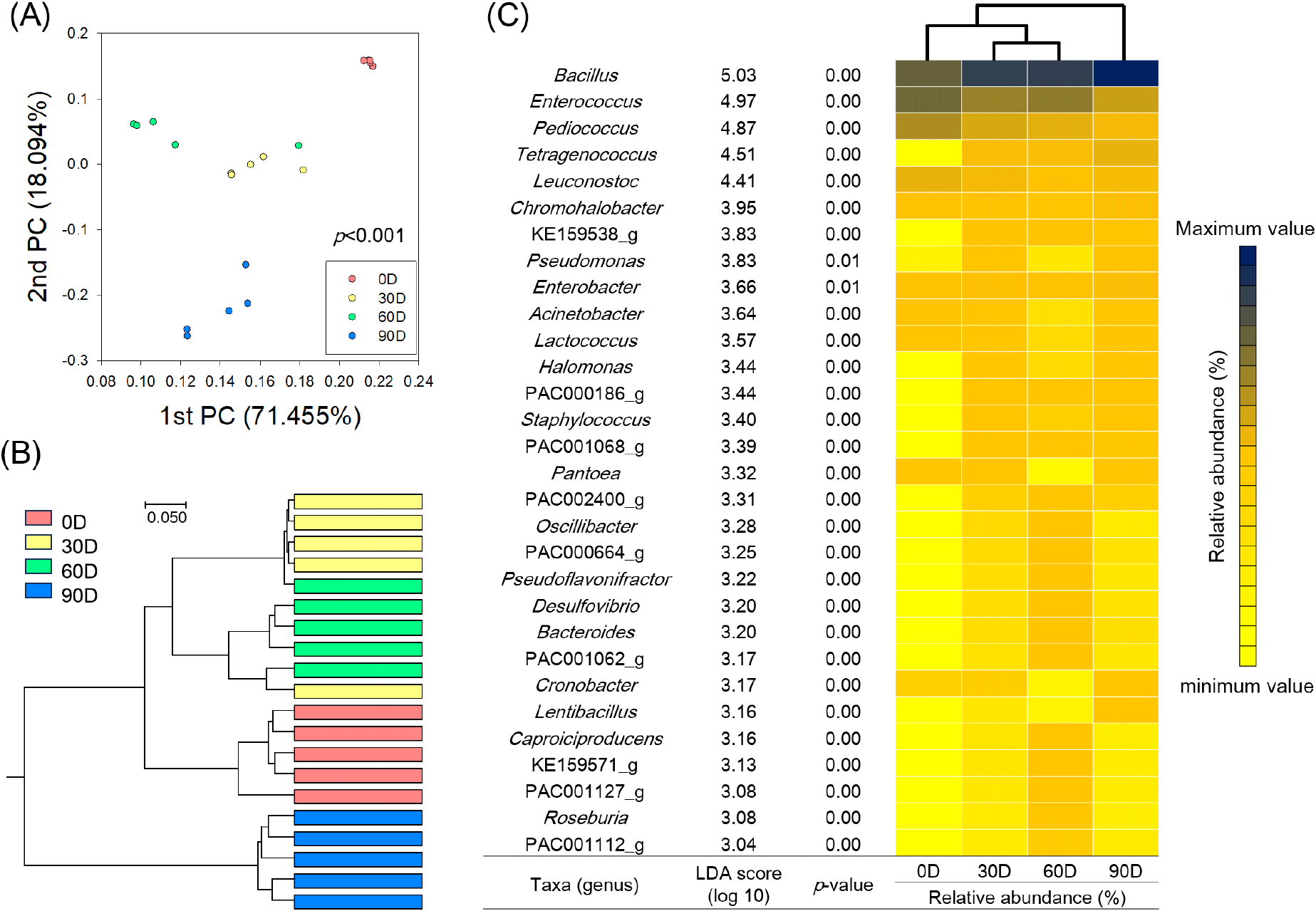
된장의 발효 기간에 따른 우점 미생물 분포 변화를 속(genus)과 종(species) 수준에서 분석하였다(Fig. 3). 속 수준에서는 발효 기간에 따라 Bacillus와 내염성 유산균으로 알려진 Tetragenococcus의 비율이 추세적으로 증가하였으며, Tetragenococcus를 제외한 Enterococcus, Pediococcus, Leuconostoc과 같은 유산균의 비율은 감소하는 것으로 나타났다. 또한 30일 간격의 된장 미생물 군집구조는 통계적으로 매우 유의한 수준의 차이(p<0.001)가 있는 것으로 나타나 발효 0일부터 90일까지 미생물 군집 구조가 매우 급격하게 변화하는 것으로 나타났으며(Fig. 4), 30일 간격의 발효 기간에 따른 미생물 군집 구조 차이에 가장 큰 영향을 미치는 바이오마커 미생물을 분석하기 위해 Linear discriminant analysis effect size(LEfSe) 분석(Segata 등, 2011)을 수행한 결과 Bacillus와 Enterococcus, Pediococcus, Tetragenococcus, Leuconostoc과 같은 유산균의 비율이 크게 변화하는 것으로 나타났다(Fig. 4C). Bacillus 속 미생물과 내염성 또는 호염성 미생물로 알려진 Tetragenococcus, Chromohalobacter, Staphylococcus, Halomonas(Jeong 등, 2024; Lee 등, 2022)의 비율은 발효 기간에 따라 추세적으로 증가하였으며, Enterococcus, Pediococcus, Leuconostoc과 같은 유산균의 비율은 감소하는 것으로 나타났다(Fig. 4C). 이전의 연구결과에서는 Bacillus가 된장의 발효 전 기간에 걸쳐 가장 우점하며, Enterococcus, Lactobacillus와 같은 미생물이 메주 또는 염수에서 기인하여 우점한다고 보고한 바 있으며(Jung 등, 2016), 된장의 발효 기간에 따라 Bacillus 속 미생물의 비율은 증가하고, Enterococcus의 비율은 감소한다고 보고(Kim 등, 2011)한 바 있어 본 연구결과에서의 발효 기간에 따른 우점 미생물의 비율 변화 패턴과 유사하였다. 장기간에 걸친 된장의 발효 기간에 따른 미생물 분포에 대한 연구에서는 우점 미생물의 분포 증감이 발효 기간에 따라 추세적으로 나타나지 않았으며(Jung 등, 2016), 이러한 결과는 장류 내의 미생물의 분포는 원재료와 발효 조건(Ha 등, 2022), 이화학적 요인(Lee 등, 2023) 등 복잡한 요인에 영향을 받는 것으로 알려져 있어 다양한 발효조건에서의 미생물 분포 변화에 대한 추가적인 연구가 필요할 것으로 판단된다.
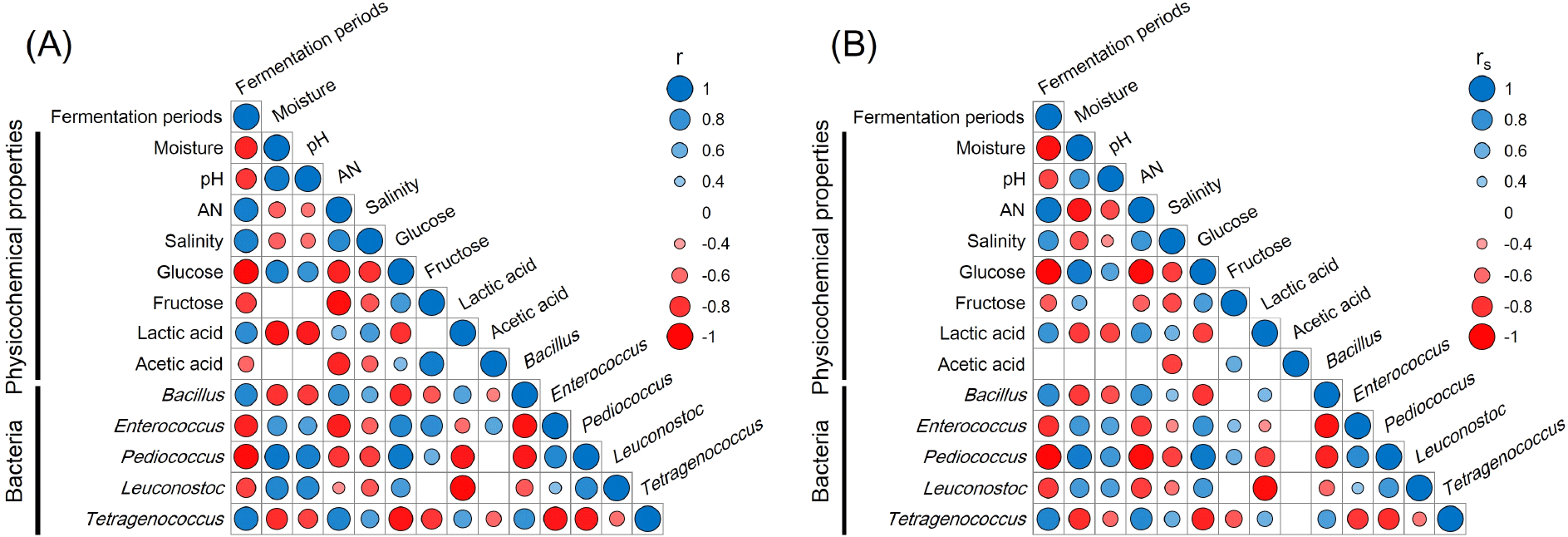
된장의 발효 기간에 따른 이화학적 특성과 우점 미생물 간의 상관관계를 Fig. 5에 나타내었다. 된장의 발효 기간은 수분함량, pH, 염도 등의 이화학적 특성과 유리당, 유기산 함량, 우점 미생물 비율 등 모든 변수와 통계적으로 유의한 수준의 상관관계가 있는 것으로 나타났다. 된장의 이화학적 특성 중 발효 기간과 아미노태 질소 함량, 염도는 다른 변수들과의 상관관계 패턴이 매우 유사한 것으로 나타났다. 이는 발효 기간에 따라 된장의 수분함량이 감소하면서 염도가 증가하고 증가한 염도에 따라 내염성 미생물에 의해 아미노태 질소 함량이 증가하는 것으로 예상된다. 아미노태 질소는 된장의 발효과정에서 다양한 미생물이 생산하는 콩 단백질 가수분해 효소에 의해 생산되는 것으로 알려져 있으며, 높은 염도의 된장에서 아미노태 질소의 함량이 증가한다는 연구결과(Lee 등, 2022)가 보고된 바 있어 본 연구결과와 매우 유사하였다. 수분함량은 pH와 다른 변수들과의 상관관계 패턴이 매우 유사하였다. pH는 된장의 lactic acid 함량과 매우 높은 상관관계를 나타내어 된장의 pH 감소는 발효과정에서 미생물에 의해 생산되는 lactic acid에 큰 영향을 받는 것으로 나타났다. 우점 미생물인 Bacillus와 Tetragenococcus의 비율은 발효 기간이 경과함에 따라 증가하였으며, Enterococcus, Pediococcus, Leuconostoc의 비율은 감소하는 것으로 나타났다. 특히 lactic acid와 같은 유기산을 생산하는 것으로 알려진 Enterococcus, Pediococcus, Leuconostoc의 내산성 유산균 비율은 감소하였으나, 내염성 유산균으로 알려진 Tetragenococcus의 비율은 증가하여 된장 발효과정에서 유산균의 비율은 염분 농도의 증감에 의한 것으로 판단된다. 이는 김치의 염 농도에 따른 유산균의 비율에 대해 조사한 연구결과에서 염 농도가 높은 김치에서 Lactobacillus, Leuconostoc, Weissella와 같은 유산균의 비율이 낮다고 보고한(Hong 등, 2021) 바 있어 본 연구결과와 매우 유사하여 된장의 특성에 영향을 미치는 우점 미생물의 비율은 된장의 염 농도와 매우 높은 상관관계가 있는 것으로 판단된다.
본 연구에서는 종균을 사용하여 제조한 개량된장의 0일 차부터 90일 차까지 30일 간격의 발효 기간에 따른 이화학적 특성과 미생물 분포를 분석하였다. 된장의 발효 기간에 따라 수분함량과 pH, glucose, fructose의 함량은 추세적으로 감소하였으며, 아미노태 질소와 염도, lactic acid의 함량은 증가하였다. 된장의 미생물 분포는 발효 기간에 따라 Bacillus, Tetragenococcus의 비율은 추세적으로 증가하였으며, Enterococcus, Pediococcus, Leuconostoc의 비율은 감소하였다. 이화학적 특성과 미생물 분포의 상관관계를 분석한 결과 발효 기간과 아미노태 질소 함량, 염도, Bacillus와 Tetragenococcus의 비율은 다른 독립변수와의 상관관계 패턴이 유사하였으며, 수분함량, pH, glucose 함량, Enterococcus와 Pediococcus, Leuconostoc의 상관관계 패턴이 유사하였다. 발효 기간에 따른 전체 된장의 이화학적 특성과 미생물 간의 상관관계 네트워크를 분석한 결과 acetic acid를 제외한 대부분의 변수 간의 유의한 상관관계가 있는 것으로 나타났다(Fig. 6). 특히 된장에서 품질 기준으로 설정하고 있는 아미노태 질소 함량은 발효 기간, Bacillus, Tetragenococcus와는 양의 상관관계, glucose 함량과는 음의 상관관계를 나타내어 발효 기간에 따라 Bacillus, Tetragenococcus가 glucose를 탄소원으로 소비하여 성장하고 아미노태 질소를 증가시키는 것으로 추측된다.
된장의 이화학적 특성과 미생물 비율의 인과관계는 명확히 알 수 없으나, 독립변수 사이의 선형 관계 상관계수(Pearson correlation coefficient, r)와 순위상관계수(Spearman rank correlation coefficient, rs)를 산출하고 유의성을 검정한 결과 대부분의 변수 간의 상관관계는 통계적으로 매우 유의한 것으로 나타났다. 이러한 결과는 된장 발효 기간 동안의 미생물 비율조절을 통한 이화학적 특성을 조절하거나 반대로 이화학적 특성 조절을 통한 미생물 비율 제어에 대한 가능성을 시사하여 된장의 품질 조정과 개선을 위한 연구자료로 활용할 수 있을 것으로 기대되나 된장은 발효 기간이 길고 다양한 외부 환경 및 미생물에 의해 영향을 받는 것으로 알려져 있으므로, 장기간에 걸친 발효 기간 동안의 발효조건과 이화학적 특성, 미생물, 대사산물 등의 상관관계에 대한 종합적인 연구가 필요할 것으로 판단된다.

4. 요약
된장 발효에 대한 다양한 연구가 수행되었음에도 불구하고, 미생물의 변화와 특성 간의 상관관계를 밝히기 위한 연구는 아직 제한적이다. 본 연구는 된장의 발효과정에서 미생물 변화와 물리화학적 특성 간의 상관관계를 규명하기 위해 수행되었다. 된장의 0일부터 90일까지의 발효 기간 동안 수분, pH, 염도 및 glucose와 fructose의 함량은 추세적으로 유의하게 감소한 반면, 아미노태 질소와 lactic acid 함량은 증가하는 것으로 나타났다. 된장의 발효과정에서 미생물 변화를 분석한 결과 발효가 진행됨에 따라 Bacillus와 Tetragenococcus의 비율은 증가한 반면, Enterococcus, Pediococcus, Leuconostoc과 같은 유산균의 비율은 감소하는 것으로 나타났다. Bacillus와 Tetragenococcus는 다른 변수들과의 상관관계 패턴이 유사하였으며, 이들의 비율은 된장의 아미노태 질소 및 lactic acid 함량과 양의 상관관계를 가지는 반면, 수분, pH, 염도 및 glucose 함량과는 음의 상관관계를 보였다. 이와 반대로 Enterococcus, Pediococcus, Leuconostoc과 같은 유산균의 비율은 아미노태 질소 및 lactic acid 함량과 음의 상관관계를 나타냈으며, 수분, pH, 염도 및 glucose 함량과는 양의 상관관계를 보였다.
이러한 연구결과는 된장 발효과정에서 미생물 군집과 이화학적 특성 간의 밀접한 상관관계를 나타내며, 특정 미생물 군집의 비율 변화가 된장의 품질 특성에 따라 발생하고, 이러한 변화가 된장의 특성에 영향을 미친다는 것을 시사한다. 따라서 본 연구는 된장의 품질 관리를 위한 기초 자료로 활용될 수 있을 것으로 기대된다.