1. 서론
자두(Prunus salicina L.)는 장미과 벚나무속 자두아속에 속하는 과실로, 원산지에 따라 동양계자두(P. salicina), 유럽계 자두(P. domestica) 및 미국계 자두(P. americana) 등으로 구분된다(Basanta 등, 2016; Guerra와 Rodrigo, 2015). 우리나라에서는 삼국시대부터 재배되어 온 역사가 오래된 과일 중 하나로, 주로 솔담, 대석신생, 조생월광, 대석조생(大石早生) 등을 포함하는 동양계 자두 품종이 재배되고 있다(Kim 등, 2000). 자두의 일반성분은 glucose와 fructose를 주성분으로 하는 9.63-29.47%의 당을 함유하고 있으며, 10여 종의 아미노산과 malic acid, levulinic acid, citric acid, succinic acid 등의 유기산, Fe, K, P, Ca 등 무기질 및 수용성 식이섬유를 함유하는 것으로 보고되었다(Kim 등, 2000; Popov 등, 2014; Sahamishirazi 등, 2017). 또한 품종에 따라 다소 차이가 있으나, 생과 100 g당 38.45-841.50 mg의 gallic acid에 상당하는 polyphenol과 함께 cyanidine-3-rutinoside, cyanidine-3-glucoside 등 anthocyanin 계열 색소를 비롯한 다양한 생리활성물질을 함유하는 것으로 알려져 있다(Sahamishirazi 등, 2017). 특히 자두와 같은 핵과류에 풍부한 polyphenol 및 anthocyanin 계열 물질은 활성산소를 제거하는 항산화 능력이 우수하여, 심장질환, 고혈압, 동맥경화 등과 같은 만성질환 예방을 위한 기능성 식품 소재로서 주목받고 있다(Sahamishirazi 등, 2017). 이러한 자두의 생리활성 성분에 기인하여 돌연변이 억제(Ham, 1987), 혈중 저밀도콜레스테롤 감소(Tinker 등, 1991), 골다공증 예방(Franklin 등, 2006), 항산화(Rupasinghe 등, 2006), 항암(Kim 등, 2013), 항염증(Popov 등, 2014) 등의 다양한 생리활성이 보고되어 있다.
식초는 알코올이 초산으로 산화되어 만들어지는 것으로, 발효에 의한 식초제조 공정은 알코올발효와 초산발효를 하나의 공정으로 진행시키는 병행복발효 공정과 알코올발효와 초산발효를 별개의 공정으로 진행시키는 단행복발효 공정으로 구분할 수 있다(Boonsupa와 Kerdchan, 2020). 재래식 감식초 제조에서와 같은 병행복발효 공정은 서로 다른 특성을 지닌 미생물에 의해 알코올발효와 초산발효가 동시에 일어나므로, 알코올 및 초산의 수율이 낮고 6개월 이상 장기간이 소요되어 균일한 품질의 식초를 대량으로 생산하는데 한계가 있다(Cho 등, 2000; Lee 등, 2016). 이에 반해 단행복발효 공정은 발효균의 특성에 맞는 공정 조건 설정이 용이하여 비교적 짧은 시간에 고품질의 식초를 대량생산할 수 있는 장점이 있어, 단행복발효 공정을 이용한 식초 제조 연구가 활발히 이루어지고 있다(Sung 등, 2014). 또한 식초는 낮은 pH로 인해 미생물의 생육을 억제하여 부패나 변질을 방지하므로 저장성이 높은 식품이며, 특유의 신맛으로 인해 전통적으로 조미료로 활용되어왔다(Budak 등, 2014). 그러나 최근에는 식초가 동맥경화나 고혈압과 같은 성인병 예방, 콜레스테롤 저하 및 체지방 감소, 피로회복 등을 위한 기능성 음료 형태로 개발되면서 그 시장규모가 지속적으로 확대되고 있다(Park 등, 2016).
자두는 수확 가능한 시기가 짧고 과육의 조직이 연하여 저장성이 낮기 때문에, 유통과정에서 변질이나 품질저하의 위험이 큰 것으로 알려져 있다. 이러한 특성으로 인해 대부분의 자두는 수확 직후 생과로 소비되며, 일부만이 저장성을 높이기 위해 주스, 잼, 엑기스, 통조림 등의 가공식품의 형태로 이용되고 있다(Joo 등, 2004). 자두의 저장성 향상을 위한 가공식품 개발과 관련한 연구에는 자두넥타 제조(Cho 등, 1985)와 자두와인 제조(Seo 등, 2001a)에 대한 연구가 보고된 바 있으나, 자두를 활용한 기능성 발효식초 제조에 관한 연구는 부족한 실정이다.
따라서 본 연구에서는 국내에서 재배되어 주로 생과로 소비되는 자두인 대석조생 자두를 이용하여 단행복발효 공정으로 자두발효식초를 제조한 뒤, 이화학적 특성과 항산화 활성을 조사하여 부가가치가 높은 가공식품으로 활용 가능성을 검토하고자 하였다.
2. 재료 및 방법
본 연구에 사용된 자두는 2023년도 경상북도 김천 지역에서 수확한 대석조생을 구입하여 실온에서 완숙 시킨 뒤, 수세 및 물기를 제거한 다음 −20°C에서 보관하였다. 이 후 식초 제조 시 상온에서 해동하여 시료로 사용하였다.
효모와 초산균 종균배양에 사용한 맥아 추출액 배지는 엿기름 배지(정수 1 L에 엿기름 가루 200 g을 가하고 60°C에서 2시간 당화 한 후 여과하여 여액 1 L로 조정한 후 121°C에서 15분간 멸균)를 사용하였다. 효모 종균 배양을 위해 제조한 맥아 추출액 배지 100 mL가 들어있는 250 mL Erlenmeyer flask에 YPDA(0.5% yeast extract, 0.5% peptone, 2% dextrose, 1.5% agar) 배지에서 계대배양한 Saccharomyces cerevisiae(KCCM 11215) 균주 1 백금이를 접종하고 30°C에서 2일간 진탕배양(150 rpm)하여 효모 종균을 배양하였다. 초산균 종균은 Acetobacter pasterianus A8(Jeong 등, 2000)을 사용하였고 2% 알코올 첨가한 엿기름 배지에 균주 1 백금이를 접종하고 30°C에서 3일간 진탕배양하여 초산균 종균을 배양하였다.
상온에서 해동한 자두 5 kg을 껍질과 함께 으깨어 펄프상태로 만든 다음 0.4%의 pectinase를 첨가하고 45°C에서 30분 간격으로 총 2시간 저어주면서 착즙하여 4.3 kg의 자두주스를 수득하였다. 수득한 자두주스의 당도는 9.4 °Brix였으며, 목표 당도 16 °Brix를 위해 sucrose를 290 g 첨가한 뒤 95°C에서 30분간 살균하였다. 살균 처리한 자두주스의 잠열을 상온에서 식힌 후, 효모주모를 2.5% 부피로 접종하고 30°C에서 6일간 정치 발효시켜 알코올 발효하였다(목표 도수 6%). 알코올 발효가 끝난 자두와인에 3일간 진탕 배양한 초산균 종초를 5% 부피로 접종하고 30°C에서 20일간 정치 발효시켜 총 4.0 kg의 자두식초를 제조하였다.
시료를 원심분리기(Hanil Science Industrial Co., Gimpo, Korea)에서 3,000 rpm으로 15분간 원심분리한 후 상등액을 취하여 pH meter (Jenway, UK)기기를 사용하여 pH를 측정하였다. 총 산도는 원심분리한 시료 1 mL를 pH 8.2±0.1까지 중화시키는 데 소비된 0.1 N NaOH의 소비 mL 수를 구하여 환산하였다. 당도는 원심분리한 시료를 굴절당도계(WSRO-90, Atago Co., Tokyo, Japan)에 취하여 가용성 고형분량(°Brix)을 측정하였다. 알코올 함량은 500 mL 플라스크에 알코올 발효액 50 mL와 증류수 100 mL를 혼합하여 가열 증류하였으며, 증류액이 35 mL가 되었을 때 이를 취하여 총 시료량이 50 mL 되도록 증류수를 첨가하였다. 이후 주정계(MT-830, Atago Co., Tokyo, Japan)를 이용하여 알코올 함량(%)을 측정하였다.
유리당은 HPLC(Agilent 1200 series, Agilent Co., Forest Hill, Vic, Australia) 기기를 이용하여 분석하였다. 유리당을 분석하기 위해 시료 5 g에 증류수 25 mL를 가하여 녹인 후 acetonitrile로 50 mL까지 채웠다. 이 용액을 Sep-pak NH2 column (Waters Co., Milford, MA, USA)과 0.45 μm membrane filter (Dismic25CS, Toyoroshikaisha, Tokyo, Japan)로 여과한 액을 시료로 사용하였다. 당 분석 column(polyamine Ⅱ, 4.6×150 mm, 5 μm, YMC Co., Kyoto, Japan)에 시료 20 μL를 주입하고 35°C에서 이동상 용매[acetonitrile:water=70:30(v/v)]를 1 mL/min 속도로 이동시키면서 refractive index(RI, Agilent 1200 series) 검출기 상에서 당을 검출하였다.
시료를 원심분리기에서 3,000 rpm으로 15분간 원심분리한 후 상등액을 0.2 μm membrane filter(Dismic-25CS, Toyoroshikaisha, Tokyo, Japan)로 여과하여 유기산 분석을 위한 시료를 준비하였다. 전 처리한 시료 20 μL을 Agilent Hi-Plex Pb Columns (300×7.7 mm, 8 μm, Agilent Technologies, USA)이 장착된 HPLC(Agilent 1200 series, Agilent Co., Forest Hill, Vic, Australia) 시스템에 주입하고 30°C에서 이동상 용매(0.1% phosphoric acid)를 1 mL/min 속도로 이동시키면서 UV 검출기를 이용하여 210 nm에서 유기산을 검출하였다. 유기산은 같은 조건으로 분석한 표준 유기산의 검량선과 비교하여 정량하였다.
시료 0.3 g에 증류수 10 mL를 첨가하여 추출한 후 여과하였다. 여과액에 5-sulfosalicylic acid dihydrate를 1 mL 가한 후, 4°C 냉장고에서 24시간 동안 방치하여 단백질을 침전시켰다. 이를 4,000 rpm으로 15분간 원심분리하여 얻은 상층액을 40°C 이하에서 감압농축기(Rotary evaporator, EYELA N-1100V-W, Tokyo, Japan)를 이용하여 농축 시킨 후, 0.2 M lithium citrate loading buffer(pH 2.2) 5 mL를 첨가하여 용해하였다. 이후 0.45 membrane filter로 여과한 시료 130 μL를 아미노산분석기(Sykam S7130 Aminoacid reagent organiger, Germany)를 이용하여 분석하였다.
시료 1 g을 취해 20 mL headspace sampler용 vial에 넣은 다음 증류수 1 mL를 첨가하였다. 이를 Turbomatrix headspace sampler(PerkinElmer, CA, USA)를 이용하여 headspace oven 120°C에서 20분간 heating한 후, headspace 500 μL를 Clarus 600 GC(Perkinelmer, CA, USA)로 분석하였다. 포집된 향기성분은 GC/MS를 이용하여 분석하였다. 컬럼은 DB-5MS(30 m ×0.25 mm, I.d. 0.25 μm, HP Agilent, USA)로 35°C에서 10분간 유지한 후, 분당 5°C의 속도로 100°C까지 승온한 후 10분간 유지, 분당 10°C의 속도로 210°C까지 승온한 후, 10분간 유지한 뒤 분석하였다. Injector는 200°C에서 split ratio 비율을 1:1로 하였으며, 운반 기체는 헬륨으로 1분에 0.8 mL의 유속으로 사용하였다. 시료의 이온화는 electron impact ionization mode로, ionization voltage는 70 eV로, mass range는 40-450으로 진행하였다. MS의 온도는 interface 250°C, ion source 230°C로 하였다. 질량 분석기로부터 확인된 모든 peak들은 Wiley7Nist0.5 (Wiley7Nist0.5 library, mass spectral search program, version 5.0, USA)를 사용하여 확인하였다.
총폴리페놀 함량은 Folin과 Denis의 방법을 응용하여 측정하였다(Folin과 Denis, 1912). 시료 150 μL, 10% F-C-reagent 300 μL, 700 mM Na2CO3 1,050 μL를 넣고 상온에서 40분 동안 반응시킨 후, 분광 광도계(Multiskan skyhigh spectrophotometer, Thermoscientific, Singapore)를 이용하여 600 nm에서 흡광도를 측정하였다. 총폴리페놀 함량 측정을 위해 표준물질로 gallic acid를 동일한 조건으로 실험하여 결과 값을 통해 표준곡선을 작성하였다. 시료의 총폴리페놀 함량은 μg gallic acid equivalent(GAE)/g으로 산출하였다.
총플라보노이드 함량은 Moreno 등의 방법을 이용하여 측정하였다(Moreno 등, 2000). 시료 125 μL, 5% NaNO2 75 μL, 증류수 150 μL를 혼합하고 6분 뒤, 10% AlCl3 150 μL를 반응시켰다. 이후 5분 뒤, 1 N NaOH 750 μL를 넣고 15분 간 반응시킨 후, 분광 광도계를 이용하여 492 nm에서 흡광도를 측정하였다. 총플라보노이드 함량을 산출하기 위해 표준물질로 quercetin을 동일한 조건으로 실험을 진행하여 얻은 결과 값을 통해 표준곡선을 작성하였다. 시료의 총플라보노이드 함량은 μg quercetin equivalent (QE)/g으로 산출하였다.
DPPH radical 소거 활성 측정은 Hatano 등(1989)의 방법을 변형하여 측정하였다. 자두 주스, 자두 식초, 시판 사과 발효식초(Ottogi, Ulsan, Korea) 각각 100 μL와 60 μM DPPH 용액 100 μL를 96 well plate에 분주하여 빛을 차단시킨 뒤, 실온에서 30분간 반응시켰다. 이 후 분광 광도계를 이용하여 560 nm에서 흡광도를 측정하였다. DPPH radical 소거 활성은 다음의 식으로 계산하였다.
ABTS+ radical 소거 활성 측정은 Re 등(1999)의 방법을 변형하여 측정하였다. 7.4 mM ABTS+ 용액과 2.6 mM potassium을 혼합하여 제조한 ABTS stock solution을 증류수로 10배 희석하여 사용하였다. 자두 주스, 자두 식초, 시판 사과 발효식초(Ottogi, Ulsan, Korea) 각각 100 μL와 ABTS 용액 100 μL를 96 well plate에 분주하여 빛을 차단시킨 뒤, 실온에서 30분간 반응시켰다. 이 후 분광 광도계를 이용하여 600 nm에서 흡광도를 측정하였다. ABTS+ radical 소거 활성은 다음의 식으로 계산하였다.
3. 결과 및 고찰
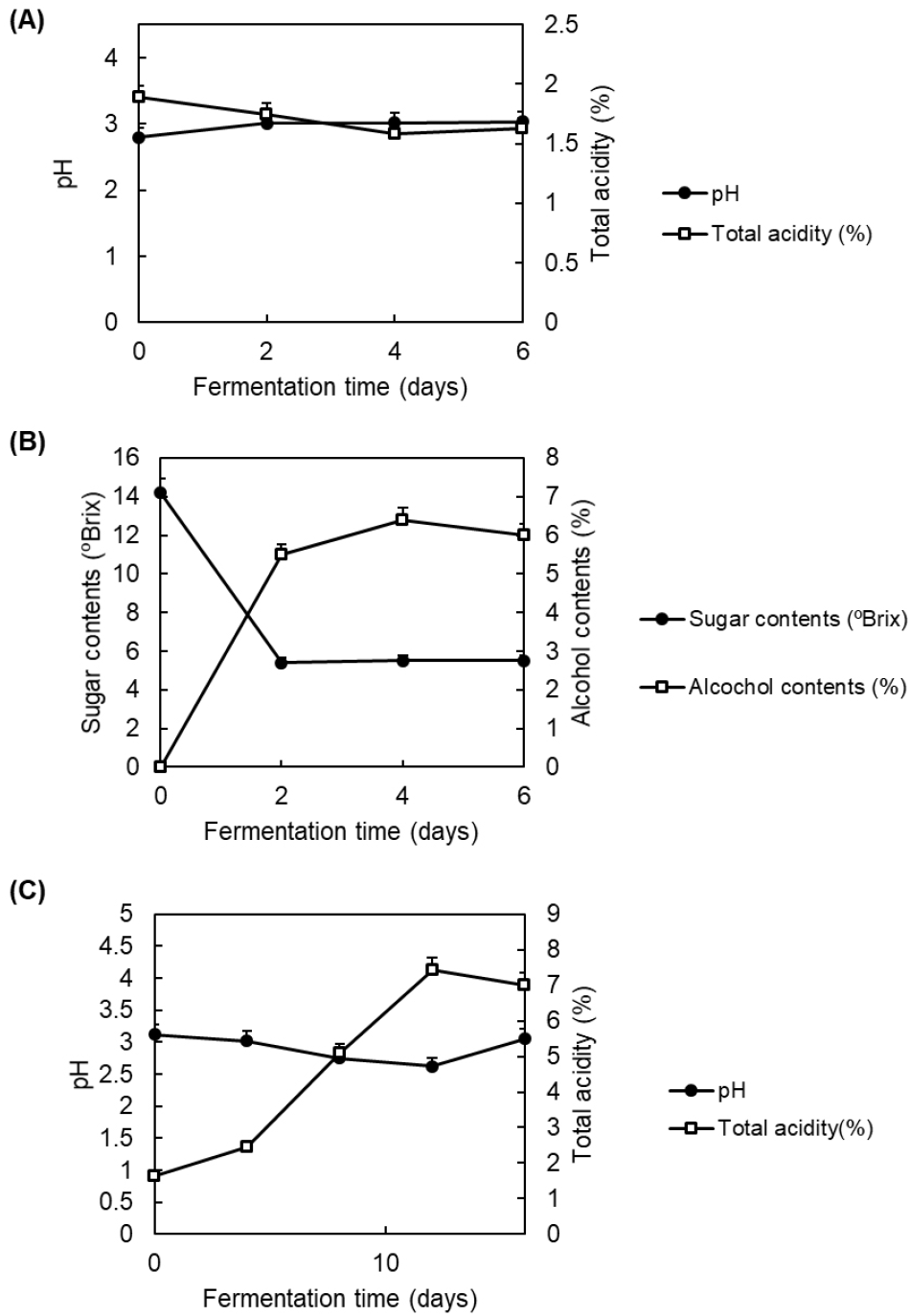
자두식초 제조 과정에서 알코올 발효 과정 중 pH와 총 산도 변화를 측정한 결과를 Fig. 1A에 나타내었다. 알코올 발효가 진행됨에 따라 pH가 초기(0일)에 2.8에서 발효 2일째, 4일째, 6일째에 각각 3.01, 3.02, 3.03의 수치를 나타내었다. 반면 총 산도는 초기(0일)에 1.89에서 발효 2일째, 4일째, 6일째에 각각 1.75, 1.58, 1.63의 수치를 나타내었다. 알코올 발효 과정에서 당도와 알코올 함량의 변화를 측정한 결과를 Fig. 1B에 나타내었다. 알코올 발효가 진행됨에 따라 당도가 초기(0일)에 14.2 °Brix에서 2일째 5.4 °Brix로 급격하게 감소하였고, 그 이후 5.5 °Brix를 유지하였다. 알코올 함량은 발효가 진행됨에 따라 증가하였는데 초기(0일)에 0%에서 2일째에 5.5%로 증가하였고, 6일째에는 6.0%로 나타났다. 결과에서 보듯이 알코올 발효 과정에서 효모가 당을 이용하여 발효하면서 알코올을 생성하는 것을 확인할 수 있었다. 알코올 발효 이후 진행된 초산 발효과정 중 자두식초의 pH 및 산도 측정 결과는 Fig. 1C에 나타내었다. 초산 발효 전 자두식초의 pH는 초기(0일)에 3.12에서 12일째까지 2.62의 수치로 감소하다가 16일째에 3.05의 pH 수치를 나타내어 일부 증가하는 경향을 보였다. 이러한 변화는 발효가 진행되면서 초산균이 알코올을 모두 소비한 이후, 생성된 초산을 다시 분해하여 물과 이산화탄소로 전환하는 대사 활동을 수행하기 때문이다. 이러한 현상은 식초 발효 과정 중에 나타나는 아세테이트 산화(acetate oxidation)로, 초산균의 자연스러운 대사 단계 중 하나로 보고된 바 있다(Saeki 등, 1997). 또한, 초산 발효과정에서 산도는 초기(0일)에 1.63%에서 발효가 진행될수록 7.0%로 증가하였다. 이는 초산 발효가 진행될수록 초산균이 알코올을 에너지원으로 이용하거나, 식초의 주요 유기산인 acetic acid를 생성하기 때문에 pH가 낮아지고 산도가 높아진다는 선행 연구결과와 유사한 경향을 확인할 수 있었다(Park 등, 2002). 자두속에 속하는 복숭아(P. persica L.), 서양자두(P. domestica L.), 매실(P. mume L.)을 원료로 한 발효식초 제조 연구에서도 본 연구결과와 유사한 결과를 확인할 수 있었다(Boonsupa와 Kerdchan, 2021).
자두주스와 자두식초의 유리당 함량을 측정한 결과는 Table 1에 나타내었다. 자두주스의 총유리당 함량은 5,672.74 mg/100 g인 반면 자두식초는 3,445.45 mg/100 g의 수치를 나타내어 자두주스를 발효시킨 뒤 총 유리당 함량이 감소한 수치를 나타내었다. 이는 알코올 발효 과정에서 효모가 당을 소모하여 알코올을 생성하고, 초산 발효에서 알코올이 유기산으로 전환되었기 때문이다(Jung 등, 2018). 각 유리당의 함량 변화를 살펴보면 fructose는 자두주스 및 자두식초에서 각각 3,025.10 mg/100 g 및 865.24 mg/100 g의 수치를 나타내어 약 71.4% 감소하였다. 반면 glucose는 자두주스에서 1,895.48 mg/100 g, 자두식초에서 550.78 mg/100 g의 수치를 나타내어 발효로 인해 약 70.9% 감소하였다. 또한, sucrose는 자두주스에서 752.15 mg/100 g의 수치를 나타내었으나, 자두 식초에서는 검출되지 않았다. Sucrose는 알코올 발효 초기에 효모에 의해 glucose와 fructose로 분해, 전환된 후 에탄올을 만드는 데 모두 소비되는데, 본 연구에서도 발효 과정에 의해 소비된 것으로 보인다(Shin 등, 2002). 또한, maltose는 자두주스에서는 검출되지 않았으나, 자두식초에서 2,029.43 mg/100 g으로 새롭게 검출되었다.
자두주스와 자두식초의 유기산 함량을 측정한 결과는 Table 2에 나타내었다. 자두주스와 자두식초의 유기산 조성을 비교한 결과, 자두주스의 총 유기산 함량은 7,354.26 mg/100 g인 반면 자두식초에서는 5,539.12 mg/100 g으로 약 25% 감소한 수치를 확인할 수 있었다. 각 종류별 유기산 함량을 확인했을 때, 발효를 통해 acetic acid가 새롭게 생성되어 식초의 주된 유기산으로 존재함을 확인할 수 있었고, 반면 일부 유기산은 발효 전에 비해 감소하거나 검출되지 않았다. 이는 오디를 이용하여 발효식초를 제조한 연구와 유사한 연구결과를 나타내었다 (Yim 등, 2023). Oxalic acid는 자두주스 6,956.04 mg/100 g에서 자두식초 2,101.12 mg/100 g으로 약 70% 감소하였고, 이와 유사하게 succinic acid도 자두주스 292.32 mg/100 g 으로 검출된 반면 자두식초 248.86 mg/100 g으로 감소하였다. 또한 malic acid는 자두주스 105.90 mg/100 g 검출되었고 자두식초에서는 불검출 되었다. 이는 발효 과정에서 이들 유기산이 효모 및 초산균의 에너지로 활용되어 분해되었거나, 다른 대사산물로 전환되었을 것으로 사료된다(Joo 등, 2009). Citric acid와 formic acid는 자두주스와 자두식초 모두 검출되지 않았다. Acetic acid는 자두주스에는 불검출되었으나, 자두식초에서 3,189.13 mg/100 g으로 그 함량이 증가하였다. 식초의 품질 특성을 확인할 수 있는 지표인 acetic acid는 초산발효에 의해 생성되는 식초의 주요 유기산으로서, 사과식초, 매실식초, 아로니아식초 제조 연구에서의 acetic acid 함량과 본 연구에서 acetic acid 함량이 유사한 수치임을 확인하여 초산균에 의한 초산발효가 잘 이루어졌음을 알 수 있었다(Hwang과 Nhuan, 2020; Ko 등, 2007; Seo 등, 2001).
자두주스와 자두식초의 유리아미노산 함량을 측정한 결과는 Table 3에 나타내었다. 발효 과정에서 자두식초의 유리아미노산 총량은 자두주스에 비해 현저히 증가하였다. 자두주스의 총유리아미노산 함량이 약 39.0 mg/100 g이었던 데 반해, 자두식초에서는 219.0 mg/100 g으로 약 5.6배 증가하였다. 이는 발효 중 미생물이 자신의 세포를 구성하는 아미노산을 방출하거나, 효소 작용으로 자두 내 단백질, 펙틴 등이 가수분해되어 유리아미노산이 증가한 결과로 사료된다(Jeong 등, 2000). Alanine은 자두주스 0.66 mg/100 g에서 자두식초 67.86 mg/100 g으로 약 100배 증가하였는데, 이는 발효 후 자두식초에서 가장 높은 함량을 보이는 유리아미노산으로서 총아미노산의 약 30%를 차지하였다. Alanine은 단맛을 내는 아미노산이므로 식초의 단맛에 영향을 주고, 발효 중 미생물의 단백질 분해 산물로 대량 방출된 것으로 판단된다(Jeong 등, 2000). GABA는 자두주스 1.85 mg/100 g에서 자두식초 7.28 mg/100 g으로 약 4배 증가하여 검출되었다. GABA는 신경안정 및 혈압강하 효과 등으로 알려진 기능성 아미노산으로, 자두식초로의 발효 과정에서 현저히 증가하여 식초의 건강기능성을 증진시키는 데 기여할 것으로 사료된다(Park, 2010). 이 외에도 glycine(0.40→5.64 mg), aspartic acid(0.89→10.10 mg), glutamic acid(1.03→4.72 mg), threonine(0.35→4.73 mg) 등 다수의 아미노산이 수 배에서 수십 배까지 증가하였다. 특히 필수아미노산인 valine (1.41→4.26 mg), leucine(0.32→6.33 mg), isoleucine(0.11→2.55 mg), lysine(0.13→8.90 mg), arginine(1.71→8.60 mg) 등의 함량도 증가하여 자두주스 발효 후 자두식초의 필수아미노산 함량이 향상되었음을 알 수 있었다. Ammonia 함량은 12.95 mg/100 g에서 46.46 mg/100 g으로 약 3.6배 증가하였다. 이러한 증가는 아미노산 탈암모니아 반응과 질소 대사 결과에 의해 ammonia가 축적되었기 때문으로 판단된다. 이러한 경향은 배를 이용한 발효 식초의 품질 특성을 연구에서도 유사하게 보고된 바 있으며(Park, 2010), 생성된 ammonia는 식초의 향이나 맛, pH에 영향을 미치는 것으로 알려져 있다. 또한, 활성산소종 제거 능력과 관련하여 항산화 활성이 보고된 taurine (4.10→6.91 mg), methionine(0.00→0.81 mg), tyrosine(1.38→4.71 mg), tryptophan(0.17→0.44 mg)과 같은 아미노산의 함량 역시 발효 과정에서 증가하는 경향을 보여, 자두식초의 항산화 기능성 증진에 기여한 것으로 판단된다(Kim 등, 2011). 이와 같이 발효를 통해 유리아미노산 함량이 전반적으로 증가하는 것으로 나타났고, 특히 GABA 등 기능성 아미노산 증가로 인해 자두식초의 건강기능성이 증진될 것으로 보이며, 이 외 필수아미노산이나 항산화 활성에 관여하는 아미노산도 증가함으로서 항산화 기능성 식초로서의 활용 가능성을 확인할 수 있었다.
자두주스와 자두식초의 휘발성 향기성분 함량을 측정한 결과는 Table 4에 나타내었다. GC-MS로 분석된 향기성분의 총 피크 면적 대비 상대적 함유율(%)을 비교한 결과, 발효 유래 향기 물질들이 자두식초의 주요 향기성분으로 확인되었다. 반면, 초기 자두과즙의 고유 향기성분 중 일부는 발효 과정에서 감소하거나 소실되었다. 특히 1-butanol과 phenylethyl alcohol이 자두식초의 주요 향기성분으로 검출되었으며, 각각 전체 향기 성분의 약 20.43%와 29.94%의 피크 면적을 나타내었다. 이들은 자두주스에서는 검출되지 않았던 화합물로, 1-butanol은 발효취를, phenylethyl alcohol은 장미 향과 유사한 floral 향을 부여하는 물질로 알려져 있다(Zhu 등, 2003). 이러한 결과는 발효 과정에서 미생물 대사에 의해 생성된 특징적인 결과로 판단된다. 또한, 발효 과정 중 초산, 부티르산, 이소발레르산(3-메틸부탄산), 카프릭산(데칸산) 등 휘발성 유기산류 함량이 증가하여 식초 특유의 신맛과 자극적인 향을 형성하였다. 예를 들어 n-데칸산(C10:0) 함량은 자두주스에서는 0.61%인 반면 자두식초에서는 8.08%로 증가하였다. 이러한 중쇄 지방산들은 발효 미생물 대사산물로 알려져 있으며, 식초의 향미 복합성 향상에 기여한다(Jeong 등, 1999). 이 밖에도 식초 발효에서 과일향으로 알려진 ethyl ester octanoic acid가 자두식초에서 검출(2.16%)되어 풍부한 풍미를 형성한 것을 확인할 수 있었다. 반면 소량이지만 propanoic acid는 자두주스에서 1.18%였던 것이 식초에서 0.32%로 감소하여, 상대적으로 초산 등 다른 산들이 발효에 의해 우세해졌음을 확인할 수 있었다. 또한 자두주스에 존재했던 benzyl alcohol, phenol, β-humulene 등의 일부 향기성분은 발효 후 함량이 감소하거나 거의 사라졌다. 예를 들어, β-humulene 은 3.33%에서 0.31%로, phenol은 2.29%에서 0.35%로 감소하였다. 이는 발효 과정에서 자두 고유의 상큼한 과일향 성분이 휘발하거나 새로운 발효향에 의해 가려진 결과로 해석된다. 본 연구에서 검출된 휘발성 화합물은 GC/MS를 이용하여 library의 질량스펙트럼 및 retention index를 비교함으로써 후보물질로 동정하였다. 따라서 본 결과는 후보물질의 상대적 경향을 비교한 것으로, 동일한 화합물이 오미자, 머루, 복분자 등 과일을 이용하여 제조한 발효식초에서도 주요 향기성분으로 보고된 바 있다(Choi 등, 2018; Kim 등, 2020). 이러한 결과는 자두식초에서도 발효 과정에서 공통적인 미생물 대사 경로를 통해 초산, 알코올, 지방산, 에스터류 화합물이 생성됨을 시사한다. 특히 phenylethyl alcohol과 benzyl alcohol은 식초의 floral 향에, acetic acid와 hexanoic acid는 산미(acidic) 향에 기여하는 것으로 알려져 있으며, 이들의 조합이 자두식초의 고유한 향 특성을 부여하는 주요 요인으로 판단된다. 이상의 결과를 종합하면, 자두식초는 자두주스의 발효를 통해 생성된 새로운 향기성분들은 식초의 풍미를 높여 기능적 음용식초로서의 가치와 매력을 향상시키는 것으로 사료된다.
자두주스와 자두식초의 총폴리페놀 및 총플라보노이드 함량을 측정한 결과는 Table 5에 나타내었다. 자두를 첨가하여 제조한 발효식초의 총폴리페놀 및 총플라보노이드 함량은 발효 전후 및 시판 사과식초와 비교했을 때 뚜렷한 차이를 보였다. 자두주스는 발효 전 폴리페놀과 플라보노이드 함량이 풍부하였으며, 발효 후 일부 감소가 있었지만, 상당량이 자두식초에 유지되었다. 반면, 사과식초는 이들 함량이 현저히 낮았다. 구체적인 수치를 비교하면, 총폴리페놀 함량은 자두주스가 130.23± 0.71 μg GAE/g, 자두식초가 118.66±0.32 μg GAE/g의 수치를 나타내어 발효 후 약 9% 감소함을 알 수 있었다. 발효로 인해 폴리페놀 함량이 일부 감소되었으나, 시판 사과식초의 폴리페놀 함량 26.40±0.48 μg GAE/g에 비해 약 4.5배 높은 수준임을 알 수 있었다. 이는 원재료인 자두가 폴리페놀을 풍부하게 함유하고 있으며, 발효 과정에서도 상당 부분이 안정적으로 유지되었기 때문으로 판단된다. 총플라보노이드 함량은 자두주스가 346.43±10.83 μg QE/g, 자두식초가 38.93±6.38 μg QE/g의 수치를 나타내어, 발효 후 약 89% 감소하였다. 이는 발효 중 산화 및 침전에 의해 플라보노이드가 손실된 것으로 해석된다. 그럼에도 불구하고 자두식초의 플라보노이드 함량은 시판 사과식초(4.14±1.59 μg)에 비해 약 9.4배 높아, 일정 수준의 플라보노이드가 잔존함을 알 수 있다. 이상의 결과를 종합하면, 자두식초는 발효 과정에서 총폴리페놀은 일부 감소하였으나 상당량 유지되었고, 총플라보노이드는 큰 폭으로 감소하였음에도 불구하고 여전히 시판 사과식초에 비해 높은 함량을 나타내어, 항산화 측면에서 유익한 기능성 식초 소재임을 알 수 있었다.
| Sample | |||
|---|---|---|---|
| Plum juice | Plum vinegar | Apple vinegar1) | |
| Total polyphenol (μg GAE/g) | 130.23±0.712)a3) | 118.66±0.32b | 26.40±0.48c |
| Total flavonoid (μg QE/g) | 346.43±10.83a | 38.93±6.38b | 4.14±1.59c |
DPPH 용액이 수소 원자를 공여할 수 있는 항산화 물질과 결합하면 환원된 형태로 전환되면서 그 색이 탈색되는데, 이러한 원리를 이용하여 항산화 소재 탐색에 널리 활용되고 있다(Kedare와 Singh, 2011). 또한, ABTS는 과황산칼륨과 함께 반응시키면 양성자화된 ABTS⁺라는 radical을 생성하는데, 항산화 물질과 반응 시 이 radical이 소거되면서 흡광도가 감소한다(Floegel 등, 2011). 이들의 변화된 흡광도 수치를 이용하여 항산화 기능성을 평가하는 대표적인 지표로 사용되고 있다. 최근 항산화 기능성이 알려진 양파, 복분자, 아로니아 등 식품 소재를 첨가하여 제조한 기능성 식초 연구에서, 이들 radical 소거 활성 측정을 통해 항산화 기능성을 평가하고자 하는 연구가 활발히 이루어지고 있다(Hong 등, 2012; Hwang과 Nhuan, 2020; Kim 등, 2022). 본 연구에서도 자두주스와 자두식초의 항산화 활성을 평가하기 위해 DPPH 및 ABTS+ radical 소거 활성을 측정하였으며, 그 결과는 Table 6에 나타내었다. DPPH radical 소거능 측정 결과에서 자두주스는 20.57%, 자두식초는 51.90%의 수치를 나타내어 발효과정을 거친 자두식초의 DPPH radical 소거능이 약 2.5배 증가되어 항산화 활성이 개선되었음을 알 수 있었다. 또한, 시판 사과식초의 DPPH radical 소거율은 9.96%의 수치를 나타내어, 자두주스 및 자두식초 모두에서 시판 사과식초에 비해 높은 DPPH radical 소거 활성을 나타내었다. 특히 자두식초는 시판 사과식초 대비 5배 이상 높은 DPPH radical 소거 활성을 나타냄을 알 수 있었다. ABTS+ radical 소거 활성 측정 결과에서, 자두주스 및 자두식초는 각각 89.93% 및 89.03%의 수치를 나타내어 발효 전후 모두 높은 ABTS+ radical 소거 활성을 나타내었다. 또한, 시판 사과식초의 ABTS+ radical 소거율은 54.38%의 수치를 나타내어 자두식초의 약 61% 수준에 그침에 따라, 자두식초의 우수한 radical 소거 활성을 확인할 수 있었다. 따라서 두 가지 radical 소거 활성을 통해 자두식초의 DPPH 및 ABTS+ radical 소거능이 시판 사과식초에 비해 우수함을 알 수 있었다. 이는 자두식초에 포함된 폴리페놀 및 플라보노이드 함량이 시판 사과식초에 비해 높았는데, 이러한 요인에 기인한 것으로 판단된다. 폴리페놀 및 플라보노이드는 radical 소거능에 직접적으로 관여하는 항산화 물질로 알려져 있으며, 폴리페놀은 자두식초로 발효 후에도 다량 함유되어 있어 항산화 활성을 나타낸 것으로 보인다. 이 외에도, 자두식초에는 폴리페놀 및 플라보노이드 성분 외에도 유기산이 함유되어 있어, 이들 유기산의 항산화 작용에 의해 높은 radical 소거 활성을 나타낸 것으로 사료된다(Lee 등, 2011). 또한, 자두에는 cyanidin을 비롯한 anthocyanin 계열 색소가 풍부하게 함유되어 있으며, 식초와 같은 산성 조건에서는 anthocyanin이 안정화되어 항산화 활성이 증가하는 것으로 알려져 있다(Hwang과 Nhuan, 2020). 따라서 본 연구에서도 이러한 anthocyanin의 안정화가 자두식초의 항산화 활성 유지에 기여한 것으로 판단된다. 본 연구를 종합하였을때, 자두를 첨가한 발효식초는 시판 사과식초 대비 우수한 radical 소거 활성을 통해 항산화 활성을 나타내었으며, 이는 자두 유래 풍부한 폴리페놀 및 플라보노이드, 발효 중 생성된 부가적인 항산화 인자들의 효과로 해석된다. 본 연구에서 자두를 이용한 발효 식초의 품질 특성과 항산화 활성을 평가한 결과, 발효 과정 중 다양한 이화학적 변화와 향기 성분이 검출되었다. 다만, GC/MS 분석으로 후보물질 수준의 동정에 그쳤으므로, 추후 주요 화합물에 대한 표준물질 검증 및 정량적 분석이 추가로 이루어진다면 보다 명확한 향기 특성 규명이 가능할 것으로 판단된다. 또한 본 연구의 항산화 활성 평가는 in vitro 항산화 활성 평가에 국한되어 있어 실제 생체 내 효능을 직접적으로 반영하기에는 한계가 있으므로, 향후 연구에서는 세포 및 동물 수준의 효능 검증에 대한 연구가 필요하다. 또한 관능평가를 통한 소비자 기호도 및 감각적 품질 평가가 병행된다면 자두식초의 기능성과 산업적 가치를 보다 구체적으로 제시할 수 있을 것으로 사료된다.
| Sample | |||
|---|---|---|---|
| Plum juice | Plum vinegar | Apple vinegar1) | |
| DPPH radical | 20.57±4.382)b3) | 51.90±0.97a | 9.96±1.72c |
| ABTS+ radical | 89.93±0.96a | 89.03±0.69b | 54.38±0.27c |
4. 요약
본 연구에서는 자두를 첨가하여 단행복발효 공정을 통해 제조한 식초의 이화학적 특성 변화와 in vitro 항산화 활성을 확인하였다. 발효 후 자두식초의 유리당은 fructose, glucose, maltose로 확인되었으며, 주요 유기산은 acetic acid, oxalic acid, succinic acid로 나타났다. 또한 GABA와 같은 기능성 아미노산을 포함한 유리아미노산 함량이 발효 전에 비해 증가하였다. 향기 성분 분석 결과, 자두의 고유한 과일향은 감소하고 발효향이 두드러짐으로써 관능적 특성이 변화되었다. 발효 후 총폴리페놀과 총플라보노이드 함량은 일부 감소하였으나, 시판 사과식초보다 높은 수준을 유지하였다. 발효 전 자두주스에 비해 자두식초의 DPPH radical 소거능이 유의적으로 증가하였으며, 특히 시판 사과식초에 비해 우수한 DPPH 및 ABTS+ radical 소거능을 보여 자두식초의 항산화 활성을 확인할 수 있었다. 이러한 분석 결과는 자두식초가 건강증진을 위한 기능성 식품 소재로 활용될 가능성을 시사하며, 향후 자두식초의 기능성 성분과 생리활성 효과에 대한 추가 연구를 통해 그 가치가 더욱 부각될 것으로 기대된다.










