1. 서론
포스트바이오틱스(postbiotics)는 프로바이오틱스(probiotics) 균주를 배양하는 과정에서 만들어지는 다양한 유익 성분들을 의미한다. 그 중 세포막 소포체(membrane vesicle, MV 또는 extracellular vesicles)는 나노입자 크기의 구조로, 최근 장 건강 및 기능성 물질의 전달 측면에서 주목받고 있다(Kim 등, 2022). 여러 연구에 따르면, MV는 프로바이오틱스의 발효 과정에서 식물 유래 대사산물, 예를 들어 플라보노이드 등의 기능성 성분을 내재화하여 장 상피세포 또는 하부 조직으로 직접 운반하는 역할을 수행할 수 있다고 한다(Kim 등, 2023; Liu 등, 2018).
한편, 플라보노이드와 같은 식물 기능성 성분은 식품 형태로 섭취 시 소화 ․ 흡수 과정에서 생체이용률이 매우 낮다(Han 등, 2013). 식이 플라보노이드의 경우, 체내 흡수율은 섭취량의 약 1% 미만에 불과하다는 결과가 보고되어 있으므로(Han 등, 2013), 이들의 전달 효율을 높일 새로운 접근법의 개발이 필요한 상황이다. MV가 이런 플라보노이드의 수송체로 작용하면 생체이용성을 효과적으로 향상시킬 가능성이 있다.
효과적인 포스트바이오틱스 생산과 기능성 발효식품 개발을 위해서는 MV와 기능성 플라보노이드 함량이 높은 발효물의 제조가 선행되어야 한다. 이를 위해 플라보노이드가 풍부한 식물 추출물을 사용하고, 프로바이오틱스 균주의 성장에 유리한 프리바이오틱스가 포함된 배지를 개발하는 것이 필요하다. 식물 추출물이나 균주가 기능성을 가질 경우, 발효물에서도 기능성을 추가하는 시너지 효과가 기대된다.
새싹보리에는 베타글루칸(bata-glucans) 등 식이섬유가 풍부하게 함유되어 있으며(Lam과 Cheung, 2013), 고구마 껍질에는 이눌린(inulin), 케스토스(kestose), 레반비오스(levanbiose) 등 여러 올리고당이 존재하여 이들이 유산균의 먹이로 사용될 수 있어 유산균의 성장에 긍정적인 환경을 제공한다(Carlson 등, 2017). 도라지, 더덕, 고구마껍질 혼합 추출물은 면역 증진 효과도 보고된 바 있고(Jeong 등, 2019; Jeong 등, 2020), 김치 유래 유산균(Leuconostoc mesenteroides, Lactiplantibacillus plantarum, Latilactobacillus curvatus, Latilactobacillus sakei)과 이들의 MV는 면역 조절 등 다양한 건강 기능 효과가 있다는 사실이 알려져 있다(Kim 등, 2022; Liu 등, 2018). 특히, 새싹보리, 도라지, 더덕, 고구마껍질 및 생배추 혼합물에 Leuconostoc mesenteroides로 발효한 시료에서 우수한 면역증진 효과가 관찰된 바 있다(Kim 등, 2023).
본 연구는 김치에서 유래한 유산균(Leuconostoc mesenteroides, Lactiplantibacillus plantarum, Latilactobacillus curvatus, Latilactobacillus sakei)이 잘 증식할 수 있도록 다양한 프리바이오틱스 함유 식물 추출물 인공배지를 개발하고, 이들 유산균 발효물이 항산화 효과와 소화효소 활성에 미치는 영향을 알아보고자 한다. 이러한 접근을 통해 MV 기반의 플라보노이드 세포 수송 기전 연구를 위한 기초 결과들을 제시하고, 기능성 포스트바이오틱스 개발의 새로운 방향성을 제시할 수 있을 것이다.
2. 재료 및 방법
새싹보리 분말은 전라북도 고창에서 재배되는 약 20 cm 자란 보리를 수확하여 씻어, 건조 및 분쇄하여 살균(121°C, 15 min)한 것을 사용하였다(Kim 등, 2023). 배추, 도라지, 더덕 그리고 고구마는 광주광역시 대형마트에서 구입하여 깨끗이 씻은 후 배추, 도라지 그리고 더덕은 건조하였고, 고구마는 껍질(1-5 mm)을 얻어 건조하였다. 건조한 시료들은 분쇄하였고, 도라지(Platycodon grandiflorum, PG) 분말, 더덕(Codonopsis lanceolata, CL) 분말 그리고 고구마껍질(sweet potato peel, SPP) 분말은 1:1:3 비율로 섞은 것을 식물혼합물이라 하였다. 분말 시료에 시료의 20배의 증류수를 더한 후, 50°C에서 24시간 흔들면서 추출하였다. 추출물은 여과지로 여과한 후 오토클레이브로 멸균하였다. 멸균한 시료는 균이 없는지를 확인 후 무균일 때 시료로 사용하였다.
Leuconostoc mesenteroides KCTC3530(Lm), Lactiplantibacillus plantarum KCTC3104(Lp), Latilactobacillus curvatus KCTC3767(Lc), 그리고 Latilactobacillus sakei KCTC3603(Ls) 균주를 한국생명공학연구원 생물자원센터에서 분양받아 사용하였다(Kim 등, 2023). 50 mL 코니칼 튜브(conical tube)에 Table 1과 같이 시료를 넣고, 선행 연구(Kim 등, 2023) 결과에 근거하여 유산균 수가 104 colony-forming units(CFU)/g이 되도록 접종하였다. Table 1에서 T1부터 T7까지는 식물 혼합물 조성이 각각 다른 7종 시험(Test, T) 시료를 의미한다. 또한 T1-Con, T1-Lm, T1-Lp, T1-Lc 및 T1-Ls는 각각 T1 시료에 대한 처리 조건을 나타내며, T1-Con은 유산균 무처리군, T1-Lm, T1-Lp, T1-Lc 그리고 T1-Ls는 각각 Lm, Lp, Lc, Ls 유산균을 접종한 시료이다.
유산균이 접종된 시료는 3일간 배양되었으며, 2일차와 3일차에 유산균 수를 측정하였다. 기능성 평가는 배양 3일째에 채취한 발효물을 사용하였다. 배양된 발효물 100 μL를 MRS agar plates(Difco BD, Sparks, MD, USA)에 도말하고, 37°C에서 2일간 배양하였다. 형성된 콜로니(colony) 수는 반복 측정하여 평균값을 산출하였으며, 유산균 수는 CFU/g으로 나타내었다.
항산화 및 소화효소 활성 실험에 사용된 시료는 발효물을 15분 동안 4,000 ×g로 원심분리하여 분리한 상층액을 동결 건조하여 제조하였다. 동결 건조된 시료는 Table 1의 시료 라벨에 FD(freeze drying)를 추가하여 구분하였으며, 예를 들어 T1-Lm의 동결 건조한 시료는 FD-T1-Lm으로 표시하여 구별하였다.
트립신 활성 측정은 식품의약품안전처 식품의약품안전평가원에서 발간된 건강기능식품 기능성 평가 가이드(위 건강 관련)(Ministry of Food and Drug Safety, 2020) 및 Lee 등(2023)의 방법을 사용하여 측정하였다.
트립신(trypsin) 활성 측정을 위하여 10 mM sodium acetate buffer(pH 7.5; Sigma-Aldrich Co., St. Louis, Mo, USA)에 트립신(trypsin from porcine pancreas; Sigma-Aldrich Co.)을 녹여 최종 농도가 0.01%가 되도록 한 후, 10 mg/mL 농도로 준비한 각 시료 0.185 mL와 0.01% 트립신 0.015 mL를 혼합하여, 37°C에서 10분간 반응시켰다. 기질로는 azocasein(Sigma-Aldrich Co.)을 사용하였는데, 이를 pH 7.5의 phosphate buffer에 녹여 3% 용액으로 만들었으며, 이 중 0.8 mL를 혼합물에 첨가하고 37°C에서 30분간 처리하였다. 반응을 멈추기 위하여 110 mM 농도의 trichloroacetic acid(TCA; Sigma-Aldrich Co.) 1.0 mL를 가한 후, 상온에서 15분간 방치하여 단백질 침전을 유도하고, 10,000 ×g에서 20분간(20°C) 원심분리하였다. 이후, 1.2 mL의 상층액과 1.4 mL의 1 N NaOH를 혼합한 후, 440 nm에서 흡광도를 측정하였다. 즉, 시료가 트립신 활성 촉진에 미치는 영향을 알아보았다.
Wu 등(2022)의 방법을 약간 변형하고 Lee와 Chung(2024)의 방법으로 α-아밀라아제 활성을 측정하였다. Starch azure(기질; Sigma-Aldrich Co.) 0.2% 용액은 pH 6.9의 0.5 M Tris-HCl 완충액을 사용하여 준비한 후, 5분간 가열 처리한 뒤 냉각시켰다. 이후 1.5 mL 튜브에 10 mg/mL 농도의 시료 0.2 mL, 5 unit α-아밀라아제(α-amylase from porcine pancreas; Sigma-Aldrich Co.) 용액 0.2 mL, 그리고 준비한 0.2% starch azure 0.3 mL를 넣고 혼합한 후 37°C에서 10분 동안 반응시켰다. 반응이 끝난 뒤에는 50% 농도의 acetic acid(Sigma-Aldrich Co.) 0.1 mL를 첨가하여 혼합한 뒤, 4°C에서 10분간 1,000 ×g로 원심분리하여, 그 후 상층액을 취해 595 nm에서 흡광도를 측정하였다. 즉, 시료가 α-아밀라아제 활성 촉진에 미치는 영향을 알아보았다.
트립신 활성과 α-아밀라아제 활성은 대조군(효소와 기질만 처리한 군)에 대한 시료 첨가군(효소, 기질, 시료 모두 처리한 군)의 흡광도를 비교하여 산출하였다. 즉 시료 첨가군의 흡광도를 대조군의 흡광도로 나누어 대조군 대비 상대적 활성(배수)으로 나타내었다(Lee와 Chung, 2024).
총폴리페놀 함량은 Folin-Ciocalteau 방법(Singleton 등, 1999)을 변형한 Lee와 Chung(2024)의 방법을 사용하였고, 총플라보노이드 함량은 Lee 등(2012)의 방법에서 일부 변경한 Lee와 Chung(2024) 방법을 사용하였다.
총폴리페놀 함량 측정은 다음과 같이 수행하였다. 먼저, 발효물을 원심 분리한 상층액의 동결 건조물을 희석한 시료(10 mg/mL) 0.6 mL를 튜브에 넣고, 0.6 mL, Folin-Ciocalteau 시약(Sigma-Aldrich Co.) 0.3 mL, 10% 탄산나트륨(Na2CO3, Sigma-Aldrich Co.) 0.3 mL를 순서대로 첨가하였다. 혼합된 시약은 암실에서 실온 상태로 1시간 반응시킨 뒤, 760 nm에서 흡광도를 측정하였다. 대조군은 시료를 첨가하지 않은 무첨가구이었다. 표준물질로는 gallic acid(Sigma-Aldrich Co.)를 사용하였고, 0-1 mg/mL 농도의 gallic acid 표준용액을 동일한 방법으로 처리하여 검량선을 작성한 뒤, 이를 바탕으로 총폴리페놀 함량을 계산하였다. 최종 결과는 추출물 동결건조물 1 g당 mg gallic acid equivalent(GAE)로 나타내었다.
총플라보노이드 함량 측정은 다음과 같이 진행하였다. 희석한 시료(10 mg/mL) 또는 표준물질인 quercetin을 0-2 mg/mL 농도로 제조한 후, 각각 시료 1 mL를 튜브에 취하였다. 여기에 5% NaNO2 용액 30 μL를 첨가하고 잘 혼합한 뒤, 실온에서 5분간 반응시킨 후, 1 M NaOH 0.2 mL를 반응 혼합물에 가하여 다시 혼합하였다. 이후 UV/Visible 분광광도계(Ultrospec 3000, Pharmacia Biotech, Cambridge, UK)를 사용하여 510 nm에서 흡광도를 측정하였다. 표준물질의 흡광도를 바탕으로 검량선을 작성하였으며, 총플라보노이드 함량은 동결건조 시료 1 g당 mg quercetin equivalent(QE)로 나타내었다.
시료의 항산화 활성을 평가하기 위해 2,2-diphenyl-β-picrylhydrazyl(DPPH; Sigma-Aldrich Co.) 라디칼 소거 활성을 분석하였다(Lee와 Chung, 2024). 실험에 사용된 시료는 각각 0.5, 1, 5 그리고 10 mg/mL의 농도로 조제하였으며, 시료 180 μL와 1.5×10−4 M DPPH 용액 120 μL를 혼합한 뒤 37°C에서 30분간 반응시켰다. 반응 후 혼합액의 흡광도는 517 nm에서 측정하였다. 1, 2.5, 5, 10, 25, 50, 100 μg/mL 농도의 ascorbic acid를 양성 대조군으로 준비하여 동일한 방법으로 분석하였으며, 음성 대조군은 시료 대신 증류수를 사용하였다. DPPH 라디칼 소거율은 다음 식을 이용하여 계산하였으며, 결과는 %로 표시한(Lee와 Chung, 2024) 다음 50%의 소거 활성을 나타내는 시료 농도인 IC50값으로 나타내었다. [1 − (시료의 흡광도 / 대조군의 흡광도)] × 100
모든 실험의 시료는 같은 시료를 3개 이상을 사용하였고, 결과들의 통계 처리는 SPSS(Statistical Package for the Social Science) version 27 프로그램(SPSS Inc., Chicago, IL, USA)을 이용하여 평균(mean)±표준편차(standard deviation, SD)로 표시하였다. 실험군간의 평균값은 일원배치 분산분석(one-way ANOVA)을 하였고, 유의적 결과가 나온 변수는 사후검정(Duncan’s multiple range test)을 실시하였으며, 모든 실험 결과의 유의성은 p<0.05 수준으로 검정하였다(Lee와 Chung, 2024).
3. 결과 및 고찰
Table 1의 조성물을 37°C에서 3일간 발효시키며, 발효 1일차, 2일차, 3일차에 각각 유산균의 생장을 확인하였다. 각 발효 시점에서 시료를 채취하여 MRS agar plates에 도말하고 배양하여 유산균 수를 정량하였으며, 발효 2일차 및 3일차의 유산균 수는 Table 2에 제시하였다.
각 조성물에는 유산균 균주 Lm, Lp, Lc, Ls를 각각 104 CFU/g 농도로 접종하였다. 그 결과, 배추 분말과 배추 추출물만 함유된 조성물인 T3(T3-Lm, T3-Lp, T3-Lc, T3-Ls) 및 T4(T4-Lm, T4-Lp, T4-Lc, T4-Ls)에서는 발효 1일차에 유산균의 성장이 확인되지 않았다(data not shown). 반면, 새싹보리 분말 또는 새싹보리 추출물이 포함된 조성물에서는 발효 1일차부터 유산균이 생장하는 것이 관찰되었다(data not shown).
T3 및 T4 조성물에서도 발효 2일차부터는 유산균의 생장이 시작되었으며, 발효 3일차에는 특히 Lm 및 Lc를 접종한 군에서 유산균 수가 2×108 CFU/g 이상으로 증가하였다. 같은 조성물에서 Lp 및 Ls보다 Lm과 Lc의 생장이 더 잘 되었다(Table 2).
새싹보리 추출물과 새싹보리 분말을 포함한 T1(T1-Lm, T1-Lp, T1-Lc, T1-Ls) 및 T2(T2-Lm, T2-Lp, T2-Lc, T2-Ls)에서는 배양 1일차부터 유산균의 활발한 생장이 관찰되었으며(data not shown), 발효 2일차에는 Lm 및 Lp를 접종한 T1-Lm, T1-Lp, T2-Lm, T2-Lp에서 유산균 수가 1×108 CFU/g 이상에 도달하였다. 발효 3일차에는 T1-Lm, T1-Lp, T2-Lm, T2-Lp의 유산균 수가 각각 10.65×108, 9.04×108, 6.97×108, 4.77×108 CFU/g으로 측정되었다. 새싹보리 추출물이 포함된 조성물에서는 Lm과 Lp의 생장이 Lc 및 Ls보다 높게 나타났다. 또한, Lm과 Lp는 새싹보리 분말이 포함된 조성물보다 새싹보리 추출물이 포함된 조성물에서 유의적으로 더 많이 증식하였다. 이러한 결과를 통해, 배추 추출물에 비해 새싹보리 추출물이 Lm, Lp, Lc, Ls 모두에게 더 적합한 인공 배지로 활용될 수 있음을 확인할 수 있었다.
기능성을 향상시키고 유산균의 생장을 촉진할 수 있는 인공배지를 개발하기 위해, 새싹보리 추출물에 배추 추출물 또는 식물혼합물 추출물을 첨가하여 이들이 유산균 생장에 미치는 영향을 분석하였다.
우선, 새싹보리 추출물에 배추 추출물을 첨가한 조성물(T5-Lm, T5-Lp, T5-Lc, T5-Ls)과 새싹보리 추출물 단독 조성물(T1-Lm, T1-Lp, T1-Lc, T1-Ls)을 비교한 결과, 배추 추출물의 첨가는 Lm, Lp, Lc 그리고 Ls의 생장에 뚜렷한 영향을 주지 않는 것으로 나타났다(Table 2).
다음으로, 새싹보리 추출물에 배추 추출물과 식물혼합물 추출물을 함께 첨가한 조성물(T6-Lm, T6-Lp, T6-Lc, T6-Ls)과 T1 조성물(T1-Lm, T1-Lp, T1-Lc, T1-Ls)을 비교하였을 때, Lm, Lp 그리고 Ls의 유산균 수에는 차이가 없었으나, Lc는 유의적으로 증가한 것으로 확인되었다.
이에 따라, 식물혼합물 추출물의 단독 효과를 평가하기 위해 식물혼합물 추출물만을 새싹보리 추출물에 첨가한 조성물(T7-Lm, T7-Lp, T7-Lc, T7-Ls)과 새싹보리 추출물 단독 조성물(T1-Lm, T1-Lp, T1-Lc, T1-Ls)을 비교하였다. 그 결과, Lm, Lp, Ls에서는 유의한 차이가 없었으나, Lc에서는 유산균 수가 유의적으로 증가하여, 식물혼합물 추출물이 Lc의 생장에 긍정적인 영향을 미침을 확인할 수 있었다.
특히 식물혼합 추출물의 첨가 효과를 비교하면, Kim 등(2023)의 연구에서는 새싹보리 분말에 도라지, 더덕, 고구마껍질(1:1:3) 혼합 추출물을 추가할 경우 Lm, Lc, Ls 모두에서 유의적인 증식 증가가 보고되었다. 그러나 본 연구에서는 새싹보리 물 추출물에 동일한 식물혼합 추출물을 첨가하였을 때, Lc에서만 증식이 유의적으로 증가하였고, Lm과 Ls에서는 증식의 변화가 나타나지 않았다. 이와 같은 차이는 실험에서 사용된 식물혼합 추출물의 첨가량 차이나, 새싹보리의 전처리 방법(분말과 추출물의 형태 차이), 그리고 전체 배지 구성 및 희석 조건 등의 영향일 것으로 생각된다. 본 연구에서는 새싹보리 추출물을 새싹보리 분말의 20배 증류수로 추출한 후 20 mL를 사용하였기 때문에, 20 mL 유산균 접종 시료를 만들기 위해 새싹보리 분말의 경우 1 g에 사용하였다. 이러한 조건 차이는 유산균 접종 전 시료에 함유된 유효성분의 농도와 유산균 증식에 미치는 영향에 있어 차이를 유발할 수 있을 것이다. 그러나 두 연구 모두에서 새싹보리(분말 또는 추출물)가 Lm 배양에 적합하다는 것은 일치하였다. 또한, Lp, Lc, Ls 역시 3일간 배양 시 1×108 CFU/g 이상의 증식이 가능하여, 새싹보리 추출물을 다양한 김치 유래 유산균의 배양 인공배지로 활용할 수 있음을 확인하였다. 이와 같은 결과는 Kim 등(2023)의 선행 연구와도 일치하였다.
최근 연구들은 프로바이오틱스가 분비하는 포스트바이오틱스가 장기 면역 유지 및 장 염증 조절에 핵심 역할을 한다고 보고하고 있다(Zhang 등, 2025). 특히, 프로바이오틱스 유래 세포막 소포체는 프로바이오틱스와 유사한 기능을 가지면서도 생체 적합성이 높아 활성 물질을 운반하여 숙주의 여러 장기에 영향을 미칠 수 있는 것으로 알려져 있다(Zhang 등, 2025). Dell’Atti 등(2025)은 이러한 프로바이오틱스 유래 MV를 포함한 포스트바이오틱스가 염증성 사이토카인 생성을 억제하여 면역 반응을 조절하고 염증을 완화하며, 류마티스 관절염 치료에 활용 가능함을 제시하였다. 그러나 MV 생산의 표준화, 투여 경로 최적화 및 임상 안전성 확보 등 해결해야 할 과제가 남아 있다(Dell’Atti 등, 2025). Meena 등(2025)도 포스트바이오틱스는 식품산업, 화장품, 의약품, 임상 및 수의학 분야에서 폭넓게 활용되고 있으나, 실질적 활용을 위해서는 생산 및 규격화 기술의 발전이 필수적이라 하였다.
본 연구에서는 이러한 새싹보리 추출물 기반 인공배지에서 균주 성장과 더불어 MV 분리 및 농축이 가능함을 확인하였다는 점에서, 향후 MV 기반 플라보노이드 세포 수송 기전 연구 및 기능성 포스트바이오틱스 개발의 유용한 기초 자료를 제공할 수 있을 것이다.
소화효소인 트립신(trypsin)과 아밀라아제(amylase)는 음식물을 분해하고 영양소 흡수를 원활하게 하는 데 중요한 역할을 한다(Hur 등, 2021). 이들 효소는 침, 위액, 췌장액, 장액 등에서 분비되며, 각각 특정 성분의 소화를 담당한다(Hur 등, 2021; Lee와 Chung, 2024; Ministry of Food and Drug Safety, 2020). 만약 이러한 효소가 제대로 작용하지 않는다면, 우리 몸은 음식에서 필요한 영양소를 충분히 얻지 못하고 소화 장애나 불편함을 겪을 수 있다(Lee와 Chung, 2024). 따라서 본 연구에서는 김치 유래 유산균 및 식물을 활용한 발효물이 이들 효소들의 활성을 촉진시킬 수 있는지 알아보았다.
Table 1의 조성물에 유산균(Lm, Lp, Lc 또는 Ls)을 접종하여 발효시킨 시료 및 유산균을 접종하지 않은 시료 모두, 효소와 기질만을 포함한 대조군[Con(E+S)]에 비해 트립신 활성이 더 높게 나타났다(Fig. 1). 또한, 유산균 발효군은 유산균을 접종하지 않은 대조군과 비교했을 때 트립신 활성이 비슷하거나 더 높은 경향을 보였다. 새싹보리 추출물을 발효시킨 T1의 경우, 유산균을 접종하지 않은 대조군(FD-T1-Con)과 비교했을 때, 유산균 발효군(FD-T1-Lm, FD-T1-Lp, FD-T1-Lc, FD-T1-Ls)은 모두 유의적으로 높은 트립신 활성을 나타냈다. 그러나 T1의 유산균 발효군 간에는 유의한 차이는 관찰되지 않았다. 한편, 새싹보리 분말을 발효시킨 T2의 경우에도, 대조군(FD-T2-Con)에 비해 유산균 발효군(FD-T2-Lm, FD-T2-Lp, FD-T2-Lc, FD-T2-Ls)에서 트립신 활성이 유의적으로 증가하였으며, 이 중 Ls를 접종하여 발효시킨 FD-T2-Ls가 가장 높은 트립신 활성을 나타냈다.
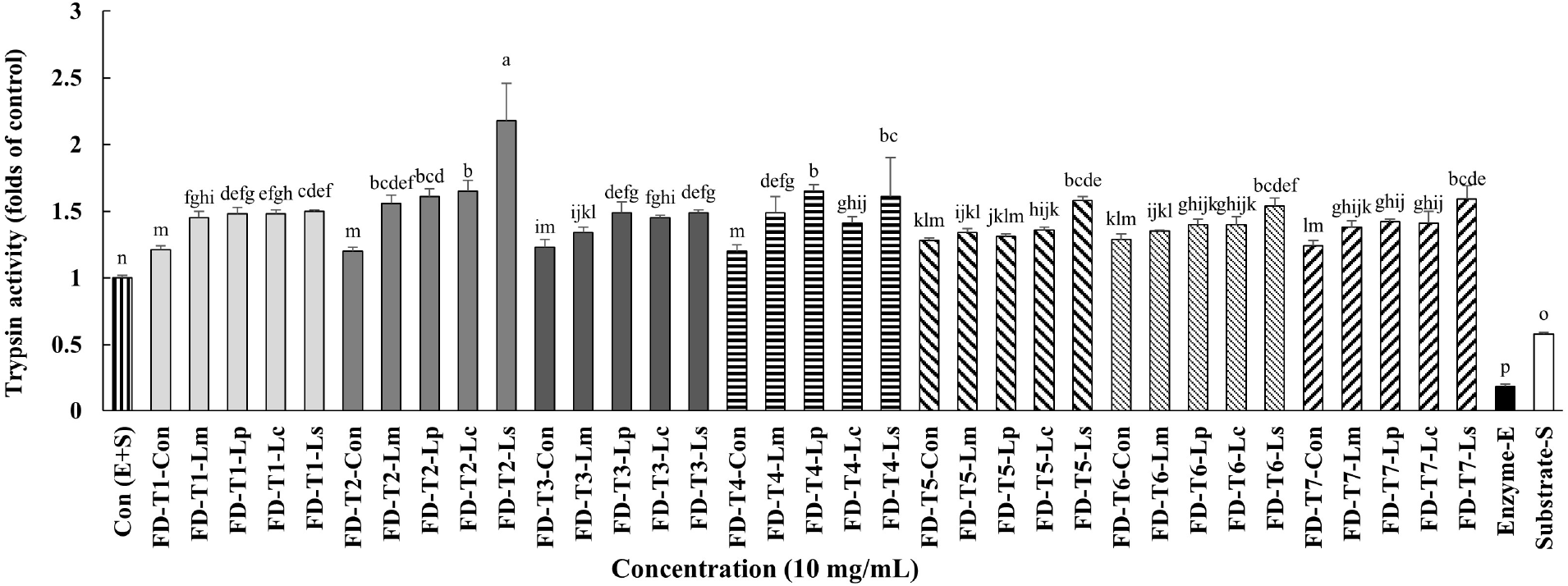
10 mg/mL 농도에서, 새싹보리 물 추출물(FD-T1-Con)은 대조군[Con(E+S)]에 비해 α-아밀라아제 활성이 억제되었으나, 새싹보리 물 추출물에 Lp 또는 Ls를 접종하여 발효시킨 시료들(FD-T1-Lp, FD-T1-Ls)에서는 대조군과 비교하여 유의적으로 α-아밀라아제 활성이 증가하였다. 한편, 새싹보리 분말을 발효한 시료 중 FD-T2-Lp를 제외하고 모두(FD-T2-Lm, FD-T2-Lc, FD-T2-Ls) 대조군보다 α-아밀라아제 활성이 감소하는 결과를 나타냈다(Fig. 2).
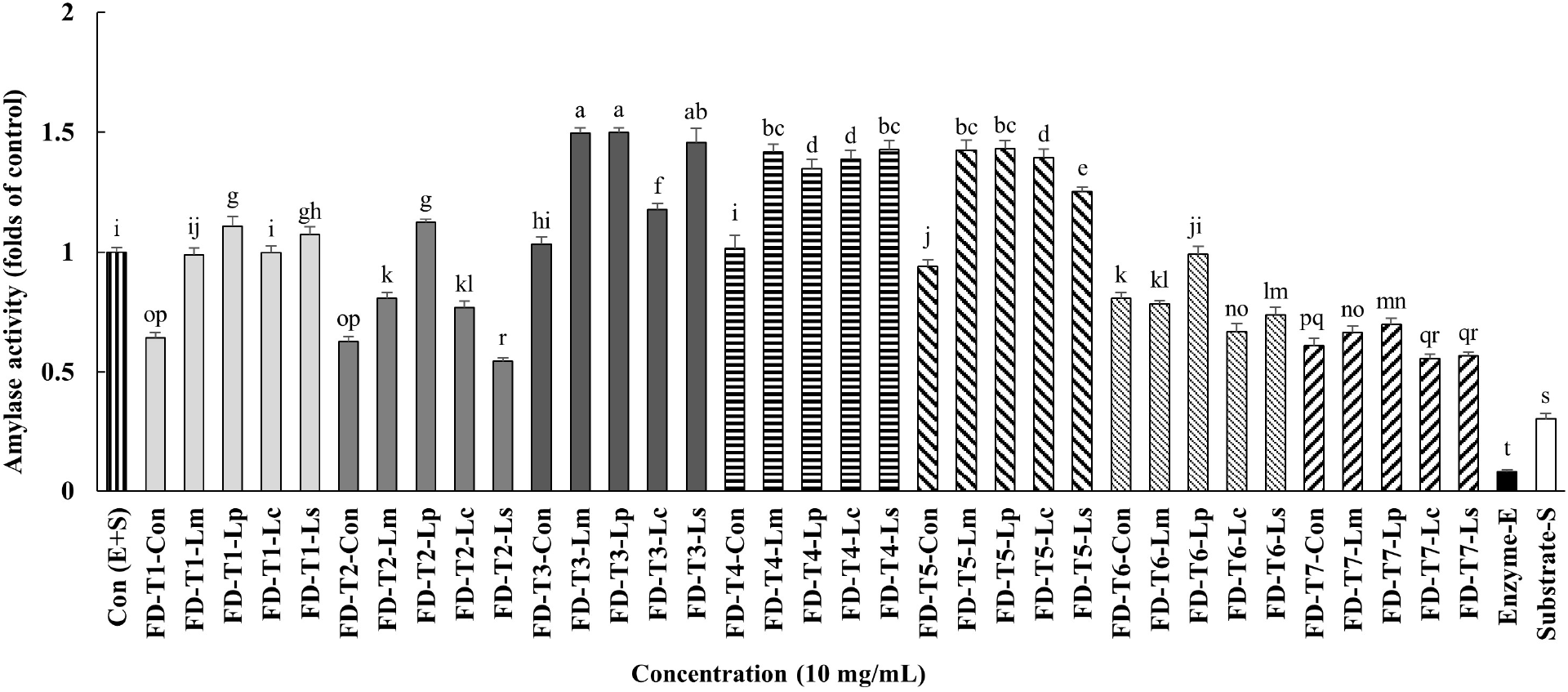
배추 물 추출물은 발효하지 않은 시료(FD-T3-Con)는 α-아밀라아제 활성을 직접적으로 변화시키지 않았으나, 해당 추출물을 발효시킨 시료들(FD-T3-Lm, FD-T3-Lp, FD-T3-Lc, FD-T3-Ls)은 대조군에 비해 α-아밀라아제 활성이 현저하게 증가하였다. 배추 분말 발효물 역시 유사한 경향을 보였다. 이를 통해, 배추 물 추출물 및 분말 발효물이 새싹보리 물 추출물 또는 분말 발효물보다 α-아밀라아제 활성을 더 효과적으로 증가시킨다는 점을 확인할 수 있었다.
또한, 새싹보리 물 추출물에 배추 물 추출물을 첨가하여 발효한 시료들(T5)은, 새싹보리 물 추출물만을 발효한 T1 시료보다 α-아밀라아제 활성이 유의적으로 증가하였다. 그러나 이러한 상승효과는 식물혼합물 추출물을 함께 첨가한 조성물(T6)에서는 억제되는 경향을 보였다. 즉, FD-T5-Lm보다 FD-T6-Lm, FD-T5-Lp보다 FD-T6-Lp, FD-T5-Lc보다 FD-T6-Lc, FD-T5-Ls보다 FD-T6-Ls가 α-아밀라아제 활성이 유의적으로 낮았으며, T6과 T7군에서 FD-T6-Lp를 제외한 모든 시료 및 발효물은 대조군보다 α-아밀라아제 활성이 억제되는 결과를 보여주었다(Fig. 2).
유산균 발효군은 대조군에 비해 전반적으로 트립신 활성이 증가하여, 발효물 내 단백질 분해능이 향상된 것을 알 수 있었다. 새싹보리 물 추출물 자체는 α-아밀라아제 활성을 억제하였으나, Lactiplantibacillus plantarum 및 Latilactobacillus sakei 발효 시에는 α-아밀라아제 활성이 유의하게 증가하는 경향을 보였다. 반면, 배추 추출물 발효물은 모든 균주에서 α-아밀라아제 활성이 유의적으로 증가하였다. 식물혼합물 첨가 시에는 α-아밀라아제 활성이 억제되는 현상이 관찰되었다.
α-아밀라아제는 전분 가수분해 효소이고 트립신은 프로테아제(protease)의 한 종류로 단백질 분해 효소이다(Lee와 Chung, 2024). Lee와 Chung(2024)의 연구보고에 의하면 배, 맥아, 대추, 익모초 및 황금 그리고 이것들을 혼합한 혼합물의 물 추출물은 트립신 활성을 증가시켰고, α-아밀라아제 활성은 농도가 높을수록 낮아져 대추와 익모초 물 추출물은 1,000 μg/mL 처리군에서는 효소와 기질만 처리한 대조군보다 α-아밀라아제 활성이 유의적으로 낮았다. 본 연구에서도 α-아밀라아제 활성이 유산균 발효물의 농도에 영향을 받는 것을 확인할 수 있었고, α-아밀라아제 활성이 억제된 시료도 어떤 농도에서는 α-아밀라아제 활성이 증가하는 것을 확인하였다(data not shown).
한편, 항당뇨 소재 개발을 위해 α-아밀라아제 활성 억제 효과를 확인한 연구들이 보고되고 있다. Ji 등(2020)은 배초향(Agastache rugosa) 추출물이 α-아밀라아제 활성을 최대 70%까지 억제하여 당뇨병 치료제(acarbose)의 70% 수준의 억제 효과를 나타냈으며, α-아밀라아제 및 α-글루코시다아제 저해 활성은 당뇨 조절 및 혈당 상승 억제에 중요한 역할을 한다고 보고하였다. 또한, Lee 등(2014)은 청미래덩굴(Smilax china L.) 추출물이 α-아밀라아제와 α-글루코시다아제 활성을 모두 억제함으로써 항당뇨 예방 및 개선 효과가 있다고 하였다. 사방오리나무 추출물 역시 α-아밀라아제 및 α-글루코시다아제의 활성을 효과적으로 억제하여, 당뇨병 관리에 유용한 대안 소재로 활용될 수 있음을 보고하였다(Choi 등, 2008).
따라서 본 연구에서는 α-아밀라아제 활성을 촉진하는 소재는 소화기능 개선을 위한 소재 개발에, α-아밀라아제 활성을 억제하는 소재는 당뇨병 개선을 위한 식의약 소재 개발에 활용할 수 있을 것으로 판단된다.
Park 등(2012)은 유산균이 생성하는 프로테아제(protease), 아밀라아제(amylase), 라이페이스(lipase) 등 효소 활성이 고분자 화합물을 분해하여 폴리페놀 및 플라보노이드 함량 증가와 신규 기능성 화합물 생성을 촉진할 수 있음을 보고하였다. 이를 바탕으로 본 연구에서는 총폴리페놀 및 총플라보노이드 함량을 분석하여, 발효 과정에서의 기능성 성분 변화를 규명하고자 하였다. 본 연구 결과들은 효소 활성 변화가 발효물의 기능성 향상에 중요한 역할을 할 수 있을 것이라는 것을 시사하고, 향후 기능성 발효물 개발에 있어 효소 활성 조절 메커니즘 규명이 필요할 것으로 사료된다.
새싹보리 물 추출물이 Lm, Lp, Lc, Ls의 인공배지로 활용 가능함을 확인하였고, 기능성을 강화하기 위해 새싹보리 물 추출물에 배추 물 추출물 및 식물 혼합물 물 추출물을 첨가했을 때 항산화 활성에 어떤 영향을 미치는지 확인하였다. 한편, T2, T3, T4는 항산화 활성 실험에서 제외하였다. 그 이유를 알아보면, T2는 새싹보리 분말이 함유된 발효물로, MV를 농축 및 순수 분리하는 데 어려움이 있기 때문이다. T3는 배추 물 추출물로 구성되어 있으나, 새싹보리 물 추출물이 이것보다 더 유산균의 인공배지로 더 효과적이기 때문에 제외하였다. T4는 배추 분말이 함유된 발효물로, 유산균의 인공배지로 활용하기에 새싹보리 물 추출물보다 적합하지 않으며, MV를 농축 및 순수 분리하는 데에도 어려움이 있어 제외하였다.
Table 1의 조성물 중 T1, T5, T6, T7에 유산균(Lm, Lp, Lc, Ls)을 접종하여 발효시킨 시료와 접종하지 않은 시료의 총폴리페놀 및 총플라보노이드 함량을 분석한 결과는 Fig. 3과 같다.
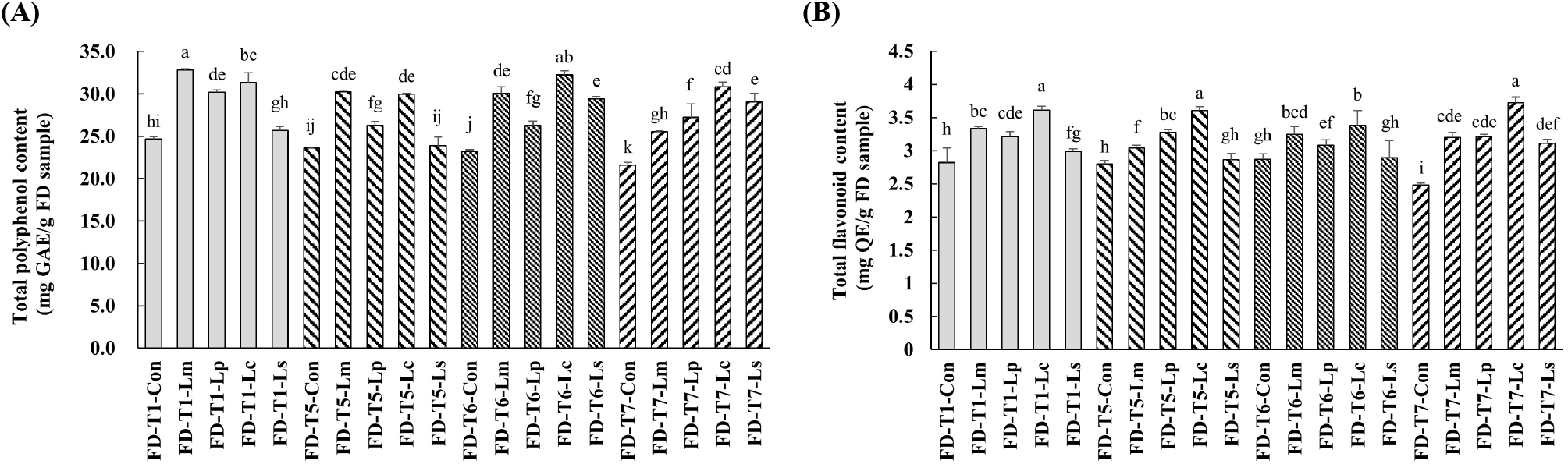
총폴리페놀 함량(Fig. 3A)은 대부분의 시료에서 발효 전 ․ 후를 비교한 결과 FD-T5-Ls를 제외한 모든 발효 시료에서 발효전보다 유의적으로 증가하였다. 특히, Lc를 접종한 발효물(FD-T1-Lc, FD-T5-Lc, FD-T6-Lc, FD-T7-Lc)은 FD-T1-Lm을 제외하고 Lm, Lp, Ls 각각을 접종한 발효물들에 비해 상대적으로 높은 총폴리페놀 함량을 나타냈다.
총플라보노이드 함량(Fig. 3B)은 FD-T5-Ls와 FD-T6-Ls를 제외한 시료에서 발효 전보다 발효 후에 유의적으로 증가하였다. 총플라보노이드 함량 역시 Lc 접종 발효물(FD-T1-Lc, FD-T5-Lc, FD-T6-Lc, FD-T7-Lc)이 다른 유산균(Lm, Lp, Ls) 접종군보다 높은 경향을 나타내었으며, 이는 총폴리페놀 함량과 유사한 경향이었다.
본 연구에서 새싹보리 물 추출물을 기반으로 한 인공배지에 유산균(Lm, Lp, Lc, Ls)을 접종하여 발효시킨 결과, 대체로 발효 후 총폴리페놀 및 총플라보노이드 함량이 유의적으로 증가함을 확인하였다. 특히 Lc를 접종한 발효물이 다른 유산균 접종군에 비해 각 항산화 성분의 함량 증가가 가장 뛰어났다. 이는 Lc가 새싹보리 물 추출물 및 식물 혼합물 내 폴리페놀 및 플라보노이드 생합성 또는 활성화에 효과적으로 작용할 수 있음을 시사한다. 반면, 일부 조성(FD-T5-Ls 및 FD-T6-Ls 등)에서는 유의적 증가가 나타나지 않아, 조성 및 유산균 균주 간 상호작용에 따른 차이가 존재함을 알 수 있다. 종합적으로, 새싹보리 기반 발효물의 항산화 활성을 극대화하기 위해서는 Lc와 같은 특정 유산균 선택이 중요하다는 것을 알 수 있었다.
총폴리페놀은 식물의 2차 대사산물 그룹으로 알려져 있으며, 총플라보노이드는 총폴리페놀에 포함되는 하위 그룹이다(Kim 등, 2022). Kim 등(2022)의 연구에 따르면, 보리새싹 열수추출물을 Leuconostoc mesenteroides와 Lactiplantibacillus plantarum으로 발효시킨 결과, 비발효 추출물에 비해 총폴리페놀과 총플라보노이드 함량이 유의하게 증가하였다. 또한, Lee 등(2018)과 Zhao 등(2022)의 연구에서도 보리 씨앗과 보리를 유산균으로 발효할 때 항산화 성분인 총폴리페놀 및 총플라보노이드의 함량이 증가하는 경향이 확인되었다. 이러한 결과들은 본 연구 결과들과 유사하였고, 유산균 발효가 새싹보리 등 식물 추출물의 기능 성분 함량을 향상시킬 수 있다는 것을 제시하였다.
유산균 발효 등으로 소화효소 활성이 증진되면 폴리페놀과 플라보노이드 방출이 촉진되어 이들 항산화 물질의 함량이 증가하고, 동시에 일부 방출된 항산화 성분들은 소화효소 활성을 다시 조절하여 발효물의 기능성에도 영향을 미치는 것으로 알려져 있다(Park 등, 2018). 이는 소화효소 활성, 총폴리페놀 그리고 총플라보노이드 함량이 상호 밀접하게 관련되어 있다는 것을 시사하고 있다.
Table 1의 조성물에 유산균(Lm, Lp, Lc, Ls)을 접종하여 발효한 시료와 무접종 대조군의 상층액을 동결 건조한 후, 각각의 DPPH 라디칼 소거활성을 측정하였다. 활성은 50% 라디칼 소거에 필요한 시료 농도(IC50 값)로 나타냈으며, 결과는 Table 3에 제시하였다. Lc를 접종한 발효물(FD-T1-Lc, FD-T5-Lc, FD-T6-Lc, FD-T7-Lc)은 Lm, Lp, Ls를 각각 접종한 발효물들과 비교하였을 때, DPPH 라디칼 소거활성이 더 높게 나타났으며, 이러한 경향은 총폴리페놀 및 총플라보노이드 함량에서도 유사하게 관찰되었다(Table 3). FD-T1-Lc, FD-T5-Lc, FD-T6-Lc 그리고 FD-T7-Lc의 IC50값은 각각 5.45±0.49 mg/mL, 6.88±0.51 mg/mL, 5.64±0.40 mg/mL 그리고 6.67±0.36 mg/mL이었다.
1) Inhibitory activity was expressed as the mean 50% inhibitory concentration (IC50) from triplicate determinations, obtained by interpolation from the concentration-inhibition curve.
2) Con, control; Lm, Leuconostoc mesenteroides; Lp, Lactiplantibacillus plantarum; Lc, Latilactobacillus curvatus; Ls, Latilactobacillus sakei. The compositions of T1, T5, T6, and T7 are presented in Table 1, and the freeze-dried supernatants of these fermented products are referred to as FD. The compositions of T1-Con, T5-Con, T6-Con, and T7-Con are provided in Table 1.
DPPH 라디칼 소거작용 분석은 시료의 항산화 활성을 통해 DPPH 라디칼에 전자 또는 수소 원자를 제공하여 DPPH를 환원시키는 반응을 기반으로 한다. 이 과정에서 DPPH의 색이 자색에서 담황색 또는 무색으로 변화하며, 이를 통해 시료의 항산화능을 정량적으로 평가할 수 있다(Lee와 Chung, 2024).
발효물은 일반적으로 비발효물보다 DPPH 라디칼 소거능이 증가하는 경향이 있으며, 이는 발효 과정에서 미생물이 폴리페놀과 플라보노이드 등 항산화 물질의 함량과 활성도를 높이기 때문이라 생각된다. Kim 등(2022)은 보리새싹 열수 추출물을 유산균으로 발효시킨 시료에서 DPPH 라디칼 소거작용이 더 높았다고 하였고, 본 연구에서도 발효물이 비발효물 대비 높은 항산화 활성을 보였으며, 발효 균주와 조건에 따른 활성 차이가 존재함을 확인하였다. 특히, Lc 균주를 접종한 발효물은 다른 유산균 발효물에 비해 DPPH 소거능 및 총폴리페놀 ․ 플라보노이드 함량이 더 높아, Lc가 항산화 성분을 더 효과적으로 생성하거나 활성화시킨 결과로 판단된다.
Lc와 같은 김치 유래 유산균은 생육 및 발효 과정에서 항산화 물질 생성 능력이 뛰어나며, 이들이 생산하는 대사산물들이 활성산소종(ROS) 등 산화 스트레스를 효과적으로 제거한다(Lu 등, 2023). Lc는 SOD(superoxide dismutase), catalase, glutathione peroxidase 등 다양한 항산화 효소를 활발히 생성하는 능력이 다른 유산균보다 우수하다는 연구 결과가 있다(Jiang 등, 2022; Lu 등, 2023). 또한 글루타티온(glutathione), GABA(γ-aminobutyric acid) 등 항산화 및 항염 작용 물질을 많이 생성하여 항산화 및 항염증 효과가 밝혀졌다(Kim 등, 2021; Lee 등, 2021).
Lc는 6탄당(hexose)을 젖산으로, 5탄당(pentose)을 phosphoketolase 경로를 통해 젖산과 초산으로 대사하는 통성 이종발효 균주로, 효율적인 대사 경로를 통해 다양한 환경에서 생육 및 기능성 대사산물 생성을 촉진한다(Wang 등, 2023). 또한 최근 연구에서는 Lc 대사산물이 AhR(aryl hydrocarbon receptor)를 활성화함으로써 장 점막의 장벽 기능을 개선하고 염증 반응을 낮추는 데 기여하는 것이 보고되었다(Wang 등, 2023).
한편, Lc의 폴리페놀 산화효소(polyphenol oxidase) 활성 자체에 관한 직접 연구는 부족하다. 일반적으로 발효과정에서 생성된 다양한 효소들은 셀룰로오스와 리그닌을 분해하여 페놀화합물의 추출을 증가시키나, 미생물의 대사과정에서 발생하는 활성산소 및 폴리페놀 분해효소의 작용으로 장기적인 발효는 오히려 페놀화합물 함량을 감소시킬 수 있다(Othman 등, 2009). 이로 인해 발효가 식물성 원료의 항산화 기능 증가 및 감소에 영향을 미칠 수 있다. 따라서 본 연구에서 Lc 접종 발효 시료가 다른 김치 유산균에 비해 항산화 효과 및 소화효소 활성이 높은 이유는 다양한 기전이 복합적으로 작용한 결과로 추정된다. 다만 이러한 기전의 정밀한 규명은 대사체 및 전사체 연구를 포함한 후속 연구가 요구된다.
본 연구 결과들에 의하면 균주 선택과 식물 발효 조건 최적화가 기능성이 향상된 MV 기반 포스트바이오틱스 개발에 중요한 역할을 함을 시사하였다.
4. 요약
본 연구에서는 김치 유래 유산균의 세포막 소포체(MV) 기반 포스트바이오틱스 개발을 위해 식물 추출물 기반 기능성 인공배지를 개발하였다. Leuconostoc mesenteroides(Lm), Lactiplantibacillus plantarum(Lp), Latilactobacillus curvatus(Lc), Latilactobacillus sakei(Ls) 총 4종의 유산균을 다양한 식물 추출물[새싹보리 추출물, 배추 추출물, 식물 혼합 추출물(도라지:더덕:고구마껍질=1:1:3)]기반 인공배지에서 3일간 발효시킨 결과, 새싹보리 추출물이 포함된 배지에서 유산균 생장이 가장 활발하였다. 특히 Lc 균주는 식물 혼합 추출물 첨가 시 유의하게 증식이 증가하여 긍정적 영향을 받는 것으로 나타났다. 발효물은 비발효물 대비 유산균 수와 소화효소(트립신, α-아밀라아제) 활성이 증가하였으며, 이는 총폴리페놀 및 플라보노이드 함량의 유의한 증가와 밀접한 관련이 있었다. 특히 Lc 접종군은 가장 높은 항산화 활성과 DPPH 라디칼 소거능을 나타내, 항산화 성분 생성에 Lc 균주의 효능을 확인하였다. 본 연구는 새싹보리 추출물이 MV 기반 포스트바이오틱스 개발을 위한 유효한 배지임을 입증하였으며, 균주 선택과 발효 최적화가 기능성 향상에 핵심적임을 보여주었다.










