1. 서론
고추(Capsicum annuum L.)는 가지과(Solanaceae) 고추속(Capsicum)에 속하는 한해살이 풀로, 독특한 맛과 향을 지니고 있다. 또한, 고추는 우리나라 7대 채소에 속하는 작물로써 청양고추, 풋고추, 꽈리고추, 오이고추, 홍고추, 파프리카 등 다양한 품종들이 재배되고 있으며, 천연 색소, 건고추, 고춧가루, 김치, 고추장, 그리고 조미료 등으로 이용되고 있다(Kim 등, 2023). 고추는 항균활성, 항산화, 항염증, 항비만, 항암 활성 그리고 간 보호 등의 생리활성을 발휘하고, capsaicinoid류, phenolic acid 류, flavonoid류, saponin류, 그리고 carotenoid류 등을 함유하고 있다고 보고되고 있다(Chilczuk 등, 2020; de Aguiar 등, 2019; Gang 등, 2008; Kwon 등, 2009; Saha 등, 2015; Tobolka 등, 2021; Yoon 등, 2012). 이러한 고추의 우수한 건강 기능성으로 인해 우리나라 1일 평균 소비량은 1인 기준으로 8-9 g으로 매년 지속적으로 증가하고 있다(Batiha 등, 2020).
최근, 건강에 도움을 주는 식품에 대한 관심이 증가하면서 청양고추, 풋고추, 꽈리고추, 오이고추, 홍고추, 파프리카, 자색가지고추 등의 다양한 고추 품종의 재배 및 소비가 확대되고 있다(Choung 등, 2012; Ciccone 등, 2013; Kim 등, 2008; Kim 등, 2018). 그 중, 유색 고추는 황색부터 자색까지 다양한 색을 띄고 있으며 풋고추에 비해 provitamin A, vitamin C, β-carotene, capsaicinoid류, 그리고 anthocyanin이 높은 함량이었다고 보고되었다(da Silveira Agostini-Costa 등, 2017; Jin 등, 2022). 붉은색과 황색 단고추에는 capsanthin, capsorubin, β-carotene, 그리고 cryptoxanthin 등의 50여 종의 carotenoid류을 함유하고 있다고 보고된 바 있다(Arimboor 등, 2015; Kim 등, 2016). 또한, 고추에 capsianoside A, capsianoside B를 포함한 diacyldigalactosyl glycerol류와 diterpene glycoside인 다수의 capsianoside류의 존재가 밝혀지고 있다(Iorizzi 등, 2001). 일부 고추 품종에 대한 성분 연구가 보고되고 있으나 국내 고추 품종별 LC-MS 기반 비휘발성 대사체 연구는 매우 제한적이었다.
자색가지고추는 다른 고추 품종과 달리 anthocyanin인 nasunin(delphinidin 3-p-coumaorylrutinoside)을 함유하고 있다고 알려져 있다(Meng 등, 2022; Tang 등, 2020; Wahyuni 등, 2011). Delphinidin류는 콩, 비트 등 다양한 작물에 함유되어 있으며, 활성 산소 억제 능력, 관절염, 유방암 증식 억제, 전립선의 종양 억제 능력, 그리고 항염증 효과를 발휘한다(Haseeb 등, 2013; Jang 등, 2014; Kim 등, 2016; Kim 등, 2020). Anthocyanin을 함유하고 있는 자색가지고추에는 다른 고추 품종과 달리 건강에 도움을 주는 유용한 고추 품종들 중 하나로 여겨진다. 그러나, 자색가지고추에는 nasunin를 제외하고 건강에 도움을 주는 기능성 성분 연구는 매우 제한적이다.
따라서, 본 연구에서는 다소비 고추인 6종의 품종(청양고추, 풋고추, 꽈리고추, 오이고추, 홍고추 그리고 자색가지고추)을 대상으로 LC-MS 대사체 분석을 통해 자색가지고추의 특이적인 대사체를 파악하고자 하였다. 특히, 자색가지고추로부터 유용 화합물을 분리하고 그 구조를 밝히고, 분리된 화합물들을 대상으로 radical-scavenging 활성을 평가하고자 하였다.
2. 재료 및 방법
자색가지고추(Capsicum annuum L.)는 강원도 춘천에서 재배된 미인보라고추 품종을, 경상남도 밀양에서 재배된 꽈리고추, 오이고추, 홍고추는 재배된 것을, 그리고 경상남도 창녕에서 재배된 청양고추와 풋고추를 구매하여 시료로 사용하였다. 시료 고추를 세척한 다음 꼭지와 씨를 제거하고 얻어진 과육을 -80°C에서 보관하여 실험에 사용하였다.
고추 과육 동결 건조 분말 1 g에 10 mM HCl이 함유된 70% MeOH 10 mL를 가하여 상온에서 24시간 추출하고 여과지 No. 2(Whatman, Maidstone, England)로 여과하였다. 얻어진 MeOH 추출물을 진공 농축기(N-2N, Eyela, Tokyo, Japan)를 이용하여 36°C에서 감압 농축하였다. 고추 과육 추출물에 water-saturated n-butanol(BuOH; 30 mL, 2회)을 가하여 용매 분획을 실시한 다음 감압 농축하여 BuOH층을 분석 실험에 사용하였다.
고추 과육 BuOH 분획물을 대상으로 ultra-performance liquid chromatograph(Acquity UPLC system, Waters, Milford, MA, USA)와 quadrupole time of flight mass spectrometer (QToF-MS; Xevo G2-XS QToF, Waters, Manchester, UK)를 이용하여 분석하였다. LC 조건의 경우 column은 Acquity UPLCⓇ HSS T3(1.8 μm, 2.1 × 50 mm, Waters)를 사용하였으며, column temperature는 40°C, flow rate는 0.35 mL/min, photodiode array(PDA) detector range는 210-400 nm로 하였다. 이동상 용매는 0.1% formic acid가 함유된 H2O(A)와 0.1% formic acid가 함유된 acetonitrile(B)을 사용하였으며, 이동상 조건은 2% B(0 min) → 2% B(2 min) → 25% B(7 min) → 50% B(24 min) → 90% B(28 min)로 linear gradient 하였다. MS 조건의 경우 ionization mode는 ESI(positive 및 negative), scan range는 m/z 50-1,200, scan time은 0.2 s, capillary voltage는 2.0 kV, sampling cone voltage는 40 V, cone gas flow는 50 L/h, desolvation gas flow는 600 L/h, desolvation temperature는 500°C, ion source temperature는 150°C, collision energy는 6 eV(low), 25-50 eV(high)로 하였다. Lock mass는 leucine-enkephalin(positive: 556.2771 Da, negative: 554.2615 Da)를 사용하였다. 고추 대사체의 감도(intensity)는 Progenesis QI(Waters, UK)를, 그리고 고추 품종별 다변량통계(principal component analysis, PCA)는 MetaboAnalyst 6.0(https://www. metaboanalyst.ca/)를 이용하여 실시하였다.
자색가지고추의 과육 10 kg에 10 mM HCl이 함유된 70% 메탄올(pH 1.3) 10 L를 가하여 마쇄한 다음, 상온에서 24시간 동안 추출하였다. 자색가지고추 추출물을 여과지 No. 2(Whatman)를 이용하여 여과하였으며, 그 여액을 진공 농축기를 이용하여 36°C에서 메탄올이 완전히 제거될 때까지 감압 농축하였다. 70% 메탄올(pH 1.3) 추출액에 ethyl acetate(EtOAc, 3 L × 3회)와 BuOH(3 L × 3회)을 순차적으로 가하여 용매 분획을 실시하였으며, BuOH 분획물(54.36 g)을 감압 농축하였다.
자색가지고추의 BuOH 분획물을 대상으로 octadecylsilane (ODS) 또는 silica gel column이 연결된 medium pressure liquid chromatography(MPLC; Isolera, Biotage, Uppsala, Sweden)을 이용하여 화합물을 분리 및 정제하였다. 화합물의 검출 파장은 254와 280 nm로 분리하였다. 고추 BuOH 분획물(54.36 g)이 흡착된 20 g의 ODS gel(LiChroprep RP-18, 40-63 μm, Merck, Darmstadt, Germany)과 ODS column(Sfar C18 120 g, Biotage)이 연결된 MPLC[이동상 용매의 gradient 용출, H2O/MeCN(v/v) = 100:0(17 min) → 70:30(30 min); 유속, 20 mL/min]를 실시하여 10개의 획분(A-J)으로 분획하였다. 획분 C(360 mg)를 대상으로 ODS-MPLC[column, Sfar C18 50 g(Biotage); 이동상 용매의 isocratic 용출, H2O/MeCN = 87:12(v/v); 유속, 25 mL/min]를 실시하여 화합물 1(9.3 mg)과 획분 C2(255.1 mg)를 분리하였다. 획분 C2(255.1 mg)를 대상으로 silica gel-MPLC[column, Sfar silica 50 g(Biotage); 이동상 용매의 isocratic 용출, CHCl3/MeOH = 73:27(v/v); 유속, 50 mL/min]를 실시하여 화합물 2(19.9 mg)를 분리하였다. 획분 D(239 mg)을 대상으로 silica gel-MPLC[column, Sfar silica 50 g(Biotage); 이동상 용매의 step-wise 용출, CHCl3/MeOH(v/v) = 73:27(0-30 min) → 71:29(30-110 min); 유속, 30 mL/min]를 실시하여 화합물 3(46.8 mg) 그리고 4(65.4 mg)는 분리하였다. 획분 E(170.1 mg)를 대상으로 silica gel-MPLC[column, Sfar silica 50 g(Biotage); isocratic 용출, CHCl3/MeOH = 71:29(v/v); 유속, 20 mL/min]를 실시하여 화합물 5(54.9 mg)를 분리하였다. 획분 H(148 mg)를 대상으로 silica gel-MPLC[column, Sfar silica 50 g(Biotage); isocratic 용출, CHCl3/MeOH = 70:30(v/v); 유속, 20 mL/min]를 실시하여 화합물 6(170.1 mg)을 분리하였다.
단리된 화합물의 NMR 분석은 Korea Basic Science Institute(KBSI, Gwangju Center)의 unityINOVA 500 및 600 spectrometer(Varian, Wainut Creek, CA, USA)를 이용하였다. NMR 용매는 CD3OD(Merck), DMSO-d6(Merck) 그리고 CF3COOD(TFA; Sigma-Aldrich)를 이용하여 분석하였다. 그리고 1H-및 13C-NMR 분석 외에 2D-NMR은 1H-1H correlation spectroscopy(1H-1H COSY), heteronuclear single quantum coherence(HSQC), heteronuclear multiple bond correlation (HMBC) 분석을 실시하였다. 단리된 화합물의 분자량 및 분자식은 상기와 동일한 조건으로 한 UPLC-ESI-QTOF-MS을 이용하여 분석하였다.
화합물 1: ESI-MS(positive) m/z 953.2[M+H]+, 975.2 [M+Na]+; 1H-NMR(600 MHz, DMSO-d6) δH 6.27(1H, d, J= 2.4 Hz, H-3), 6.53(1H, d, J=2.4 Hz, H-5), 3.64(1H, d, J=17.2 Hz, H-7a), 3.43(1H, d, J=17.2 Hz, H-7b), 7.07(2H, s, H-2’), 4.74(1H, d, J=7.8 Hz, H-1’’), 3.25(1H, dd, J=10.2, 7.8 Hz, H-2’’), 3.17(1H, m, H-3’’), 3.08(1H, d, t, J=9.0 Hz, H-4’’), 3.37(1H, m, H-5’’), 3.50(1H, d, J=12.0 Hz, H-6’’a), 3.69(1H, t, J=12.0 Hz, H-6’’b), 5.34(1H, d, J=7.8 Hz, H-1’’’), 3.08(1H, dd, J=9.0, 7.8 Hz, H-2’’’), 3.24(1H, d, J=9.0 Hz, H-3’’’), 3.20 (1H, d, J=9.0 Hz, H-4’’’), 3.37(1H, d, J=9.0 Hz, H-5’’’), 3.45 (1H, m, H-6’’’a), 3.82(1H, d, J=9.0 Hz, H-6’’’b), 4.62(1H, br. s, H-1’’’’), 3.70(1H, dd, J=3.6, 10.2 Hz, H-2’’’’), 3.67(1H, dd, J=10.2, 9.0 Hz, H-3’’’’), 4.87(1H, t, J=9.0 Hz, H-4’’’’), 3.63 (1H, m, H-5’’’’), 0.98(3H, d, J=6.0 Hz, H-6’’’’), 7.55(2H, d, J= 9.0 Hz, H-2’’’’’), 6.79(2H, d, J=9.0 Hz, H-3’’’’’), 7.55(1H, d, J=16.2 Hz, H-7’’’’’), 6.39(1H, d, J=16.2 Hz, H-8’’’’’); 13C-NMR (150 MHz, DMSO-d6) δC 107.1(C-1), 150.4(C-2), 103.4(C-3), 157.7(C-4), 100.6(C-5), 157.1(C-6), 28.8(C-7), 169.5(C-8), 117.9(C-1’), 109.2(C-2’, C-6’), 145.6(C-3’, C-5’), 139.3(C-4’), 164.1(C-7’), 101.5(C-1’’), 73.0(C-2’’), 76.3(C-3’’), 69.4(C-4’’), 77.1(C-5’’), 60.6(C-6’’), 94.5(C-1’’’), 72.4(C-2’’’), 76.0(C-3’’’), 69.5(C-4’’’), 76.0(C-5’’’), 66.4(C-6’’’), 125.1(C-1’’’’), 130.3(C-2’’’’, C-6’’’’), 115.7(C-3’’’’, C-5’’’’), 159.7(C-4’’’’), 144.7(C-7’’’’), 114.4 (C-8’’’’), 166.3(C-9’’’’), 100.3(C-1’’’’’), 70.3(C-2’’’’’), 68.2(C-3’’’’’), 73.5(C-4’’’’’), 66.0(C-5’’’’’), 17.4(C-6’’’’’).
화합물 2: ESI-MS(positive) m/z 919.2[M]+; 1H-NMR(600 MHz, CD3OD) δH 8.81(1H, s, H-4), 6.96(1H, d, J=1.2 Hz, H-6), 6.94(1H, d, J=1.2 Hz, H-8), 7.64(2H, s, H-2’. H-6’), 5.60(1H, d, J=7.8 Hz, H-1’’), 3.85(1H, d, J=7.8 Hz, H-2’’), 3.69(1H, m, H-3’’), 3.60(1H, m, H-4’’), 3.63(1H, m, H-5’’), 4.07(1H, d, J=10.2 Hz, H-6’’a), 3.73(1H, d, J=2.4 Hz, H-6’’b), 4.73(1H, s, H-1’’’), 3.84(1H, d, J=9.6 Hz, H-2’’’), 3.55(1H, m, H-3’’’), 4.88(1H, t, J=9.6 Hz, H-4’’’), 3.78(1H, d, J=9.6 Hz, H-5’’’), 0.99(1H, d, J=7.8 Hz, H-6’’’), 7.35(2H, d, J=8.7 Hz, H-2’’’’, H-6’’’’), 6.80(2H, d, J=8.7 Hz, H-3’’’’, H-5’’’’), 6.17(1H, d, J=15.6 Hz, H-7’’’’), 7.52(1H, d, J=15.6 Hz, H-8’’’’), 5.22 (1H, d, J=7.8 Hz, H-1’’’’’), 3.73(1H, d, J=7.8 Hz, H-2’’’’’), 3.90 (1H, m, H-3’’’’’), 3.75(1H, m, H-4’’’’’), 3.87(1H, m, H-5’’’’’), 3.97(1H, br. d, J=10.2 Hz, H-6’’’’’a), 3.81(1H, d, br. d, J=10.2 Hz, H-6’’’’’b); 13C-NMR(150 MHz, CD3OD) δC 163.6(C-2), 145.5(C-3), 133.4(C-4), 156.6(C-5), 105.7(C-6), 169.5(C-7), 97.8(C-8), 113.0(C-9), 156.8(C-10), 119.0(C-1’), 113.0(C-2’, C-6’), 147.5(C-3’, C-5’), 146.0(C-4’), 102.1(C-1’’), 72.2(C-2’’), 71.45(C-3’’), 75.6(C-4’’), 68.0(C-5’’), 17.8(C-6’’), 102.1(C-1’’’), 72.2(C-2’’’), 71.4(C-3’’’), 75.6(C-4’’’), 68.0(C-5’’’), 17.8(C-6’’’), 127.3(C-1’’’’), 131.5(C-2’’’’, C-6’’’’), 117.1(C-3’’’’, C-5’’’’), 160.6 (C-4’’’’), 115.0(C-7’’’’), 147.5(C-8’’’’), 169.5(C-9’’’’), 102.7(C-1’’’’’), 78.1(C-2’’’’’), 77.7(C-3’’’’’), 74.9(C-4’’’’’), 70.6(C-5’’’’’), 62.2(C-6’’’’’).
화합물 3: ESI-MS(negative) m/z 521.2[M-H]−; 1H-NMR (500 MHz, CD3OD) δH 6.58(1H, d, J=1.8 Hz, H-2), 6.56(1H, d, J=8.4 Hz, H-5), 6.48(1H, dd, J=8.4, 1.8 Hz, H-6), 2.72 (1H, dd, J=13.8, 8.6 Hz, H-7a), 2.96(1H, dd, J=13.8, 5.4 Hz, H-7b), 3.96(1H, m, H-8), 3.75(1H, m, H-9a), 3.69(1H, m, H-9b), 3.69(3H, s, 3-OCH3), 6.93(1H, d, J=1.8 Hz, H-2’), 6.91 (1H, d, J=1.8 Hz, H-6’), 6.56(1H, d, J=15.6 Hz, H-7’), 6.30 (1H, dt, J=15.6, 6.0 Hz, H-8’), 4.22(2H, dd, J=6.0, 1.8 Hz, H-9’), 3.82(3H, s, 3’-OCH3), 4.68(1H, d, J=7.8 Hz, H-1’’), 3.54(1H, t, J=7.8 Hz, H-2’’), 3.41(1H, t, J=7.8 Hz, H-3’’), 3.65(1H, m, H-4’’), 3.65(1H, m, H-5’’), 3.77(1H, m, H-6’’a), 3.65(1H, m, H-6’’b); 13C-NMR(125 MHz, CD3OD) δC 133.3 (C-1), 113.8(C-2), 148.5(C-3), 145.4(C-4), 115.7(C-5), 122.7 (C-6), 39.3(C-7), 70.6(C-8), 66.9(C-9), 56.3(3-OCH3), 135.5(C-1’), 109.2(C-2’), 153.5(C-3’), 145.1(C-4’), 139.0(C-5’), 119.2 (C-6’), 131.6(C-7’), 129.7(C-8’), 63.8(C-9’), 56.5(3’-OCH3), 105.4(C-1’’), 76.0(C-2’’), 78.0(C-3’’), 71.3(C-4’’), 78.2(C-5’’), 62.5(C-6’’).
화합물 4: ESI-MS(negative) m/z 565.1[M-H]−; 1H-NMR (500 MHz, CD3OD) δH 6.63(1H, s, H-3), 7.99(2H, d, J=8.5 Hz, H-2’, H-6’), 6.94(2H, d, J=8.5 Hz, H-3’, H-5’), 4.87(1H, d, J=10.0 Hz, H-1’’), 4.01(1H, t, J=10.0 Hz, H-2’’), 3.64(1H, t, J=10.0 Hz, H-3’’), 3.99(1H, t, J=10.0 Hz, H-4’’), 3.47(1H, m, H-5’’), 3.79(1H, dd, J=12.0, 5.5 Hz, H-6’’a), 3.96(1H, dd, J=12.0, 2.0 Hz, H-6’’b), 5.03(1H, d, J=10.0 Hz, H-1’’’), 4.09 (1H, dd, J=10.0, 9.0 Hz, H-2’’’), 3.54(1H, t, J=9.0 Hz, H-3’’’), 3.66(1H, t, J=9.0 Hz, H-4’’’), 3.75(1H, m, H-5’’’a), 4.05(1H, m, H-5’’’b); 13C-NMR(125 MHz, CD3OD) δC 166.8(C-2), 103.9 (C-3), 184.4(C-4), 160.4(C-5), 108.5(C-6), 163.0(C-7), 105.9 (C-8), 157.6(C-9), 105.6(C-10), 123.5(C-1’), 130.3(C-2’, C-6’), 117.1(C-3’, C-5’), 163.0(C-4’), 76.6(C-1’’), 71.3(C-2’’), 75.3 (C-3’’), 70.5(C-4’’), 83.1(C-5’’), 63.2(C-6’’), 75.2(C-1’’’), 73.2 (C-2’’’), 80.4(C-3’’’), 72.5(C-4’’’), 72.1(C-5’’’).
화합물 5: ESI-MS(positive) m/z 611.1[M+H]+; 1H-NMR (500 MHz, CD3OD) δH 6.30(1H, d, J=2.0 Hz, H-6), 6.39(1H, d, J=2.0 Hz, H-8), 7.67(1H, d, J=2.0 Hz, H-2’), 6.87(1H, d, J=8.5 Hz, H-5’), 7.63(1H, dd, J=8.5, 2.0 Hz, H-6’), 5.11(1H, d, J=7.5 Hz, H-1’’), 3.25-3.49(6H, m, H-2’’-H-6’’b, H-4’’’, H-5’’’), 3.80(1H, dd, J=11.0, 1.5 Hz, H-6’’a), 4.52(1H, d, J= 1.5 Hz, H-1’’’), 3.63(1H, dd, J=3.5, 1.5 Hz, H-2’’’), 4.52(1H, dd, J=9.5, 3.5 Hz, H-3’’’), 1.12(3H, d, J=6.5 Hz, H-6’’’); 13C-NMR(125 MHz, CD3OD) δC 159.4(C-2), 135.7(C-3), 179.5(C-4), 163.1(C-5), 100.0(C-6), 166.1(C-7), 95.0(C-8), 158.6 (C-9), 105.7(C-10), 123.2(C-1’), 117.8(C-2’), 145.9(C-3’), 149.9 (C-4’), 116.1(C-5’), 123.7(C-6’), 104.8(C-1’’), 75.8(C-2’’), 78.3 (C-3’’), 71.5(C-4’’), 77.3(C-5’’), 68.6(C-6’’), 102.5(C-1’’’), 72.2 (C-2’’’), 72.3(C-3’’’), 74.0(C-4’’’), 69.8(C-5’’’), 18.0(C-6’’’).
화합물 6: ESI-MS(positive) m/z 625.1[M+H]+; 1H-NMR (500 MHz, CD3OD) δH 6.20(1H, d, J=2.4 Hz, H-6), 6.39(1H, d, J=2.4 Hz, H-8), 7.94(1H, d, J=2.1 Hz, H-2’), 6.91(1H, d, J=8.4 Hz, H-5’), 7.61(1H, dd, J=8.4, 2.1 Hz, H-6’), 3.94(3H, s, OCH3), 5.23(1H, d, J=7.8 Hz, H-1’’), 3.18-3.50(8H, m, H-2’’-H-6’’b, H-3’’’-H-5’’’), 3.80(1H, dd, J=11.0, 1.5 Hz, H-6’’a), 3.82(1H, dd, J=11.4, 1.2 Hz, H-6’’a), 4.53(1H, d, J=1.2 Hz, H-1’’’), 3.63(1H, dd, J=3.0 Hz, J=1.2 Hz, H-2’’’), 1.10(1H, d, J=6.0 Hz, H-6’’’); 13C-NMR(125 MHz, CD3OD) δC 158.9 (C-2), 135.6(C-3), 179.4(C-4), 163.1(C-5), 100.1(C-6), 166.1 (C-7), 95.0(C-8), 158.6(C-9), 105.6(C-10), 123.0(C-1’), 114.6 (C-2’), 148.4(C-3’), 150.9(C-4’), 116.2(C-5’), 124.1(C-6’), 56.9 (OCH3), 104.6(C-1’’), 76.0(C-2’’), 78.2(C-3’’), 71.7(C-4’’), 77.4 (C-5’’), 68.6(C-6’’), 102.5(C-1’’’), 72.2(C-2’’’), 72.4(C-3’’’), 73.9 (C-4’’’), 69.8(C-5’’’), 18.0(C-6’’’).
자색가지고추로부터 단리된 화합물의 ABTS+ radical 소거능 활성은 Song 등(2024)의 방법을 약간 변형하여 측정하였다. ABTS+ radical 반응 용액은 7 mM ABTS와 2.45 mM의 potassium persulfate을 1:1(v/v) 비율로 12시간 동안 암소에서 반응시킨 후 이용하였다. 반응액은 734 nm에서 흡광도 값(optical density, OD)이 1.0±0.02가 되도록 증류수로 희석하여 제조되었다. 단리된 화합물 10 μL과 ABTS+ radical 반응용액 190 μL를 1시간 동안 암소에서 반응시킨 후 735 nm에서 분광광도계(MQX200R, BioTek, Winooski, USA)를 이용하여 흡광도를 측정하였다. 표준물질인 ascorbic acid를 이용하여 표준곡선을 작성하였고, ascorbic acid과 상응하는 농도(equivalent to ascorbic acid, AAE)로 환산하여 나타내었다.
3. 결과 및 고찰
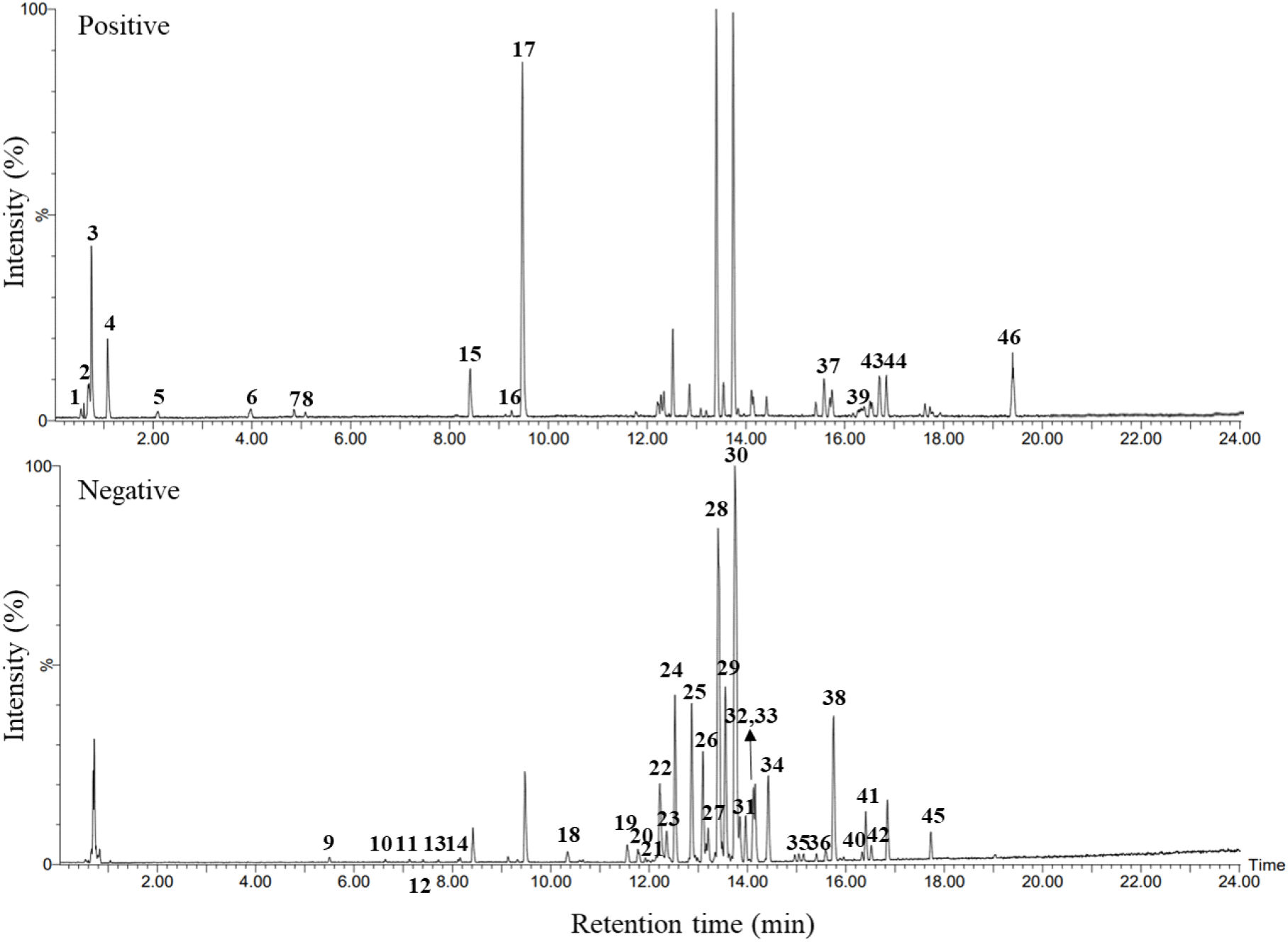
국내에서 재배되는 고추 품종들 중 널리 소비되고 있는 6품종의 고추[자색가지고추(purple pepper), 오이고추(cucumber pepper), 풋고추(green pepper), 홍고추(red pepper), 꽈리고추(twist pepper) 및 청양고추(cheongyang pepper)]를 대상으로 LC-ESI-QToF-MS 대사체 분석을 통해 성분학적 특성을 파악하였다. 고추 6개 품종의 BuOH 추출물을 동일한 양으로 혼합하여 LC-ESI-QToF-MS로 분석한 결과, TIC chromatogram에서 46종의 주요 피크들이 검출되었으며(Fig. 1), MS spectra를 기반으로 FOODB, HMDB, 그리고 Massbank를 이용하여 고추의 대사체를 동정하였다(Table 1). 본 실험에 사용한 6품종의 고추에서 검출된 주요 대사체로는 monomeric diterpene capsianoside류, dimeric esters capsianoside류, coumaroyl glycoside류, flavonoid glycoside류, 그리고 anthocyanin임을 알 수 있었다. 고추에서 monomeric capsianoside류(capsianoside I, II, III 등), 2종의 diterpene이 결합된 배당체인 dimeric esters capsianoside류(capsianoside A, B, C 등), coumaroyl glycoside류, flavonoid glucoside류, 그리고 anthocyanin류를 포함한 대부분의 대사체들이 동정된 바가 있으며(Macel 등, 2019; Materska 등, 2003; Syukur 등, 2018), 이는 본 연구 결과와 유사하였다. 특히, 고추의 매운맛 성분인 capsaicin과 dihydrocapsaicin 등을 포함한 capsaicinoid류는 일반적으로 고추 과육보다 씨앗이나 capsaicin 분비선 등 내부 부위에 다량 존재하고 있다고 잘 알려져 있다(Srinivasan 등, 2015). 본 연구에서는 씨앗이나 capsaicin glands 등의 내부 부위를 제거한 고추 과육만을 실험에 사용하였기 때문에 capsaicinoid류는 매우 미량이어서 LC-MS 분석에서 검출되지 않은 것으로 사료된다. 고추의 적색을 나타내는 색소성분인 capsaxanthin류 또한 미량으로 인해 LC-MS 분석에서 검출되지 않은 것으로 여겨진다.
LC-MS 대사체 분석 결과를 기반으로 principal component analysis(PCA)를 실시한 결과, 고추 6품종은 3개의 집단[풋고추, 꽈리고추, 그리고 홍고추(집단 1), 오이고추와 청양고추(집단 2), 자색가지고추(집단 3)]으로 크게 구별되었다(Fig. 2A). 고추품종을 구별하는 VIP>1.0의 주요 대사체를 기반으로 Heatmap 분석을 실시한 결과(Fig. 2B), 풋고추, 꽈리고추, 그리고 홍고추를 포함하는 집단 1은 집단 2에 비해 상대적으로 낮은 함량이나, capsianoside E 등을 포함한 dimeric ester capsianoside류과 capsianoside I 등을 포함한 monomeric ester capsianoside류가 주요 대사체로 검출되었다.
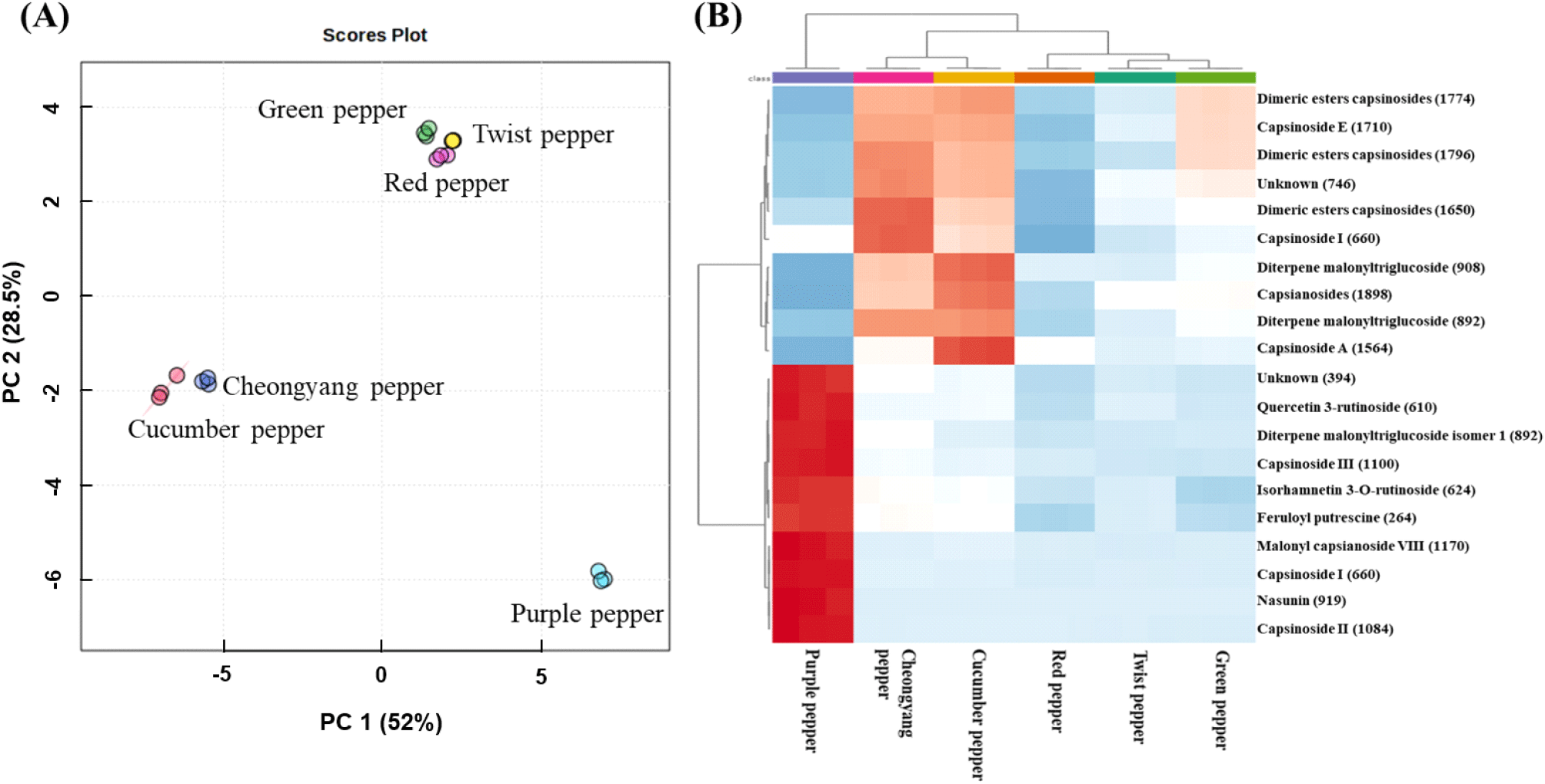
오이고추와 청양고추를 포함하는 집단 2는 capsianoside A와 E을 포함한 분자량이 다른 dimeric ester capsianoside류와 capsianoside I 등을 포함한 분자량이 다른 monomeric ester capsianoside류가 주요 대사체로 검출되었다. 자색가지고추(집단 3)는 분자량이 다른 dimeric ester capsianoside류, capsianoside I과 II를 포함한 분자량이 다른 monomeric ester capsianoside류, nasunin, quercetin 3-rutinoside, 그리고 feruloyl putrescine가 주요 화합물로 검출되었다. 자색가지고추는 late anthocyanin biosynthetic gene들을 발현시켜 nasunin을 생성한다고 알려져 있다(Tang, 2020). 또한, 자색가지고추는 안토시아닌 생합성 과정 중 coumaroyl glucoside류와 flavonoid glycoside류의 대사체의 함량에 영향을 줄 수도 있다고 보고된 바 있다(Fernández-Ronco 등, 2013; Liu 등, 2022). 자색가지고추에는 nasunin를 다량 함유하고 있음이 재차 확인할 수 있었으며, 본 실험에 사용한 다른 고추 품종에 비해 상대적으로 높은 함량인 coumaroyl glucoside류, flavonoid glycoside류, 그리고 capsianoside류도 확인할 수 있었다. 본 연구에서는 6종의 고추 품종 과육만을 대사체 분석하였으나, 고추 품종 또는 부위 별 체계적인 대사체 분석 연구가 앞으로 요구된다.
자색가지고추는 본 연구에 사용한 고추 품종들과 달리 coumaroyl glucoside류, flavonoid glycoside류, capsianoside류 등의 다양한 유용 화합물을 함유하고 있음을 확인하였다. 이에 자색가지고추의 성분 데이터베이스에 기초자료로 활용하기 위하여 그 함유 화합물의 분리하고 정확한 구조해석을 시도하였다. 자색가지고추의 BuOH 분획물로부터 ODS 및 silica gel column chromatography를 이용하여 6종의 화합물(1-6)을 분리하였으며, MS 및 NMR 분석을 통해 그 구조를 밝혔다. 이 중 (8R)-isodehydrodiconiferyl alcohol-4’-β-D-glucopyranoside (icariside E5, 3)(Iorizzi, 2001), apigenin-6-C-β-D-glucopyranoside-8-C-α-L-arabinopyranoside(isoschaftoside, 4)(Materska, 2003), quercetin 3-rutinoside(rutin, 5)(Aisyah 등, 2017), isorhamnetin 3-rutinoside(narcissoside, 6)(Kwon 등, 2011)은 다양한 고추품종에 동정된 바 있다. 화합물 1은 신규화합물로 분리되었으며, 화합물 2는 자색가지고추의 주요 색소성분인 nasunin으로 구조 해석되었으나 이에 대한 상세한 NMR 분석 정보가 미흡한 실정이었다. 이에 화합물 1과 2에 대한 구조해석 결과를 제시하였다.
화합물 1의 ESI-MS(positive) spectrum에서 sodiated molecular ion peak인 m/z 975.2382[M+Na]+와 protonated molecular ion peak인 m/z 953.2406[M+H]+이, fragment ion peak로 m/z 791.20, 521.09, 그리고 293.10이 관찰되었다. 또한, high resolution mass spectrometry(HR-MS) 분석 결과에서 이 화합물의 분자식은 C42H48O25[m/z 951.2407, C42H47O25, +0.0 mDa]을 알 수 있었다. 화합물 1의 1H-NMR spectrum(600 MHz)에서 benzene ring의 meta-coupling에 해당하는 3종의 proton signal들[δH 7.07(2H, s, H-2’, H-6’), 6.53(1H, d, J=2.4 Hz, H-5), 6.27(1H, d, J=2.4 Hz, H-3)]과 1종의 methylene proton signal들[δH 3.64(d, J=17.2 Hz, H-7a), 3.43(d, J=17.2 Hz, H-7b)]이 관찰되어 화합물의 aglycone들은 gallic acid와 trihydroxyphenylacetic acid의 존재가 시사되었다. 또한, trans-p-coumaric acid에 해당하는 2종의 p-substituted benzene ring proton signal들[δ 7.55(2H, d, J=9.0 Hz, H-2’’’’’, H-6’’’’’), 6.79(2H, d, J=9.0 Hz, H-3’’’’’, H-5’’’’’]과 2종의 olefinic double bond proton signal들[δH 7.55(2H, d, J=9.0 Hz, H-2’’’’’, H-6’’’’’), 6.79(2H, d, J=9.0 Hz, H-3’’’’’, H-5’’’’’]과 2종의 olefinic double bond proton signal들[δH 7.55(1H, d, J=16.2 Hz, H-7’’’’’), 6.39(1H, d, J=16.2 Hz, H-8’’’’’)]이 관찰되었다. 이에 더하여 2종의 β-glucose와 1종의 α-rhamnose에 해당하는 3종의 anomeric proton signal들[δH 5.34(1H, d, J=7.8 Hz, H-1’’’), 4.74(1H, d, J=7.8 Hz, H-1’’), 4.62(1H, br. s, H-1’’’’)]과 그 외 proton signal들(δH 3.82-0.98)이 관찰되었으며, 이들은 1H-1H COSY spectrum에서 관찰된 proton-proton 상관관계들과 coupling constant value로부터 재차 확인되었다. 화합물 1의 13C-NMR spectrum(150 MHz)에서 3종의 carbonyl carbon signal들[(δC 169.5(C-8), 164.1(C-7’), 166.34(C-9’’’’’)], benzene ring 및 olefinic double bond에 해당하는 20종의 carbon signal들(δC 159.76-107.16), 1종의 methylene carbon signal(δC 28.84), 그리고 당 유래 18종의 carbon signal들(δC 101.58-17.40)을 포함한 총 42종의 carbon signal들이 관찰되었다. MS 및 1D-NMR 분석 결과로부터 화합물 1은 gallic acid, trihydroxyphenylacetic acid, trans-p-coumaric acid, 그리고 3종의 당이 결합된 구조로 시사되었다. HSQC, 1H-1H COSY, HMBC 등의 2D-NMR 분석을 통해 이 화합물의 aglycone들은 gallic acid, 2,4,6-trihydroxyphenylacetic acid, 그리고 trans-p-coumaric acid로 확인되었다. HMBC spectrum에서 관찰된 δH 4.62(H-1’’’’)과 δC 66.4(C-6’’’)의 3JHC 상관관계로부터 glucose의 6위와 rhamnose의 1위가가 결합된 rutinose임을 알 수 있었다. 또한, HMBC spectrum에서 관찰된 δH 5.34(H-1’’’)와 δC 169.5(C-8), 그리고 δH 4.74(H-1’’)와 δC 157.1(C-6)의 3JHC 상관관계들로부터 1종의 glucose와 rutinose는 2,4,6-trihydroxyphenylacetic acid의 6위와 8위에 각각 결합되어 있음을 알 수 있었다. 그리고, δH 4.87(H-4’’’’)와 δC 166.3(C-9’’’’’)의 3JHC 상관관계가 관찰되어 p-coumaric acid는 rutinose의 C-4’’’’에 결합되어 있음을 알 수 있었다. HMBC 분석 결과를 종합해 보면, gallic acid는 2,4,6-trihydroxyphenylacetic acid의 2위에 결합되어 있는 것으로 해석되었다. 그러므로 화합물 1은 4’-trans-p-coumaloylrutinosyl 2-(O-galloyl)-6-(O-β-glucopyranosyl)-4-hydroxyphenyl acetate으로 해석되었으며, 이는 신규 화합물로 판명되었다(Fig. 3). 화합물 1의 당 D/L configuration는 향후 확인 연구가 요구된다.
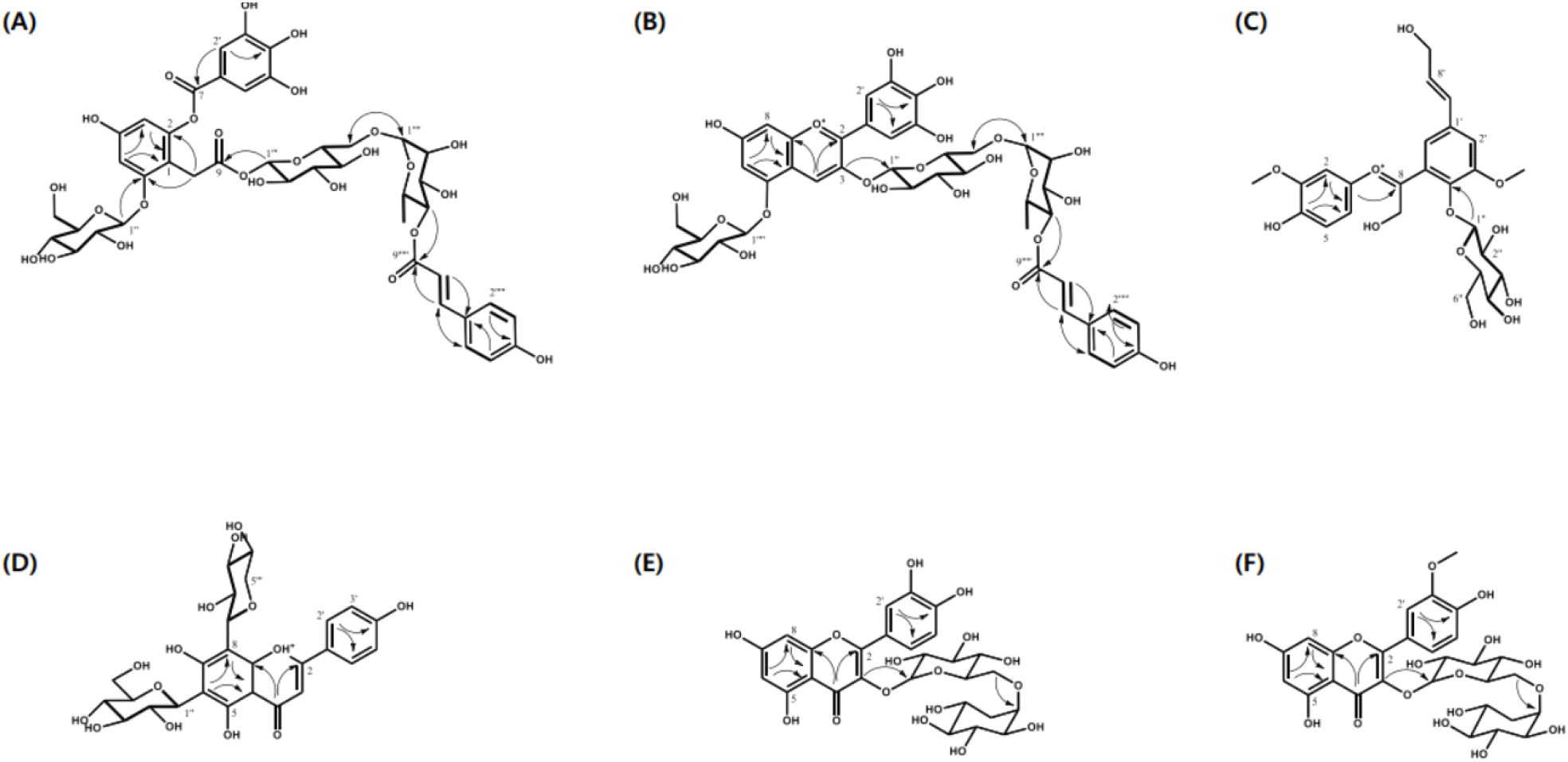
화합물 2의 ESI-MS(positive) spectrum으로부터 protonated molecular ion peak m/z 919.2533[M]+가, m/z 757.19, 465.10, 그리고 303.05의 fragment ion peak들이 관찰되었다. 특히 fragment ion peak인 m/z 303.05가 관찰되어 화합물 2의 aglycone은 anthocyanin의 기본골격인 delphinidin으로 시사되었다. 또한 HR-ESI-MS 분석 결과로부터 이 화합물의 분자식은 C42H47O23[m/z 919.2540, +0.0 mDa]을 알 수 있었다. 또한, 13C-NMR spectrum(150 MHz)으로부터 1종의 carbonyl carbon signal[δC 169.55(C-9’’’’’)], benzene ring 및 olefinic double bond에 해당하는 23종의 carbon signal들(δC 160.68-115.05), 그리고 당 유래 18종의 carbon signal들(δC 102.75-17.89)을 포함한 총 42종의 carbon signal들이 관찰되었다. 화합물 2의 1H-NMR spectrum(600 MHz)으로부터 anthocyanin A ring에 해당하는 2종의 meta-coupling proton signal들[δH 6.96(1H, d, J=1.2 Hz, H-6), 6.94(1H, d, J=1.2 Hz, H-8)], B ring의 gallol형에 해당하는 1종의 proton signal[δH 7.64(2H, s, H-2’, H-6’)], 그리고 C ring에 해당하는 1종의 proton signal[δH 8.81(1H, s, H-4)]이 관찰되어 이 화합물의 aglycone의 기본 골격인 delphinidin임이 강하게 시사되었다. 또한 trans-p-coumaric acid에 해당하는 2종의 p-substituted benzene ring proton signal들[δH 7.35(2H, d, J=8.7 Hz, H-2’’’’’, H-6’’’’’), 6.80(2H, d, J=8.7 Hz, H-3’’’’’, H-5’’’’’)]과 2종의 olefinic double bond proton signal들[δH 6.17 (1H, d, J=15.6 Hz, H-7’’’’’), 7.52(1H, d, J=15.6 Hz, H-8’’’’’)]이 관찰되었다. 이에 더하여 2종의 β-D-glucose와 1종의 α-L-rhamnose에 해당하는 3종의 anomeric proton signal들[δH 5.60 (1H, d, J=7.8 Hz, H-1’’), 5.22(1H, d, J=7.8 Hz, H-1’’’), 4,73 (1H, s, H-1’’’’)]과 그 외의 proton signal들(δH 3.44-4.88)이 관찰되었다. MS 및 1D-NMR 분석 결과로부터 화합물 2는 delphinidin, trans-p-coumaric acid, 그리고 3종의 당이 결합된 구조로 시사되었다. 화합물 2의 부분구조들은 HSQC, 1H-1H COSY, HMBC 등의 2D-NMR 분석을 통해 확인되었다. HMBC spectrum에서 관찰된 δH 4.73(H-1’’’’)과 δC 67.4(C-6’’’)의 3JHC 상관관계로부터 glucose와 rhamnose가 결합된 rutinose임을 알 수 있었다. 또한 HMBC spectrum에서 관찰된 δH 5.22 (H-1’’’)와 δC145.5(C-3), 그리고 δH 5.60(H-1’’)와 δC 156.6(C-5)의 3JHC 상관관계들로부터 1종의 glucose와 rutinose는 delphinidin의 3위와 5위에 각각 결합되어 있음을 알 수 있었다. 그리고 δH 4.88(H-4’’’’)와 δC 169.5(C-9’’’’’)의 3JHC 상관관계가 관찰되어 p-coumaric acid는 rutinose의 C-4’’’’에 결합되어 있음을 알 수 있었다. 화합물 2의 MS 및 1D-NMR 결과는 가지로부터 동정한 delphinidin 3-[4-p-coumaroyl)-rutinoside]-5-glucoside(nasunin)의 그것들과 일치함이 확인되었다(Ichiyanagi 등, 2005). 따라서 화합물 2는 delphinidin 3-[4-p-coumaroyl)-rutinoside]-5-glucoside(nasunin)으로 구조 해석되었다(Fig. 3B).
자색가지고추로부터 분리된 6종의 화합물은 4’-trans-p-coumaloylrutinosyl 2-(O-galloyl)-6-(O-β-glucopyranosyl)-4-hydroxyphenyl acetate(1), nasunin(2), icariside E5(3), isoschaftoside(4), rutin(5), narcissoside(6)로 구조해석되었다. 이 중 화합물 2-6은 고추에서 동정된 바 있으나(Lemos 등, 2019), 자색가지고추의 과육에도 존재하고 있음을 확인할 수 있었다. 화합물 1은 고추에서 처음으로 분리된 화합물로, 자색가지고추에 존재하고 있음을 LC-MS 대사체 분석을 통해 재차 확인할 수 있었다. 그러나, 화합물 1은 고추에서 nasunin(2)로부터 생성된 분해산물일 가능성이 제기되었다. 또한, 화합물 1은 고추 추출을 제조하는 동안 일반적으로 열이나 빛 등에 불안전한 화합물인 nasunin으로부터 산화 분해 산물일 가능성도 있어, 고추 유래 화합물인지 밝히는 데는 한계가 있다고 판단되었다. 현재 자색가지고추에서 미확인된 다수의 페놀성 화합물 및 capsianoside류를 대상으로 추가 분리 및 구조해석 중에 있다.
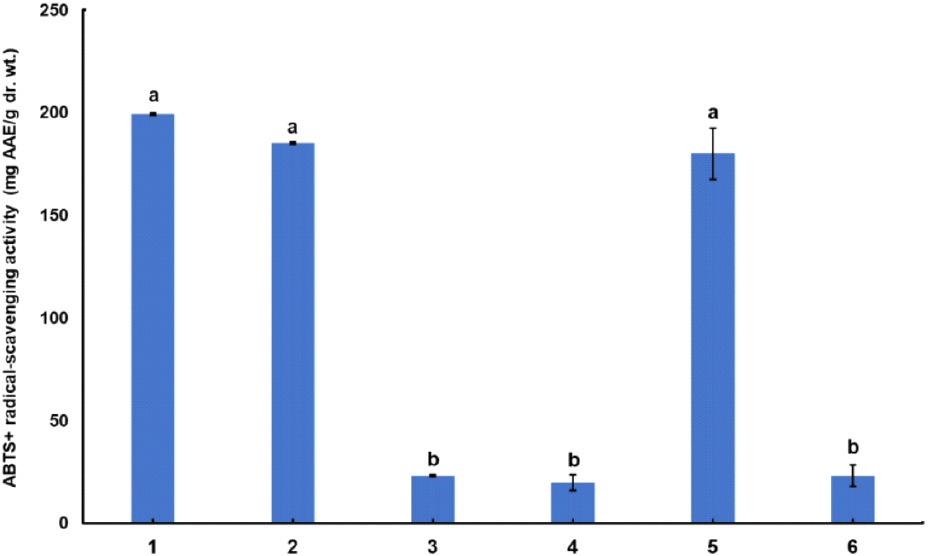
자색가지고추로부터 분리된 6종의 단리된 화합물을 대상을 ABTS+ radical-scavenging 활성을 평가하였다(Fig. 4). 화합물 1[4’-trans-p-coumaloylrutinosyl 2-(O-galloyl)-6-(O-β-glucopyranosyl)-4-hydroxyphenyl acetate], 2(nasunin), 그리고 5(quercetin 3-rutinoside)의 ABTS+ radical-scavenging 활성은 다른 3종 화합물(3, 4, 6)에 비해 유의하게 높게 나타났다. 페놀성 화합물의 radical-scavenging 활성은 hydroxyl group의 수와 위치에 따라 큰 차이가 있다고 보고되고 있다(Thavasi 등, 2009). 특히, galloyl과 catechol 구조를 갖는 페놀성 화합물이 radical-scavenging 활성을 비롯한 항산화 활성이 우수하다고 보고된 바 있다(Andjelković 등, 2006). 본 연구에서는 galloyl group을 갖는 화합물 1과 catechol 구조를 갖는 화합물 2와 5가 1종의 hydroxyl group을 갖고 있는 다른 3종 화합물(3, 4, 6)에 비해 radical-scavenging 활성이 우수한 것으로 여겨진다. Quercetin과 apigenin을 기본 골격으로 하는 flavonoid류와 cyanidin과 같은 anthocyanin류는 높은 항산화, 항암, 항균, 그리고 항바이러스 효과가 있으며, icariside E5(3), isoschaftoside(4), 그리고 narcissoside(6)도 높은 항산화 능력을 가지고 있다고 보고된 바 있다(Enogieru 등, 2018; Fu 등, 2022; Kang 등, 2021; Lee 등, 2024; Matsubara 등, 2005; Noda 등, 2000; Yang 등, 2012). 그러므로, 본 연구에서 동정한 6종의 화합물들은 자색가지고추의 항산화 활성을 포함한 생리활성에 기여할 것으로 기대된다.
4. 요약
최근 소비가 증가하고 있는 자색가지고추의 유용 성분을 파악하고자, 자색가지고추 추출물의 항산화 능력을 평가하고 그에 기인하는 유용 성분을 단리하고 항산화 활성물질을 구명하였다. 자색가지고추 BuOH층에서 항산화활성을 띄는 6종의 유용성분을 분리하였다. 단리된 화합물들을 대상으로 MS와 NMR을 이용하여 신규 화합물인 4’-trans-p-coumaloylrutinosyl 2-(O-galloyl)-6-(O-β-glucopyranosyl)-4-hydroxyphenyl acetate(1), nasunin(2), icariside E5(3), isoschaftoside(4), rutin(5), 그리고 narcissoside(6)으로 동정하였다. 단리된 6종의 화합물은 ABTS+ radical-scavenging 활성을 보였으며, 그 중 화합물 1, 2, 그리고 5는 다른 3종의 화합물에 비해 높은 활성을 나타냈다. 본 연구결과는 자색가지고추의 품질관리에 있어서 지표 또는 유용성분으로 활용이 기대된다.










