1. 서론
생명 유지에 필요한 에너지의 생산을 위해 인체는 계속해서 산소를 필수로 하며 미트콘드리아의 호기적 대사 과정에서 H2O2, ․OH, O2− 등의 활성산소종은 지속적으로 생성된다(Cho 등, 2008). 이와 같은 활성산소종의 생성에 의해 발생하는 산화적 스트레스로부터 대항하기 위해 우리 몸 속에 내제된 reactive oxygen species(ROS) 조절 체계가 이를 자체적으로 제거한다(Kim 등, 2023; Yu 등, 2017). 그러나 흡연, 음주, 약물 및 스트레스 등과 같은 물리 화학적 원인으로 생성된 과잉의 활성산소종은 superoxide dimutase(SOD), catalase(CAT), glutathione peroxidase(GPx)와 같은 체내 ROS 조절 기전에 관여하는 효소에 이상을 유발하여 세포 내 ROS를 증가시킴으로써 세포의 구성성분인 단백질, 지질 및 DNA에 비가역적, 비선택적 파괴를 촉진한다(Jeong 등, 2017; Kim 등, 2023). 이는 세포의 항상성 유지를 방해하고 노화를 촉진하여 암, 뇌 질환, 심혈관계질환, 피부 질환 등의 각종 질병을 유발한다고 보고되어 있다(Na 등, 2016). 따라서 이러한 활성산소종의 과잉 생성으로 발생하는 산화적 스트레스로부터 인체 내 ROS 조절 체계의 균형을 유지하기 위해 관여 효소를 발현시키거나 자유 라디칼 생성을 억제하는 항산화제를 통한 추가적인 조절이 요구된다(Bouayed와 Bohn, 2010).
항산화제는 활성산소종을 직접적으로 소거하거나 체내 항산화 기전에 필요한 효소의 발현을 유도또는 활성 산소에 의해 손상된 세포를 복구하여 간접적으로 항산화 활성을 가진다(Hong 등, 2009). 일반적으로 합성 항산화제인 BHA와 BHT를 널리 사용하고 있으나 장기 복용에 따른 부작용, 독성 및 변이성 지적과 더불어 소비자의 부정적 인식으로 인해 오랜 기간 섭취 시에도 안전한 천연 항산화제 개발에 관한 연구가 활발하게 진행되고 있다(Jeong 등, 2021; Lee 등, 2022). 천연 항산화제는 대표적으로 폴리페놀 화합물, carotinoid, ascorbic acid 등 여러 식물을 원료로 한 추출물이 대부분이지만(Nain 등, 2021), 최근에는 동식물성 단백질을 가수분해하여 제조한 단백가수분해물과 저분자 펩타이드 또한 항산화 효능이 있다고 보고되고 있다(Ha 등, 2017; Na 등, 2016). 특히, 일상에서 접하기 쉬운 동물성 단백질인 난황은 필수 아미노산을 고루 포함하고 있을 뿐만 아니라 항균 및 면역 기능에 도움을 줄 수 있는 lgY와 같은 단백질을 포함하고 있다(Sarantidi 등, 2023). 또한, 비타민 A, 비타민 B2, 비타민 B12, 엽산, 비타민 D, 비타민 E, 비타민 K, 칼슘, 철, 콜린, 셀레늄, β-카로틴, 루테인, 제아잔틴 등을 함유하고 있어 영양학적으로 높은 가치를 가지지만, 난황의 lecithin이 천연 유화제로써 다양하게 활용됨에 따라 lecithin 추출 이후의 부산물 폐기량이 증가하고 있다(Yang 등, 2014; Zhao 등 2023). Lecithin 추출에 이용되는 난황 분말의 인지질 함량은 약 16.8%에 불과하며 60% 이상의 단백질을 함유하고 있음에도 불구하고 폐기되는 실정이다(Han 등, 2015).
따라서 본 연구는 4종의 단백질 가수분해 효소를 이용해 lecithin 추출 이후의 부산물인 탈지난황으로부터 생리활성 펩타이드를 함유하는 단백가수분해물을 제조한 후, 항산화 활성 및 안정성을 평가하여 항산화제로서 부산물의 잠재적 가치를 확인하고자 한다.
2. 재료 및 방법
본 실험에서 사용한 난황 분말과 난백 분말은 경기도 여주에 위치한 ㈜은산푸드에서 판매된 것을 구입하였으며, 난황 분말은 덕산(Seoul, Korea)으로부터 구입한 95% prethanol A와 ㈜대정화금(Siheung, Korea)으로부터 구입한 95% n-hexane으로 직접 탈지 과정을 거쳐 사용하였다. 대조군으로 사용된 갈색거저리 유충(Tenebrio molitor, mealworm)은 오엠오(Damyang-gun, Jeollanam-do, Korea)에서 동결 건조된 갈색거저리 유충을 구입해 사용하였으며, 탈지 대두 분말은 증안리 약초마을 협동조합(Yangpyeong-gun, Gyeonggi-do, Korea)에서 생산된 것을 구입하였다. L-ascorbic acid는 Junsei Chemical Co.(Tokyo, Japan)로부터 구입하였으며, 녹차(세작)는 ㈜오설록(Yongsan-gu, Seoul, Korea)에서 건조품 형태로 구매하였다. 실험에 사용한 모든 시료는 -20°C 이하 동결고에 보관하며 사용하였다. Alcalase, bromelain, flavourzyme 및 neutrase 단백질 분해 효소는 Novo사 제품을 대종상사(Seoul, Korea)로부터 구입하였다. 가수분해도 측정을 위해 사용된 2,4,6-trinitrobenzene sulfonic acid(TNBS)는 G-Bio-sciences사(St. Louis, MO, USA)로부터 구입하였으며, sodium dodecyl sulfate(SDS)는 Wako사(Osaka, Japan)로부터 구입하였다. Sodium bicarbonate는 덕산(Seoul, Korea)으로부터 구입하였으며, sodium dodecyl sulfate-polyacrylamide gel electrophoresis(SDS-PAGE) 전기영동에 사용되는 tetramethylethylenediamine(TEMED), 30% acrylamide/bis solution 29:1은 Bio-Rad(Hercules, CA, USA)로부터 구입하였다. 그 밖의 언급이 없는 분석용 시약 및 유기 용매는 모두 Sigma-Aldrich사(St. Louis, MO, USA)로부터 구입하여 사용하였다.
냉장 보관한 난황 분말의 lecithin 추출을 위해 혼합 용매 추출법을 이용하였다(Seo, 2012). 혼합 용매 추출법은 기타 lecithin 추출 방법에 비해 비교적 경제적이고 과정이 간단하여 산업적으로 주로 이용된다(Zhao 등, 2023). 먼저 난황 분말에 8배(w/v)의 95% prethanol을 첨가해 55°C에서 150 rpm으로 3시간 교반하며 추출한 후, 20분 정치하여 침전시켜 상등액과 침전물을 분리하였다. 해당 과정을 3회 반복한 후 침전물은 instrument tray에 올려 fume hood 내에서 24시간 이상 건조하였다. 건조된 분말에 8배(w/v)의 95% n-hexane을 첨가해 55°C에서 150 rpm으로 3시간 교반하며 추출한 후, 20분 정치하여 침전시켰다. 상층액과 침전물을 분리한 후, 수거한 침전물을 n-hexane을 이용해 세척하였다. 동일한 과정을 2회 반복한 후 instrument tray에 옮겨 fume hood 내에서 24시간 이상 건조하였다. 제조된 탈지난황 분말은 -20°C 동결고에 보관하며 사용하였다.
탈지난황을 증류수에 현탁하여 4%(w/v)의 기질 용액으로 제조한 후, 90°C에서 20분 동안 중탕시켜 자가 효소를 불활성화 시켰다. 방랭한 후 단백질 가수분해효소(alcalase, bromelain, flavourzyme, neutrase)를 각각 기질 용액에 기질 대비 1% (v/w)로 첨가하여 55°C, 130 rpm에서 12시간 동안 가수분해하였다. 이후 가수분해물을 90°C에서 20분간 가열하여 효소를 불활성화시켰다. 방랭한 가수분해물의 고형분을 제거하기 위해 13,000 ×g에서 20분 동안 원심분리하여 상등액은 cell strainer로 여과한 후 0.2 μm membrane filter(mixed cellulose ester membrane filter, Adventec, Toyo Roshi Kaish, Ltd., Tokyo, Japan)를 이용하여 여과 과정을 거쳐 단백가수분해물을 얻었다. 단백가수분해물을 72시간 동안 동결 건조하여 -20°C 동결고에 보관하면서 실험에 사용하였다. 단백가수분해물의 수율은 가수분해물 제조에 이용한 탈지난황의 무게 대비 동결 건조 이후 단백가수분해물의 무게를 %(w/w)로 나타내었다.
탈지대두 및 갈색거저리 유충 단백가수분해물의 제조는 각각 Park 등(2023)의 방법과 Yu 등(2017)의 방법에 따라 alcalase 단백질 가수분해효소를 이용하여 진행하였으며, 난백 단백가수분해물의 제조는 neutrase 효소를 이용하여 탈지난황 단백가수분해물 제조와 동일한 방법으로 진행하였다.
녹차 추출물(green tea extract)은 분말 중량 10배(w/v)의 증류수를 혼합하여 80°C에서 3시간씩 총 2회 반복 추출하여 제조하였으며, 해당 추출물은 6 μm 여과지(Whatman No. 3, Little Chalfont, England)로 여과 후 55°C 수욕상에서 회전식 감압농축기로 농축 후 동결 건조하여 -20°C의 동결고에 보관하면서 실험에 사용하였다.
단백질 가수분해도를 측정을 위해 효소제 처리 시간을 달리하여 TNBS assay 방법(G-Biosciences Co.)을 이용하였다(Cho 등, 2019). 시간별 가수분해물을 13,000 ×g, 4°C, 10분간 원심분리하여 상등액을 얻어 실험에 이용하였다. 990 μL의 10 mM sodium bicarbonate(pH 8.5)에 10 μL의 1% TNBS 혼합(v/v)하여 0.01% TNBS를 제조하고, 시간별 효소 기질 반응액을 각 가수분해물을 13,000 ×g로 원심분리하여 얻은 상등액 100 μL와 TNBS 50 μL를 섞어 37°C에서 2시간 반응시킨 후 반응을 정지시키기 위해 10% sodium dodecylsulfate(SDS)와 1 N HCl을 첨가하였다. 그 후 microplate spectrophotometer(Bio Tek Instruments Inc., Winooski, VT, USA)를 이용하여 335 nm에서 흡광도를 측정한 후 시료의 가수분해도를 L-tyrosine 함량으로 환산한 available amino group concentration(μg/mL)을 이용하여 나타내었다.
각 효소별 탈지난황 단백가수분해물의 단백질의 패턴을 관찰하기 위해 SDS-polyacylamide gel electrophoresis(SDS-PAGE)를 이용하였다. SDS-PAGE는 Park 등(2023)의 방법에 따라 수행하였다. 효소별 12시간 기질 반응용액을 13,000 ×g, 4°C, 10분간 원심분리하여 얻은 상등액과 sample buffer를 3:1 비율로 혼합하여 15% gel에 loading한 후 80 V에서 약 2시간 동안 전기영동하였다. 이때 단백질의 분자량 확인을 위한 molecular weight marker는 Bio-Rad Laboratories(Carlsbad, CA, USA)의 제품을 이용하였으며, loading이 끝난 gel을 0.1% coomassie brilliant blue를 사용하여 염색한 후, 10% acetic acid가 함유된 30% methanol을 이용하여 탈색하였다. 이후 결과는 Gel Logic 2200 PRO Imaging System(Carestream Health Inc., Rochester, NY, USA)을 이용하여 polyacrylamide gel을 스캐닝한 후 이미지로 영상화하였다.
ABTS radical 소거 활성 실험은 Yu 등(2017)의 방법을 응용하여 측정하였다. 최종농도가 7 mM인 ABTS와 2.45 mM인 potassium persulfate를 혼합한 후 실온인 암소에서 12-16시간 동안 방치하여 ABTS radical 용액을 제조하였다. 제조한 ABTS radical 용액은 734 nm에서 흡광도 값이 0.70±0.02가 되도록 phosphate buffered saline(PBS, pH 7.4)으로 희석하였다. 시료 20 μL에 희석된 ABTS radical 용액 180 μL를 가하여 상온에서 1분 동안 반응시킨 뒤 734 nm에서 흡광도를 측정하였다. 이때 결과 값은 흡광도를 1/2로 환원시키는데 필요한 시료의 농도인 RC50값과 활성 비교를 위한 양성대조군인 trolox를 사용하여 표준 곡선을 작성한 후 mg당 trolox 당량으로 나타내었다(Yu 등, 2017).
Hydrogen peroxide (H2O2) 소거 활성 측정은 Jang 등(2019)의 방법에 따라 시료 20 μL, PBS 100 μL, 1 mM H2O2 20 μL를 96 well plate에 가한 후 37°C incubator에서 5분간 반응시켰다. 이후 1.25 mM ABTS 30 μL와 1 U/mL peroxidase 30 μL 가하고 37°C incubator에서 10분간 반응시켜 405 nm에서 흡광도를 측정하였다. Peroxidase는 control과 반응 후 흡광도 값을 1.0-1.3 사이가 되도록 PBS로 희석하였다. 이때 결과 값은 흡광도를 1/2로 환원시키는데 필요한 시료의 농도인 RC50값과 활성 비교를 위한 양성대조군인 trolox를 사용하여 표준 곡선을 작성한 후 mg당 trolox 당량으로 나타내었다(Yu 등, 2017).
탈지난황의 항산화 안정성을 알아보기 위하여 25°C incubator에 시료를 보관하면서 16일간 ABTS radical 소거 활성을 측정하였다. 7일간은 매일 동일한 시간에 항산화 활성을 측정하였으며, 7일차 이후로는 3일 간격으로 항산화 활성을 측정하였다. 이때 항산화 안정성 비교를 위해 L-ascorbic acid와 녹차 추출물을 대조군으로 활용하였으며, 0일차를 기준으로 변화하는 항산화 활성을 %로 나타내었다.
실험 결과에 대한 통계 분석은 SPSS Statistics 26(Statistical Package for the Social Science, Version 26.0 SPSS Inc., Chiago, IL, USA)를 사용하였으며, 모든 데이터는 최소 3번 반복하여 평균과 표준편차(mean±SD)로 나타내었다. 그룹 간의 유의성 차이 검증에는 일원배치 분산분석(one-way ANOVA)을 사용하였고, Duncan’s multiple range test를 이용해 사후 검증을 시행하였다. 5%(p<0.05)의 유의수준에서 각 구간의 유의적 차이를 검증하였다.
3. 결과 및 고찰
각 효소별 반응 시간에 따른 단백가수분해도를 평가하기 위해 효소 처리 시간별(0, 0.5, 1, 2, 4, 8, 12, 24 h) 반응물을 채취하였다. 24시간 경과하였을 때, alcalase군과 flavourzyme군의 available amino group의 농도가 각각 3,447.71 μg/mL와 3,190.63 μg/mL로 가장 높았다. 반면, bromelain군과 neutrase군의 available amino group의 농도는 각각 1,580.61 μg/mL와 2,112.2 μg/mL로 비교적 낮은 가수분해도를 나타내었다(Fig. 1). 이처럼 효소별로 가수분해도가 다르게 나타난 이유는 각 효소가 지니는 기질 특이성 차이로 인한 것으로 판단된다(Wouters 등, 2016). Alcalase군과 flavourzyme군은 12시간 동안 available amino group 농도가 꾸준히 증가하다 12시간부터는 완만한 증가폭을 나타내었으며, bromelain군과 neutrase군은 8시간 동안 조금씩 증가한 후 8시간 이후부터는 가수분해도의 유의적 변화를 보이지 않아 12시간이 적절한 효소 처리 시간이라고 판단하였다.
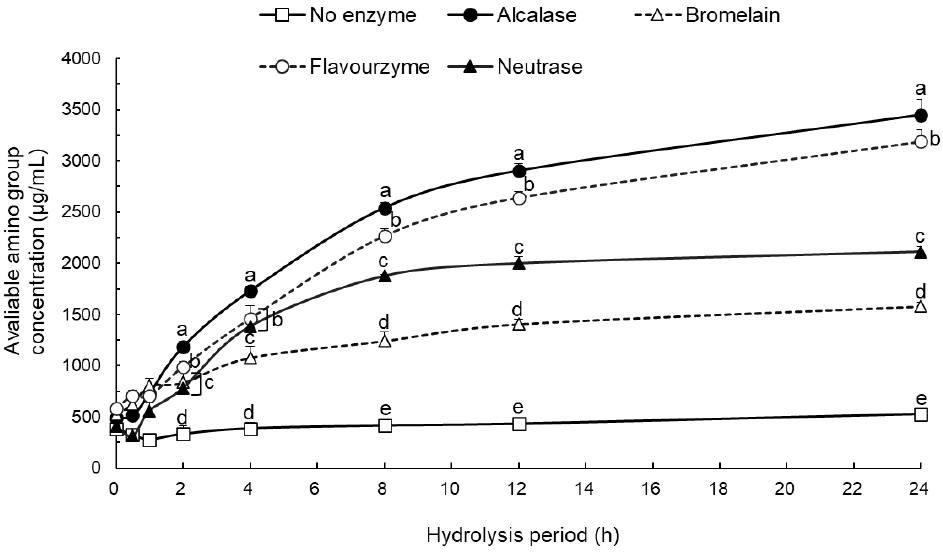
12시간 반응시킨 각 효소별 탈지난황 단백가수분해물의 SDS-PAGE 패턴을 확인한 결과, 비효소군은 37 kDa 주위의 고분자 단백질의 존재를 확인할 수 있었지만 효소 처리군의 경우 해당 밴드의 발현이 약해진 것으로 보아 비효소군에 비해 저분자량의 단백질이 많이 생산된 것을 알 수 있었다(Fig. 2). 특히, alcalase군과 flavourzyme군은 10 kDa 이상의 단백질 밴드가 거의 보이지 않고 대부분 10 kDa 이하로 분해되었음을 확인할 수 있으며, TNBS assay 결과와 유사하게 alcalase와 flavourzyme 효소 처리군이 다른 효소에 비해 가수분해 효율이 좋음을 알 수 있었다(Table 1).
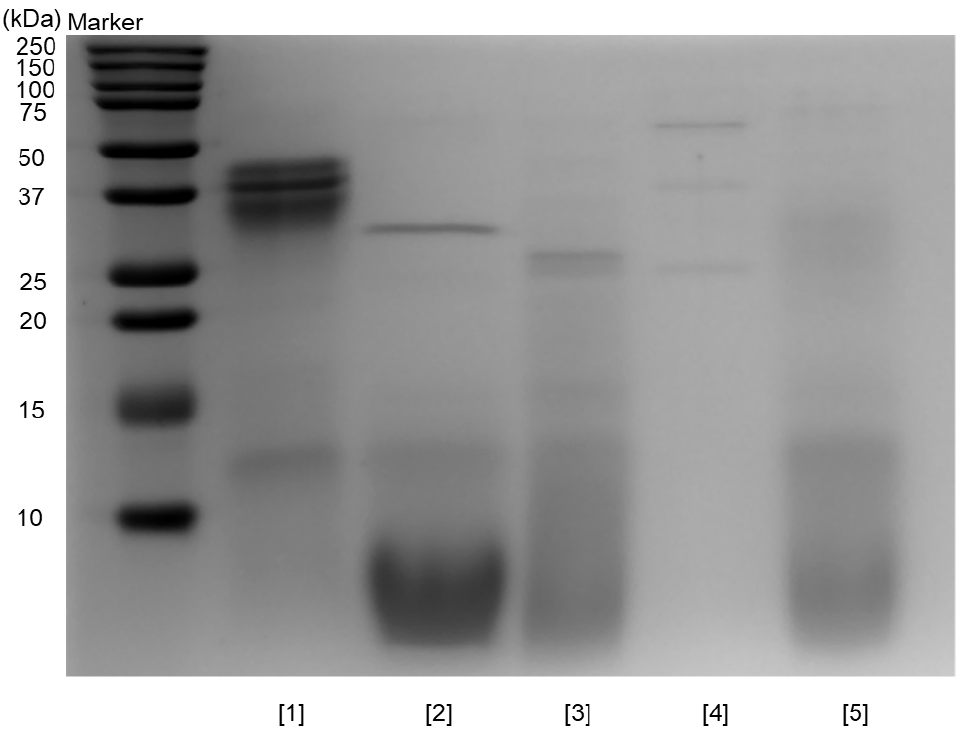
| Enzymes | Yields of protein hydrolysates (%)1) |
|---|---|
| No enzyme | 4.06±0.95d2) |
| Alcalase | 27.13±2.44a |
| Bromelain | 11.14±1.62c |
| Flavourzyme | 8.64±1.34c |
| Neutrase | 14.31±2.40b |
위 결과를 바탕으로 본 연구에서는 효소별 12시간 가수분해물을 선택하여 동결 건조 후 항산화 활성 평가에 활용하였다. 이때 각 효소별 단백가수분해물의 제조 수율은 비효소군 4.06%, alcalase군 27.13%, bromelain군 11.14%, flavourzyme군 8.64%, neutrase군 14.31%으로 alcalase가 가장 수율이 높았으며, TNBS assay와 유사한 결과가 나타남을 확인하였다. 동물 및 식물 유래의 단백질 원료를 이용한 단백가수분해물을 제조 시에 수율이 낮게는 20% 이상에서 높게는 40% 이상을 보인다고 보고되고 있지만(Park 등, 2023), 탈지난황 단백가수분해물의 경우 alcalase를 제외한 나머지 효소들은 모두 제조 수율이 상대적으로 낮은 것을 확인할 수 있었다. 이는 실험에 이용된 난황 분말내 단백질이 탈지 과정에서 유기 용매에 의해 변성되어 가수분해의 효율이 낮아진 것이라 생각된다.
ABTS 라디칼 소거 활성 측정법은 ABTS를 potassium persulfate와 반응시켜 생성된 청록색의 ABTS radical이 항산화 물질에 의해 제거되면서 라디칼의 짙은 청록색이 무색으로 탈색되는 원리를 이용한 항산화 활성 측정법으로 측정이 빠르고 pH 변화에 안정적이다(Lee와 Moon, 2019). 이를 이용하여 trolox를 표준 물질로 하여 탈지난황 단백가수분해물의 항산화력을 TEAC값으로 환산하였으며, 시료별로 ABTS radical을 50% 제거하는 값을 RC50으로 환산하여 Table 2에 나타내었다. RC50값은 alcalase군 57.83 μg/mL, neutrase군 59.66 μg/mL, flavourzyme군 63.54 μg/mL, bromelain군 69.10 μg/mL, 비효소군 166.03 μg/mL로 효소별로 유의적인 차이를 보였으며 비효소군에 비해 효소군에서 전반적으로 높은 항산화 활성을 보였다. 특히, 효소군 중에서는 alcalase 단백가수분해물의 ABTS radical 소거 활성이 가장 높았다.
Hydrogen peroxide(H2O2)는 호흡 및 대사 과정 중 전자 전달 과정, 산화 환원 효소 반응에 의해 생성되는 부산물로 반응성이 매우 강한 특성을 지니고 있다. 활성산소종의 일종인 과산화수소는 주로 정상 세포의 mitochondria나 peroxisome에서 생성되며 보통의 환경에서는 항상성을 유지해 대부분은 세포 내의 항산화 효소인 catalase, peroxidase 등에 의해서 독성이 없는 H2O로 제거된다. 하지만 UV와 같은 외부 자극이나 대사 작용의 문제로 인해 항상성 체계의 균형이 깨지면 활성 산소가 지나치게 생성되어 산화적 스트레스로 인한 세포 내 독성이 유발된다. 그 결과, DNA가 변성되거나 세포막이 파괴되어 신경퇴화, 노화, 동맥경화, 암 등과 같은 성인병을 야기한다(Jeong 등, 2017; Na 등, 2016; Yoon 등, 2022). 본 연구에서는 peroxidase의 기질인 ABTS를 H2O2와 반응시켜 탈지난황 단백가수분해물의 H2O2 소거 활성을 측정하였다(Table 3). 각 효소별 탈지 난황 단백가수분해물의 H2O2 소거능을 RC50값으로 비교한 결과, alcalase 83.28 μg/mL, neutrase 88.27 μg/mL, bromelain 94.98 μg/mL, flavourzyme 98.46 μg/mL, 비효소군 253.03 μg/mL로 나타났다. 따라서 효소처리군 모두가 비효소군 대비 높은 H2O2 소거 활성을 보였으며 그 중 alcalase 효소 처리군이 가장 우수한 활성을 가지는 것을 확인할 수 있었다.
이상의 결과, alcalase로 가수분해하여 얻은 단백가수분해물에서 ABTS 라디칼 저해 활성의 RC50이 57.83 μg/mL, H2O2 소거 활성의 RC50이 88.19 μg/mL으로 나타났으며, 4종의 효소 처리군 중 항산화 활성이 가장 우수한 것으로 나타났다. 이는 ABTS 라디칼 소거활성과 H2O2 소거활성이 hydrogen atom transfer 방법으로 작용 기전이 동일해 상관관계가 존재한다는 것을 의미한다. 선행연구에서 보고된 다양한 단백가수분해물의 ABTS radical 저해 활성 결과를 비교했을 때 neutrase 갈색거저리 유충 가수분해물(Yu 등, 2017), alcalase 탈지대두 가수분해물(Castro와 Sato, 2015), neutrase 난백 가수분해물(Cho 등, 2014), flavourzyme 참치 가공부산물 가수분해물(Park 등, 2023)이 우수한 항산화 활성을 보였으며, H2O2 소거 활성 결과를 비교한 경우, alcalase 갈색거저리 가수분해물, flavourzyme 참치 가공부산물의 활성이 높게 나타났다. 이는 효소의 기질 특이성과 원료별 구성 아미노산과 단백질 1차 구조의 차이에 의해 가수분해 시 효소별로 생성되는 펩타이드 및 아미노산의 조성이 상이하기 때문에 항산화 효과가 차이를 나타내는 것으로 생각된다.
자유 라디칼과 기타 ROS를 효율적으로 제거한다고 알려진 L-ascorbic acid는 식품, 음료 또는 과일주스 등에 항산화제 및 항갈변제로 인정되어 널리 사용되고 있으나, 구조가 불안정하여 열, 빛과 같은 외부의 환경에 민감하게 반응해 쉽게 활성을 잃는다(Yu 등, 1991). 이러한 L-ascorbic acid의 안정성을 향상시키기 위해 ascorbic acid 유도체가 사용되는 경우도 있으나 효율이 떨어지는 단점이 있다(Lee 등, 1999). 또한, 녹차에 함유된 카테킨은 자유 라디칼의 형성을 억제하는 등의 안정적이며 강한 항산화 활성을 띄지만 높은 가격으로 인해 산업적으로 활용이 어렵다는 단점이 있어 저렴하면서도 안정적인 항산화제의 개발이 필요한 실정이다(Yeo 등, 1995).
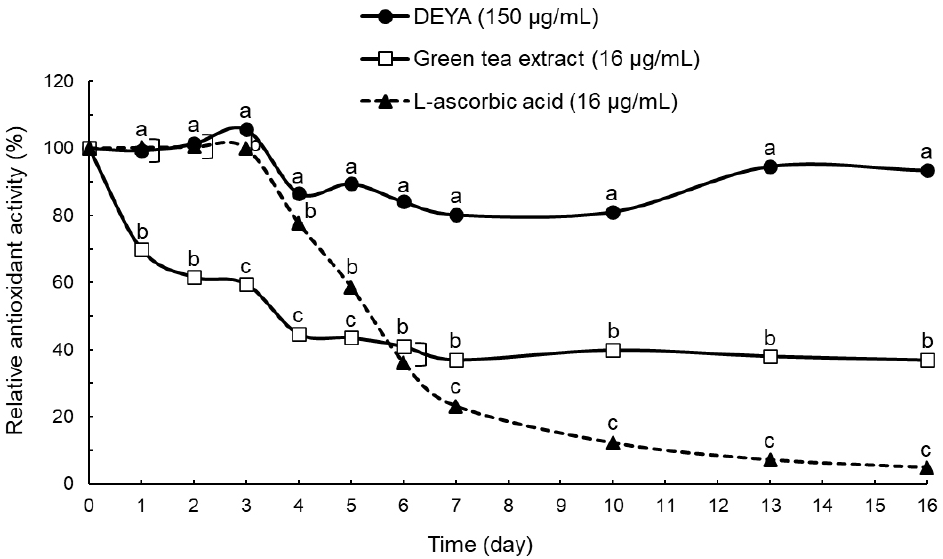
따라서 본 실험에서는 L-ascorbic acid와 녹차 추출물을 대조군으로 선정하였으며, 앞선 실험 결과에서 가장 우수한 항산화능을 보였던 탈지난황 alcalase 가수분해물과 보관 기간에 따른 radical 소거능 변화를 바탕으로 항산화 안정성을 평가하였다.
L-ascorbic acid와 녹차 추출물을 대조군으로 선정하여 RC50값인 2 μg/mL와 녹차 추출물의 RC50값인 6 μg/mL보다 높은 농도인 8 μg/mL로 실험을 진행하였으나, 2일차에서 항산화 활성을 모두 잃어 유의미한 데이터를 얻을 수 없다고 판단하였다(data not shown). 따라서 대조군의 농도가 16 μg/mL일 때 연구에 가장 효과적으로 사용될 수 있을 것으로 판단하여 평가를 진행하였다. 이때 탈지난황 alcalase 가수분해물(DEYA: 150 μg/mL)과 대조군의 항산화 안정성은 보관 시간에 따른 radical 소거능 변화율로 Fig. 3에 나타내었다. 0일차의 radical 소거능을 100%로 보았을 때 7일 경과 후 탈지난황에 비해 대조군의 활성이 급격히 저하되는 것을 확인하였다. 보관 16일차에 녹차 추출물와 L-ascorbic acid는 각각 36.88%, 4.82%의 활성을 나타내었지만 DEYA는 90% 이상의 높은 활성을 유지하였으며, 28일차까지도 90% 이상의 높은 활성을 유지하는 것으로 확인되었다. 항산화능이 매우 우수하다고 알려져 있지만 안정성이 낮은 대조군들에 비해 DEYA의 항산화 활성이 안정적인 것을 확인하였으며(data not shown), DEYA는 안정적인 항산화능을 보유한 천연물 유래 항산화 소재로 활용할 수 있을 것이라 판단된다.
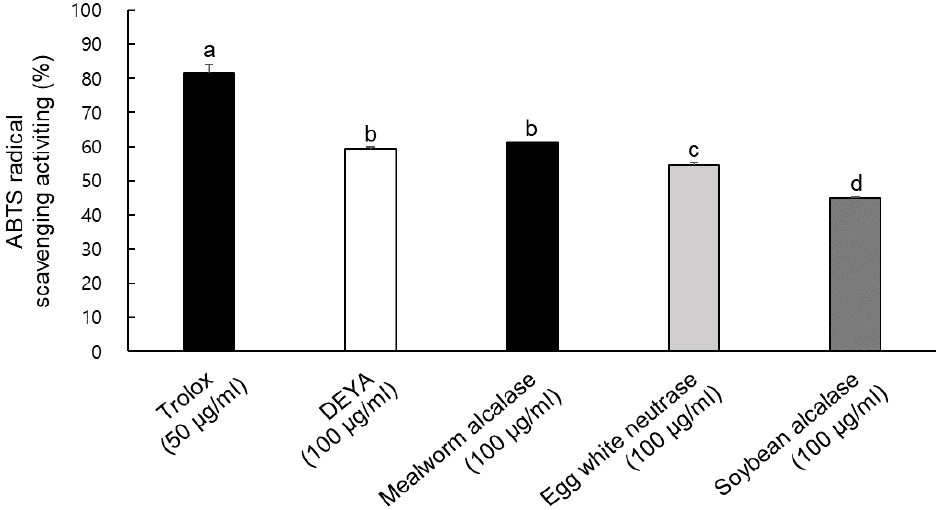
선행연구(Castro와 Sato, 2015; Cho 등, 2014; Yu 등, 2017)에서 높은 항산화능을 보인 난백, 갈색거저리 유충(밀웜) 및 탈지대두 단백가수분해물과 DEYA의 항산화 활성을 비교하였다. 선행연구에서 가장 우수한 항산화 활성을 나타낸 효소를 이용하여 단백가수분해물을 직접 제조해 실험에 사용하였다. 해당 시료들과 DEYA의 항산화 활성을 비교하기 위해 동일한 농도(100 μg/mL)로 실험한 결과, 밀웜과 난백단백가수분해물의 radical 소거능은 DEYA와 유사하였지만, 대두 단백가수분해물의 경우 유의적으로 낮은 활성을 나타내었다(Fig. 4).
상위 결과들을 토대로 alcalase, bromelain, flavourzyme, neutrase 효소를 처리한 탈지난황 단백 가수분해물의 항산화 활성이 비처리군에 비해 유의적으로 향상되었으며, ABTS radical 소거 활성과 H2O2 소거 활성 모두 DEYA가 가장 우수한 항산화 활성을 보였다. 또한, DEYA는 항산화 안정성 실험에서 L-ascorbic acid와 녹차 추출물에 비해 매우 안정적인 항산화능을 보였으며, 기타 식품소재 유래 단백가수분해물들과 항산화 활성 비교에서는 유의적으로 높거나 유사한 항산화 활성을 가지고 있음을 확인하였다. 이를 통해 탈지난황 단백가수분해물의 항산화제로서 잠재적 가치를 확인하였다.
4. 요약
본 연구에서는 탈지난황을 활용한 항산화 소재 개발 가능성을 탐색하기 위해 탈지난황 단백가수분해물을 제조하고 항산화 활성을 평가하였다. 4종의 단백질 가수분해 효소(alcalase, bromelain, flavourzyme, neutrase)를 처리한 후 시간에 따른 각 효소별 가수분해도를 확인한 결과, 효소 처리군의 가수분해도가 비처리군에 비하여 전반적으로 높았으며, 특히 DEYA가 가장 높은 가수분해도를 보였다. 각 효소와 12시간 반응시켜 제조한 효소별 단백가수분해물의 ROS 소거 활성을 평가하기 위해 ABTS radical 및 H2O2 소거 활성 실험을 진행한 결과, DEYA가 다른 가수분해물에 비해 유의적으로 높은 항산화 활성을 보이는 것으로 확인되었다. 이상의 실험을 기반으로 효소별 단백가수분해물 중 가장 높은 가수분해도와 항산화 활성을 보였던 DEYA를 상온에 보관하며 항산화 안정성 평가를 진행한 결과, DEYA는 L-ascorbic acid와 녹차 추출물 대비 월등히 우수한 안정성을 보였으며, 28일 차까지도 90% 이상의 항산화 활성을 유지하였다. 또한, DEYA는 난백 단백가수분해물, 갈색거저리 유충 그리고 탈지대두와의 ABTS radical 소거 활성 비교 실험을 진행한 결과에서도 유사하거나 상대적으로 우수한 활성을 보였다. 최종적으로 본 연구에서는 산업적으로 이용되고 있는 lecithin 추출 공정과 효소적 가수분해를 통해 제조한 탈지 난황 단백가수분해물의 우수한 항산화 활성을 확인할 수 있었다. 이는 향후 항산화 기능성을 가진 기능성 식품과 식품첨가물 개발을 위한 기초 연구 자료로서 활용될 수 있을 것으로 기대된다.










