1. 서론
인체는 대사과정 중 산화적 스트레스에 의해 발생한 활성산소를 효율적으로 제거할 수 있는 항산화 시스템을 가지고 있다. 그러나 항산화 시스템의 항산화 효소가 활성산소를 효율적으로 제거하지 못할 경우 초과산화(superoxide), 과산화수소(hydrogen peroxide), 수산(hydroxyl radical) 등의 활성산소종이 생성된다(Magnani 등, 2000). 이러한 활성산소종은 산화력이 강해 세포 구성성분을 비가역적으로 손상시켜 암, 당뇨병, 염증 등 전반적인 세포의 노화 및 생리적 장해를 초래한다(Valko 등, 2007). 특히, 활성산소종의 과다 생성과 산화 스트레스 증가에 의해 유발될 수 있는 당뇨병은 고혈당을 특징으로 하는 대사성 질환으로, 췌장 베타세포에서 인슐린 분비 이상에 의해 발생한다(Baynes와 Thorpe, 1999; Bentle 등, 2000). 우리나라를 비롯한 전 세계적으로 당뇨병 유병률은 매년 증가되고 있으며, 30세 이상 성인 10%가 당뇨병 환자이고, 20%가 당뇨병 전 단계인 공복혈당 장애 환자이며, 30%가 고혈당 증상을 가지고 있다고 보고되었다(Kim 등, 2013; Kim 등, 2018). 제2형 당뇨병의 경우 체내 산화적 스트레스의 경감 및 혈당강하 활성을 가진 식물류를 이용한 대체 식이요법에 대한 의존도가 높아 환자의 80%가 대체요법을 이용하고 있다(Meena 등, 2009). 따라서 최근에는 천연물을 중심으로 다양한 건강기능성 소재의 개발이 진행되고 있으며, 이들의 생리활성이나 질병의 회복 또는 예방에 대한 연구가 활발히 이루어지고 있다(Yi 등, 2017).
여주(Momordica charantia L.)는 아시아, 아마존, 동아프리카와 카리브 지역의 열대에서 서식하는 1년생 박목, 박과의 덩굴성 한해살이 풀로서 쓴맛을 가지고 있어 고과 또는 bitter melon이라고 불린다(Jia 등, 2017). 여주는 스테롤 배당체, 아미노산, 사포닌, 알칼로이드, 비타민 C, 미네랄 및 β-carotene 등 여러 가지 생리활성 물질들과 flavan-3-ol 유도체 및 phenolic acids 등의 항산화 성분을 함유하고 있다(Nam과 Kim, 2015). 특히 과실과 종자에 주로 함유되어 있는 charantin은 췌장의 베타세포에 작용하여 인슐린의 분비를 촉진함으로써 혈당 강화 효과를 가지는 것으로 알려져 있다(Grover와 Yadav, 2004). 이와 같은 여주의 다양한 기능성이 밝혀짐에 따라 여주의 소비가 증대되고 있어 건강식품 소재로서의 활용성 가능성이 매우 높다(Park 등, 2018). 그러나 여주는 세포벽이 단단하고, 품종 및 재배지와 수확 기간 등에 따라서 기능성 물질의 함유량에 차이를 보여(Goo 등, 2016; Lee 등, 2016; Moon 등, 2015), 기능성 식품 소재화를 위한 추출방법에 대한 연구가 요구된다.
천연물의 유용성분을 추출하는 방법으로 용매 추출법과 열수 추출법이 주로 사용되었으나, 최근에는 초음파 추출법, 마이크로파 추출법 및 초임계 추출법 등의 다양한 방법이 시도되고 있다(Heo 등, 2019). 특히 초음파 추출법은 다양한 식물성 소재에서 페놀화합물의 추출효율을 향상시키는 것으로 보고되고 있다(Vuong 등, 2015). 초음파는 추출 용매에 cavitation bubble을 발생시키는데, 이러한 bubble이 붕괴되면서 국부적으로 고온, 고압 환경을 만들어 bubble 가까이에 위치한 식물 세포벽을 파괴시키는 작용을 한다(Rostagno 등, 2003). 초음파의 작용으로 붕괴된 식물 세포벽은 식물 조직 내로 용매 침투를 용이하게 하여 식물세포 내부의 유기화합물의 방출을 증가시킨다(Sharmila 등, 2016). 초음파 추출법은 기존의 추출방법과 비교했을 때 추출 공정을 단순화시켜 추출 속도를 높이고 용매를 절약하는 이점을 가지므로 유용성분의 효율적인 추출을 가능하게 한다(Vilkhu, 2008).
따라서 본 연구에서는 프로브형태와 수조형태의 초음파추출 장치를 이용하여 물 또는 에탄올을 사용하여 추출하고, 이들 추출물의 항산화, 항당뇨 및 항염활성을 열수추출, 에탄올추출 및 고온고압 물추출로 얻은 추출물과 비교하여, 기능성 식품소재로서의 활용성 가능성을 측정하였다.
2. 재료 및 방법
여주(Momordica charantia L.)는 경상북도 경산시에서 2020년에 재배된 것으로, 15-20 cm 길이의 여주를 구입하여 실험에 사용하였다. 여주는 세척 후 씨를 제거하고 동결건조 후 Food Mixer(FM-681C, Hanil, Incheon, Korea)를 사용하여 마쇄하고 45 mesh(Chung Gye Indus., MFG Co., Seoul, Korea)로 체질하였다.
수분 함량은 수분자동측정기(FD-720, Kett, Tokyo, Japan)를 이용하여 측정하였다. 조지방 함량은 조지방자동추출기(Soxtec 2050, Foss, Hoganas, Sweden)를 이용하여 시료 중의 지방을 dietyl ether로 추출하여 측정하였다. 조회분 함량은 500°C의 회화로(Muffle Furnace, Isuzu, Tokyo, Japan)를 이용하여 직접회화법으로 측정하였다. 회화와 방냉을 반복하여 항량을 구했으며, 회화 전후 시료의 중량 차를 계산하여 조회분량을 산출하였다. 조단백은 식품공전의 일반성분시험법의 Kjeldahl법에 따라 microkjdeldahl 장치(BUCHI Distillation Unit K-350, Flawil, Switzerland)를 사용하여 측정하였다. 탄수화물 함량(%)은 시료 전체 함량인 100%에서 수분, 조지방, 조회분, 조단백 함량을 뺀 값으로 하였다.
여주 폴리페놀 추출물은 프로브형태 초음파 에탄올추출(PUE-E), 프로브형태 초음파 물추출(PUE-W), 수조형태 초음파 에탄올추출(BUE-E), 고온가압 물추출(AE-W), 에탄올추출(EE), 열수추출(HWE)을 이용하여 제조되었다. 프로브형태 초음파 에탄올추출은 시료 2 g에 60% 에탄올 80 mL를 넣고, probe가 장착된 초음파장치(KFS-600N, Korprotech, Seoul, Korea)를 이용하여 270 W의 초음파 세기로 15분간 추출하였다. 또한 프로브형태 초음파 물추출은 프로브형태 초음파 에탄올추출과 동일하나 용매로 증류수를 사용하였다. 수조형태 초음파 에탄올추출은 시료 5 g에 40배에 해당하는 60% 에탄올 200 mL를 가하여 물을 채운 초음파 수조 장치(30×24×14.5 cm, 5510R-DTH, Branson, Danbury, CT, USA)에서 42 kHz, 135 W 조건으로 45분 동안 추출하였다. 이 때 시료가 초음파 수조 하단에 닿지 않도록 병뚜껑을 부착한 아크릴판을 수조 바닥에 장착하여 추출을 진행하였다. 고온고압 물추출은 시료 5 g에 증류수 200 mL를 가하여 121°C에서 autoclave(MaXterile 100, Daihan Scientific, Wonju, Korea)를 이용하여 15분간 추출하였다. 에탄올추출과 열수추출은 시료 5 g에 200 mL의 용매(에탄올, 증류수)를 넣어 잘 섞은 다음, shaking water bath(BS-11, JeioTech, Seoul, Korea)를 이용하여 각각 60°C, 90°C의 온도에서 100 rpm으로 3시간 동안 추출을 진행하였다.
이상과 같이 각각의 추출법으로 얻은 추출액을 4°C, 8,000 rpm(Suter R22, Hanil, Seoul, Korea)에서 20분간 원심분리한 다음, filter paper(Whatman No. 1, Maidstone, England)로 여과하여 얻어진 여과액을 감압농축(N-1300, Eyela, Tokyo, Japan)하였다. 농축된 추출물은 동결건조(Freeze Dryer, IlshinBioBase, Seoul, Korea)하여 일정농도로 제조하여 실험에 사용하였다.
총폴리페놀 함량은 Folin-Ciocalteu(Folin과 Ciocalteu, 1927)의 방법을 이용하여 측정하였다. 시료 0.1 mL에 Folin-Ciocalteu’s phenol reagent(Sigma-Aldrich Co., St. Louis, MO, USA) 0.1 mL를 첨가하여 3분간 실온에 방치한 후 10% Na2CO3 0.2 mL를 혼합하고 증류수 2 mL를 첨가하였다. 반응액은 실온에서 1시간 방치하여 725 nm에서 흡광도를 측정하였다. 총폴리페놀 함량은 gallic acid(Sigma-Aldrich Co.) 용액으로 작성한 표준곡선으로부터 환산하였으며, mg gallic acid equivalent (GAE)/g dry matter(DW)로 나타내었다.
시료의 2,2’-azino-bis(3-ethylbenzothiazoline-6-sulfonic acid)(ABTS) 라디칼 소거능은 Lee 등(2019)의 방법을 이용하여 측정하였다. 7 mM ABTS+와 2.45 mM potassium persulfate를 증류수에 용해하여 12-14시간 동안 암실에서 보관하여 ABTS cation(ABTS+) radical을 형성한 후 734 nm에서 0.700±0.002의 흡광도가 되도록 80% ethanol로 희석하였다. 농도별로 희석한 시료 15 μL와 희석된 ABTS+ 용액 300 μL를 6분간 반응시킨 후 microplate reader (Epoch, BioTek Instrument Inc., Winooski, VT, USA)를 이용하여 734 nm에서 흡광도를 측정하였다.
Hydroxyl radical 소거능은 Oh 등(2015)의 방법에 따라 측정하였다. 농도별로 희석한 시료와 1 mM FeSO4, 1 M EDTA, 10 mM 2-deoxyribose를 각각 50 μL를 첨가하고, 이 반응액에 0.1 M phosphate buffer(pH 7.2) 300 μL와 10 mM H2O2 및 1 mM ascorbic acid를 각각 50 μL를 가하여 잘 혼합한 후 37°C에서 1시간 동안 반응시켰다. 반응액의 250 μL를 취하여 2.8% trichloroacetic acid 용액 500 μL를 가한 후 1% thiobarbituric acid 용액 500 μL를 가하여 100°C에서 10분간 가열시켰다. 이것을 급냉하여 532 nm에서 흡광도를 측정하였다.
환원력은 Lee 등(2019)의 방법을 이용하여 측정하였다. 각 추출물을 농도별로 증류수에 녹인 후 e-tube에 250 μL 취하였다. 그 후 0.2 M sodium phosphate buffer(pH 6.6) 250 μL와 1% potassium ferricyanide 250 μL를 첨가하여 50°C에서 20분간 반응시킨 다음, 혼합된 반응액에 10% trichloroacetic acid 250 μL를 첨가하였다. 위 반응액을 25°C, 1,000 rpm에서 10분 동안 원심분리 후, 상층액 500 μL와 0.1% ferric chloride 100 μL를 혼합하여 700 nm에서 흡광도를 측정하였다.
α-Amylase 저해활성은 porcine pancreatin 유래의 α-amylase(Sigma-Aldrich Co.)를 이용하여 starch를 기질로 하여 측정하였다(Fuwa, 1954). 각 농도별 폴리페놀 추출물 40 μL에 1 unit/mL α-amylase 효소액 100 μL, 1% starch 100 μL를 넣어 혼합하여 37°C에서 3분간 반응시켰다. 그후 96 mM 3,5-dinitrosalicylic acid 100 μL를 첨가하여 90°C에서 15분 동안 가열하여 냉각시킨 후 900 μL 증류수를 가하여 540 nm에서 흡광도를 측정하였다. 이 때 positive control로 acarbose(Sigma-Aldrich Co.)를 사용하였다.
여주 폴리페놀 추출물의 α-glucosidase 저해활성은 다음과 같이 측정하였다. 각 농도별 추출물 50 μL와 α-glucosidase 0.2 U/mL 50 μL, 200 mM potassium phosphate buffer(pH 6.8) 50 μL와 혼합한 후 37°C에서 15분간 반응시키고, 3 mM ρ-nitrophenyl-α-D-glucopyranoside (ρ-NPG) 100 μL를 첨가하여 37°C에서 10분 동안 반응시켰다. 이 반응액에 0.1 M NaOH 50 μL를 첨가하여 반응을 정지시킨 후 405 nm 에서 흡광도를 측정하였다. 이 때 positive control로 acarbose(Sigma-Aldrich Co.)를 사용하였다.
RAW 264.7 murine macrophage cell line은 한국세포주은행(Seoul, Korea)에서 분양받았으며, 세포 성장을 위한 기본 배지로는 10% FBS와 1% penicillin을 첨가한 Dulbecco’s modified Eagle medium(DMEM, GrandIsland, NY, USA) 배지를 사용하였다. 세포배양은 37°C, 5% CO2로 조절된 incubator(MCO-18AIC, Sanyo, Japan)에서 적응시켜 계대배양하였다.
Nitric oxide(NO) 측정을 위한 시료의 농도를 설정하기 위해 MTT assay를 이용하여 RAW 264.7 세포의 생존율을 확인하였다. 즉, 세포를 1×105 cells/well이 되도록 96 well plate에 분주하여 37°C, 5% CO2 incubator에서 24시간 배양한 후, 여주 추출물을 400-700 μg/mL 농도로 함유한 새 배지로 교체한 다음 24시간을 배양하였다. 여기에 3-(4,5-dimethylthiazol-2-yl)-2,5-diphenyltetrazolium bromide(MTT)를 각 well에 20 μL 첨가하고 2시간 동안 방치하여 환원반응을 유도하였다. 형성된 formazan을 100 μL DMSO를 가하여 완전히 녹인 후 30분 동안 반응시켜 540 nm에서 흡광도를 측정하여 세포 생존율을 백분율로 계산하였다.
RAW 264.7 세포로부터 생성된 NO의 함량은 Griess (Sigma-Aldrich Co.) 시약을 이용하여 세포 배양액에 존재하는 NO2-의 형태로써 측정하였다. DMEM(GrandIsland) 배지를 이용하여 1×105 cell/well로 세포를 분주 후 37°C, 5% CO2 incubator(MCO-18AIC, Sanyo, Japan)에서 배양하였다. 배양된 세포에 1 μg/mL의 lipopolysaccharide (LPS, Sigma-Aldrich Co.)를 처리하여 1시간 자극시킨 후, 시료 20 μL를 처리하여 24시간 동안 배양하였다. 그 다음 세포배양 상등액 100 μL에 Griess 시약 100 μL를 가하여 96-well plate에서 10분간 반응시킨 다음 540 nm에서 흡광도를 측정하였다.
3. 결과 및 고찰
여주의 일반성분을 측정한 결과는 Table 1과 같다. 건조물 기준 여주의 조단백질, 조지방, 조회분 및 탄수화물의 함량은 각각 10.41%, 조지방 2.32%, 조회분 14.97% 및 탄수화물 72.27%이었다. 여주의 건조물 기준 조단백질, 조지방 및 조회분 함량이 각각 3.31%, 1.08% 및 2.31%를 나타낸 Lee(2016)의 연구에 비해 높은 조단백질, 조지방, 조회분 함량을 보였다. 또한 파푸아뉴기니에서 재배된 여주 건조물의 조지방 함량은 0.76%로 보고되어(Yuwai 등, 1991), 본 연구에서 측정된 값이 약 3배 이상 높은 것으로 나타났다. Horax 등(2010)은 미국 아칸소 주에서 개화 후 3-4주에 수확된 여주의 일반성분을 측정한 결과, 수분 14.2%, 조단백 8.85% 및 조지방 9.7%로 보고하였다. 또한 우리나라 재래종 여주를 비롯하여 일본 도입종인 Erabu와 Dragon 품종의 일반성분을 측정한 결과, 조단백, 조지방 및 조회분 함량은 각각 5.4-15.1%, 1.5-3.0% 및 8.6-13.6%의 범위로 함량에 큰 차이를 보였다(Lee 등, 2015). 이상과 같이 각 연구의 일반성분의 차이는 여주의 재배지역, 수확시기 및 품종에 따라 성분의 차이를 보이는 것으로 생각된다.
| Composition | Content (%) |
|---|---|
| Crude protein | 10.44±0.011) |
| Crude fat | 2.32±0.17 |
| Crude ash | 14.97±0.91 |
| Carbohydrate2) | 72.27±1.27 |
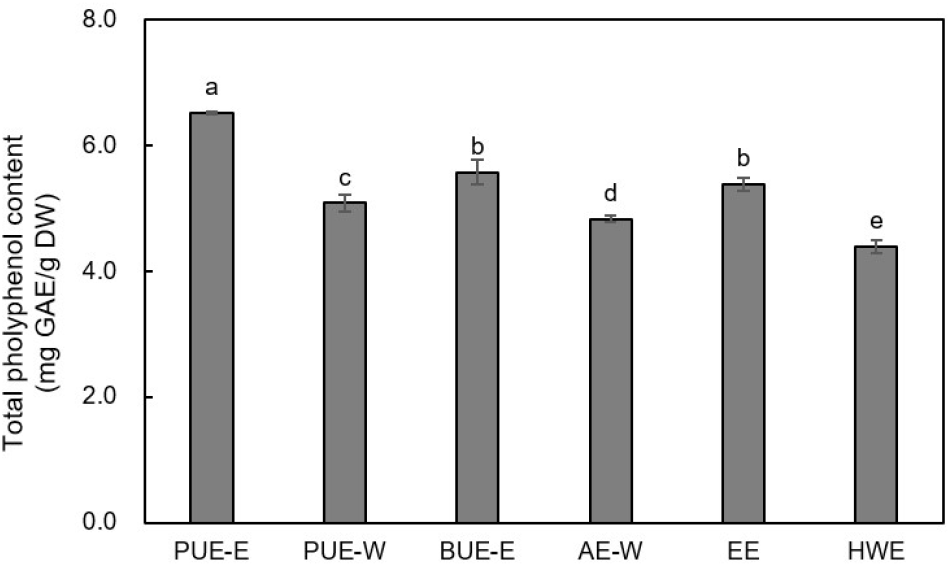
폴리페놀 화합물은 식물계에 널리 분포된 2차 대사산물로 다양한 구조와 분자량을 가진다. 이들은 페놀성 OH가 다른 분자들과 쉽게 결합함으로써 항산화, 항암, 항알러지 등의 다양한 생리활성을 가지는 것으로 알려져 있다(Velioglu, 1998). 여주의 추출방법에 따른 총폴리페놀 함량은 Fig. 1과 같이, 4.39-6.51 mg GAE/g DW 범위로 나타났으며, PUE-E에서 가장 높은 함량을 보였다. 이어서 에탄올을 용매로 사용하여 추출한 BUE-E와 EE가 각각 5.57 mg GAE/g DW 및 5.38 mg GAE/g DW으로 높은 함량을 나타내었다. PUE-W, AE-W 및 HWE는 각각 5.08 mg GAE/g DW, 4.83 mg GAE/g DW 및 4.39 mg GAE/g DW로 에탄올을 이용하여 얻은 추출물에 비하여 낮은 값을 보였는데, 이는 페놀성 물질은 물에 비해 에탄올과 친화성이 높기 때문으로 판단된다. Wen 등(2019)은 추출용매에 따른 커피 찌꺼기 초음파 추출물의 총폴리페놀 함량을 측정한 결과, 물과 메탄올을 용매로 사용하여 얻은 추출물의 총폴리페놀 함량은 각각 6.34 mg GAE/g sample 및 8.94 mg GAE/g sample로, 초음파 추출 시 물을 용매로 사용했을 때 더 낮은 폴리페놀 함량을 나타냈다고 보고하였다. Park 등(2017)은 다양한 추출방법에 의해 추출된 아가위나무 열매의 총폴리페놀 함량을 측정한 결과, 초음파 추출, 환류냉각 추출 및 상온교반 추출에서 각각 84.20 mg GAE/g extract, 61.31 mg GAE/g extract 및 41.27 mg GAE/g extract으로 초음파 추출물에서 가장 높은 함량을 나타내어 본 연구 결과와 비슷한 경향을 보였다. Budrat와 Shotipruk (2009)는 메탄올을 용매로 속슬렛 추출하여 얻은 여주 추출물의 총폴리페놀 함량은 3.32-4.99 mg GAE/DW이었으며, 다양한 방법으로 건조된 여주의 에탄올 추출물의 총폴리페놀 함량은 2.75-3.40 mg GAE/g으로 보고되었다(Youn 등, 2019). 또한 미숙 여주 및 완숙 여주에서 얻은 물추출물의 폴리페놀 함량은 각각 3.24 mg GAE/g DW 및 2.24 mg GAE/g DW(Kubola와 Siriamornpun, 2008)로 보고되어, 본 연구의 초음파 추출이 여주로부터 폴리페놀을 추출에 효과적임을 알 수 있었다. 이와 같은 결과는, 초음파 추출은 초음파의 공동현상으로 생성된 기포가 식물 세포벽을 파괴하여 세포 내부 물질의 용출 및 용해성이 증가됨으로써 총폴리페놀 함량이 증가되는 것으로 판단된다(Horzic 등, 2012). 또한 초음파 프로브 추출물이 초음파 수조 추출물에 비해 높은 폴리페놀 함량을 보이는 것은, 발생장치가 수조 하단에 위치하여 수조에 담긴 매질을 통해서 간접적으로 시료에 에너지를 전달하는 초음파 수조 장치와 달리, 초음파 프로브 추출의 경우에는 초음파가 프로브에서 발생되어 시료에 직접적으로 에너지가 전달되는 특성으로 인해 초음파 효율이 증가하기 때문으로 판단된다. 즉, 초음파 프로브 추출에서는 초음파 수조 추출보다 더 강한 초음파 효과가 작용하여 입자 크기를 감소시켜 표면적 증가로 인해 유용성분의 추출 효과를 높이기 때문으로 생각된다(Capelo 등, 2005).
여주 추출물의 항산화 활성을 측정하기 위하여 ABTS 라디칼 소거능, hydroxyl 라디칼 소거능, 환원력 및 Fe2+ 킬레이팅 효과를 측정한 결과는 Table 2와 같다. ABTS 라디칼 소거능의 IC50값은 PUE-E가 0.52 mg/mL로 가장 낮았고, 다음으로 EE와 PUE-E가 각각 0.54 mg/mL 및 0.64 mg/mL로 나타났으나 세 추출물 간의 유의적인 차이는 없었다. 또한 물을 용매로 하여 얻은 추출물의 경우, PUE-W의 IC50값이 0.75 mg/mL로, AE-W 및 HWE를 이용하여 얻은 추출물에 비해 높은 ABTS 라디칼 소거능을 보였다. Nam과 Kim(2017)은 미숙과 건여주의 ABTS 라디칼 소거능을 측정한 결과, 에탄올 추출물과 열수 추출물 모두 1,000 μg/mL 농도에서 약 70%의 소거 활성을 보고하였으며, Pham 등(2019)은 여주의 에탄올 추출물과 열수 추출물에서 각각 490 μg/mL, 470 μg/mL 농도에서 50%의 ABTS 라디칼 소거능을 보인다고 보고하였다. 여주의 부위별 80% 메탄올 추출물은 1 mg/mL 농도에서 과실 90.3%, 뿌리 56.71%, 잎 28.65%의 ABTS 라디칼 소거활성을 보여, 여주과실이 다른 부위에 비해 높은 라디칼 소거능을 가지는 것으로 나타났다(Choi 등, 2012). 또한, Boo 등(2019)은 70% 에탄올 추출물의 ABTS 라디칼 소거능은 1 mg/mL 농도에서 줄기, 과육 및 잎에서 각각 15.50%, 27.69% 및 34.093%로 보고하여 본 연구에 비해 낮은 활성을 보였다. 이상과 같이 각각의 연구에서 ABTS 라디칼 소거활성에 차이를 보이는 것은 추출방법을 비롯한 여주의 품종 및 재배 환경 등의 차이에 의한 것으로 생각된다.
Hydroxyl radical은 활성산소 중 반응성이 매우 강하여 DNA 가닥의 절단, 염기 변형 및 구성당 분해 등 유전 물질과 생체 거대분자를 손상시키는 주된 인자이자 발암과정의 각 단계에서 원인물질로 작용한다. 이러한 hydroxyl 라디칼에 대한 여주 추출물의 소거활성을 측정한 결과, PUE-E가 가장 낮은 IC50값(1.94 mg/mL)을 보였으며, 이어 EE가 낮은 IC50값(2.21 mg/mL)을 나타내었다. 다음으로 PUE-W와 BUE-E가 0.51 mg/mL로 동일한 IC50값을 나타내었으며, 열수 추출물의 IC50값이 가장 높았다. 여주의 품종별 hydroxyl radical 소거능은 3 mg/mL 농도에서 31.7-75.8%의 값을 보여 품종에 따른 항산화 활성의 차이를 보였다(Li 등, 2010). Kubola와 Siriamornpun(2008)은 여주 열수 추출물의 hydroxyl radical 소거능 IC50값은 잎, 줄기, 미숙과 및 숙성과 각각 119, 167, 267 및 173 mg/mL로 보고하여, 본 연구에서 얻은 폴리페놀 추출물의 소거능이 매우 높음을 확인하였다.
환원력은 항산화력을 가진 물질이 ferric-ferricyanide(Fe3+) 혼합물에 수소를 공여하여 free 라디칼을 안정화시켜 ferrous(Fe2+)로 전환되는 환원력을 700 nm 파장에서 흡광도를 측정한 것으로, 환원력이 강할수록 녹색에 가깝게 발색된다(Oyaizu, 1986). 추출방법에 따른 여주 추출물의 환원력을 측정한 결과, PUE-E의 IC50값이 0.23 mg/mL로 가장 낮았으며, 다음으로는 BUE-E, PUE-W, EE, AE-W 및 HWE 순으로 낮은 IC50값을 나타내었다. 딸기의 고온가압 및 초음파 추출물의 환원력을 측정한 결과, 초음파 추출물이 모든 농도에서 고온가압 추출물보다 유의적으로 높은 환원력을 보여(Bae 등, 2019), 본 연구 결과와 같았다. Youn 등(2019)은 여주의 70% 에탄올 추출물은 1.0 mg/mL에서 약 0.6의 환원력을 보인다고 보고하여 본 연구에 비해 다소 높게 나타났다. 환원력은 인도페놀 화합물을 환원시킬 수 있는 비타민 C 같은 reductone류와 ene-diamine, thiol-enol 및 ene-aminol과 같은 활성기를 가지고 있는 화합물들이 free 라디칼과 직접 반응하는 작용으로 산화반응을 종결시킴으로써 항산화 활성을 나타낸다(Shimada 등, 1992). 또한, 식물로부터 추출된 추출물의 환원력은 페놀성 물질의 함량과 종류에 따른 다양한 항산화 활성을 보인다(Shebis 등, 2013). 따라서 초음파 추출을 이용하여 얻은 추출물은 폴리페놀을 비롯한 다양한 환원성 물질들이 풍부하여 높은 환원력을 보인 것으로 판단된다.
식품 속의 Fe3+, Cu2+와 같은 금속이온은 라디칼의 생성을 촉진시켜 지질산화 과정의 촉매 역할을 한다. 따라서 환원물질이 금속이온을 킬레이팅하면 지질산화 과정의 촉매작용을 감소시켜 free 라디칼의 생성 억제 효과를 나타낸다. 여주 추출물의 Fe2+ 킬레이팅 효과는 ABTS 라디칼 소거활성과 비슷한 경향을 보였다. PUE-E와 EE의 IC50값이 각각 1.35 mg/mL 및 1.53 mg/mL로 유의적으로 높은 킬레이팅 효과를 나타내었으며, 다음으로 BUE-E와 PUE-W가 각각 2.26 및 2.71 mg/mL의 IC50값을 나타내었다. 반면 AE-W와 HWE는 매우 낮은 Fe2+ 킬레이팅 효과를 나타내었다. Hashemi와 Ebrahimzadeh(2014)는 초음파 추출, 여과 추출 및 속슬렛 추출을 하여 얻은 누에콩 추출물의 Fe2+ 킬레이팅 효과를 측정한 결과, 각 추출물의 농도가 450.2 μg/mL, 657.4 μg/mL, 826.9 μg/mL에서 50%의 Fe2+ 킬레이팅 효과가 나타나 초음파 추출물의 킬레이팅 효과가 가장 높은 것으로 보고하여, 본 연구 결과와 일치하였다. 또한 50% 에탄올로 추출된 여주 추출물은 3.4 mg/mL 농도에서 84.8%의 Fe2+ 킬레이팅 효과를 보였으며(Choo 등, 2014), 여주의 유전자형에 따른 메탄올 추출물은 250 μg/mL 농도에서 40.99-73.91%의 킬레이팅 효과를 나타내어(Kumari 등, 2018), 연구에 따른 큰 차이를 보였다. 이상에서와 같이 에탄올을 용매로 하여 probe 형태의 초음파를 이용하여 얻은 폴리페놀 추출물이 높은 항산화 활성을 나타내어, 여주의 기능성 식품소재로서의 활성 시 PUE-E가 매우 효율적임을 알 수 있었다.
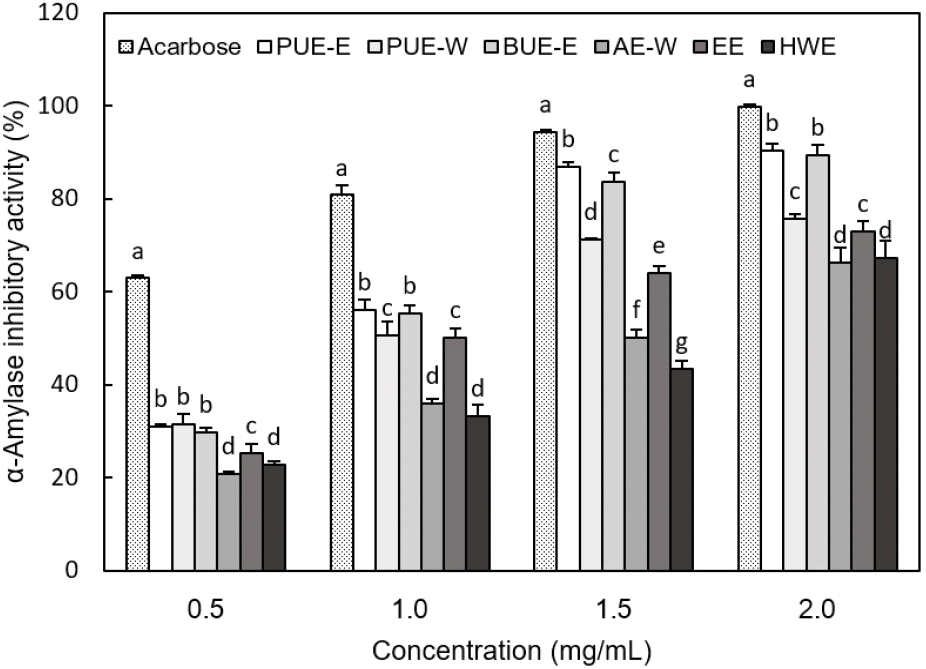
α-Amylase는 전분이나 glycogen과 같은 α-결합의 glucose로서 구성되어 있는 다당류의 α-D-(1,4)-glucoside 결합을 분해하는 효소로서, 탄수화물 대사에 필수적인 효소이다(Patel과 Ghane, 2021). 이러한 효소의 활성이 저해될 경우 식사를 통해서 체내로 들어온 전분의 분해와 흡수가 감소되어 혈중으로 유리되는 당의 양이 감소됨으로써 혈당 조절 역할을 할 수 있다(Jang과 Jeong, 2010). 따라서 인슐린 비의존형 당뇨와 비만 및 고혈당증과 같은 질환에서 혈당상승에 관여하는 α-amylase의 저해활성은 혈당 상승억제 지표로서의 역할을 한다. 여주 추출물의 항당뇨 활성을 알아보기 위하여 α-amylase 저해활성을 측정한 결과, 추출물의 농도가 높아질수록 저해활성이 증가하는 경향을 보였다(Fig. 2). 추출물의 농도 0.5 mg/mL와 1.0 mg/mL에서 PUE-E, PUE-W 및 BUE-E와 같이 초음파를 이용하여 얻은 추출물이 다른 추출법에 의해 얻은 추출물에 비해 비교적 높은 저해활성을 보였다. 1.5 mg/mL에서는 PUE-E와 BUE-E의 저해활성이 각각 86.92, 83.68%로 다른 추출물에 비해 유의적으로 높은 값을 나타내었다. 또한 2.0 mg/mL 농도에서도 PUE-E와 BUE-E가 각각 90.46%, 89.38%로 가장 높은 저해능을 보였는데, 이는 양성대조구인 acarbose의 약 90%의 활성으로 뛰어난 α-amylase 저해효과를 가진 것을 알 수 있었다. 이상과 같이 초음파를 이용하여 얻은 추출물이 다른 추출물에 비해 높은 저해활성을 나타내었는데, 이는 초음파 작용으로 생성된 hydroxyl 라디칼이 효소의 α-amylase 분자 구조를 변형시켜 활성을 억제하는 것으로 보고되었다(Kadkhodaee과 Povey, 2008). Nam과 Kim(2015)은 여주의 80% 에탄올 추출물이 4.0 mg/mL 농도에서 acarbose의 70% 활성을 보였으며, Ahmad 등(2012)은 여주 씨에서 추출한 조지방 성분과 polypeptide-p의 α-amylase 저해효과를 측정한 결과, 2 mg/mL에서 조지방은 36%, polypeptide-p는 38%의 저해효과를 보고하여 본 연구 결과에 비해 다소 낮은 활성을 나타내었다.
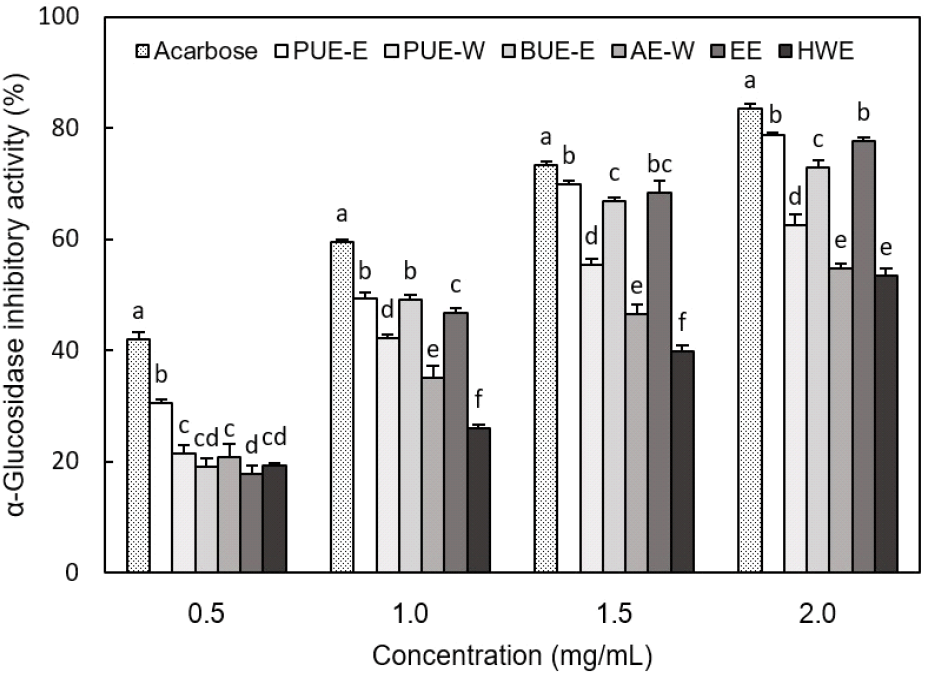
α-Glucosdiase는 소장 상피세포에 존재하여 탄수화물을 단당류로 분해하는 효소로서 탄수화물 소화에 중요한 역할을 한다(Patel과 Ghane, 2021). 따라서 인슐린 저항성에 의하여 혈당 조절 등 탄수화물 대사가 원활하지 않는 인슐린 비의존형 당뇨병 및 고혈당증과 같은 질환의 치료를 위해서는 당의 소화 및 흡수를 제어할 필요가 있다(Nam과 Kim, 2015). 본 연구에서 여주 추출물의 α-glucosidase 저해활성은 Fig. 3에 나타내었다. 0.5 mg/mL에서는 PUE-E가 30.48%로 측정되어 유의적으로 가장 높은 저해활성을 보였다. 1.0 mg/mL 농도에서는 모든 추출물들의 저해활성이 급격히 증가하였으며, 특히 에탄올을 용매로 사용하여 PUE-E, BUE-E 및 EE로 얻은 추출물이 높은 저해활성을 나타내었다. 1.5 mg/mL에서는 PUE-E와 EE가 각각 69.91% 및 66.8%의 저해활성을 보였다. 이는 PUE-E와 EE가 당뇨병 치료제로 사용되는 acarbose 활성의 95% 및 93%의 저해효과를 나타내어 항당뇨의 기능성 소재로서의 가능성을 알 수 있었다. 2.0 mg/mL 농도에서는 PUE-E와 EE가 각각 78.74와 77.65%로 측정되어 유의적으로 가장 높은 저해활성을 보였다. 이상의 결과에서 뛰어난 α-glucosidase 저해활성을 나타낸 여주 초음파 추출물은 항당뇨 기능성 소재로서의 가능성을 보였다. Yuk 등(2015)은 여주 씨의 95% 에탄올 추출물과 물 추출물이 각각 80.1%, 8.1%의 저해능을 나타내어 95% 에탄올 추출물이 물 추출물보다 10배 높은 α-glucosidase 저해활성을 보였다고 보고하였다. 또한 재배지역에 따른 국내산 여주의 α-glucosidase 저해활성을 측정한 결과 열수 추출물이 2.5 mg/mL에서 29.65%를 나타내어 가장 낮은 활성을 보였고, 100% 에탄올 추출물이 66.88%를 보여 가장 높은 저해활성을 보였다(Kang 등, 2018). Nam과 Kim(2015)은 미성숙 건여주의 열수 및 에탄올 추출물의 α-glucosidase 저해활성을 측정한 결과, 에탄올 추출물이 열수 추출물보다 유의적으로 높은 저해활성을 보였다고 보고하였다. 이상에서 보고된 연구 결과는 본 측정 결과와 일치하였으며, 여주의 α-glucosidase 저해활성을 증가시키기 위해서는 물을 용매로 사용하는 것보다 에탄올을 가하여 추출하는 것이 더 효과적인 것을 알 수 있었다. 한편, 여주는 항당뇨 활성이 뛰어난 과실로 알려져 있는데, 이는 여주 과실에 함유된 스테로이드성 배당체 물질인 charantin이 인슐린 내성과 관련해 혈당 조절에 큰 도움을 주는 것으로 보고되어 있다(Goo 등, 2016). 또한 여주 과실과 종자에 주로 함유된 식물 인슐린은 펩타이드의 일종으로 간에서 당질의 연소를 돕고 체내의 포도당 재합성을 저해시켜 인슐린과 유사한 작용을 하는 것으로 알려져 있다(Ali 등, 1993).
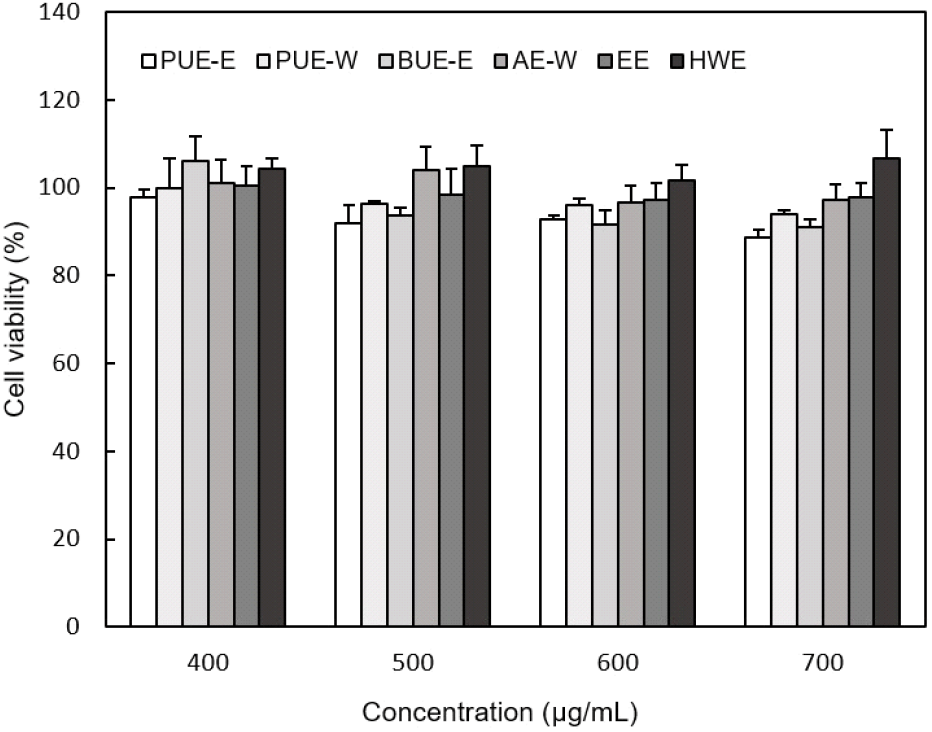
세포독성시험인 MTT assay는 가장 널리 사용되는 안전성시험으로, 살아있는 세포를 이용하여 추출물이 세포를 사멸시키는 정도를 평가하는 시험이다. 여주로부터 추출된 폴리페놀 추출물에 의한 세포 증식에 미치는 영향을 확인하기 위해 대식세포 RAW 264.7을 이용하여 측정하였다. 세포에 각 시료를 400-700 μg/mL 농도로 처리하고 24시간 후 정상대조군의 생존율에 비례하여 세포독성을 측정한 결과를 Fig. 4에 나타내었다. 여주 추출물이 세포독성으로 인한 cell population의 저하에 기인하는지 측정한 결과, 모든 농도에서 80% 이상의 생존율을 보여 대식세포에서 독성이 거의 없는 것을 확인하였다.
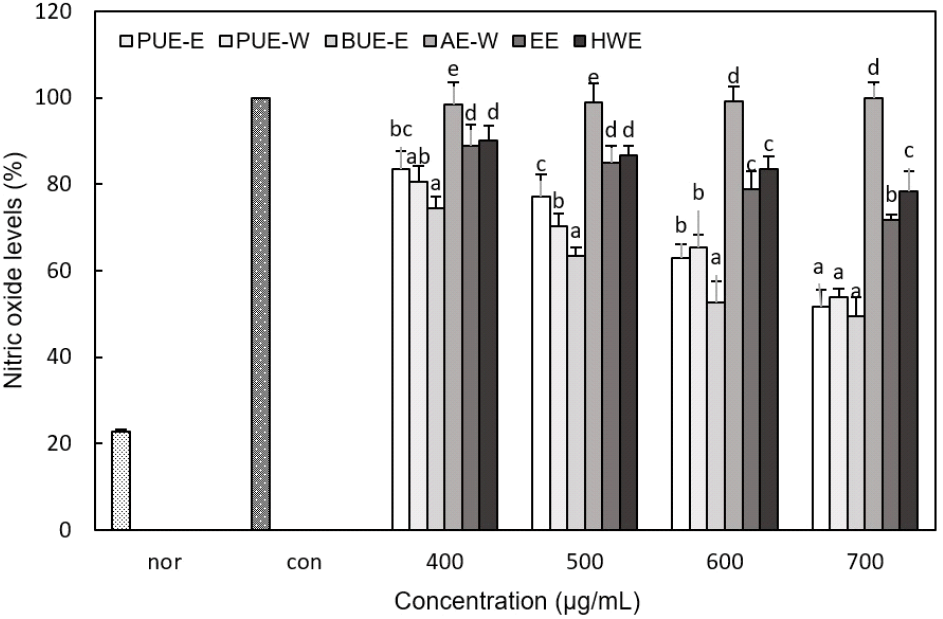
염증반응을 조절하는 대식세포는 그람 음성균의 외막 성분인 lipopolysaccharide(LPS)에 의해 과도하게 자극되면 nitric oxide(NO) 등의 염증 매개 물질을 다량 분비하게 된다(Moncade과 Higges, 1993). NO는 대식세포의 항균 활성 및 세포의 신호전달에 중요한 역할을 하지만, 과도한 NO의 생성은 염증을 유발하여 혈관확장, 세포독성, 조직 손상 등을 일으킨다(Forstermann과 Sessa, 2012). 따라서 추출물의 항염증 활성을 측정하기 위해 RAW 264.7 cell의 NO 생성억제 정도를 측정한 결과(Fig. 5), AE-W를 제외한 모든 추출물에서 농도 의존적으로 NO 생성이 감소되는 것을 확인하였다. BUE-E의 경우 모든 농도에서 유의적으로 NO 생성에 높은 저해율을 나타내었으며, 특히 700 μg/mL 농도에서 49.43%의 NO 생성으로 약 50%의 NO 생성억제 효과를 보였다. 같은 농도에서 PUE-E와 PUE-W 또한 각각 51.71%, 53.98%의 낮은 NO 생성량을 나타내었으며, BUE-E, PUE-E, PUE-W 간의 유의적인 차이는 없었다. 반면 EE와 HWE는 각각 71.68% 및 78.51%로 NO 생성 억제효과가 다소 낮았으며, AE-W의 경우 모든 농도에서 NO 생성률이 99% 이상으로 NO 생성 억제효과를 나타내지 않았다. 이와 같이 초음파를 이용하여 얻은 추출물의 항염 활성이 높게 나타났는데, 이는 초음파 추출의 경우 비교적 낮은 40°C에서 추출이 진행되어 항염증 활성을 갖는 성분의 파괴 및 열변성이 적었기 때문으로 사료된다(Simon 등, 2000). Shin 등(2014)은 스피루리나에서 초음파 추출물이 열수 추출물보다 약 12% 적은 NO 생성량을 보고하여 본 연구 경향과 일치하였다. 손바닥선인장의 70% 에탄올 추출물의 경우 1 mg/mL에서 47.1%의 NO 생성량을 보여(Kim과 Lim, 2019) 본 결과에 비하여 낮은 항염증 활성을 보였고, 건조한 여주의 80% 에탄올 추출물은 200 μg/mL 농도에서 55%의 NO 생성량을 보고하여 본 측정값에 비하여 높은 활성을 보였다(Nam과 Kim, 2015).