1. 서론
인삼(Panax ginseng C. A. Meyer)은 한국, 중국, 베트남 등 아시아에서 재배되는 대표적인 약용식물로서 의약품 및 건강기능식품의 원료로 사용되고 있다(Kim 등, 2008). 인삼의 주요 약효 성분인 진세노사이드(ginsenoside)는 뿌리보다는 줄기와 잎에서 함량이 높고, 특히 1-2 년 재배한 저년근에서 함량이 높은 것으로 알려져 있다(Choi 등, 2009). 이러한 연구 결과를 바탕으로 3-6년 이상의 재배 기간 등 인삼의 한계점을 보완하고자 인삼의 기능성 성분은 포함하면서 상대적으로 짧은 재배 기간을 가지는 새싹삼이 개발되었다(Cho 등, 2019).
새싹삼(Panax ginseng sprout)은 인삼 종자의 싹을 틔운 후, 인삼 전용 상토 또는 수경에서 약 25-40일 정도 재배한 신선 채소이다(Chang 등, 2020). 인삼에 비해 상대적으로 재배 기간이 짧고 뿌리뿐만 아니라, 잎과 줄기까지 모든 부위를 섭취할 수 있다는 특징을 가진다. 또한, 새싹삼은 연중 재배 및 연작이 가능하다는 장점이 있어 경제성이 높은 작물이다(Jung, 2018; Kim 등, 2020). 새싹삼의 유통 형태는 뿌리 표면에 묻은 흙을 가볍게 털어내거나 물로 세척한 후, 스티로폼 또는 플라스틱 용기에 담겨 유통된다. 새싹삼 유통 시 구매 의욕 증가, 수분공급 및 신선도 유지 목적으로 포장 용기 내에 수분을 흡수시킨 청이끼를 넣어 포장하고 있다. 그러나 청이끼는 수분 함량이 높은 상태에서 유통되기 때문에 곰팡이 또는 이취가 발생할 수 있는 문제점이 있다고 보고되고 있다(Chang 등, 2020). Choi 등(2021)의 연구에 따르면 새싹삼 포장용 청이끼에서 곰팡이 오염도를 조사한 결과, 새싹삼에 비해 청이끼에서 곰팡이의 오염도가 유의적으로 높았고, 주요 곰팡이는 Penicillium spp.으로 관찰되었다. 마찬가지로 새싹삼의 주요 곰팡이가 Penicillium spp.로 관찰되어 청이끼에서의 교차오염 가능성을 제시하였다. 현재까지 국내․외에서 청이끼가 원인이 되어 발생한 식중독 사례는 보고된 바가 없지만, 미생물에 오염된 청이끼에서 새싹삼으로 교차오염이 될 가능성이 있으므로 발생 가능한 위해요소를 분석하고, 사전 예방적인 관리가 필요하다.
일반적으로 새싹삼은 세척 후 별도의 조리 및 가공과정을 거치지 않고 주스, 샐러드 등의 형태로 섭취한다. 국내에서 유통 중인 인삼류에 대한 미생물의 오염도를 조사한 연구는 많지 않은 실정이다. Shim 등(2013)에서 국내 유통 중인 수삼 37점의 미생물 오염도를 조사한 결과, 일반세균 및 대장균군이 평균 4.83 및 5.00 log CFU/g 오염되어 있는 것으로 보고하였다. 이처럼 생으로 섭취하는 신선 채소의 경우 가열 살균공정을 거치지 않기 때문에 식중독을 일으킬 수 있는 잠재력이 높다고 알려져 있다(Beuchat, 1996; Gleeson와 O’Beirne, 2005). 2000년대에 들어서면서 전 세계적으로 다양한 새싹채소 등 신선 채소에 오염된 Escherichia coli O157:H7, Salmonella spp., Listeria monocytogenes 등으로 인한 식중독 사고가 지속적으로 발생하고 있다(Centers for Disease Control and Prevention, 2021). 대표적인 식중독 사고 사례로 2011년에 독일에서 E. coli O104:H4에 오염된 새싹채소인 fenugreek sprouts를 섭취하여 3,950명의 환자가 발생하였고, 53명이 사망하였다(Muniesa 등, 2012). 또한, 미국에서는 2016년에 E. coli O157:H7에 오염된 alfalfa sprouts를 섭취하여 11명의 환자가 발생하였고, 2명이 입원하였다(CDC, 2020).
이에 우리나라에서도 새싹채소, 샐러드와 같이 그대로 섭취하는 신선편의식품에 대하여 미생물 규격을 설정해 두고 있다(Ministry of Food and Drug Safety, 2022). 위생지표세균 중 대장균은 n=5, c=1, m=10, M=100으로 정하고 있다. 병원성미생물 중 Staphylococcus aureus는 1.0×102 CFU/g 이하, Clostridium perfrigens는 1.0× 102 CFU/g 이하, Bacillus cereus는 1.0×103 CFU/g 이하여야 한다. Salmonella spp. 및 enterohemorrhagic E. coli 의 경우 25 g당 음성이어야 한다고 규정되어 있다(MFDS, 2022). 또한, 최근에는 새싹삼의 활용도를 높이고자 과채주스, 녹즙 등 다양한 가공식품으로 개발하려는 연구가 이루어지고 있다(Cho 등, 2019). 가열하지 않고 섭취하는 과채주스 및 음료의 미생물 규격의 경우 세균수는 1.0×105 CFU/g 이하이고, 대장균은 음성이어야 한다(MFDS, 2022). 이러한 비가열 과채주스 및 음료의 경우 제조공정 중 별도의 가열 살균 공정을 거치지 않기 때문에, 원재료의 미생물 오염 수준은 음료의 오염 수준을 결정하는 중요한 요소이므로 원료의 미생물 관리는 필수적이다. 그러나 생식용 채소나 비가열 음료 등 가공식품의 원료에 대해서는 관리가 미흡할 뿐만 아니라, 기준 규격도 부재한 실정이다. 현재까지 새싹삼과 청이끼의 미생물 오염도를 조사한 연구 결과는 국내외에 보고된 바가 없다. 따라서 본 연구에서는 국내에서 재배 및 유통 중인 새싹삼과 포장에 사용되는 청이끼의 위생지표세균 및 병원성미생물 오염도 조사를 통해 잠재적 식중독 위험성을 확인하고, 미생물에 대한 안전성 확보를 위한 기초 자료를 마련하고자 한다.
2. 재료 및 방법
본 연구에서는 2021년 5월 온라인에서 유통되는 새싹삼을 구입하여 사용하였다. 새싹삼 농가 20곳에서 상토 또는 수경재배 방식으로 재배된 새싹삼과, 유통 시 관상 및 수분공급을 목적으로 새싹삼의 뿌리 위를 덮거나 아래에 깔려 있는 청이끼에 대한 미생물 오염도를 조사하였다. 새싹삼은 배송받은 즉시 냉장고에 보관하여 24시간 이내에 분석하였고, 표면에 남아 있는 흙을 최대한 털어내어 분석에 사용하였다. 본 연구에 사용된 새싹삼의 세척 유무, 청이끼 포함 유무 및 생산 특징은 Table 1과 같다.
위생지표세균 중 일반세균의 측정은 새싹삼 및 청이끼(10 g)를 멸균백(3M™, St. Paul, MN, USA)에 취한 뒤 각각 0.1% peptone water(Difco™, Detroit, MI, USA) 90 mL를 넣어 stomacher(BagMixer® 400, Interscience, France)를 이용하여 90초간 균질화하였다(Hyun 등, 2022; Song 등, 2019). 균질화된 시험액 1 mL를 10배씩 단계희석하여, Aerobic Count Plate 건조필름(AC, 3M™)에 1 mL씩 분주하여 37°C에서 24-48시간 배양하였다. 건조필름의 계수는 3M™ Petrifilm™ Plate Reader(6499, 3M™)를 사용하여 집락수를 계산하였다. 각각의 시료는 3회 반복 실험을 진행하였고, 미생물 수는 log CFU/g으로 나타내었다.
위생지표세균 중 대장균 및 대장균군을 식품공전(MFDS, 2022)에 준하여 측정하였다. 일반세균을 측정하는 방법으로 시료를 전처리한 후 균질화된 시험액 1 mL를 10배씩 단계희석하여 Escherichiacoli and Coliform Plate 건조필름(EC, 3M™)에 1 mL씩 분주하였다. 이후 37°C에서 24-48시간 배양하였고, 푸른색 또는 붉은색 집락 중 주위에 기포를 형성한 집락을 각각 대장균 또는 대장균군으로 계수하였다. 건조필름의 계수는 3M™ Petrifilm™ Plate Reader(3M™)를 사용하여 집락수를 계산하였다. 각각의 시료는 3회 반복 실험을 진행하였고, 미생물 수는 log CFU/g으로 나타내었다.
효모 및 곰팡이 측정을 위한 건조필름법은 여러 연구에서 농산물의 효모 및 곰팡이의 오염도를 분석할 때 사용하는 방법이다(Kim 등, 2012; Song 등, 2019). 일반세균을 측정하는 방법으로 시료를 전처리한 후 균질화된 시험액 1 mL를 10배씩 단계희석하여 Yeast and Mold Plate 건조필름(YM, 3M™)에 1 mL씩 분주하였다. 이후 25°C에서 3-5일 배양하였고, 효모 및 곰팡이의 구분하기 위해 엷은 핑크색 및 청녹색을 띠고 뚜렷한 외각을 가진 작은 균체는 효모로, 다양한 색깔을 띠고 불명확한 외각을 가진 큰 균체는 곰팡이로 계수하였다(Bird 등, 2015). 각각의 시료는 3회 반복 실험을 진행하였고, 미생물 수는 log CFU/g으로 나타내었다.
병원성미생물의 분리는 식품공전 미생물시험법에 준하여 수행하였다(MFDS, 2022). E. coli O157:H7의 증균을 위해 새싹삼 또는 청이끼(10 g)에 modified tryptic soy broth(Oxoid™, Basingstoke, UK) 90 mL를 가하여 90초간 균질화한 후 35°C에서 24시간 배양하였다. 증균배양액을 cefixime-tellurite supplement(Oxoid™)를 첨가한 sorbitol MacConkey agar(Oxoid™)에 획선도말하여 35°C에서 24시간 배양하였다. 이후 의심되는 집락을 tryptic soy agar(TSA, Difco™)에 접종한 후 37°C에서 24시간 재배양하여 동정을 진행하였다.
Salmonella spp.의 증균을 위해 새싹삼 및 청이끼(10 g)에 90 mL의 buffered peptone water(BPW, Difco™)를 가하여 90초간 균질화한 후 35°C에서 24시간 배양하였다. 배양액 1 mL를 취하여 Tetrathionate broth(Oxoid™) 10 mL에 접종하여 37°C에서 24시간 또는 배양하고, 동시에 배양액 0.1 mL를 Rapparot-Vassiliadis enrichment broth(Oxoid™) 10 mL에 접종한 후 41.5°C에서 24시간 증균 배양하였다. 각각의 증균배양액 1 loop를 취하여 Xylose Lactose Tergital™ 4 agar(XLT, Oxoid™)에 접종하고, 37°C에서 24시간 배양하였다. XLT agar상에서 검은색을 나타내는 단일 집락을 취하여 TSA(Difco™)에 접종한 후 37°C에서 24시간 재배양하여 동정을 진행하였다.
S. aureus의 증균을 위해 새싹삼 및 청이끼(10 g)에 10% NaCl(Samchun Pure Chemicals Co., Gyeonggi-do, Korea)을 첨가한 TSB(Difco™) 90 mL를 가하여 90초간 균질화한 후 35°C에서 24시간 배양하였다. 증균배양액을 CHROMagar Staph aureus(CHROMagar™, Paris, France)에 획선도말한 후 37°C에서 48시간 배양하였다. 이후 CHROMagar상에서 분홍색 또는 자주색 단일 집락을 취하여 TSA(Oxoid™)에 접종한 후 37°C에서 24시간 재배양하여 동정을 진행하였다.
L. monocytogenes의 증균을 위해 새싹삼 및 청이끼(10 g)에 90 mL의 Listeria enrichment broth(Difco™)를 가하여 90초간 균질화한 후 30°C에서 24-48시간 배양하였다. 증균배양액을 1 mL를 취하여 선택배지인 Fraser broth(Oxoid™) 9 mL에 접종한 후 37°C에서 24시간 배양하였다. 이후 검은색으로 변한 배양액 1 loop를 취하여 Polymycin acriflavine lithium chloride ceftazidime aesculin mannitol agar(PALCAM, Oxoid™)에 접종하고, 37°C에서 24-48시간 배양하였다. PALCAM agar상에서 검은색 환에 푸른색을 나타내는 집락을 취하여 단일 집락을 분리하기 위해 0.6% yeast extract(Difco™)가 첨가된 TSA(Oxoid™)에 접종한 후 37°C에서 24시간 재배양하여 동정을 진행하였다.
E. coli O157:H7 및 Salmonella spp.로 추정되는 분리 집락은 Vitek GN 카드(BioMérieux, Marcy I’Etoile, France)를, S. aureus 및 L. monocytogenes로 추정되는 분리 집락은 Vitek GP 카드(BioMérieux)를 이용하여 미생물 자동 동정장비(VITEK 2 compact system 60, BioMérieux)로 1차 동정을 하였다. 동시에 각각의 균주에 대해 PowerCheck™ E. coli 4-plex detection kit, PowerCheck™ Salmonella Triplex detection kit, PowerCheck™ Staphylococcus aureus detection kit, PowerCheck™ Listeria monocytogenes detection kit (KogeneBiotech, Seoul, Korea)를 이용하여 thermal cycler(C1000 touch™, Bio-Rad, Hercules, CA, USA)로 동정을 진행하였다. PCR 조건은 제조사 매뉴얼에 따라 실시하였고, 조건은 다음과 같다. E. coli O157:H7의 경우 95°C에서 12분간 pre-denaturation을 진행한 후 95°C에서 30초간 denaturation, 60°C에서 45초간 annealing, 72°C에서 1분간 extension 조건에서 32 cycle을 하고, final extension을 72°C에서 10분간 실시하였다. E. coli O157:H7을 제외한 다른 미생물의 경우, 95°C에서 10분간 pre-denaturation을 진행한 후 95°C에서 30초간 denaturation, 60°C에서 30초간 annealing, 72°C에서 30초간 extension 조건에서 35 cycle을 하고, final extension을 72°C에서 10분간 실시하였다(KogeneBiotech). 각각의 병원성미생물에 대한 target gene과 amplicon size는 Table 2와 같다. PCR에 의한 증폭 생성물은 2% agarose gel 전기영동을 통해 확인하였다. VITEK(상동성 99%) 및 PCR 분석에서 모두 양성으로 분석된 시료의 경우 분석을 종료하였다. 반면, PCR 결과 양성이나 VITEK 결과 미생물의 종이 일치하지 않는 경우 또는 상동성이 낮게 분석된 경우, 추가적으로 16s rRNA sequencing을 이용하여 최종 확인하였다. 16s rRNA sequencing은 ㈜마크로젠(Macrogen Inc., Seoul, Korea)에 의뢰하여 분석하였다. 의뢰한 양성 의심 집락에서 16s rRNA 유전자를 증폭하기 위해 27F(5'-AGA GTT TGA TCM TGG CTC AG-3')와 1492R (5'-TAC GGY TAC CTT GTT ACG ACT T-3') primer를 사용하였다. Sequencing primer로는 785F (5'-GGA TTA GAT ACC CTG GTA-3')와 907R(5'-CCG TCA ATT CMT TTR AGT TT-3')을 사용하였다. 분석된 염기서열은 NCBI(National Center for Biotechnology Information)에서 제공하는 BLAST에서 DNA 데이터베이스와 비교하여 상동성이 99% 이상인 경우 그 유전자형으로 결정하였다. L과 M 농가에서 구매한 청이끼 시료를 제외하고는 각각 3회 반복 실험을 진행하였고, 병원성미생물이 양성으로 검출된 반복 수/전체 반복 수(검출률 %)로 나타내었다.
| Foodborne pathogens | Target gene | Amplicon size (bp) |
|---|---|---|
| E. coli O157:H7 | VT1 (stx1), VT2 (stx2) | 637, 297 |
| Salmonella spp. | invA | 640 |
| S. aureus | femA | 264 |
| L. monocytogenes | prfA | 450 |
3. 결과 및 고찰
새싹삼 및 청이끼에 대한 위생지표세균(일반세균, 대장균 및 대장균군), 효모, 곰팡이의 오염도를 조사한 결과는 각각 Table 3 및 Table 4와 같다. 새싹삼 20점의 일반세균 오염 수준은 5.57-8.08 log CFU/g이고, 평균 6.85 log CFU/g으로 검출되었다(Table 3). 특히 모든 농가에서 일반세균이 5.50 log CFU/g 이상 검출되어 기존의 연구 결과와 유사하거나 조금 높은 수준을 보였다. Bae 등(2011)에 따르면 국내에 유통 중인 새싹채소의 미생물 오염도를 조사한 결과, 일반세균은 평균 7.78 log CFU/g으로 검출되었다. 또한 무순, 알파파 등의 새싹채소의 미생물 오염도를 조사한 결과, 일반세균은 평균 7.91-8.15 log CFU/g으로 다소 높게 관찰되었다(Jang 등, 2021). 대장균은 16점의 시료에서 검출한계 이하(≤1.00 log CFU/g)로 관찰된 반면, H 농가에서 수집된 시료에서 3.95 log CFU/g의 다소 높은 오염도가 나타났다. 국내 비가열 과채주스 및 음료의 미생물 기준은 일반세균 1.0×105 CFU/g 이하, 대장균 음성이어야 한다(MFDS, 2022). 이러한 기준과 비교하면 새싹삼 16점(80%)에서 일반세균 기준이 초과하였고, 4점(20%)에서 대장균 기준을 초과하였다. 대장균군은 대부분의 농가에서 관찰되었고, 오염 수준은 0.33-7.08 log CFU/g, 평균 오염도는 4.27 log CFU/g이었다. 효모 및 곰팡이는 모든 농가에서 검출되었고, 평균 오염도는 각각 3.99 및 4.94 log CFU/g이었다. 또한, 세척하여 유통된 K, L 및 N 농가의 경우, 일반세균의 오염 수준이 5.52-7.88 log CFU/g으로 검출되어 세척 후 유통할 경우 미생물 감소에 대한 효과는 미비한 것으로 관찰되었다. 반면, 백삼을 세척 및 탈피 후 미생물을 조사한 결과, 원재료인 수삼에 비해 약 2.00 log CFU/g이 감소되었고, 세척한 홍삼에서는 약 1.50 log CFU/g이 감소한 것으로 관찰되었다(Shim 등, 2015). 따라서 가정에서는 새싹삼을 생으로 섭취하기 전에 흐르는 물로 충분히 세척하는 방법만으로도 새싹채소를 안전하게 섭취할 수 있을 것이다. 국내에서 유통 중인 인삼 및 인삼류에 대한 미생물의 오염도를 조사한 연구는 몇몇 보고되어 있다. Yu 등(2007)에서는 물로 단순 세척한 인삼(4년근)의 일반세균의 평균 오염도는 2.30-3.78 log CFU/g으로 새싹삼에 비해 상대적으로 낮게 검출되었다. Shim 등(2013)은 시중에 유통되는 수삼(37점), 백삼(15점) 및 홍삼(15점)을 대상으로 미생물 오염도를 조사하였는데, 일반세균의 평균 오염도는 각각 4.83, 3.90 및 1.71 log CFU/g으로 나타나 새싹삼에 비해 일반세균 오염도는 다소 낮은 것으로 관찰되었다. 또한, 대장균은 모든 시료에서 검출되지 않았고, 대장균군의 오염도는 수삼은 5.00 log CFU/g, 백삼은 3.30 log CFU/g, 홍삼은 0.09 log CFU/g으로 검출되었다고 보고하였다. Kwon 등(1999)에 따르면 백삼의 일반세균은 4.61 log CFU/g, 대장균군은 3.20 log CFU/g으로 검출되어 본 연구 결과보다 오염도가 조금 낮은 수준이었다. 이러한 시료 간 미생물 오염도의 차이는 재배 기간, 가공 공정 유무 등에 의한 것으로 사료된다. 본 연구에서 사용한 새싹삼의 경우, 백삼 및 홍삼과는 다르게 세척 과정을 제외하고는 특별한 가공 공정이 없이 수확 후 바로 유통되기 때문에 오염도가 상대적으로 높은 것으로 보인다. 따라서 비가열 과채주스 및 음료의 미생물 기준을 충족시키기 위해서는 원재료의 미생물 관리는 필수적이기 때문에, 오염원이 될 가능성이 있는 상토, 용수 등의 안전관리가 필요하다.
새싹삼 포장에 사용된 17점의 청이끼에 대한 일반세균 오염 수준은 5.74-9.70 log CFU/g이고, 평균 8.50 log CFU/g으로 검출되었다(Table 4). 특히 대부분 농가에서 사용 중인 청이끼의 일반세균이 7.00 log CFU/g 이상 검출되어 높은 수준의 오염도를 보였다. 대장균은 8점(47%)에서 검출되었고, 평균 오염도는 1.23 log CFU/g이었다. 대장균군의 경우 모든 농가에서 검출되었고, 평균 오염도는 5.78 log CFU/g이었다. 효모 및 곰팡이의 경우에도 평균 오염도가 각각 4.77 및 4.80 log CFU/g으로 오염도가 비교적 높게 관찰되었다. 새싹삼에 비해 청이끼에서 높은 미생물 오염도가 관찰된 것은 청이끼의 수분 함량이 높아 미생물 번식에 상대적으로 유리하기 때문일 것이다. Choi 등(2021)의 연구 결과에 따르면 청이끼의 곰팡이 오염도를 조사하였을 때 Penicillium spp.(35%), Aspergillus spp. (25%) 및 Fusarium spp.(20%) 등이 관찰되었다. 청이끼에 대한 오염도가 대체로 높으나, 현재까지 국내에 유통 중인 청이끼에 대한 병원성미생물의 오염도 조사 연구는 거의 없는 실정이다. 본 연구 결과로 미루어 볼 때 새싹삼과 직접적인 접촉이 높은 청이끼에 의한 교차오염을 방지하기 위한 관리가 필요할 것으로 생각된다. 따라서 새싹삼 유통 시 청이끼를 대체할 물질 또는 기술에 대한 개발이나 청이끼의 살균 조건 등에 관한 추가적인 연구가 필요할 것이다.
새싹삼 및 청이끼에 대해 4종의 병원성미생물(E. coli O157:H7, Salmonella spp., S. aureus, L. monocytogenes)의 오염도를 조사하였다. 또한, 새싹삼은 상토에서 재배되는 새싹채소이기 때문에 B. cereus에 대한 정량분석을 실시하였다. 새싹삼에서 4종의 병원성미생물은 모두 검출되지 않았다(data not shown). Shim 등(2013)의 연구에 따르면 수삼, 백삼 및 홍삼의 병원성미생물 오염도를 조사한 결과, E. coli O157:H7, Salmonella spp., L. monocytogenes, S. aureus는 검출되지 않았다고 보고하였다. 새싹삼의 B. cereus 오염 수준은 1.63-5.13 log CFU/g이고, 평균 오염도는 3.56 log CFU/g 수준으로 검출되었다(Fig. 1(A)). 그대로 섭취하는 신선편의식품류의 국내 미생물 기준은 B. cereus가 1.0×103 CFU/g 이하여야 한다(MFDS, 2022). 이러한 기준과 비교하면 새싹삼 14점(70%)에서 B. cereus 기준이 초과하는 것으로 관찰되었다. 하지만 본 연구에서는 새싹삼의 표면에 남아 있는 흙 등의 이물질을 털어낸 후 세척 과정 없이 분석하였기 때문에 토양에 널리 분포되어 있는 B. cereus 오염도가 다소 높게 나온 것으로 생각된다. Shim 등(2013)의 연구에서는 국내에 유통 중인 수삼, 백삼 및 홍삼의 B. cereus의 오염도는 각각 0.58-3.73, 0.50-2.50 및 0.50 log CFU/g 수준이었다고 보고하였고, 이는 새싹삼과 유사하거나 다소 낮은 수준이었다. 이러한 오염도의 차이는, 새싹삼은 수확 후 전처리 과정이 없이 바로 유통되기 때문에 B. cereus가 비교적 높은 수준으로 검출되는 것으로 보인다. 그러나 세척하여 유통된 K, L 및 N 농가의 B. cereus 오염도가 4.00 log CFU/g 이상으로 검출되어 저장, 유통 및 소비단계에서의 추가적인 관리가 필요할 것으로 사료된다. B. cereus는 토양에 널리 분포된 세균으로 신선 채소에서 빈번히 검출된다(Carlin 등, 2000). Kim 등(2012)에 따르면 E. coli 로 오염된 상토에서 자란 상추에서 E. coli 가 4.00 log CFU/g 이상 검출되어 오염된 상토에서 상추로 병원성미생물이 직접 이행될 수 있다고 보고하였다. 또한, 재배 기간, 상토의 종류, 상토의 재사용 횟수 등의 차이에 의한 것으로 보인다. 국내 대부분 농가에서 상토는 연작장해가 발생하기 전까지 재사용하고 있다(Park 등, 2020). 실제 농가에서 재사용한 상토의 미생물 오염도를 조사한 결과, S. aureus가 관찰되었다(unpublished data). 따라서 상토의 미생물 오염은 농산물의 오염에도 영향을 미칠 수 있으므로 상토의 위생적인 관리가 필요할 것으로 사료된다.
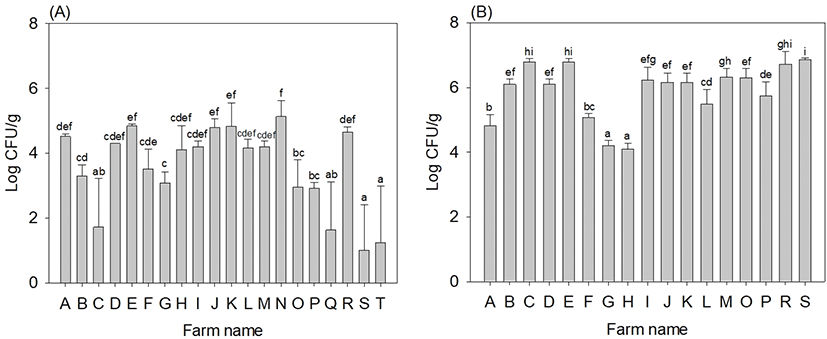
Table 5는 청이끼에 대한 병원성미생물의 오염도를 조사한 결과이다. 그 결과, E. coli O157:H7, Salmonella spp., L. monocytogenes는 검출되지 않았고, S. aureus만 청이끼 7점(41%)에서 검출되었다. F 농가의 경우, PCR 결과 S. aureus 양성, VITEK 결과 S. aureus로 분석되었으나, 상동성이 98%로 16s rRNA sequencing을 추가적으로 진행하였다. 결과적으로 16s rRNA sequencing 결과(상동성 99%)로 검출된 S. aureus strain은 STA8 (LC189114.1), FQXIII(MF144454.1), DSM20231(CP011526.1), DSM20231T (LN681573.1), ATCC 12600(L36472.1), NBRC 100910 (NR_113956.1), S. argenteus MSHR1132(FR821777.2)로 분석되었다. G 농가의 경우, PCR 결과 S. aureus 양성, VITEK 결과 S. aureus로 분석되었으나, 다소 낮은 상동성(91%)을 보여 16s rRNA sequencing을 추가적으로 진행하였다. 16s rRNA sequencing 결과(상동성 99%), S. aureus strain STA1(LC189107.1), FQXIII(MF144454.1), DSM20231(CP011526.1), DSM20231T (LN681573.1), ATCC 12600(L36472.1), NBRC 100910(NR_113956.1), S. argenteus MSHR1132(FR821777.2)로 분석되어 F 농가와 유사한 결과를 보였다. 이처럼 F 및 G 농가의 경우, 16s rRNA sequencing에서 높은 상동성(99%)과 score (bit)를 보이고, VITEK 및 PCR 결과가 모두 S. aureus로 동정되었기 때문에 F 및 G 농가의 청이끼에서 S. aureus가 검출된 것으로 판정하였다. 반면, A, B, L, M 및 S 농가의 경우 VITEK(상동성 99%)과 PCR 결과에서 모두 S. aureus로 분석되어 16s rRNA sequencing을 진행하지 않았다. 청이끼의 S. aureus 검출은 부적절한 원료 가공과정, 청결하지 못한 작업 환경이나 작업자에 의해 오염되었을 것으로 추정된다. 주요 식중독 원인균은 S. aureus는 공기, 토양 등 환경에 널리 분포하고, 사람과 동물의 피부 등에도 상재하고 있어 식품에 쉽게 오염될 수 있다. 농산물의 생산, 가공 등 모든 과정이 작업자를 통해 이루어지기 때문에, 작업자의 개인위생은 식중독 발생 예방에 중요하다(Shim 등, 2013). 따라서 작업자의 개인위생 관리에 대한 교육을 통해 미생물의 오염을 최소화하여, 안전한 새싹삼을 생산 및 유통할 수 있도록 해야 할 것이다. 청이끼의 B. cereus 오염 수준은 4.10-6.87 log CFU/g이고, 평균 오염도는 5.88 log CFU/g 수준으로 검출되었다(Fig. 1(B)). 이러한 결과는 전반적으로 청이끼의 B. cereus 오염 수준이 새싹삼에 비해 높다는 것을 보여준다. 청이끼는 마른 상태로 농가에 공급되고, 새싹삼 포장 전 물에 불려 수분을 머금은 상태로 포장되기 때문에 수분 함량이 높아 상대적으로 미생물 번식이 유리하기 때문으로 판단된다. 현재까지 새싹삼의 신선도와 안전성을 증진시키기 위한 기술 개발에 관한 연구는 제한적으로 수행되어 있다. Chang 등(2020)에서는 청이끼 없이 새싹삼을 플라스틱 용기(polypropylene, PP)에 담아 barrier film(산소 투과율 20 cc/day/m2)으로 포장 후 기체 조절(8% O2 및 18% CO2) 시 곰팡이 발생을 억제하여 무름 증상이 완화됨을 확인하였다. 이 외에도 Kim 등(2011)의 연구에서는 세척 인삼을 2-phenylethyl alcohol로 훈증(100 μL/L, 4시간)하여 PP 용기로 포장하였을 때 일반세균의 증식이 억제되었고, 조직의 경도가 높게 유지하여 저장성이 증가하는 것으로 나타났다. 따라서 새싹삼의 저장성 및 안전성을 증진시키기 위해 적절한 수확 후 관리 기술의 개발이 필요할 것으로 생각된다.
본 연구의 결과를 종합해보면, 새싹삼에서는 병원성미생물이 검출되지 않아 안전성 면에서는 크게 우려할 수준은 아닌 것으로 판단된다. 하지만 청이끼에서 S. aureus가 검출됨에 따라 새싹삼으로의 교차오염을 사전 예방하는 차원에서 이에 대한 개선이 필요할 것으로 판단된다.










