1. 서론
한국에서 재배되는 마(Dioscorea polystachya Turcz.)는 Dioscoreaceae과에 속하는 뿌리 작물로 한국, 중국, 일본, 베트남, 대만을 포함하는 동북아시아 전역에 널리 분포한다(Wu 등, 2016). 국내에서는 약용과 식용으로 같이 사용되며, 약용으로는 산우(山芋), 서여(薯蕷), 산약(山藥)이라는 명칭으로 참마 또는 산마(D. japonica Thunb.), 단마(D. batatas Decane.) 를 사용하고 식용으로는 재배 품종인 장마(D. polystachya Turcz.), 단마, 둥근마(D. bulbifera L.) 등이 주로 쓰이고 있다(Shin 등, 2006; Kang 등, 2014). 이러한 재배용 마의 부산물인 영여자는 마의 잎겨드랑이에 달리는 주아(Aerial bulbil)를 말하며 흔히 마의 씨앗 또는 열매로 불려진다. 또한, 동의보감에 의하면 영여자는 성질이 따뜻하고 독성이 없어 기력을 보하고 위장을 보호하여 자양강장 효과가 뛰어나다고 하였다.
식용으로 재배되는 마는 연간 약 9,000여 톤 정도이며(KOSIS, 2019), 2019년 기준 국내 생산지는 경상북도(79%), 경상남도(16%), 경기도(3%), 기타 외 지역(2%) 등이다. 마는 주로 생물로 판매되거나 즙, 환, 액상차, 분말, 식초, 죽 등 다양한 형태로 판매되어 왔으며 최근 아침대용식으로 마 분말이 인기를 끌고 있다. 장마의 영양성분은 수분 87.8%, 탄수화물 9.6%, 식이섬유 1.8%, 단백질 1.6%로 이뤄져 있으며, 이 외에도 arginine, batatasin, mucin, choline, saponin, diosgenin 등의 기능 성분을 포함하고 있다(RDA and NIAS, 2020). 또한, 마에 포함된 다당류는 주로 면역 활성을 가진 식물성 다당류로 면역 강화(Choi 등, 2004), 항산화(Ju 등, 2014), 노화방지(Yilong 등, 2010), 항염(Jin 등, 2011), 항당뇨(Zhao 등, 2017) 등과 같은 다양한 생리활성이 보고되었다. 반면에 영여자는 항균(Chin 등, 2010), 항돌연변이, 항산화(Park 등, 2012) 등 생리활성 연구, 작물의 재배 및 생산성에 관한 연구(Kim 등, 2010; Kim 등, 2012; Lee 등, 1993), 생태 및 유전적 식별에 관한 연구(Walck 등, 2010; Peng 등, 2017) 등이 제한적으로 진행되었다.
국내에서 영여자의 사용이 제한적인 원인은 몇 년 전까지 식품 원료로 인정받지 못해 마의 부산물로만 취급되어 국내 마 생산량의 50%에 해당하는 양이 생산됨에도 불구하고 폐기되어졌다(Park 등, 2012). 2016년 농촌진흥청은 영여자를 “식품에 사용할 수 있는 원료” 목록에 등재시켜 활용도를 높일 수 있도록 하였다. 영여자는 저장 중 특히 온도에 민감하여 저온에서 조직이 손상되기 때문에 생물로써 유통에 제한이 있으며 활용도를 높이기 위해서는 적절한 가공 처리가 필요한 실정이다. 이러한 단점을 보완하기 위한 가공 방법으로는 첫째, 조직 손상을 최소화하고 추출 용이한 형태로 만드는 것이 중요한데 이에는 열풍건조, 동결건조 등과 같은 건조 방법이 있다. 둘째는, 건조된 형태의 소재를 친환경적으로 추출하는 가열, 효소, 고압, 초임계 등 여러 가공 방법들이 사용되고 있다. 이 중 효소 처리 기술은 원료의 손상을 최소화하고 기능 성분을 수용화 한다. 효소 처리는 단백질, 섬유, 전분 등의 다당류 분해를 용이하게 하여 작물 내의 추출 수율, 유용성분, 기능 성분의 증진 효과를 부여한다. 반면에, 이러한 기술들은 농가, 영농, 중소 등의 생산 시설에서 이들을 적용하기에 실질적인 어려움이 많다. 효소 처리 후 주정 처리는 저분자 기능 성분을 다량 용출시켜 2차 가공 소재 형태로써 그 활용 범위를 넓힐 수 있다.
따라서 본 연구에서는 장마의 종자인 영여자에 효소 주정 복합 처리를 통해 유용성분 및 기능성분을 증진시키고자 하였고 조건별로 이화학적 특성과 생리활성을 조사하였다. 이러한 평가 자료를 활용하여 영여자의 활용 가치와 식품 원료로의 이용률을 증가시키고, 소비 증가를 위한 기능성 소재 개발을 위한 기초 자료로 제시하고자 한다.
2. 재료 및 방법
본 실험에서는 2018년 9월 경상북도 안동에서 생산된 국내산 장마 영여자(Dioscorea polystachya Turcz. bulbil, DPB)를 농가에서 구입하여 사용하였으며, 탈피 및 세척 과정을 거쳐 60°C에서 96시간 열풍 건조(DS-240BC, DooSung Co., Ltd., Gwangju, Korea)하였다. 이를 분쇄(SMX-C4000WK, Shinil Co., Incheon, Korea)하여 30 mesh 체를 통과한 것을 −70°C 초저온 냉동고 (GS28130416-141, GMS Co., Ltd., Yangju, Korea)에서 냉동 보관하면서 실험에 사용하였다. 영여자 효소 처리에 사용된 Termamyl 2X (240 KNU/g)는 Novozymes(Novo Nordisk, Copenhagen, Denmark)의 제품을 구입하여 사용하였고, 주정 처리에 사용된 발효 주정은 Ethanol Supplies World Co.(Jeonju, Korea)에서 구입하여 사용하였다. 분석 시약으로 사용된 dinitrosalicylic acid(DNS), folin-ciocalteu’s reagent, gallic acid, glucose, catechin, vanillin, ginsenoside Rb1, sulfuric acid, 2,2'-diphenyl-1-picrylhydrazyl (DPPH), 2,2'-azino-bis(3-ethylbenzothiazoline-6-sulfonia acid)(ABTS), potassium persulfate, α-glucosidase, sodium phosphate, ρ-nitrophenyl-α-D-glucopyranoside, sodium carbonate, absolute ethanol은 Sigma-Aldrich Co.(St. Louis, MO, USA)에서 구입하여 사용하였다.
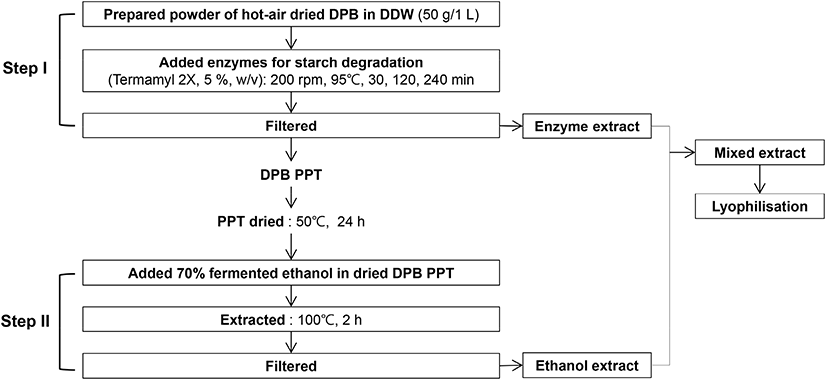
장마 영여자의 효소 주정 복합 처리는 선행 연구된 Nam 등(2019)의 주정과 효소 복합 처리를 변형한 방법으로 진행하였다. 효소 주정 복합 처리는 효소 처리 단계(Step I)와 주정 처리 단계(Step II)로 나누어 처리하였으며, Fig. 1과 같다. 예비 시험을 통해 전분 분해 효소인 Termamyl 2X가 영여자의 기질 분해에 가장 효과적이었다(예비 시험 결과는 표기하지 않음). 효소 처리 단계(Step I)는 영여자 열풍 건조 분말 50 g에 증류수 1 L를 가하여 혼합한 후, 전분 분해 효소(Termamyl 2X)를 영여자 분말의 5%(w/v) 농도로 첨가하였다. 이를 유리 광구병에 넣고 밀봉하여 상압의 95°C 항온수조 (WiseBath, MaXturdy, Daihan Sci., Wonju, Korea)에서 200 rpm 속도로 각 처리 조건인 30(효소 30분 처리, T30), 120(효소 120분 처리, T120), 240(효소 240분 처리, T240)분 동안 처리하였다. 처리된 영여자 효소 추출액은 3,000 ×g, 4°C 조건에서 10분간 원심분리 (Labogene, Gyro1580MGR, Gyrogen Co., Ltd., Daejeon, Korea)한 다음, 여과지(Whatman No. 4, GE Healthcare Co., Bukinghamshire, England)로 감압여과하였다. 원심분리된 각 고형물은 50°C에서 24시간 열풍 건조하였다. 주정 처리 단계(Step II)에서는 건조된 고형물을 70% 발효 주정 0.95 L로 혼합하였고, 환류 냉각법으로 100°C에서 2시간 처리하였고, 처리된 영여자 주정 추출액은 효소 처리 단계의 추출액과 같이 동일하게 3,000 ×g, 4°C 조건에서 10분간 원심분리한 다음, 여과지로 감압여과하였다. 감압여과된 영여자 효소 처리 추출액과 주정 처리 추출액은 0.45 μm syringe filter (Millipore, Billetica, MA, USA)로 재차 여과하여 이화학적 분석 시료로 사용하였고, 항산화 활성 시험에는 효소 처리 추출액과 주정 처리 추출액을 혼합하여 동결건조된 것을 분석 시료로 사용하였다. 대조구(CON)는 전분 분해 효소를 첨가하지 않고 효소 처리 단계를 진행하였으며, 주정 처리 단계는 동일하게 진행하여 비교하였다.
영여자의 일반성분은 열풍 건조 분말을 AOAC(1995)의 방법으로 분석하였다. 수분은 105°C 상압가열 건조법, 조단백질은 Micro-kjeldahl 질소정량법, 조지방은 Soxhlet 추출법, 조회분은 550°C 건식회화법으로 분석하였다. 탄수화물은 100에서 수분, 조단백질, 조지방, 조회분 함량을 뺀 값으로 계산하였다. 무기질과 비타민 분석을 위한 시료 추출과 분석은 AOAC 방법으로 활용하였다. 비타민 A, 비타민 B1, 비타민 C는 고속액체크로마토그래피(HPLC)법, 비타민 B2는 루미플라빈 형광비색법, Niacin은 케니히반응 비색법을 이용하였다.
영여자 추출물 시료의 총 가용성 고형분(total soluble solid, TSS)은 Anderson 등(1970)의 방법에 따라 영여자 추출물 10 mL를 취하여 105°C에서 건조시켜 그 무게를 측정하고 사용된 원료 양의 백분율로 나타내었다.
영여자 추출물 시료의 갈변도는 Ajandouz 등(2001)의 방법에 따라 측정하였다. 효소 주정 복합 처리된 영여자 추출물의 동결 건조물 0.1 g을 증류수 100 mL에 재용해하여 1 mL를 취하여 5배 희석한 것을 micro plate leader (Infinite M200 Pro, Seestrasse, Männedorf, Switzerland)기를 이용하여 효소와 열에 의한 반응으로 영여자 구조에 결합된 당이 분해되어 갈색화 반응으로 나타나는 갈변도(browning index, BI; 420 nm)를 측정하였다.
총당(total sugar)은 phenol sulfuric acid법(Kang 등, 1998)을 이용하였으며, 영여자 추출물 0.5 mL에 5% phenol 용액 0.5 mL와 sulfuric acid 2.5 mL를 가하여 혼합하였다. 이 혼합액을 30분간 실온에 방치한 후 470 nm에서 흡광도를 측정하였으며, 표준곡선은 glucose를 이용하였다.
환원당(reducing sugar)은 DNS 비색법(Miller, 1959)으로 측정하였다. 영여자 추출물 1 mL에 DNS 시약 3 mL를 넣고 5분간 중탕한 다음 냉각하여 25 mL 정용플라스크에 정용하였다. 550 nm에서 흡광도를 측정하여 glucose 함량에 상당하는 값(glucose equivalent, GE, g%)으로 나타내었다.
영여자 추출물의 유리당 함량은 Hwang 등(2013)의 방법을 변형하여 분석하였다. 분석기기는 Ultra Performance Liquid Chromatography(UPLC, Waters Acquity, Waters, New castle, DE, USA)를 이용하였고, 칼럼은 Shodex(4.6×250 mm, 5 μm, Asahipak NH2P-50 4E, Tokyo, Japan), 분석 조건은 isocratic elution으로 하여 retention time 10 min으로 하였다. 이동상은 acetonitrile-water(75:25, v/v), 검출기는 Evaporative Light Scattering Detector(Waters), 유속은 1.2 mL/min, 주입량은 10 μL로 하였다. 유리당의 함량은 mannose, sucrose, glucose를 이용하여 작성한 표준곡선에 의해서 함량을 측정하였다.
총폴리페놀(total polyphenol) 함량은 Folin-Denis법(Gutfinger, 1981)을 변형하여 측정하였다. 영여자 추출물 0.1 mL에 Folin 시약 0.1 mL를 첨가하여 잘 혼합한 후 3분간 방치하였다. 이 혼합액에 2 mL의 2% Na2CO3를 서서히 가하고 1시간 동안 방치한 후 750 nm에서 흡광도를 측정하였다. Gallic acid를 이용하여 작성한 표준곡선으로부터 총폴리페놀 함량을 측정하였다.
총플라보노이드(total flavonoid) 함량은 Zhishen 등(1999)의 방법을 변형한 방법으로 측정하였다. 영여자 추출물 0.34 mL에 증류수 1.92 mL를 첨가하고 2% NaNO2 0.2 mL를 넣어 혼합하였다. 이 혼합액에 10% AlCl3 0.2 mL와 1 M Na2CO3 1.34 mL를 넣고 실온에서 30분간 방치한 후 410 nm에서 흡광도를 측정하였다. 총플라보노이드 함량은 (+)-catechin을 정량하여 작성한 표준곡선으로부터 구하였다.
영여자 추출물 내 조사포닌(crude saponin)의 함량은 Kim 등(2019)의 방법으로 측정하였다. 영여자 추출물 100 μL에 8% 바닐린-에탄올 용액 300 μL를 넣은 후, 72% H2SO4 4 mL를 넣었다. 이를 60°C의 항온수조(WiseBath)에서 10분간 반응시킨 것을 545 nm의 흡광도에서 측정하였다. 조사포닌의 표준곡선은 진세노사이드 Rb1을 표준품으로 최종 농도가 0.03125, 0.0625, 0.125, 0.25, 0.5 ppm이 되도록 하여 측정하였다.
DPPH 라디칼 소거능 측정은 Blois(1958)의 방법을 일부 변형하여 측정하였다. DPPH 시약은 absolute ethanol으로 0.15 mM DPPH 용액을 제조하였고, 시료는 70% ethanol으로 농도별(100, 200, 500, 1000 μg/mL)로 희석하여 사용하였다. DPPH 용액 160 μL와 시료 40 μL를 혼합하여 암실에서 30분간 반응시킨 후, 518 nm에서 흡광도를 측정하였다. 대조군은 시료 대신 70% ethanol을 사용하였고, 라디칼 소거능은 백분율(%)로 나타내었다.
ABTS 라디칼 소거능 측정은 Re 등(1999)의 방법을 일부 변형하여 수행하였다. ABTS 시약은 absolute ethanol으로 7 mM의 ABTS 용액을 만들어 사용하였고, potassium persulfate는 distilled water에 희석하여 2.45 mM 농도로 용액을 제조하였다. ABTS 용액과 potassium persulfate 용액은 1:1로 혼합하고 실온의 암실에서 12시간 동안 반응시켜 ABTS 라디칼을 생성시켰다. 제조된 ABTS 용액은 734 nm에서 흡광도 1.20±0.20이 될 때까지 에탄올로 희석하였으며, 시료는 70% ethanol으로 농도별(100, 200, 500, 1000 μg/mL)로 희석하여 사용하였다. 농도가 조정된 ABTS 용액 180 μL에 시료 20 μL를 넣어 실온에서 10분간 반응시킨 후 734 nm에서 흡광도를 측정하였다. 대조군은 시료 대신 70% ethanol을 처리하였고, 라디칼 소거능은 백분율(%)로 나타내었다.
α-Glucosidase 저해 활성은 다당류가 단당류로 분해되는 경로의 억제 효능으로 평가하는 Li 등(2005)의 방법에 따라 측정하였다. 0.1 M sodium phosphate buffer(pH 7.0)에 α-glucosidase(0.2 unit/mL)와 ρ-nitrophenyl-α-D-glucopyranoside(2.5 mM, ρNPG)를 용해하여 제조하였고, 농도별(100, 200, 500, 1000 μg/mL) 시료 20 μL를 0.2 unit/mL α-glucosidase 효소액 20 μL와 2.5 mM ρNPG 20 μL를 가하여 혼합한 후 15분간 암반응시켰다. 0.2 M sodium carbonate solution 80 μL를 가하여 반응을 정지시킨 후 405 nm에서 흡광도를 측정하였다. 저해율은 아래의 식을 사용하여 백분율(%)로 나타내었다.
3. 결과 및 고찰
열풍 건조된 영여자 분말의 일반성분, 무기질, 비타민은 예비 테스트로 진행되었고, 그 결과는 다음과 같다(예비 테스트 결과는 표로 나타내지 않음). 수분 6.04%, 조단백질 7.94%, 조지방 0.48%, 조회분 4.08%, 탄수화물 81.46%로 분석되었으며, 무기질은 calcium 81.57 mg/100 g, phosphorus 263.34 mg/100 g, iron 3.46 mg/100 g, potassium 2079.15 mg/100 g, sodium 31.14 mg/100 g, 비타민은 retinol 0.30 mg/100 g, thiamin 0.60 mg/100 g, riboflavin 0.07 mg/100 g, ascorbic acid 114.92 mg/100 g, niacin 1.36 mg/100 g으로 나타났다. 열풍 건조 후 분말화한 나이지리아산 마는 품종에 따라 수분 5.57-10.94%, 조단백질 3.55-7.04%, 조지방 0.51-0.97%, 조회분 2.04-5.56%, 탄수화물 74.18-83.94%, calcuim 423-910 mg/100 g, potassium 917-1560 mg/100 g, sodium 43-113 mg/100 g, magnesium 72-148 mg/100 g, phosphorus 577-1070 mg/100 g, iron 4.60-11.10 mg/100 g, zinc 0.80-2.21 mg/100 g의 함량을 보고하였다(Olatoye and Arueya, 2019). 또한, Kim 등(2015)의 국내산 마 품종별 연구에서 열풍 건조된 장마 품종은 수분 11.96%, 조단백질 7.86%, 조지방 0.37%로 보고되었다. 국내산 장마와 나이지리아산 마의 성분을 비교해보면 함량에 다소 차이가 있는 것으로 보이며, 국내산 장마와 본 연구의 국내산 장마 영여자의 경우에는 수분 함량을 제외하고 기타 성분에서 크게 다르지 않은 것으로 확인되었다. 현재 국내산 영여자의 일부 성분에 대한 연구가 많이 미비한 실정으로 추후 연구가 필요할 것으로 판단된다.
효소를 이용하여 처리 시간별로 비교한 영여자 추출물의 가용성 고형분 함량(TSS)과 갈변도를 측정한 결과는 Table 1과 같다. TSS는 17.57-70.19%의 범위로 처리 시간이 증가할수록 유의적으로 증가하였고, CON에 비해 3.7-4.0배 증가된 것을 확인하였다(p<0.001). 처리 시간이 증가할수록 고형분 함량이 증가하는 결과는 전분 분해 효소(α-amylase)에 의해 영여자의 α-1,4 glucoside 결합이 절단되어 가수분해된 결과로 사료된다.
| Treatment | TSS2) (%) | BI3) (420 nm) |
|---|---|---|
| CON1) | 17.574)±0.20d5) | 0.061±0.001d |
| T30 | 64.71±0.11c | 0.097±0.001c |
| T120 | 66.52±0.16b | 0.117±0.001b |
| T240 | 70.19±0.26a | 0.148±0.000a |
| F-value | 49,947.41***6) | 9,440.77*** |
1) CON, control, treated non-enzyme; T30, treated enzyme time 30 min; T120, treated enzyme time 120 min; T240, treated enzyme time 240 min.
처리 시간에 따라 갈변도(BI)를 측정한 결과 0.061에서 0.148로 모두 유의적으로 증가하였다(p<0.001). 이러한 결과는 침출 조건을 달리한 발아 벼 차의 품질 특성 연구에서 열처리 시간이 증가할수록 갈변도가 증가한다는 연구 결과와 유사한 경향을 나타내었다(Lee 등, 2009). 이는 효소와 열에 의해 영여자 내의 유리당과 결합한 당이 가수분해 되어 고온에서 amino-carbonyl 반응으로 갈변이 증가된 결과로 판단된다.
효소 처리 시간별로 비교한 영여자 추출물의 총당과 환원당을 측정한 결과는 Table 2와 같다. 영여자 추출물의 total sugar은 1.86-14.73%의 범위로 분석되었으며, CON(1.86%)에 비해 T30(14.73%)이 7.9배 증가했다가 처리 시간이 증가할수록 점차 낮아짐을 확인할 수 있었다. Reducing sugar는 0.72-3.93%의 범위로 분석되었으며, CON(0.72%)에 비해 T30(3.93%)이 5.5배 증가했고, total sugar의 결과와 유사한 경향으로 나타났다. 전분 분해 효소 Termamyl 120 L에 의한 전분 가수분해는 반응 온도, 시간, 교반 속도에 영향을 미치는 것으로 알려져 있다(Slominska 등, 2003). Total sugar와 reducing sugar의 전체적인 결과로 볼 때, T30의 처리 정도가 효소에 의한 가수분해력이 가장 우수한 것으로 확인할 수 있다.
1) Abbreviations are the same as in Table 1.
효소를 이용하여 처리 시간별로 비교한 효소 주정 복합 처리 영여자 추출물의 유리당 구성 성분을 UPLC로 분석한 결과는 Table 2와 같다. 총 8종의 표준물질과 대조한 결과 유리당은 mannose, sucrose, glucose 성분이 검출되었으며, fructose, maltose, arabinose, xylose, galactose는 검출되지 않았다. 국내산 마의 유리당은 fructose, glucose, sucrose가 확인되었으며(Kim 등, 1992; Kim 등, 2015), 중국산 마의 유리당은 mannose, glucose, galactose를 보고하였다(Ju 등, 2014). 검출된 유리당은 재배 품종과 분석 조건에 따라 차이가 있을 것으로 사료된다. 효소가 미처리된 CON의 구성당은 환원당에 해당하는 glucose(1.00%)만 검출되었으며, 30분, 95°C의 단순 가열 처리만으로는 열분해 효과가 나타나지 않았다. 효소 처리가 진행된 처리군들은 영여자 추출물의 구성당 중 비환원당의 비율이 14.3-15.1%의 범위를 나타내었으며, 환원당에 속하는 당의 비율은 84.9-85.7%의 범위를 나타내었다. 또한, 유리당 결과는 total sugar와 reducing sugar의 경향과 유사하였으며, CON에 비해 구성당의 종류와 그 함량들을 합산한 결과가 6.9-11.2배 증가된 것으로 보아 효소 및 열 가수분해가 매우 효과적으로 이루어진 결과라고 판단할 수 있다. 이는 본 연구에 사용된 B. licheniformis (EC 3.2.1.1) 유래 내열성 α-amylase가 95-100°C의 온도에서 최대 활성을 나타내는 내열성 효소이므로 높은 온도에서 시료를 처리하여 영여자 기질의 기공 확장에 기여하고 효소가 효과적으로 침투할 수 있는 조건을 제공하였기 때문으로 사료된다(Nam 등, 2018). 또한, 효소 처리 시간이 증가하면서 유리당이 감소하는 경향은 환원당 결과와 비례하는 것으로 보아 효소 활성이 서서히 시작되면서 최대 활성 상태에 진입된 후 지속적으로 높은 온도에 노출되면서 활성이 저하되는 현상으로 생각되나 추가적인 연구가 필요할 것으로 판단된다(Nam 등, 2019).
본 연구에서 효소 처리 추출물(Step I)과 주정 처리 추출물(Step II)의 이화학적 특성 중 TSS, total polyphenol, total flavonoid, crude saponin를 비교한 결과 효소 처리 시간이 증가함에 따라 Step I의 결과는 증가하였다(Table 3, 4). 이러한 결과로 볼 때, 효소 처리 시간과 전분 가수분해도(DE)는 밀접한 관련이 있기 때문으로 판단된다. DE와 TSS, total polyphenol, total flavonoid, crude saponin에 대한 효소 처리만의 결과를 Table 3에 나타내었다. DE의 경우 CON은 단순 열수 처리의 효과만으로 5.38%를 나타내었고, 효소 처리만 진행한 T30, T120, T240에서 각각 13.23, 13.99, 14.56%로 DE가 증가함으로 효소 분해 효과를 확인할 수 있었다. 또한, 효소 처리의 시간이 증가할수록 DE가 유의적으로 증가하였다(p<0.001). TSS, total polyphenol, total flavonoid, crude saponin의 경우, 증가된 DE의 경향에 따라 유의적으로 증가하였다(p<0.001). 특히, TSS는 산출된 F값으로 보아 효소 처리 시간 간의 차이가 결과에 큰 영향을 미쳤다는 것을 확인할 수 있었다. 효소에 의한 전분 분해는 반응 시간이 증가됨에 따라 영여자 전분의 점도가 감소하면서 효소 최적 반응을 위한 유용한 환경을 제공하였고(Nam 등, 2018), 효소의 활성을 가속화 하면서 유용성분 추출이 극대화된 요인으로 생각된다.
1) Abbreviations are the same as in Table 1.
1) Abbreviations are the same as in Table 1.
처리 시간별로 비교한 효소 주정 복합 처리한 장마 영여자 추출물의 total polyphenol, total flavonoid, crude saponin을 측정한 결과는 Table 4와 같다. 영여자 추출물의 total polyphenol는 0.87%에서 1.07%의 범위를 나타내었으며, 처리 시간이 증가할수록 유의적으로 증가하였다(p<0.001). Bhandari and Kawabata(2004)의 네팔산 참마 괴경 연구에서 아세톤으로 추출한 참마는 종에 따라 total polyphenol 함량을 0.01-0.17% 범위로 보고하였으며, 본 연구 결과보다 낮게 나타났다. 이러한 결과로 볼 때, 전분 분해 효소와 열처리 시간이 증가할수록 페놀 함량이 증가됨을 알 수 있다. 즉, 페놀 화합물의 증가는 Table 1의 갈변도 결과와 정비례하였다. 또한, 처리 과정에서 발생하는 물리적 손상(박피, 절단, 파쇄, 고온)은 표면의 조직 및 세포를 손상시키고, 공기 중에 노출되거나 반응 표면이 증가되면서 효소 반응이 가속화로 melanin 반응을 일으켰을 것으로 판단된다(Kate and Sutar, 2018).
영여자 추출물의 total flavonoid는 0.44%-0.55%로 처리 시간이 증가할수록 현저히 증가하였다(p<0.001). Chen 등(2017)의 연구에서 건조 공정을 달리하여 80% 메탄올로 추출한 마 분말은 total flavonoid 함량을 0.05-0.08%의 범위로 보고하였다. 따라서 본 연구의 효소처리에 의해 total flavonoid 함량이 매우 높아진 것으로 판단된다. 상압에서 찌는 방법이나 고압 스팀 방법과 같은 가열 조리 과정은 식품의 matrix를 연화시키면서 구조를 파괴하므로 고분자에서 생리 활성 성분을 용이하게 용출시키는 것으로 알려져 있다(Zhao 등, 2019; Gong 등, 2021). 그러나 효소 처리된 영여자의 유용성분에 대한 자료는 미비한 실정이며, 효소 처리가 영여자의 구조와 구성 요소에 어떠한 영향을 미치는지에 대한 메카니즘은 추가 연구가 필요한 것으로 사료된다.
영여자 추출물의 crude saponin는 0.94%-2.60%의 범위로 나타났으며, 효소 처리군은 CON보다 2.6-2.8배 증가되었으나 각 효소 처리 시간에 의한 영향은 미미한 것으로 나타났다. 또한, 효소 주정 복합 처리된 crude saponin 함량(Table 4)을 100으로 볼 때, 효소 처리만 진행된 Table 3의 crude saponin 함량은 효소 처리 시간에 따라 60.7-88.1%의 비율로 산출되었다. 국내산 마 품종별 이화학적 성분 연구에 의하면 열풍 건조된 장마 원물은 total polyphenol, total flavonoid, crude saponin이 각각 0.23%, 0.16%, 0.04%로 분석되었다고 보고하였으며(Kim 등, 2015), 본 연구 결과와 비교해 보면 total polyphenol은 3.8-4.7배, total flavonoid는 2.8-3.4배 더 증진되었다. Crude saponin의 경우에서는 23.5-65.0배 대폭 증진된 것을 확인할 수 있었다. 유용 성분을 증진시키기 위한 영여자의 효소 처리 시간은 최소 30분에서 최대 4시간의 처리가 효과적인 것으로 확인되었다. 조사포닌 만의 결과로 볼 때, 이 이상의 처리 시간은 불필요할 것으로 예상되었다. 결과적으로 효소 처리 후 고형물에 주정 처리를 진행할 경우 잔존한 유용성분 함량까지 추출할 수 있음을 확인하였다.
항산화 활성을 가진 천연물은 자유라디칼을 제거하는 능력을 가지고 있어 신체 내 활성산소에 의한 세포 손상을 방지하는 역할을 한다. 천연물의 항산화 활성 측정에는 DPPH 및 ABTS 라디칼 소거능을 측정하는 방법이 가장 널리 활용되고 있는데. 각 분석법은 천연물의 성질에 따라 결합도가 달라져 항산화능의 차이를 비교 분석할 수 있다(Wang 등, 1998).
효소 처리 시간에 따른 항산화 활성의 변화를 알아보기 위해 DPPH radical과 ABTS radical scavenging을 평가하여 그 결과를 Fig. 2(A)에 나타냈다. DPPH는 CON 15.57-31.16%, T30 17.42-35.22%, T120 16.97-31.53%, T240 17.54-30.99%의 활성을 보였으며, 농도(100-1000 μg/mL)가 증가할수록 활성이 증가하는 경향을 보였으나 효소 처리 시간에 따른 유의적 차이는 보이지 않았다. ABTS는 CON 7.93-29.09%, T30 10.45-26.06%, T120 8.03-23.35%, T240 7.45-23.11%의 활성을 보였으며, 농도(100-1000 μg/mL)에 따라 활성이 증가하였다. CON과 비교하여 효소를 30분간 처리한 T30에서 활성이 유의적으로 증가하였으나 T120, T240에서는 유의적 차이가 나타나지 않았다.
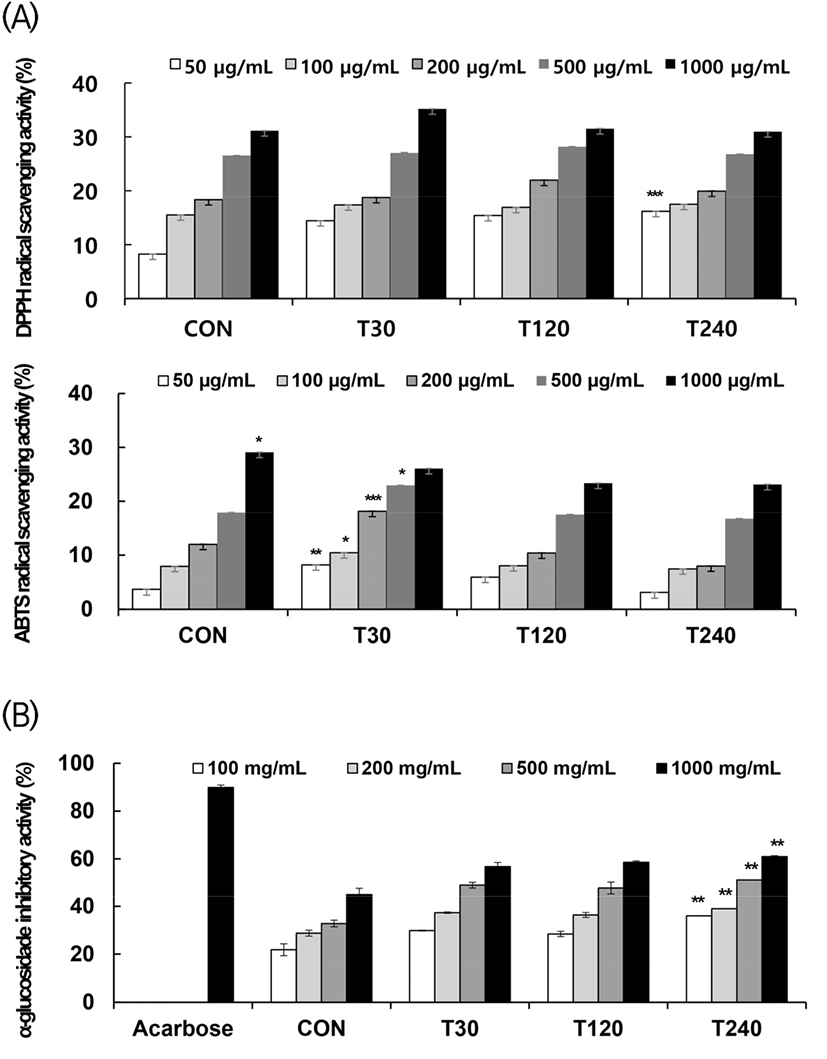
α-Glucosidase는 다당류를 단당류 형태로 분해하여 소화 흡수를 가능하게 하는 효소이며, α-glucosidase 저해제는 α-glucosidase 효소 및 이당류 소화 효소류(maltase, sucrase)를 동시에 저해하여 포도당 분해 및 흡수를 지연시키고 혈당 상승을 억제한다(Olden 등, 1991; Taylor 등, 1991; Yagi 등, 1976). 따라서 α-glucosidase 저해제는 식품 섭취 후 체내에서 포도당으로 인한 혈당 상승을 억제함으로써 항당뇨 활성 측정의 지표로 사용할 수 있다(Gua 등, 2006; Kang 등, 2017). 각 시료의 α-glucosidase 저해 효과를 측정한 결과, 효소를 240분간 처리한 T240이 36.04-60.98%의 저해 활성을 보여 가장 높았다. T120 (28.40-58.59%)와 T30(29.83-56.80%)이 두 번째로 활성이 높았으며, CON은 21.84-45.11%로 유의적으로 가장 낮게 나타났다(Fig. 2(B)). 이는 Kim 등(2009)의 연구에서 효소 처리에 의해 쓴 메밀 추출물의 α-glucosidase 저해 효과가 증가하였다는 연구와 일치하였다. Camargo 등(2016)의 연구에서는 포도주 부산물에 효소 처리를 통해 α-glucosidase 저해 활성이 증가되었고 이는 폴리페놀의 증가와 밀접한 관계가 있다고 보고하였다. 본 연구에서도 이와 같이 효소 처리에 의해 총 폴리페놀 및 조사포닌 함량이 증가되어 α-glucosidase 저해 활성이 증가한 것으로 판단된다. 따라서 효소 주정 복합 처리는 영여자의 유용 성분 및 기능성을 극대화시키기 위한 효과적인 가공 방법이 될 수 있다고 판단된다.










