서 론
현대사회에서 과학기술의 발달, 경제 수준의 향상으로 인해 인간 평균 수명의 연장과 국민 건강에 대한 관심은 증가된 반면, 음주, 흡연, 신체 활동들의 감소, 스트레스 등의 건강 위험 요인은 증가하고 있다(Lee 등, 2017). 이러한 요인들은 인체의 노화나 여러 가지 합병증을 유발하며, 그 주요 원인인 활성산소종(reactive oxygen species, ROS)은 세포의 미토콘드리아에서 산소를 사용하여 에너지를 생성할 때, 산화 환원 과정에서 발생하는 부산물이다(Pham-Huy 등, 2008). 이는 세포 산화 환원 신호 및 면역 기능에 유익한 효과를 나타내지만, 그 함량이 높아질 경우, 세포 기능과 구조를 손상시킬 수 있는 유해한 산화적 스트레스로 작용한다고 알려져 있다(Sen 등, 2010). ROS는 superoxide radical, hydroxyl radical, singlet oxygen 및 H2O2 등의 산화적 스트레스를 생성하여 세포막 분해, 단백질 분해, 지방 산화, DNA 합성 억제 등 생체 내 심각한 생리적 장애를 발생시킨다(Behl와 Moosmann, 2002).
뇌 조직은 높은 산소 소비량과 고농도의 불포화 지방산으로 구성되어 있는데, 이는 다른 조직에 비해서 상대적으로 낮은 항산화 방어 기전을 가지며, 산화적 스트레스에 민감하게 반응하는 조직이다(Choi 등, 2012). 체내 활성산소종이 과도하게 생성될 경우, 뇌의 DNA, 막 지질, 막 단백질과 같은 거대 분자와 반응을 하며, 이는 결과적으로 세포막의 지질 과산화를 일으키는 연쇄반응으로 이어져 거대 분자에 매우 파괴적으로 작용하여 주요 뇌 신경세포의 손상을 일으킨다(Niki 등, 1993). 이러한 산화적 스트레스는 뇌의 기능적 효율성의 저하, 느려진 반응, 기억력 감소, 떨림 및 신경 기능의 문제를 일으키며, 이는 세포자살(apoptosis) 및 세포괴사(necrosis)를 유도하여 궁극적으로 AD 및 뇌졸증을 포함한 신경 퇴행성 질환 등을 일으키는 것으로 알려져 있다(Lim과 Kim, 2007; Reiter, 1995). 이러한 퇴행성 질환을 개선하기 위해 다각도로 연구되고 있으나, 뇌조직의 경우 손상이 되면 기능의 회복이 어렵고, 현재 개발된 합성 의약품은 그 효능 여부와 부작용 등의 논란이 크게 대두되고 있다. 따라서 뇌조직에서의 산화적 스트레스의 균형 대사를 위해서는 천연 항산화제의 적절한 섭취가 중요하다.
이러한 산화적 스트레스를 억제시키는 항산화제는 합성 항산화제인 butylated hydroxyanisole(BHA), butylated hydroxytoluene(BHT)이 경제성과 높은 항산화력으로 인해 널리 사용됐지만, 합성 항산화제의 경우, 다양한 부작용 등 안전성에 논란이 있어, 허용 대상 식품이나 사용량이 엄격히 규제되고 있다(Yoon 등, 2013). 따라서, 안전하게 오랫동안 섭취된 천연물로부터 인체에 안전하고 항산화력이 높은 물질을 이용하는 연구가 활발히 진행되고 있다(Cho 등, 2008). 이에 따라, 항산화 효과와 안정성을 확보한 뇌 신경세포에 대한 산화적 스트레스를 감소시켜줄 수 있는 천연 항산화제의 섭취 필요성이 대두되고 있다.
금은화(Lonicera japonica)는 동아시아 재래종으로, 인동과(Caprifoliaceae)에 속하는 인동덩굴(L. japonica)의 꽃봉오리 또는 막 피기 시작한 꽃으로 주로 여름철 꽃이 피기 전에 채취된다(Shin 등, 2012). 금은화는 항균 효과, 미백효과 등이 보고되고 있으며, 그 외에 간 손상, 호흡기 관련, 망막허혈 및 혈소판 활성 등의 개선 효과 등에 이르기까지 다양한 분야에 걸쳐 연구가 진행되고 있다(Bae 등, 2005; Kim 등, 2011; Yu 등, 2017). 다양한 연구가 수행되었음에도 뇌 신경세포 보호 효과와 관련한 생리활성 연구는 미흡한 실정이다. 따라서 본 연구에서는 금은화의 ethyl acetate 분획물을 활용하여 항산화 활성 평가와 아세틸콜린 분해 억제효과, 과산화수소로부터 유도된 뇌 신경세포 사멸에 대한 보호 효과를 등을 확인하여, 신경세포의 사멸에 의해 발생되는 퇴행성 뇌질환의 예방 및 개선를 위한 기능성 식품 소재로서의 활용 가능성을 평가하고자 연구를 수행하였다.
재료 및 방법
본 실험에 사용한 금은화는 2019년 강원도 양양군의 농가에서 재배된 것을 구입하여 사용하였다. 시료는 동결건조기(FDU-8612, Operon, Gimpo, Korea)를 이용하여 건조한 후, 시료 20 g에 40% 에탄올 1 L를 첨가하여 2시간 동안 환류 냉각 추출하였으며, 추출액은 No. 2 여과지(Whatman Inc, Kent, UK)로 여과하여 농축(N-N series, Eyela Co., Tokyo, Japan)하였다. 농축한 추출물은 증류수 250 mL로 정용하고, 같은 양의 n-hexane을 분획을 진행하였다. 이 과정과 동일하게 chloroform 및 ethyl acetate을 이용하여 순차적으로 분획을 진행하여 분획물을 얻었으며, 이를 동결건조하여 -20°C에 냉동 보관한 후 각 실험에 사용하였다.
본 실험에 사용된 시약은 Folin & Ciocalteu’s phenol reagent, Na2CO3, gallic acid, NaOH, diethylene glycol, rutin, sodium phosphate buffer, 2,2'-azino-bis(3-ethyl benzothiazoline- 6-sulfonic acid)(ABTS), potassium persulfate, 1,1-diphenyl- 2-picrylhydrazyl(DPPH), sodium acetate buffer, HCl, 2,4,6-tri (2-pyridyl)-1,3,5-triazine(TPTZ), trichloroacetic acid, thiobarbituric acid, ascorbic acid, cetechin, tris HCl buffer, 5,5'-dithiobis- 2-nitrobenzoic acid(DTNB), acetylthiocholine, fetal bovine serum, calf serum, penicillin, streptomycin, H2O2, Roswell memorial institute medium(RPMI) broth, 2’,7’- dichlorofluorescein diacetate(DCF-DA), 3-(4,5-dimethyl-thiazol- 2-yl)-2,5-diphenyl tetrazolium bromide(MTT), Minimum Essential Medium (MEM), Dulbecco Modified Eagle Medium(DMEM), dimethyl sulfoxide(DMSO)는 Sigma-Aldrich Chemical Co. (St. Louis, MO, USA)에서 구입하였고, 그 외 사용된 용매 및 시약은 모두 1급 이상의 등급을 사용하였다.
추출한 시료 용액 1 mL와 3차 증류수 9 mL를 혼합한 후, Folin & Ciocalteu’s phenol reagent 1 mL를 넣고 혼합하여 5분간 실온에서 반응시켰다. 혼합용액에 7% Na2CO3 10 mL를 넣어 다시 혼합하여 3차 증류수로 25 mL를 정용한 뒤, 23°C에서 2시간 동안 반응시킨 후 760 nm에서 흡광도(UV- 1800, Shimadzu, Tokyo, Japan)를 측정하였다. 측정된 흡광도 값은 gallic acid를 이용하여 시료와 동일한 방법으로 수행된 표준곡선을 통해 총페놀성 화합물 함량을 계산하였다.
총플라보노이드 함량 측정은 시료 용액 1 mL에 diethylene glycol 10 mL와 NaOH 1 mL를 넣고 혼합하여 30°C에서 1시간 동안 반응시킨 후 420 nm에서 흡광도(UV-1800, Shimadzu, Tokyo, Japan)를 측정하였다. 측정된 흡광도 값(optical density, OD)은 rutin을 사용하여 시료와 동일한 방법으로 작성된 표준곡선에 대입하여 총플라보노이드 함량을 계산하였다. 우수한 활성을 가지는 에탄올 추출 농도를 확인하기 위해 0, 20, 40, 60, 80 및 95% 에탄올 추출물을 이용하여 실험을 진행하였다.
ABTS 라디칼 소거 활성 측정은 150 mM NaCl이 포함된 100 mM sodium phosphate buffer(pH 7.4)에 1.0 mM 2,2'- azobis-(2-amidinopropane) HCl(AAPH)과 2.5 mM ABTS를 혼합하여, 68°C 항온수조에서 30분 동안 가열하여 반응시켜준 후 실온에 10분 동안 냉각하였다. 만들어진 혼합용액을 Syringe filter로 여과하여 4°C에서 24시간 동안 보관 후 사용하였으며, 흡광도 값이 734 nm에서 0.70±0.02가 되게 희석하였다. 시료 용액 20 μL에 흡광도 값을 맞춘 ABTS 용액 980 μL를 가하여 37°C에서 10분간 반응시킨 후 734 nm에서 흡광도(UV-1800, Shimadzu, Tokyo, Japan)를 측정하였다(Kim 등, 2003).
DPPH 라디칼 소거활성 측정은 80% 메탄올에 0.1 mM DPPH를 용해하여 517 nm에서 흡광도 값이 1.00±0.02가 되도록 희석하였다. 시료 용액 50 μL에 흡광도 값을 맞춘 DPPH 용액 1.45 mL를 가하여 30분간 암실에서 반응시킨 후 517 nm에서 흡광도(UV-1800, Shimadzu, Tokyo, Japan)를 측정하였다(Blois, 1958).
ABTS 및 DPPH 라디칼 소거활성 측정은 다음 식에 의하여 계산되었다.
Ferric reducing/antioxidant power(FRAP) 용액 제조 방법은 300 mM sodium acetate buffer(pH 3.6)와 40 mM HCl이 포함된 10 mM TPTZ 혼합용액과 20 mM FeCl3을 일정한 비율로 배합하여 37°C에서 15분간 반응시켜 만들었다. 시료 50 μL에 만들어진 FRAP 혼합용액 1.5 mL를 가하여 실온에서 30분간 반응시킨 다음 593 nm에서 흡광도(UV-1800, Shimadzu, Tokyo, Japan)를 측정하였다(Benzie과 Strain, 1996).
마우스 뇌 조직을 이용한 지질과산화물 생성억제활성을 측정하기 위해 1주간 사육한 4주령의 수컷 Institute of Cancer Research(ICR) 마우스를 실험동물공급업체(Samtako, Osan, Korea)로부터 구입하여 항온(22±2°C), 항습(50-55%)을 유지하며, 12시간 간격으로 낮과 밤을 교대시키는 동일한 환경에서 충분한 식수와 사료를 공급하여 사육하였다. 상기 환경에서 사육한 ICR 마우스의 뇌를 적출하여 뇌 조직무게에 20 mM tris HCl buffer(pH 7.4)을 10배 첨가하여 균질화시켜 원심분리(12,000 ×g, 15분, 4°C)하여 얻어진 상층액을 시험에 사용하였다. 뇌 조직 상층액 0.1 mL, 10 μM 황산철(II) 0.1 mL, 0.1 mM 아스코브르산 0.1 mL 및 시료 0.2 mL를 혼합하여 37°C에서 1시간 동안 반응시켰다. 이후 반응용액에 30% trichloroacetic acid 0.1 mL와 1% thiobarbituric acid 0.3 mL를 첨가하여 80°C 항온수조에서 20분 동안 가열한 후, 원심분리를 이용하여 얻은 상등액을 532 nm에서 흡광도(UV-1800, Shimadzu)를 측정하였다(Chang 등, 2001). 본 동물실험은 경상대학교 동물윤리심의위원회 승인을 거쳐 진행하였다(경상국립대학교 동물실험 인가번호: GNU-120831- M0067).
아세틸콜린 분해효소(acetylcholinesterase, AChE) 억제활성 측정은 acetylcholine iodide을 기질로 사용하여 측정하였다. 아세틸콜린 분해효소는 신경세포의 특성을 갖는 PC12 세포 배양액을 200 ×g에서 6분간 4°C에서 원심분리하여 상층액을 제거하고, 균질화 완충용액(1 M NaCl, 50 mM MgCl2, 1% Triton X-100(pH 7.2)) 1 mL를 넣어 균질화시킨 후, 다시 원심분리(12,000 ×g, 30분, 4°C)하여 얻어진 상층액을 실험에 사용했다. 50 mM sodium phosphate buffer(pH 8.0), 시료용액 10 μL 및 acetylcholinesterase 10 μL를 혼합하여 37°C에서 15분 동안 방치시킨 후, 50 mM sodium phosphate buffer(pH 8.0)에 용해시킨 0.5 mM Ellman’s 반응용액(0.5 mM acetylcholine iodide, 1 mM DTNB)을 70 μL를 첨가하여 37°C에서 10분 동안 배양한 후, 흡광도는 microplate reader (Epoch 2, BioTek Instruments Inc., Winooski, VT, USA)로 405 nm에서 측정하였다(Ellman 등, 1961).
본 실험에 사용한 MC-IXC 세포(CRL-2270, ATCC, Manassas, VA, USA)는 인간의 뇌 조직에서 유래되었으며, 신경세포의 특성을 나타낸다. MC-IXC 세포는 10% FBS와 50 units/mL 페니실린 및 100 μg/mL 스트렙토마이신이 포함된 MEM 배지에 접종하여 배양했으며, 37°C에서 5% CO2 조건에서 배양하였다. Mouse의 뇌 해마 조직에서 유래된 HT22 세포는 경상국립대학교 수의과대학 조직학 실험실에서 2017년 10월에 분양받아 사용하였다. HT22 세포는 10% calf serum, 50 units/mL penicillin 및 100 μg/mL streptomycin이 포함된 DMEM 배지에서 37°C, 5% CO2 조건으로 배양했다.
뇌 신경세포 생존율은 신경세포 생존력 및 세포독성을 측정할 수 있는 MTT 실험을 통해 확인할 수 있다. 96 well plate에 MC-IXC와 HT22 세포를 각 well에 1.0×104 cells/well의 농도로 분주하고 24시간 배양시킨 후, 시료 용액을 각각의 뇌 신경세포에 처리했다. 24시간 후, 200 μM 과산화수소를 처리하여 3시간 동안 배양기에서 반응을 시켰다. 이후 MTT 용액을 처리하여 배양기(37°C, 5% CO2)에서 3시간 동안 배양한 후, 배양액을 제거한 뒤 DMSO를 이용하여 반응을 종결시켰다. 흡광도는 microplate reader(Epoch 2, BioTek Instruments Inc., Winooski, VT, USA) determination wave 570 nm와 reference wave 690 nm에서 흡광도를 측정하였다(Heo 등, 2001).
산화적 스트레스 생성 억제효과는 뇌 신경세포 내에 활성산소종의 활성을 측정하는 2’,7’-dichlorofluorescein diacetate (DCF-DA) assay을 통해 확인한다. Blank 96 well plate에 MC-IXC와 HT22 세포를 각 well에 1.0×104 cells/well의 농도로 분주하고, 배양기(37°C, 5% CO2)에 24시간 동안 배양시켰으며, 이후 24시간 동안 배양시킨 후, 200 μM 과산화수소를 처리하여 3시간 동안 37°C에서 5% CO2의 조건으로 반응을 시켰다. 이후 빛을 차단한 상태에서 50 μM DCF-DA를 처리하여 50분 동안 배양하였고, 형광광도계(fluorometer, Infinite F200, Tecan, Mannedorf, Swiss)를 사용하여 excitation wave 485 nm와 emission wave 535 nm에서 형광을 측정하였다(Heo 등, 2001).
금은화의 생리활성 물질을 동정하기 위해 금은화 40% 에탄올 추출물을 ethyl acetate로 분획하여 얻은 동결건조물을 50% 메탄올로 녹여 100 µg/mL로 샘플을 제작했다. BEH C18 column(100×2.1 mm, 1.7 μm; Waters, Milford, MA, USA)이 장착된 ultra performance liquid chromatography- quadrupole-time of flight mass spectrometry(UPLC-Q- TOF/MS, Xevo G2-S, Waters, Milford, MA, USA)를 이용하여 분석을 진행하였다. 대사물질의 MSE 스펙트럼은 10-40 eV, 50-1500 m/z에서 분석하였다.
결과 및 고찰
페놀성 화합물은 식물계에 널리 분포된 2차 대사산물로, 페놀성 화합물은 수산기에 의한 수소 공여와 페놀 고리 구조hydroxyl(-OH)기와 벤젠 고리를 가지고 있는 것이 특징이다. 의 공명 안정화에 의한 항산화 능력을 나타내는 것으로 보고되고 있다(Kim 등, 2008). 0, 20, 40, 60, 80 및 95% 에탄올 추출물의 수율은 각각 26.74%, 35.08%, 35.36%, 32.00%, 30.88%, 12.31%를 나타냈다(Data not shown). 가장 높은 총페놀성 화합물의 함량을 가진 추출물은 40% 에탄올 추출물로써, 74.32 mg GAE/g의 함량을 나타냈으며, 60%, 80%, 20% 에탄올 추출물이 각각 71.86, 63.70, 63.53 mg GAE/g의 순으로 나타났다(Table 1). 플라보노이드는 폴리페놀에 속하는 성분으로, 식물의 잎, 꽃, 줄기 및 열매 등에 많이 함유되어 있으며, 이는 주로 flavonols, flavones 및 flavanones 등으로 구성되어 있다(Herrmann, 1988; Herto 등, 1993). 금은화의 총플라보노이드 함량은 40%와 60% 에탄올 추출물에서 각각 53.32, 57.86 mg RE/g으로 높은 함량을 보였으며, 80%와 20% 추출물에서 각각 52.47, 43.24 mg RE/g으로 나타났다(Table 1).
Song 등(2018)의 연구에 따르면 다양한 방법(진탕, 열수, 초음파, 침지)으로 추출하여 용매별 폴리페놀 함량과 금은화의 chlorogenic acid의 추출 효율을 측정한 결과, 열수 추출과 40%, 60%, 80% 에탄올 농도일 때 상대적으로 폴리페놀 함량 및 chlorogenic acid의 추출 효율이 높은 것으로 보아, 이는 유효 성분의 효율적인 추출조건으로 판단된다. Shin과 Yoo(2012)의 연구에 따르면 총페놀성 화합물 분석 결과, 금은화 70% 에탄올 추출물이 열수 추출물보다 높은 페놀성 화합물과 총플라보노이드 함량이 높게 나타났음을 제시하였고, 이는 70% 에탄올 추출물이 금은화 주요 성분인 chlorogenic acid, hesperidine, naringine, luteolin 등과 같은 polyphenol 류 생리 활성 성분을 더 효과적으로 추출하기 때문으로 판단된다. 본 연구에서는 금은화의 0, 20, 40, 60, 80 및 95%로 농도를 에탄올 추출물들의 총페놀성 화합물 함량과 총플라보노이드 함량을 비교했을 때, 40과 60%에서 높은 총페놀성 화합물 및 총플라보노이드 함량을 확인함으로써 항산화 물질이 다량 함유되어 있다는 것을 알 수 있었다. 이에 따라 총페놀성 화합물 함량과 총플라보노이드 함량이 가장 높게 나타난 40% 에탄올 추출물을 사용하여 분획을 진행하였으며, n- hexane, chloroform, ethyl acetate 및 증류수 분획물을 각각 얻었다.
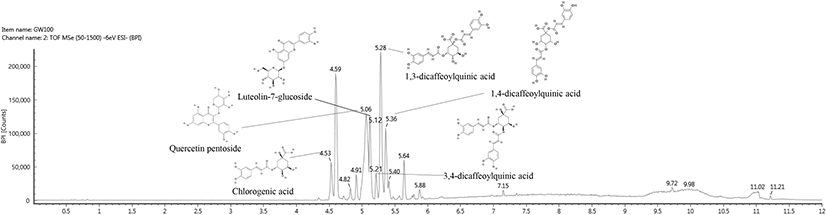
항산화 및 뇌 신경세포 보호 효과를 보여주는 금은화 ethyl acetate 분획물의 생리활성 물질을 동정하기 위해, UPLC- Q-TOF/MSE를 이용하여 주요 생리활성 물질에 관한 분석연구를 진행했으며, 구성 화합물의 fragmentation 및 retention time을 이용하여 각각 확인했다(Fig. 1과 Table 2). 금은화 ethyl acetate 분획물에서 분리된 화합물은 크로마토그램으로 나타냈으며, 동정된 생리활성 물질은 chlorogenic acid(4.53 min), quercetin pentoside(5.06 min), luteolin-7-glucoside(5.12 min), 3,4-dicaffeoylquinic acid(5.21 min), 1,3-dicaffeoylquinic acid(5.28 min), 1,4-dicaffeoylquinic acid(5.36 min)로 확인하였다(Clifford 등, 2005; Goger 등, 2019; Hvattum, 2002). Kwon 등(2010)에 따르면, scopolamine으로 유도된 기억력이 손상된 동물 모델에서 chlorogenic acid의 섭취는 Y-maze 실험과 Morris water maze 실험을 통해 단기기억 능력 및 작업기억의 손상을 유의적으로 개선했다. 또한, 해마와 전두엽 피질에서 AChE와 MDA 억제를 통해서 세포 보호 효과를 나타냈다. Lima 등(2006)에 따르면, 간암 세포종인 HepG2 세포에서 tert-butyl hydroperoxide(t-BHP)로 유도된 세포 사멸에 대한 luteolin-7-glucoside의 세포 보호 효과를 확인해 본 결과, 지질과산화의 부산물인 thiobarbituric acid reactive substances (TBARS)의 수준을 감소시켰으며, t-BHP에 의한 GSH 수준 감소에 대해 우수한 보호 효과를 보였다. Kim 등(2005)에 따르면, 인간 신경 모세포종인 SH-SY5Y 세포에서 과산화수소로 유도된 신경세포 사멸에 대한 보호 효과를 연구한 결과, 3,4-di-O-caffeoylquinic acid(3,4-diCQA)에 의한 신경세포 보호 효과가 있음을 입증 확인했다. 또한, 이러한 결과를 종합하였을 때, 금은화의 chlorogenic acid, luteolin- 7-glucoside 그리고 dicaffeoylquinic acid 유도체 등의 페놀 화합물들은 산화적 스트레스로 인한 뇌 신경세포 보호와 기능 유지에 도움을 줄 수 있는 천연 소재로써 활용할 수 있는 가능성을 가지는 것으로 판단된다.
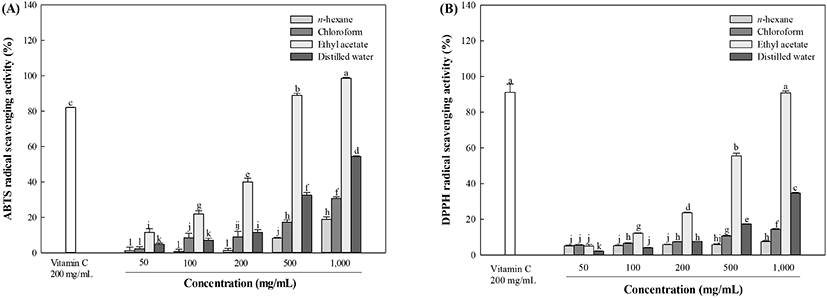
ABTS 라디칼 소거활성은 ABTS 시약의 potassium persulfate에 의해 인위적으로 생성된 양이온 라디칼이 시료가 가지는 항산화 물질에 의해 제거되어 ABTS 라디칼의 색인 청록색에서 무색으로 변하는 색 변화 정도를 측정하는 방법으로, 수용성과 지용성 두 가지 물질의 항산화 능력을 측정할 수 있어 범용으로 활용되는 방법이다(Re 등, 1999). ABTS 라디칼 소거 활성을 측정한 결과는 Fig. 2(A)와 같다. 1,000 μg/mL 농도에서 ethyl acetate 분획물(98.56%, IC50=261.37 μg/mL)이 증류수 분획물(54.40%, IC50=439.79 μg/mL)에 비해 약 1.8배 높은 ABTS 라디칼 소거활성을 보였다. DPPH 라디칼 소거활성을 측정한 결과는 Fig. 2(B)와 같다. 1,000 μg/mL 농도에서 ethyl acetate 분획물이 90.80%, 증류수 분획물이 34.66%로 ethyl acetate 분획물의 DPPH 라디칼 소거능이 증류수 분획물 대비 약 2.6배 높은 것을 확인할 수 있었다. Ethyl acetate 분획물의 IC50 값은 421.96 μg/mL로 다른 분획물과 비교하였을 때 가장 낮은 값을 보여 우수한 라디칼 소거활성을 나타냈다. Cho 등(2013)의 연구에 따르면, 금은화의 메탄올 추출에 의한 극성별 분획물(n-hexane, chloroform, ethyl acetate, n-BuOH, 증류수)의 항산화 활성을 DPPH 라디칼 소거효과로 측정한 결과, 100 μg/mL 농도의 BHA와 금은화 추출 ethyl acetate 분획의 비교에서 이들은 유사한 라디칼 소거활성을 나타냈다. 또한, 금은화의 메탄올 추출물을 분획하여 chloroform, ethyl acetate, n-BuOH 및 증류수 분획물로 DPPH 라디칼 소거효과를 측정한 결과, ethyl acetate 분획물이 가장 IC50이 낮은 것을 확인했으며, 이는 ethyl acetate 분획물이 상대적으로 다른 분획물보다 더 많은 luteolin, caffeic acid 및 protocatechuic acid 등의 활성 물질을 함유하기 때문으로 판단된다(Choi 등, 2007). 따라서, 분획물 중 가장 in vitro 항산화 활성이 높은 금은화 ethyl acetate 분획물(ethyl acetate fraction of L. japonica, EFLJ)을 사용하여 이후 실험을 진행하였다.
FRAP을 통한 환원력 측정 실험은 산성의 조건에서 ferric tripyridyltriazine(Fe3+-TPTZ) 복합체가 ferrous tripyridyltriazine (Fe2+-TPTZ)으로 환원이 되며, 높은 환원력을 가지는 시료에 의해 환원되는 양이 증가해 흡광도 값이 측정되는 것을 이용하여 항산화 활성을 측정할 수 있다(Benzie과 Strain, 1996). 금은화의 ethyl acetate 분획물의 FRAP 분석에 의한 철 환원력 측정 결과는 Fig. 3(A)에 나타냈다. 분획물의 농도가 증가함에 따라 활성이 증가하는 경향을 보였으며, 500 µg/mL와 1,000 µg/mL 농도에서는 1.18과 2.00의 흡광도 값을 각각 나타냈다. Lee 등(2019)의 연구에 따르면 reverse phase high- performance liquid chromatography(RP-HPLC)를 통한 chlorogenic acid, quercetin 함량은 금은화의 항산화 특성에 큰 영향을 미치는 주요 활성 화합물로 보고하였으며, Wu(2007)에 따르면 금은화의 chlorogenic acid는 Fe3+ 이온을 효과적으로 감소시킬 수 있다고 보고했다. Miao 등(2018)에 따르면, 14종의 다양한 화합물의 FRAP 환원력 측정 실험에서 chlorogenic acid와 quercetin은 높은 철 환원력을 보여주었다. Firuzi 등(2005)에 따르면, FRAP 분석에서 서로 다른 화합물(flavones, flavonols 및 isoflavones)의 시간에 따른 흡광도 변화를 확인한 결과, quercetin이 효과적으로 Fe3+를 Fe2+로 환원시킨다고 보고했다. 따라서, chlorogenic acid와 quercetin과 같은 생리활성 물질들이 금은화의 철 환원력 측정에 영향을 미치는 주요 활성 화합물로 추정된다.
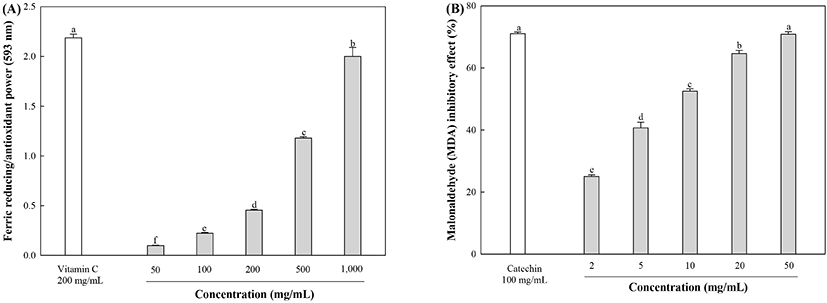
뇌 조직은 세포막에 다가 불포화 지방산이 고농도로 존재하고, 라디칼 형성 시 촉매로 이용되는 금속이온(Fe2+, Cu2+)이 존재하기 때문에 산소의 요구량이 많아 쉽게 산화된다(Kim 등, 2017). 금속이온은 펜톤반응을 통해서 ROS를 생성과정에 관여하며, 과량의 ROS는 뇌의 불포화 지방산과 반응하여, 지질 과산화 물질인 malondialdehyde(MDA)를 생성한다(Reiter, 1995; Sung 등, 2000). 그 과정에서 세포 내에 많은 MDA가 축적되면 세포막에서 교차결합, 중합 및 변성이 일어나 이온 수송, 효소 활성 및 세포 표면의 부착상태를 변성시키며, DNA의 염기와 반응하여 돌연변이성 병변을 일으킨다고 알려져 있으며, 세포의 산화 스트레스의 지표로 사용이 된다(Ji 등, 2013; Sung 등, 2000). 본 연구에서는 지질과산화물 함량을 측정함으로써 EFLJ의 지질과산화 생성 억제 효과를 평가했다(Fig. 3(B)). EFLJ의 50 μg/mL 농도에서 70.88%를, 양성대조군인 카테킨은 동일 농도에서 71.03%를 나타냈지만, EFLJ의 IC50은 21.24 μg/mL로, 양성대조군인 카테킨(23.03 μg/mL)과 비교하였을 때, 낮은 IC50값을 나타내 우수한 지질과산화물 생성 억제 활성을 갖는 것을 확인했다. Yi 등(2011)의 연구에서, lipopolysaccharide(LPS)로 유발된 급성 폐 손상에 금은화 물 추출물이 미치는 영향을 알아봤을 때, LPS 투여 시 폐 내의 MDA 함량의 증가가 되었으나, 금은화 물 추출물 투여를 통해 폐 내 MDA 함량의 증가가 억제됨을 확인했다. 또한, rats에서 dimethylnitrosamine으로 유도된 급성 간 손상에 대한 MDA 함량이 감소하였다(Teng 등, 2010). 금은화의 주된 성분인 chlorogenic acid는 rat의 뇌에서 sodium nitroprusside, quinolinic 및 Fe2+에 의해 각각 유도된 산화 스트레스에 대한 MDA 생산을 억제하였다(Oboh 등, 2013). 이러한 연구와 유사하게 본 연구에서도 EFLJ는 MDA 수준을 억제할 수 있을 것으로 판단된다.
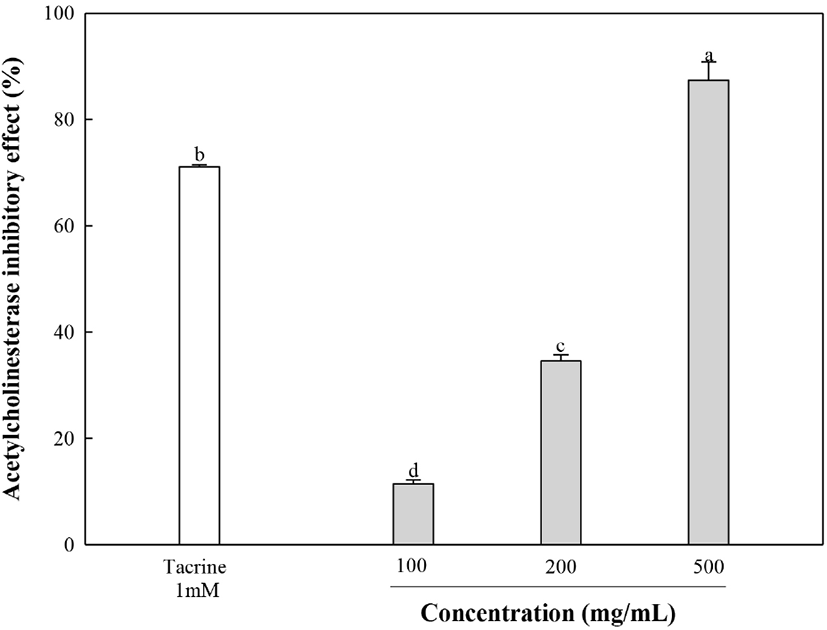
체내의 대표적인 신경전달 물질 중 하나인 아세틸콜린(acetylcholine, ACh)은 콜린성 신경계에 주로 분포하는 기억 메커니즘의 핵심 요소 중 하나이다(Watanabe 등, 2009). 아세틸콜린은 choline acetyltransferase 효소의 작용을 받아 acetyl CoA와 choline이 합성되고, 이는 다시 AChE 효소의 작용으로 acetate와 choline으로 분해된다. 하지만, AChE의 농도가 증가하면 뇌 신경세포의 콜린성 신경전달물질이 분해되어 기억 및 인지기능 장애가 유발될 수 있다(Vincenzo, 2001). 따라서 본 연구에서는 금은화의 AChE의 억제 활성을 확인했다(Fig. 4). EFLJ의 IC50은 282.72 μg/mL로 나타났으며, 양성대조군인 tacrine의 IC50은 49.3 ng/mL로 나타났다. 금은화 주성분인 chlorogenic acid는 유의적으로 AChE 활성을 억제했으며(Oboh 등, 2013), Yoo 등(2013)의 연구에 따르면 scopolamine에 의해 기억 상실이 유도된 쥐 모델에서 luteolin이 이랑(dentate gyrus)에서 AChE 수준을 감소시켜줌으로써 인지기능의 개선을 나타냈다. 이러한 결과를 바탕으로 luteolin과 chlorogenic acid 등과 같은 폴리페놀 화합물에 의한 AChE 억제 활성이 유도된 것으로 판단되며, 이러한 생리활성 물질을 통해서 아세틸콜린 분해를 효과적으로 저해하는 데 도움이 될 것으로 판단된다.
세포 내 ROS는 반응성이 매우 높은 화합물로 지질, 단백질 및 DNA를 산화시켜 세포의 손상이나 게놈 불안정을 유발하는 산화적 스트레스를 발생시킨다(Dizdaroglu 등, 2012). 산화 스트레스는 주로 활성 산소 종 (ROS), 활성 질소 종 (reactive nitrogen species, RNS) 및 항산화 방어 메커니즘으로 구성된 상대적으로 높은 수준의 독성 반응성 종의 존재 사이에서 불균형을 특징으로 하는 생화학적 상태이다(Ozben, 2007). 산화적 스트레스는 신경세포 핵과 미토콘드리아 DNA의 손상을 증가시키며, 항산화 효소의 활성을 감소시키고, 산화적 스트레스를 일으키는 ROS는 신경 손상을 일으켜 알츠하이머성 질환(Alzheimer’s disease, AD)과 같은 퇴행성 뇌 신경 질환과 기억력 장애를 유발한다(Heo 등, 2004). 식물 유래 플라보노이드 및 폴리페놀 화합물은 이러한 산화적 스트레스에 대한 보호 효능이 우수한 것으로 알려져 있어 천연 유래 소재의 연구가 필요하다(Ishige 등, 2001). 본 연구에서는 과산화수소로 유도된 HT22와 MC-IXC 세포에서 금은화 ethyl acetate 분획물의 산화적 스트레스에 대한 보호 효과를 확인하였다. 항산화 실험에서, 비타민 C와 비교하기 위해 유사한 금은화 샘플의 농도를 설정하였으며, 활성이 우수한 금은화 ethyl acetate 분획물의 IC50을 구하고자 50 μg/mL- 1,000 μg/mL 농도를 설정했다. 세포 실험의 경우, 사전 실험을 통해 세포에 독성을 일으키지 않는 최적의 농도를 확인했으며, 5 μg/mL-50 μg/mL로 하여 세포실험을 진행했다.
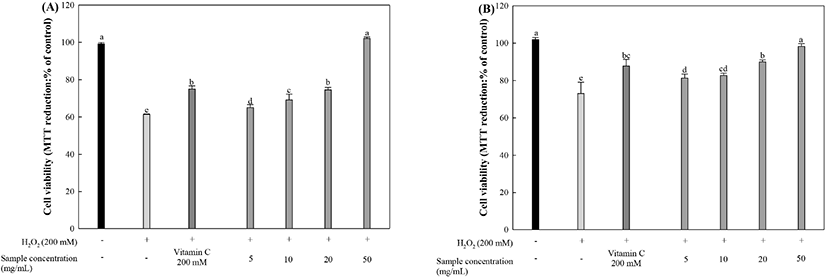
MTT 분석은 살아있는 세포 속 미토콘드리아가 MTT 시약과 함께 배양되었을 때, 포르마잔(formazan) 결정을 생성하는 것을 이용한 세포 생존율 측정 방법이다(Heo 등, 2001). 과산화수소로 인한 산화적 스트레스가 유도된 HT22와 MC- IXC 뇌 신경세포 생존율을 측정한 결과는 다음과 같다(Fig. 5). HT22 세포에서 신경세포 생존율을 측정한 결과, 과산화수소를 처리한 HT22 신경세포에서는 대조군 대비 61.39%의 신경세포 생존율을 나타냈지만, 양성대조군인 비타민 C는 75.00%의 신경세포 생존율 상승을 보였다(Fig. 5(A)). Ethyl acetate 분획물 20 μg/mL와 50 μg/mL 농도의 EFLJ는 각각 74.54%, 102.06%의 신경세포 생존율을 나타냈다. MC-IXC 신경세포에서의 신경세포 생존율을 측정한 결과, 과산화수소를 처리한 MC-IXC 신경세포에서는 대조군 대비 73.02%의 신경세포 생존율을 보였으며, 양성대조군인 비타민 C는 87.81%의 신경세포 생존율을 보였다(Fig. 5(B)). EFLJ 20 μg/mL와 50 μg/mL 농도는 각각 90.03%, 98.24%를 나타냈다. HT22와 MC-IXC 두 세포에서 모두 20 μg/mL에서는 양성대조군인 비타민 C와 유사한 신경세포 생존율을 나타냈으며, 50 μg/mL에서는 뇌신경세포 생존율이 비타민 C보다 더 높은 신경세포 생존율을 나타냈다.
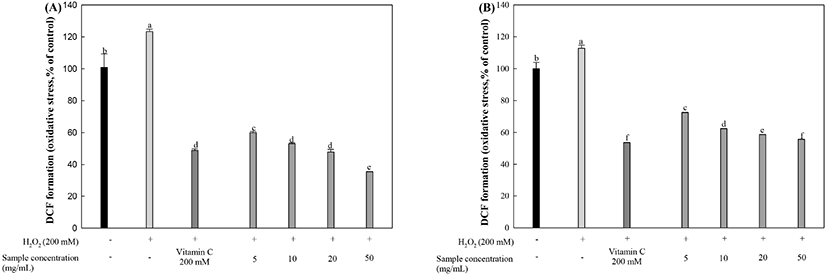
뇌 신경세포 내 활성산소종의 함량 측정 방법인 DCF-DA 실험은 세포 내 미토콘드리아에서 비형광 화합물인 DCF-DA가 세포 내에서 ROS 존재 시에 산화되어 형광을 띄는 DCF로 분해된다(Heo 등, 2001). 과산화수소로 인한 산화적 스트레스가 유도된 HT22와 MC-IXC 세포에서의 활성산소종 생성 정도를 측정한 결과는 다음과 같다(Fig. 6). 과산화수소를 처리한 HT22 세포에서 대조군 대비 123.30%의 ROS 함량을 보였고, 양성대조군인 비타민 C는 대조군 대비 59.99%의 ROS 함량을 나타냈다(Fig. 6(A)). EFLJ 20과 50 μg/mL 농도는 각각 47.85%, 35.54%의 형광 광도를 보였으며, 양성대조군인 비타민 C와 비교했을 때, 효과적으로 세포 내 활성산소종의 생성이 감소된 것을 확인할 수 있었다. MC-IXC 세포에서는 과산화수소를 처리한 그룹에서 대조군 대비 112.77%의 형광 광도가 증가하는 것을 확인했고, 과산화수소와 비타민 C를 동시에 처리한 집단에서는 53.54%의 형광 광도를 나타냈다(Fig. 6(B)). EFLJ 20 μg/mL와 50 μg/mL 농도로 MC-IXC 세포에 처리하였을 때, 각각 58.69%와 55.68%의 형광 광도를 보였으며, 양성대조군인 비타민 C와 비교해 보았을 때, 유사한 활성산소종의 생성 억제를 나타냈다.
이는 높은 항산화 활성을 가진 금은화가 생리적 특성상 높은 산소 농도가 요구되는 반면, 높은 수준의 불포화 지방산을 가지는 뇌 조직에서, 생체 세포막의 주요 구성성분인 다중 불포화 지방산을 MDA로 전환하는데 주된 관여를 하는 ROS를 제거함으로써 뇌 신경세포 보호 효과를 나타내는 것으로 판단된다(Choi 등, 2012). 대뇌 신경세포인 rat C6 glioma cell에서는, AlCl3가 신경전달 물질에 손상을 주어 신경연접(synapse)간 원활한 자극전달을 방해하거나 자유라디칼의 생성 유발로 인해 감소된 신경세포 생존율을 금은화 추출물이 유의하게 증가시킴으로써 세포독성을 억제했다고 보고된 바 있다(Jung 등, 2017). Peng 등(2005)에 따르면, 금은화는 hyperoside, chlorogenic acid, luteolin 및 caffeic acid를 주요 생리활성 성분으로 가지고 있음을 확인했으며, Son 등(2020)의 연구에 따르면, 금은화 생리활성물질 중 하나인 caffeic acid가 glutamate로 인해 신경독성이 유도된 HT22 세포에서 신경세포 보호활성을 가지며, ROS로 인한 세포 사멸을 막아주는 것을 확인할 수 있었다. 이런 결과를 종합해 볼 때, 금은화의 caffeic acid 물질뿐만이 아니라, 금은화의 다양한 생리활성 물질들이 뇌 신경세포 생존율의 증가와 활성산소종의 생성을 억제함으로써 신경세포 보호 효과를 갖는 천연 항산화제로서의 활용 가능성이 있는 것으로 판단된다.










