서 론
인삼(Panax ginseng C. A. Meyer)은 오갈피나무과(Araliaceae)의 속하는 다년생 초본류로 사포닌을 다량 함유하여 면역기능 개선, 피로개선 등의 기능성을 가지고 있다(MDFS, 2020). 최근 인삼 뿌리보다 잎에 더 많은 사포닌을 함유하고 있다고 보고되고, 이는 항산화, 항노화, 항당뇨 및 심혈관계 질병 예방 등 각종 생리 기능성이 우수하다고 보고되어 있다(Seong 등, 2019). 그러나, 인삼 재배 기간은 4-6년으로 길며, 연작이 불가능하여 재배 가능 면적이 점차 줄어드는 실정이다(Lee 등, 2020). 그에 비해 새싹삼(Panax ginseng sprout, PGS) 재배는 모밭에서 24개월 미만 재배한 모종삼(묘삼)을 25-40일 정도 재배해 뿌리와 어린잎 전체를 수확하여 인삼에 비해 재배 기간이 짧고 연작이 가능하다는 장점과 뿌리뿐 아니라 잎까지 섭취하는 새싹삼은 진세노사이드 함량이 높다고 보고되어 있다(Chang 등, 2020). 이러한 특성으로 잎까지 수확하기 위해 토경재배보다는 수경재배(hydroponics)를 활용한 새싹삼 재배가 이루어지고 있다. 수경재배는 식물공장에서 주로 사용하는 방식으로 외부 조건의 영향을 받지 않고 농작물에 대해 통제된 일정 시설 내에서 빛, 온도, 습도, CO2 농도, 배양액 등 환경 조건을 조절한다(Seo 등, 2008). 이 중 밀폐형 식물생산시스템에서 작물 생육에 필요한 광원은 인공광원으로 발광다이오드(light-emitting diode, LED)가 주목받고 있다. LED는 소형 광원으로 공간 활용이 용이하고 특정 파장대 LED 조합으로 광질, 광도와 광주기의 형태로 다양한 광 조건 인위적으로 조절할 수 있어 많이 사용되고 있다(Lee 등, 2016). 담수경 재배환경은 순환식 수경재배로 배양액을 흘려주며 산소를 공급해주는 방식으로 관리의 효율성이 높으나 양액으로 인한 부영양화 및 미생물 증식으로 뿌리가 짓무르고 썩는 집단 감염의 위험성이 있다. 이런 문제점을 감소시키기 위해 플라즈마 처리가 살균에 효과가 있다고 보고된다. 물속에서 플라즈마를 발생시킨 후에 생성된 수산기(-OH)는 강한 산화력을 지닌 방전수를 활용해 과일 세척, 수질 정화, 폐수 처리 등에 살균에 효과적으로 활용되고 있다(Park 등, 2019). 또한, 플라즈마는 활성화, 살균, 촉매의 고유한 특성을 가져 물리적, 화학적 자극으로 씨앗의 발아율이나 새싹 성장률을 향상시킬 수 있다고 보고되고 있다(Yoo, 2015). Ryu 등(2016)에 따르면 마이크로웨이브 플라즈마 활성수를 처리한 상추와 페튜니아 유묘 처리구가 대조구보다 생육이 더 증가했다고 보고하였다.
또한, 작물 재배 시 원적외선을 사용하여 작물의 생육을 촉진하는데, Chee(2001)의 연구에 따르면 원적외선은 파장이 길어 열작용이 큰 전자파로 공진 및 공명 작용이 강해 가열 매체 없이 직접 작물에 조사로 작물의 모세혈관을 확장 시켜 혈액순환과 세포조직 생성, 생육촉진 및 물질농축에 도움이 된다고 하였다. 이에 원적외선 처리수에서 성장한 무의 자엽이 1.25배 높게 성장하였고, 무 크기가 상대적으로 컸다고 보고되어 있다(Cho, 2009).
따라서 본 연구에서는 담수경 재배환경을 바탕으로 바이오블록(원적외선)을 활용하고 LED 시간 및 플라즈마 방전수 처리를 달리하여 새싹삼의 생육 변화 및 품질분석을 통해 새싹삼의 담수경 재배환경 조건을 확립하고자 하였다.
재료 및 방법
본 실험에서 사용된 시료는 1년근 종자삼(Panax ginseng C. A. Meyer)으로 2020년 10-11월 수확해 냉동 저장된 종자삼(1-year seed ginseng, mother’s farm, Jangseong-gun, Jeollanam-do, Korea)을 2021년 2월 22일에 구입하여 상온에서 해동한 후 test bed에 바로 이식하였다.
본 생육실험은 익산시 춘포면에 위치한 더자람 식물원 내에 스마트팜 베드를 설치하였다. 생육환경에서 생육 test bed는 500 cm×30 cm×20 cm로 제작하고, 50 cm×30 cm 스펀지 베드를 test bed 내에 띄워서 담수경 재배하였다. 1년근 종자삼을 스펀지 베드에 45개씩 9베드를 test bed에 이식하고 생육 촉진을 위한 72시간 암막형성 후 7일 간격으로 4주간 생육을 측정하였다. 새싹삼의 생육처리 조건은 Table 1과 같다.
LED 조건에서 대조구(CGS)는 스탠드 LED(SL-660, LED stand, Samjung inverter Co., Ltd., Hwaseong, Gyeonggi-do, Korea)를 사용하고, CGS에 처리한 색온도 5926(CCT°K), 광속(광선속) Luminous flux 475.1(lm), 광효율 Efficiency 52.26 lm/w, 연색지수 CRI 84.4 Ra, 최대파장 Peak wavelength 446.1 nm, 최종파장 Dominant wavelength 489.4 nm, 조도 Illuminance 3985 Lx이며, 처리구 TGS에는 식물성장용 LED(Plant Grow Lighting, Custom-made Spectrum, ALLIX Co., Jeonju, Jeollabuk-do, Korea)를 1.5 m LED bar 형식으로 1줄 처리하였다. 처리구(TGS) LED는 색온도 4,390 CCT°K, 광속(광선속) Luminous flux 1,584 lm, 광효율 Efficiency 75.06 lm/w, 연색지수 CRI 92.1 Ra, 최대파장 Peak wavelength 449.4 nm, 최종파장 Dominant wavelength 571.7 nm, 조도Illuminance 2884 Lx로 설정하였다(Fig. 1). 양액은 수소화 미네랄 양액(HW) pH 5.13, EC (ds/m) 0.31이며, 조성비(%)는 K 9.57, Ca 8.09, Mg 14.17, Na 17.61, Cl 41.15, NO3-N 0.61, S 4.82, P 2.24, Zn 1.31, Cu 0.05, Mn 0.95이고, 발효 양액(NO)은 pH 6.53, EC(ds/m) 0.12이며, 조성비(%)는 K 12.62, Ca 18.08, Mg 4.30, Na 9.44, Cl 46.08, NO3-N 4.04로 구성되어 있다. 설치된 Test bed 안쪽 바닥에 바이오블록(원적외선)을 대조구(CGS)를 제외한 새싹삼 처리구(TGS)는 2줄로 배열하고, 20 cm 간격으로 50개를 배치하였다. 바이오블록은 현무암 원석을 300-1,000 mesh로 분쇄 후 용해로 1,500-2,000°C 기준으로 용해하여 각 지름 7-8 cm, 두께 2-3 mm, 중량 40 g으로 제조한 것을 사용하였으며, 바이오블록 방사에너지(W/m2·μm, 37°C)는 3.57×102이고, 방사율(5-20 μm)은 0.926을 나타냈다. 또한, 대조구(CGS)를 제외한 모든 처리구(TGS)에 O2를 공급하였다. 플라즈마 장치 설계는 총 세 부분으로 나뉘어 전원부, 발진부, 방전부로 센서 베드에 연결하여 조절하고, 150 mm×800 mm 마이크로버블 제조장치(MVI-408, Wilo Co., Busan, Korea)를 중간부에 연결하여 처리구 TGS2, TGS3, TGS4에만 플라즈마 방전수를 공급하였다. 수경 재배 시스템의 양액 순환 과정은 1일 1회 회수되도록 설정하고, 재활용 순환수 조건을 EC 0.5 이하, pH 6.5-7.0, DO 6-10 ppm으로 설정하였다. 스마트팜 내 온도 21.0±3.0°C, 생육베드 내 온도 20.0±2.0°C, 습도 55±5% RH를 유지하였다.
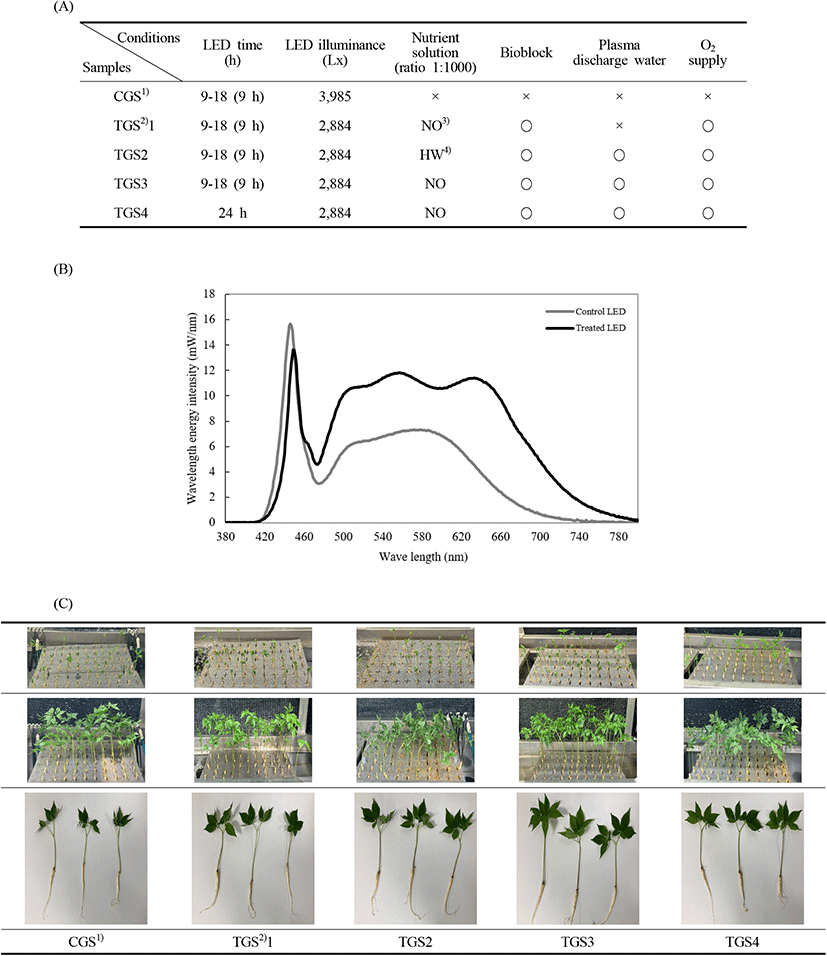
생육 기간은 총 21일간으로 종자삼을 2021년 2월 22일에 이식하고, 3월 2일까지 7일간 발아 관찰 후, 7일 간격으로 분석하여 21일차인 2021년 3월 15일에 재배를 종료하였다. 재배하는 동안 생육 변화를 측정하였다.
종자삼은 스펀지 베드에 이식 후 암실환경을 72시간 조성 후 7일 간격으로 21일차까지 발아율, 뿌리 부패율 그리고 생육 변화를 측정하였다. 생육 변화 측정방법은 Seong 등(2019)의 방법을 참고하여 측정하였다. 재배일수별 새싹삼의 지상부인 잎 개수와 줄기 길이와 지하부인 뿌리 두께와 길이를 각각 측정하였다. 줄기 부분은 뇌두 시작부터 잎자루 시작 부위까지를 측정하고, 새싹삼 두께(근경)는 뇌두 부분에서 1 cm 떨어진 부위에 버니어캘리퍼스(Metric 500-704-20 waterproof IP67 digital vernier caliper, Mitutoyo Co., Kawasaki, Japan)를 이용하여 측정하였다. 지하부 뿌리(근장)는 뇌두 부분부터 뿌리 가장 끝부분까지 30 cm 자를 이용하여 측정하였다. 모든 시료는 스마트팜 내에 식재된 새싹삼을 측정하였고 Test bed 당 45개씩 식재된 스펀지 베드 9개 중 3개를 무작위로 뽑아 한 시료 당 30개씩 측정하여 평균값을 나타냈다.
새싹삼 잎의 색도는 7일에서 21일 차까지 7일 간격으로 측정하였다. 7일차 새싹삼 잎은 작아 새싹삼을 3개씩 모아서 잎의 중간 부분을 측정하고 14일차와 21일차는 잎 하나의 중간 부분을 측정하였다. 색차계(CM-700d, Minolta Inc., Tokyo, Japan)를 사용하여 Hunter L, a, b 값을 측정한 뒤 평균값으로 나타내었다. L value는 0(black), +100(white), a value는 60(redness), -60(greenness), b value는 +60(yellowness), -60 (blueness)으로 수치화하였다. 시료는 각 5회 반복하여 측정하였다. 백색판 값은 L: 99.30, a: -0.09, b: -0.12로 맞추어 실험하였다.
조사포닌 함량은 건강기능식품공전(2004)에 나와 있는 ‘인삼/홍삼성분함유 제품’ 실험 방법으로 수정하여 분석하였다. 인삼 생 시료를 분쇄한 후에 시료 약 5 g을 정밀히 달아서 250 mL 환류 플라스크에 넣고 부탄올 50 mL를 가하여 70-80°C의 항온수조(BS-21 Shaking Water Bath, Jeiotech Co., LTD., Daejeon, Korea)에서 1시간 환류 추출한 후 여과하였다. 잔류물에는 부탄올 용액 50 mL 가하여 한번 더 환류 추출하여 이 작업을 1회 반복하여 추출하였다. 추출한 후 250 mL 분액 깔대기에 옮기고 증류수 50 mL를 가한 후 격렬히 흔들어서 물과 부탄올 층이 완전히 분리될 때까지 정치하였다. 그 후 물 층을 제거하고 부탄올 층(상층)을 미리 항량한 농축 플라스크에 넣고 감압농축하였다. 농축물에는 에테르 50 mL를 가하여 약 36°C water bath에서 30분간 환류 냉각하며 추출하고, 탈지한 뒤 에테르층을 분액하여 제거하였다. 잔류물을 항량이 될 때까지 105°C에서 건조하고 데시케이터에서 30분간 방랭한 후 무게를 측정하였다. 조사포닌 함량 계산식은 아래와 같다.
A: 물포화 부탄올층을 농축 건조한 후의 플라스크의 무게(mg)
B: 항량을 한 빈 플라스크 무게(mg)
S: 시료 채취량(g)
초기 종자삼 및 21일간 재배한 새싹삼(TGS)을 각 베드에서 무작위로 채취하였다. 잎과 뿌리 모두 한꺼번에 동결건조한 후 분쇄하여 사용하였다. 추출방법은 Lee 등(2020)의 방법을 참고하여 추출하였다. 동결건조 새싹삼 분말 1 g에 80% Ethanol 20 mL를 넣고 80°C 항온수조(BS-21 Shaking water bath)에서 100 rpm, 3시간 진탕 추출하고, 4°C, 10,000 rpm (Centrifuge 5804R, Eppendorf AG, Hamburg, Germany)에서 15분간 원심분리 후 0.45 μm Syringe filter(RC25 syringe filter 17765, Sartorius AG, Göttingen, Germany)로 여과하였다. 추출시료는 0-4°C에 보관한 후 희석하여 각 실험에 사용하였다.
총폴리페놀 함량은 Singleton과 Rossi(1965)의 Folin- Denis 방법을 수정하여 분석하였다. 일정 농도로 희석한 시료 100 μL에 2%의 Na2CO3 2 mL를 첨가하여 3분 동안 상온에서 방치시킨 다음 1 N Folin-Ciocalteu 시약(Sigma-Aldrich Co., St. Louis, MO, USA) 100 μL를 넣은 후 35°C에서 11분 반응시켰다. 이후 흡광기기(Jasco V-730 Spectrophotometer, Jasco Corp., Tokyo, Japan)를 사용하여 750 nm에서 흡광도를 측정하였다. 총폴리페놀 함량은 gallic acid(Sigma- Aldrich Co.)를 표준물질로 하여 산출하였고, 동결건조 새싹삼 100 g 당 mg gallic acid equivalent(GAE, dry basis)로 함량을 나타냈다.
총플라보노이드 함량은 Moreno 등(2000)의 방법을 수정하여 분석하였다. 시료 100 μL에 증류수 1 mL와 5% NaNO2 용액 75 μL를 넣은 후 상온에서 5분간 반응시켰다. 이후 10% AlCl3·6H2O 용액 150 μL를 첨가하고 6분 동안 상온에서 방치시킨 후, 1 M NaOH 용액 500 μL를 첨가하여 11분 동안 발색시키고, 510 nm에서 흡광도를 측정하였다. 총플라보노이드 함량은 (+)-catechin hydrate(Sigma-Aldrich Co.) 표준곡선을 이용하여 산출하였고, 동결건조 새싹삼 100 g 당 mg (+)-catechin hydrate equivalent(CHE, dry basis)로 함량을 나타냈다.
엽록소 및 총카로티노이드 함량은 Lichtenthaler 등(1987)의 방법을 수정하여 측정하였다. 동결건조 시료 0.1g에 80% Acetone을 첨가한 10 mL를 48시간 0-4°C에서 냉암소 보관하여 색소를 추출하였다. 추출시료는 흡광기기(Jasco V-730 Spectrophotometer)를 사용하여 663, 645, 470 nm에서 측정하고 아래의 식을 이용하여 계산하였다.
ABTS(2,2-azino-bis-(3-ethylbenzothiazoline-6-sulfonic acid) 라디칼 소거능은 Re 등(1999)의 방법을 수정하여 분석하였다. 7 mM ABTS 용액과 2.45 mM potassium persulfate를 1:1로 혼합한 후 암소에서 약 24시간 반응시켰다. 이후 실험 직전에 ABTS 용액을 735 nm에서 흡광도가 1.4±0.01이 되도록 phosphate buffer saline(pH 7.4)으로 희석하여 사용하였다. 희석된 ABTS 용액 1 mL를 일정농도로 희석한 시료 50 μL에 첨가하여 암소에서 30분간 실온 반응시켰다. 이후 흡광기기(Jasco V-730 Spectrophotometer)를 사용하여 735 nm에서 흡광도를 측정하였다. 측정흡광도는 L-ascorbic acid (Sigma-Aldrich Co.)를 이용하여 만든 표준곡선을 이용하여 ABTS 라디칼 소거능 결과값을 백분율(%)로 나타냈다.
결과 및 고찰
새싹삼의 발아율 및 생육 일수에 따른 뿌리 부패율(Table 1)은 다음과 같다. 새싹삼 7일차 대조구(CGS)는 95.68%의 발아율을 보였으며, 처리구(TGS) 발아율은 각각 TGS1은 99.60%, TGS2 99.40%, TGS3 99.80% 그리고 TGS4는 99.82%로 대조구보다 높은 발아율(%)을 보였다. 이는 양액을 처리하지 않은 CGS에서 미발아 종자삼이 많이 분석되었다. 반면에 대부분 발아한 TGS는 양액뿐 아니라, 초기 생육에 영향을 주는 바이오블록(원적외선)의 영향으로 판단되는데, Park 등(2016)의 연구에 따르면 화산력 바이오블록을 처리한 페레니얼 레이그라스의 발아 1주 때 다른 처리구에 비해 발아율이 80-85% 증가되었다고 보고된 바와 비슷한 경향으로 보여진다.
대조구 CGS 7일차 부패율은 5.45%를 처리구는 각각 TGS1은 3.84%, TGS2 2.03%, TGS3 3.64% 그리고 TGS4는 12.73%로 다른 처리구보다 높은 부패율(%)을 보였다. 재배 일수가 증가할수록, CGS는 총 부패율이 8.36%로 높은 반면에 처리구 TGS1, TGS2 및 TGS3는 4.24-4.65%로 낮은 부패율(%)을 나타냈다. 이는 Ryu 등(2004)의 연구에서 플라즈마 방전수 처리했을 때 대장균 4 log 이상의 살균능을 보였고, 5일간 밀폐용기에 처리하였을 때도 4 log 이상의 살균 지속력을 보였다고 보고하였다. 따라서 플라즈마 방전수에 잔존된 라디컬의 영향으로 재배수 오염 저감 및 미생물 살균에 영향을 줬을 것으로 판단된다. 그러나 처리구 TGS4는 15.09%로 유의적으로(p<0.05) 높은 부패율을 보였는데, 이는 다른 처리구에 비해 조사시간이 긴 TGS4는 재배수 온도가 높아져 세균증식에 영향을 준 것으로 판단된다.
새싹삼 재배 기간 중 생육 변화 측정 결과는 Table 1과 같다. 7일차에서는 뿌리길이를 제외하고 대조구(CGS)보다 처리구(TGS)에서 높은 경향으로 나타났다. TGS4가 7일차와 14일차에서 다른 처리구에 비해 유의적으로(p<0.05) 높게 나타났는데, 이는 Park 등(2012)의 연구에서 광조사를 24시간으로 처리한 상추에서 높이, 줄기 및 엽면적 등 가장 높은 값을 보였으며, 식물에서 초장은 온도와 관계없이 광원의 주기가 길어짐에 따라 증가한다는 보고와 일치하였다(Erwin 등, 1991). 그러나 21일차에는 전체길이 증가율이 다른 처리구에 비해 낮은데, 이는 광의 강도 및 조사시간이 식물의 생육에 영향을 주는데 연속적인 광조사로 인해 식물에 스트레스로 작용한 것으로 판단된다(Park 등, 2012). 21일차 또한 CGS보다 처리구 TGS에서 생육 증가율이 높게 나타났는데, 이는 Lee 등(2016)의 연구에서 단색파장을 혼합한 LED에서 재배했을 때 생장과 바이오매스가 증가한다고 보고하였고, 그 중 잎의 광합성 관련 기관의 발달과 전분 축적에 효과적인 적색 파장이 식물 생장에 관여한다는 결과로 처리구의 새쌈삼 생육에 영향을 받았을 것으로 판단된다(Saebo 등, 1995). 그에 비해 CGS에는 청색광의 비율이 높은데, Kim 등(2017)의 연구에서 청색광의 비율이 80% 이상 LED를 처리했을 때, 상추의 잎장 및 생체중이 감소한다는 결과를 미루어 보아 CGS LED의 대부분을 차지하는 청색광으로 인해 생육에 영향을 줬을 것으로 판단된다.
전체 길이에서 TGS가 CGS에 비해 유의적으로(p<0.05) 높게 나타났다. 그 중 수소화 미네랄 양액(HW)을 처리한 처리구보다 발효 양액(NO)을 처리한 처리구에서 더 높은 값을 나타냈다. 이는 Yi 등(2013)의 연구에서 NO3-를 100% 처리한 고추의 생장에서 생육이 우수하다고 하였으며, NO3-가 많을수록 생식생장에 유리하게 작용한다고 보고하였다. 본 연구에서 NO3-N의 비율이 높은 NO 양액 처리구 결과와 비슷한 경향을 나타냈다. 초장 길이 및 엽수에서 Shin 등(2013)의 연구에 따르면 NO3-N의 비율을 높게 한 상추에서 작물 생장이 우수하였으며, 초장 길이 및 엽수 또한 다른 처리구보다 많다는 결과를 보고하여, NO 양액을 처리한 처리구에서 생장이 우수한 것으로 보이고, 양액 종류 및 양액 조성으로 인해 처리구 간 생장 반응에서 차이를 나타냈다.
새싹삼의 생육기간 동안 잎 색도변화 측정 결과는 Table 2와 같다. Hunter L값이 밝기를 나타내는데 값이 (+)가 될수록 명도가 높아지고 (-)가 될수록 명도가 낮아지는데, 7일차에는 대조구(CGS)가 50.10으로 나타나고 처리구(TGS)는 30.73- 33.59로 CGS보다 명도가 낮게 나타났다. 또한, 21일차에 L값 CGS는 38.52로 나타나고 TGS는 28.26-33.89로 나타나, 대조구 잎이 더 밝은 것으로 측정되었다. Hunter a값은 (+)값이 될수록 적색 정도를 나타내고, (-)값일수록 녹색 정도를 나타낸다. 7일차보다 21일차에 녹색정도가 모든 시료에서 높게 측정되었다. 21일차에 CGS가 -12.47로 TGS보다 녹색정도가 강하게 나타났다. Hunter b값은 (+)값이 될수록 황색 정도를 나타내고, (-)값일수록 청색 정도를 나타낸다. 7일차에는 CGS가 24.32로 유의적으로(p<0.05) 높게 측정된 반면, TGS4는 11.78로 낮게 측정되었다. 21일차에는 TGS가 모든 비슷한 경향을 보이고, CGS가 14.48로 다른 처리구에 비해 황색정도가 강하게 나타났다.
새싹삼의 엽록소 및 총카로티노이드 함량은 Table 3과 같다. 진한 녹색을 나타내는 엽록소 a 함량에서 대조구(CGS)가 유의적으로(p<0.05) 높게 나타났는데, 이는 CGS에 청색광 비율이 높은 LED 처리로 인해 새싹삼 엽록소 합성에 영향을 준 것으로 판단된다. 색광은 엽록소 함량 및 주로 잎의 기능 발달에 작용하는데, Son 등(2012)의 연구에 따르면 청색 LED 처리구에서 엽록소 함량이 생육 기간 중 점차 증가하고 또한 생육을 촉진시켜 청색광이 광합성에 밀접한 관계가 있음을 보고하였으며, Yang 등(1997)에서도 인삼 모상근의 클로로필 생성은 청색 파장에서 높았다고 하였다. 또한, 처리구 TGS4가 엽록소 a뿐 아니라, 녹황색을 나타내는 엽록소 b와 총엽록소 함량에서 유의적으로(p<0.05) 높게 나타났다. 이는 다른 시료에 비해 광 조사시간이 길어 광합성에 영향을 준 것으로 판단되는데, Park 등(2012)에 따르면 광의 세기뿐 아니라, 노출 시간도 식물의 광합성에 영향을 준다고 보고하였으며 적색광은 잎의 광합성 관련 기관의 발달과 전분 축적에 효과적이라는 보고된 바로 처리구(TGS)의 LED에 포함된 적색광 및 조사시간으로 엽록소 축적에 영향을 준 것으로 판단된다(Lee 등, 2016). 이로써 엽록소의 함량은 광의 노출시간 및 LED의 적색광(R): 청색광(B)의 비율에 영향이 있다고 보여진다.
총카로티노이드 함량은 9-18 h 처리한 TGS 간 비슷한 함량을 보였으나, 24 h 처리한 TGS4의 총카로티노이드 함량은 유의적으로(p<0.05) 급격히 감소하는 결과를 보였다. Yang 등(1997)의 연구에서 광량이 높은 인삼 모상근 처리구에서 카로티노이드가 급격히 감소하는 양상 나타냈다고 보고하였는데, 위의 결과와 일치하는 양상을 나타냈다. 이에 새싹삼 재배 시 새싹삼 잎의 엽록소 및 총카로티노이드 생성에 적절한 광량 및 처리시간이 있다고 판단된다.
조사포닌 함량은 Table 3과 같다. 초기 종자삼(CON) 사포닌 함량에 비해 대조구(CGS) 및 처리구(TGS)에서 사포닌 함량이 유의적으로(p<0.05) 증가하였다. 21일차 생육한 CGS의 사포닌 함량은 22.87% 증가한 반면에 플라즈마 방전수 처리 및 발효 양액(NO) 공급한 처리구 TGS3, TGS4에서는 각각 65.91%, 137.93%로 높은 증가율을 보였다. Noh 등(2020)에 따르면 담액수경재시 상추에 플라즈마 활성수 처리는 뿌리부분의 페놀류와 같은 이차 대사산물 및 기능성 물질 함량 증대 시켰다고 보고하여 NO3-가 다량 함유된 NO 양액 공급이 식물 내 질소 축적으로 기능성 물질에 증가에 영향을 준 것으로 판단된다. 또한, TGS4가 다른 처리구에 비해 유의적으로(p<0.05) 높게 나타났는데, 이는 Fournier 등(2003)의 연구에 따르면 Panax quinquefolius의 임간재배에서 광량을 높게 증가시켰을 때 총 사포닌의 함량은 계속 증가하였으며, 적색광원 조사 시 사포닌 함량을 증가시켰다는 결과로 보아 TGS4가 광원에 노출되는 시간이 쌓여 광량 및 적색광원의 영향으로 총 사포닌의 함량이 증가된 것으로 보이며, Kim 등(2009)의 연구결과와 같은 경향을 보여 추후 광원 및 조사시간에 대한 연구가 필요하다고 판단된다.
새싹삼의 총폴리페놀 및 플라보노이드 함량은 Table 3과 같다. 처리구 TSG4에서 유의적으로(p<0.05) 높은 값을 나타냈다. 자연환경에서 스트레스에 노출된 식물은 세포막과 유기체를 스스로 보호하기 위해 식물 스스로가 항산화 효소를 활성시킨다(Mittler 등, 2004)고 보고된 바로 광 노출시간이 긴 TSG4에서 항산화 물질이 많이 발생된 것으로 판단된다. 또한, 플라즈마 방전수를 처리한 처리구(TGS)에서 폴리페놀과 플라보노이드 함량이 높은 경향이 나타났는데, 이는 Noh 등(2020)에 따르면 플라즈마 활성수 생성 시 만들어진 RNS 중에서 NO3-는 식물체의 뿌리에 있어서 질소(N)의 공급원이 되어 상추의 페놀산 및 플라보노이드의 생합성에 관여한다고 하였으며, 플라즈마 활성수가 직접 접촉되는 뿌리 부분 경우 모든 페놀류가 높게 나타나, 뿌리채소의 수경재배 방식에 적용 시 기능성 물질 증대할 수 있다고 보고하였다. 뿐만 아니라 적정량의 질소 공급은 phenolic acid, flavonoids, ascorbic acid를 증가시켰다는 결과(Mampholo, 2018)로 NO3-가 다량 함유된 발효 양액(NO) 공급이 처리구 TSG1, TSG3 및 TSG4의 생육 중에 항산화 물질 증대에 영향을 준 것으로 판단된다.
새싹삼의 ABTS 항산화능(%)은 Table 3과 같다. ABTS 라디칼 소거능(5,000 μg L-ascorbic acid/g sample)은 종자삼(CON)은 27.85%이며, 대조구(CGS)는 51.83%로 나타났고, 처리구 TGS1은 56.57%, TSG2는 55.1%, TSG3는 56.5% 그리고 TGS4가 68.06%로 나타나 다른 처리구보다 TGS4가 유의적으로(p<0.05) 높게 나타났다. 이는 조사포닌 및 폴리페놀, 플라보노이드 결과와 비슷한 경향으로 나타났다.










