서 론
곰팡이독소는 Fusarium 속, Aspergillus 속, 및 Penicillium 속 등 특정 곰팡이에 의해 생성되는 2차 대사산물로서 미량으로도 인축에 급․만성 독성을 유발할 수 있다(Lee와 Ryu, 2017). 작물의 생산, 수확 및 저장 등의 과정에서 생성된 곰팡이독소는 전 세계적으로 매년 약 25-50%의 농산물을 감염시킨다고 알려져 있으며(FAO, 2004), 이들은 물리․화학적으로 매우 안정하여 가공 및 일반적인 조리과정에 의해 잘 분해되지 않는다. 현재까지 알려진 곰팡이독소는 약 400여 종이나 주로 문제가 되는 것은 아플라톡신, 오크라톡신 A, 푸모니신, 제랄레논과 트라이코쎄신류 곰팡이독소인 데옥시니발레놀, 니발레놀, T-2 독소 등이다(Binder 등, 2007).
국제암연구소(International Agency for Research on Cancer, IARC)는 발암성과 관련해 아플라톡신은 발암물질(Group 1), 오크라톡신 A는 인체발암가능물질(Group 2B)로 분류하고, 제랄레논과 데옥시니발레놀은 발암물질로 분류할 수 없는 물질(Group 3)로 분류하고 있다(IARC, 1993). 트라이코쎄신류 독소와 제랄레논 등은 발암물질로 분류되지는 않지만 구토, 설사, 생식 저하, 면역력 저하, DNA 손상 등을 일으킬 수 있다(Arnold 등, 1986; Mirocha 등 1971; Pestka, 2010; Wu, 2014). 따라서 우리나라를 비롯한 유럽 연합, 미국 등 전 세계 여러 국가에서 아플라톡신, 오크라톡신 A, 데옥시니발레놀, 제랄레논, 푸모니신 등의 독소에 대한 허용기준을 설정하여 관리하고 있다(MFDS, 2018a). 최근 향신료나 약용식물 등에서 곰팡이독소 오염이 빈번하게 확인됨에 따라(Han 등, 2012; Zinedine 등, 2006) 이들에 대한 안전성 문제가 대두되고 있다. 따라서 국제적으로 향신료 및 약용식물에 대한 곰팡이독소 허용 기준치를 설정하거나 그 기준을 확대하였으며(EPC, 2016; JPC, 2016; USPC, 2017), 우리나라도 최근 아플라톡신의 기준을 식물성 원료 및 전체 가공식품으로 확대하여 관리하고 있다(MFDS, 2018a).
생강(Zingiber officinale)은 생강과에 속하는 다년생 초본식물의 뿌리로, 특유의 매운맛과 향을 가지고 있어, 주로 향신료로 사용되며 편강, 가루, 차 등으로 가공되어 다양하게 이용되고 있다. 생강은 열대 및 아열대 지역에서 생산되며 인도, 중국, 나이지리아 등에서 주로 생산되어 유럽과 미국 등으로 수출된다. 국내 생강은 전북 완주군, 충남 서산시, 경북 안동시에서 주로 생산되며 재배면적은 2019년 기준, 2,324 ha이고 생산량은 24,966 tone으로 추정된다(MAFRA, 2020). 생강은 진저론(zingerone), 진저롤(gingerols), 쇼가올(shogaols), 파라돌(paradols) 등의 생리활성물질을 생성한다고 보고되어 있으며(Yang 등, 2016), 항산화(Stoilova 등, 2007), 항균(Park 등, 2008), 항당뇨(Akhani 등, 2004), 항염증(Kubra 등, 2012) 등 다양한 생리활성이 보고되어 있다.
생강은 식용 및 약용적 가치로 인해 많은 국가에서 널리 사용되고 있으나 곰팡이독소 오염이 빈번히 보고되어 왔다. 남아프리카에서 여름과 겨울에 판매되는 생강을 수집하여 아플라톡신의 오염을 조사한 결과 아플라톡신 B1은 오염수준은 0.01-6.04 μg/kg이었으나 86% 이상의 높은 오염율을 나타내었다고 보고하였다(Omotayo 등, 2019). 미국에서는 39개의 생강 시료에 대해 아플라톡신과 오크라톡신 A의 오염을 조사한 결과 26개(66.7%)에서 아플라톡신이 1-31 μg/kg 수준으로 검출되었고, 오크라톡신 A는 29개(74.4%)에서 1-10 μg/kg 수준으로 오염율과 오염수준이 높음을 보고하였다(Trucksess 등, 2007). 나이지리아에서는 건기와 우기에 생강의 곰팡이독소 오염을 조사한 결과 우기에 아플라톡신과 오크라톡신 A의 오염율이 상당히 높았으며 평균 오염농도는 각각 3.13과 5.10 μg/kg이었다고 보고하였다(Lippolis 등, 2017). 이와 같이 생강은 국외에서 발암가능성의 아플라톡신과 오크라톡신 A에 취약한 농산물로 알려져 있으나 국내에는 관련 연구가 거의 없어 오염실태 파악이 시급하다. 따라서 본 연구에서는 국내에서 생산된 생강 및 생강가루의 곰팡이독소 오염실태를 조사하였으며, 곰팡이독소 저감을 위한 생강의 저장조건을 탐색하였다.
재료 및 방법
생강의 곰팡이독소 오염도 조사를 위해 농가에서 저장 중인 생강(2019년산) 22점과 수확기 생강(2020년산) 5점을 대표 주산지인 충남 서산시와 전북 완주군에서 수집하였다. 수집된 생강은 수돗물에 깨끗이 씻어 흙 등 이물질을 제거한 다음 얇게 절단하여 70°C 오븐에서 48시간 동안 건조하였다. 건조된 생강은 분쇄기(CMFP-40000, Hanil, Seoul, Korea)를 이용하여 균질화한 후 -20°C에 냉동 보관하면서 실험에 사용하였다. 생강 가루는 열풍건조 또는 동결건조되어 유통되고 있는 지역산 총 17점(전남, 3점; 전북, 5점; 경남, 1점; 경북, 3점; 충남, 3점; 강원, 2점)의 시료(최소 150 g 이상)를 구입하여 실험에 사용하였다.
저장 실험을 위한 생강은 2020년도에 두 지역(A, B)에서 수확한 것을 사용하였다. 생강은 지역별로 20 kg 두 마대자루씩 5°C/73%, 13°C/96%, 14°C/68% 저장조건에서 2020년 11월 16일부터 2021년 5월 18일까지 6개월간 저장하였다. 이 조건은 각각 냉장 조건(5°C/73%), 일부 농가에서 사용하는 저온창고 조건(14°C/68%), 그리고 생강의 품질 유지를 위한 권장 저장조건(13°C/96%)에 해당한다. 저장고 내의 온도와 상대습도는 한 시간 간격으로 자동 온․습도계(HOBO Pro V2 U23-002, Onset Computer Corporation, Bourne, MA, USA)를 이용하여 측정하였다. 저장기간 및 저장조건에 따른 생강의 곰팡이독소 오염 조사를 위해 저장 0, 2, 4, 6개월 후 시료를 1 kg씩 3회 채집하여 위에서 설명한 것과 같이 세척 후 건조 및 마쇄하여 냉동고(-20°C)에 보관하면서 독소 분석에 사용하였다.
실험에 사용한 데옥시니발레놀, 니발레놀, 제랄레논, 아플라톡신 B1, B2, G1, G2, 오크라톡신 A는 Biopure(Tulln, Austria)사의 제품을 구입하여 사용하였다. 아세토니트릴(acetonitrile, ACN)과 메탄올(methanol, MeOH)은 high performance liquid chromatography(HPLC)급(Fisher, Darmstadt, Germany)을 사용하였다. Phosphate buffered saline(PBS)는 Oxoid(Hampshire, UK)에서 구입하여 사용하였다. Acetic acid는 Merck(Darmstadt, Germany)의 제품을 사용하였다. 탄산수소나트륨(NaHCO3), Tween-20, trifluoroacetic acid(TFA), 염화나트륨(NaCl), 포름산은 Sigma-Aldrich Co. Ltd.(St. Louis, MO, USA)에서 구입하여 사용하였다. 3차 증류수는 Millipore (Bedford, MA, USA)의 초순수제조장치를 이용하여 18.2 MΩ 이상으로 제조하여 사용하였다.
데옥시니발레놀과 니발레놀의 전처리는 Lee 등(2020a)의 방법을 변형하여 수행하였다. 시료 5 g에 20% ACN 20 mL를 가하여 300 rpm에서 1시간 동안 진탕 추출(LSI-1005, Daihan Scientific, Seoul, Korea)하였다. 추출액은 2,898 ×g에서 10분간 원심분리하여 상층액을 얻었으며, 상층액 5 mL를 취해 1차 증류수 20 mL와 혼합하여 정제과정에 사용하였다. DON-NIV 면역친화컬럼(DON-NIVTMWB, Vicam, MA, USA)에 혼합액 25 mL를 통과시킨 후(2-3 drops/s), 1차 증류수(10 mL)로 세척하였다. 주사기를 이용하여 컬럼에 남아 있는 물을 제거한 후 MeOH 2 mL를 가하여 컬럼에 남아 있는 독소를 용출하였다. 용출액은 질소 건조(50°C)하여, 이동상 용액(1 mL, water:ACN:MeOH, 90:5:5, v/v/v)으로 재용해 한 후 0.2 μm 시린지 필터(PTFE 13 mm, RD Tech Research Develompent, Gyeongju, Korea)로 여과 후 ultra performance liquid chromatography (UPLC) 분석을 수행하였다.
제랄레논 분석은 Lee 등(2020b)의 방법을 변형하여 수행하였다. 시료 5 g에 NaCl 1 g을 첨가한 후 75% ACN 20 mL를 넣어 1시간 동안 진탕 추출하였다. 추출액은 2,898 ×g에서 10분 동안 원심분리를 통해 상층액 5 mL를 얻었으며 이를 1차 증류수 20 mL와 혼합하여 정제과정에 사용하였다. 정제용 컬럼(ZeralaTest WB)에 혼합액을 통과시킨 다음 10 mL의 증류수로 세척하였으며 MeOH 2 mL를 컬럼에 가하여 독소를 용출하였다. 용출액은 질소 건조한 후 1 mL의 이동상 용액(Water:ACN:MeOH, 43:35:22, v/v/v)으로 재용해 하였으며 0.2 μm 시린지 필터로 여과한 다음 UPLC 분석을 수행하였다.
아플라톡신의 분석은 Trucksess 등(2006)의 방법을 변형하여 수행하였다. 시료 5 g에 NaCl 1 g과 추출용액(MeOH:1% Tween-20을 함유한 PBS 용액=8:2, v/v) 20 mL를 넣고 300 rpm에서 1시간 동안 진탕 추출하였다. 추출액은 2,898 ×g에서 10분 동안 원심분리하여 얻어진 상층액 7 mL를 취해 28 mL의 PBS로 현탁 한 다음 현탁액 20 mL를 취해 정제컬럼(AflaTest WB)에 주입하였다. 정제 컬럼에 10 mL의 PBS와 증류수를 각각 흘려 불순물을 제거한 다음 MeOH 2 mL를 흘려 독소를 용출하였다. 용출액은 질소 건조(50°C) 후 TFA 0.2 mL를 넣어 암조건에서 20분 동안 반응시켰다. 반응액은 20% ACN 0.8 mL를 가해 재현탁 하였으며, 0.2 μm 시린지 필터 후 UPLC 분석을 수행하였다.
오크라톡신 A의 분석은 Truksess 등(2008)의 방법을 변형하여 수행하였다. 시료 5 g에 NaCl 1 g과 추출용액(MeOH:0.5% NaHCO3 수용액=7:3, v/v) 20 mL를 가하여 300 rpm에서 1시간 동안 추출하였다. 추출액을 2,898 ×g에서 10분 동안 원심분리한 후 상등액 7 mL를 취해 28 mL의 1% Tween-20을 함유한 PBS 용액으로 희석하였으며, 희석액 35 mL를 면역친화컬럼(OchraTest WB)에 주입하였다. 정제컬럼에 10 mM PBS 3 mL를 가하여 1차 세척한 다음, 5 mL의 물로 2차 세척하였으며, 2 mL의 MeOH을 주입하여 독소를 용출하였다. 용출액은 질소 건조(50°C) 후 1 mL의 이동상(1% acetic acid가 들어 있는 water:ACN=5:5, v/v)으로 재용해한 다음 0.2 μm 시린지 필터 후 UPLC 분석을 수행하였다.
데옥시니발레놀, 니발레놀, 제랄레논, 아플라톡신 B1, B2, G1, G2, 오크라톡신 A는 UPLC(Waters Acquity UPLC® H Class, Waters Corp., MA, USA)를 사용하여 정량 및 정성 분석되었다. 분석 컬럼은 Xselect CSH C18, 1.7 μm, 2.1×100 mm(Waters Corp., MA, USA)를 사용하였고, 유속 0.3 mL/min, 시료 주입량 10 μL, 분석 시간 10분의 등용매조건(isocratic)으로 분석하였다. 데옥시니발레놀과 니발레놀의 검출은 water:ACN:MeOH(90:5:5, v/v/v) 이동상과 흡광검출기(diode array detector) 파장 218 nm를 사용하여 분석을 수행하였다. 제랄레논 분석용 이동상은 water:ACN:MeOH(43: 35:22, v/v/v)이었고, 형광검출기(fluorescence detector) 파장 Ex=274 nm, Em=440 nm로 검출하였다. 아플라톡신 분석용 이동상은 water:ACN:MeOH(20:65:15, v/v/v)이었고, 형광검출기 파장 Ex=360 nm, Em=440 nm를 사용하여 분석을 수행하였다. 오크라톡신 A 분석을 위한 이동상은 1% acetic acid를 함유한 50% water:ACN(1:1, v/v)으로 하였으며, 형광검출기 파장 Ex=333 nm, Em=460 nm를 이용하여 분석을 수행하였다.
본 연구에 사용된 분석법은 ‘식품 등 시험법 마련 표준절차에 관한 가이드라인’에 준하여 시험법의 유효성을 검증하였다(MFDS, 2016). 직선성 확인을 위해 데옥시니발레놀과 니발레놀은 0, 50, 100, 200, 500, 1,000, 2,000 ng/mL, 제랄레논은 0, 2, 5, 10, 20, 50, 100, 200 ng/mL 농도가 되도록 검량선을 작성하였다. 아플라톡신 B1, G1은 0, 0.01 0.1, 0.2, 0.5, 1, 2, 5, 10 ng/mL 아플라톡신 B2, G2는 0, 0.025, 0.05, 0.125, 0.25, 0.5, 1.25, 2.5 ng/mL 농도가 되도록 조제하였으며, 오크라톡신 A는 0, 0.5, 1, 2, 5, 10, 20, 50 ng/mL 농도가 되도록 조제하였다. 농도별 표준물질은 각각의 피크 면적을 이용하여 검량선을 작성하였으며, 검량선의 결정계수를 구하였다. 시험법의 정확성 및 정밀성을 확인하기 위해 독소에 오염되지 않은 생강에 표준물질을 첨가한 후 분석하여 회수율 및 상대표준편차(relative standard deviation, RSD)를 산출하였다. 데옥시니발레놀과 니발레놀은 200, 500, 1000 μg/kg 수준이 되도록 첨가하였으며, 제랄레논은 50, 100, 200 μg/kg 수준으로 첨가하였다. 아플라톡신은 B1, G1은 2, 5, 10 μg/kg이 되도록 첨가하였으며 B2, G2는 0.5, 1.25, 2.5 μg/kg이 되도록 첨가하였다. 오크라톡신 A는 2, 5, 10 μg/kg이 되도록 첨가하여 회수율을 조사하였다. 회수율 실험은 3 반복을 수행하였으며, 회수율 평균과 RSD를 계산하여 시험법의 정확도 및 정밀도를 평가하였다. 검출한계는 크로마토그램 상에서 신호 대 잡음비(signal/noise ratio)를 3으로 정량한계는 검출한계의 3배 이상으로 하였다.
결과 및 고찰
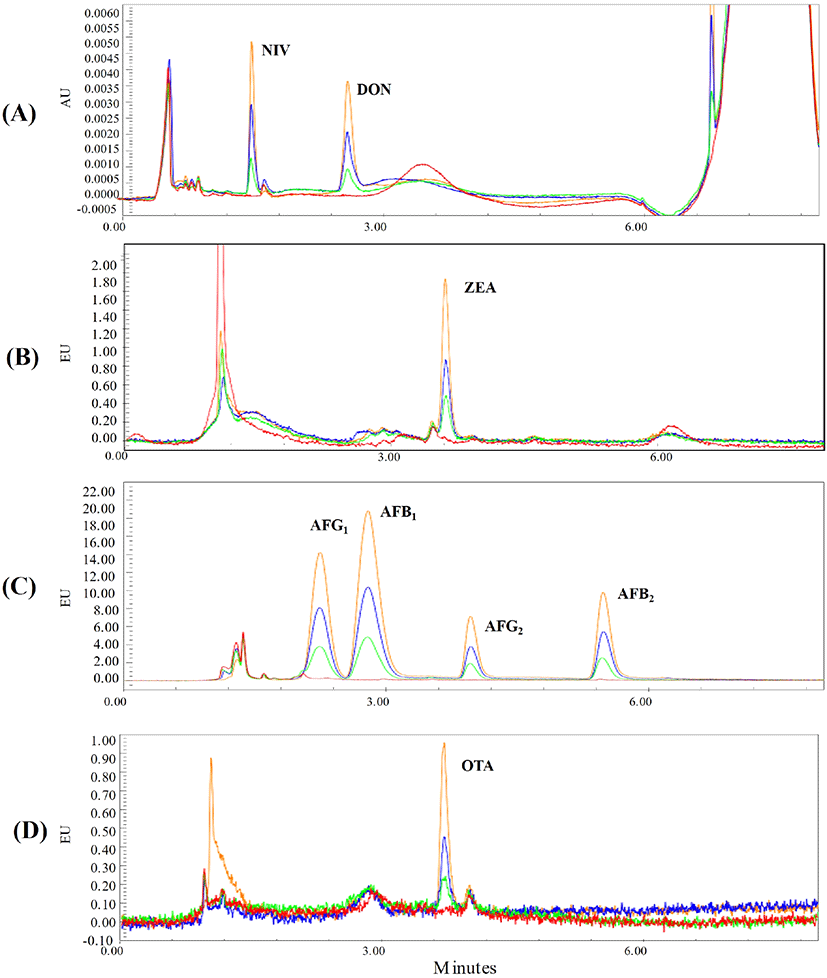
검량선의 결정계수(R2)는 0.9992 이상으로 적합한 수준이었으며(Data not shown), 회수율과 검출 및 정량한계는 Table 1에 나타내었다. 본 연구 방법은 회수율 70.9% 이상과 정밀성 15.4% 이하의 RSD를 나타내어, 식약처의 ‘식품 등 시험법 마련 표준절차에 관한 가이드라인’의 회수율 및 정밀성 유효범위를 만족하였다. 데옥시니발레놀과 니발레놀의 검출 및 정량한계는 Bryla 등(2018)이 제시한 검출한계 각각 4.8, 10.1 μg/kg와 정량한계 각각 16.8, 33.1 μg/kg보다 높았으며, 제랄레논의 검출 및 정량한계는 Ibanez-Vea 등(2011)이 보고한 0.3, 6.0 μg/kg보다 높았다. 아플라톡신의 검출 및 정량한계는 Wen 등(2013)이 보고한 검출(0.03-0.2 μg/kg) 및 정량한계(0.1-0.6 μg/kg)보다 낮았으며, 동일한 문헌에서 보고한 오크라톡신 A의 검출(0.1 μg/kg) 및 정량한계(0.9 μg/kg) 보다 높은 수준이었다. 각각의 곰팡이독소의 크로마토그램을 Fig. 1에 나타내었다.
1) DON, deoxynivalenol; NIV, nivalenol; ZEA, zearalenone; OTA, ochratoxin A; AFB1, aflatoxin B1; AFB2, aflatoxin B2; AFG1, aflatoxin G1; AFG2, aflatoxin G2.
2) DON, NIV: 200 μg/kg (low level), 500 μg/kg (medium level), 1,000 μg/kg (high level); ZEA: 50 μg/kg (low level), 100 μg/kg (medium level), 200 μg/kg (high level); OTA, AFB1, AFG1: 2 μg/kg (low level), 5 μg/kg (medium level), 10 μg/kg (high level); AFB2, AFG2: 0.5 μg/kg (low level), 1.25 μg/kg (medium level), 2.5 μg/kg (high level).
Fusarium 속은 토양에서 흔하게 서식하는 대표적인 토양 전염성 병원균으로 그 중 일부는 독소를 생성하는 곰팡이다. F. graminearum은 데옥시니발레놀을, F. asiaticum은 니발레놀을 주로 생성하며 제랄레논은 F. graminearum과 F. culmorum 종에 의해 주로 생성된다(Lee 등, 2012). 아플라톡신은 Aspergillus flavus와 A. parasiticus에 의해 주로 생성되며, 오크라톡신 A는 A. ochraceus와Penicillium verrucosum에 의해 주로 생성된다(Marin 등, 2013; Van der Merwe 등, 1965).
국내산 생강과 생강가루의 곰팡이독소 오염을 조사한 결과 오염율은 각각 37.03%와 41.17%로 유사한 수준이었다(Table 2). 생 생강은 니발레놀 오염율(37.03%) 및 오염수준(24.74-263.40 μg/kg)이 가장 높았으며, 제랄레논, 오크라톡신 A, 데옥시니발레놀, 아플라톡신이 모두 1건 이상 검출되었으나 오염수준은 낮았다. 생강에서 아플라톡신 B1의 오염수준은 0.07 μg/kg으로 우리나라의 최대허용기준치(10 μg/kg)의 0.7% 수준으로 매우 낮았다. 기준 미설정 독소인 오크라톡신 A, 데옥시니발레놀, 니발레놀, 제랄레논의 경우 곡류의 기준을 적용했을 때 기준치(오크라톡신: 5 μg/kg, 데옥시니발레놀: 1,000 μg/kg, 제랄레논: 100 μg/kg; 니발레놀은 기준이 없어 데옥시니발레놀과 동일한 1,000 μg/kg을 적용)의 6.18- 26.34%로 안전한 것으로 생각된다. 생강가루는 데옥시니발레놀(35.29%) > 니발레놀(29.41%) > 제랄레논(23.53%) 순으로 오염율이 높았으며, 아플라톡신과 오크라톡신 A는 불검출되었다. 생강가루의 데옥시니발레놀, 니발레놀, 제랄레논의 오염수준은 생 생강에 비해 높았으나 데옥시니발레놀을 제외하고 통계적으로 유의차는 없었다(Data not shown). 생강가루 조제시 품질이 좋지 않은 생강을 이용할 경우 곰팡이독소 오염수준이 높을 수 있다(Yang 등, 2019). 또한, 입자가 작고 접촉표면이 클수록 곰팡이독소 생성에 유리할 수 있기 때문에 생강보다 생강가루에서 곰팡이독소 오염수준이 높은 것으로 판단된다.
1) Mycotoxin level >LOD (DON, NIV: 17.00 μg/kg; ZEA: 3.00 μg/kg; OTA: 0.35 μg/kg; AFB1, AFG1: 0.03 μg/kg; AFB2, AFG2: 0.01 μg/kg).
국내산 농산물의 곰팡이독소 오염사례를 살펴보면 곰팡이독소 오염율과 오염수준은 품목별로 차이가 있었다. Kim 등(2013)은 국내산 곡류에서 곰팡이독소 오염을 조사한 결과, 백미와 보리에서 제랄레논의 오염율은 각각 36.2%와 34.9%이었으며, 최대오염량은 각각 6.66 μg/kg, 8.95 μg/kg이었다고 보고하였다. 또한, 백미와 보리에서 데옥시니발레놀의 오염율은 각각 6.4%, 55.8%이었으며 최대오염량은 93.10 μg/kg, 334.0 μg/kg으로 보리의 오염율과 오염수준이 상대적으로 높았다고 보고하였다. Jang 등(2008)은 두류 중 제랄레논의 오염율 및 오염수준은 각각 10.2%, 8.01-38.98 μg/kg이었다고 보고하였다. Park 등(2013)은 유통식품 151건을 조사한 결과 아플라톡신과 오크라톡신 A가 검출되었으며, 아플라톡신이 검출된 품목은 수수(0.32 μg/kg), 잣(1.80 μg/kg), 고추장(0.40-0.55 μg/kg), 땅콩버터(0.33-0.99 μg/kg), 고춧가루(0.25- 0.91 μg/kg) 등이었으며 오크라톡신 A가 검출된 품목은 건포도(0.97 μg/kg)이었다고 보고하였다. 2018년 식약처의 식품의 곰팡이독소 기준․규격 재평가 보고서에 따르면 국내 생강 및 생강가루에서 곰팡이독소는 검출되지 않았다(MFDS, 2018b). 그러나 Choi 등(2021)은 한약제로 사용되는 국내산 생강(건강) 16점에 대해 아플라톡신, 오크라톡신 A, 푸모니신, 제랄레논의 오염을 조사한 결과, 4점(25.0%)에서 제랄레논이 3.89-15.96 μg/kg 수준으로 검출되었으며 다른 독소는 검출되지 않았다고 보고하였다. 이는 본 연구 결과에서 아플라톡신과 오크라톡신 A는 거의 검출되지 않고 제랄레논은 검출된 결과와 유사하며 제랄레논의 오염율과 오염수준 또한 유사하였다.
국외 생강의 곰팡이독소 연구사례를 살펴보면 국가별로 차이를 보였다. Wen 등(2013)은 중국의 생강과 생강가루에 대해 아플라톡신과 오크라톡신 A의 오염을 조사한 결과, 생강에서는 독소가 검출되지 않았으나, 생강가루에서는 아플라톡신 B1과 G2가 정량한계 이하(B1: 0.3, G2: 0.2 μg/kg)로 검출되었다고 보고하였다. 또한, 곰팡이가 핀 생강 시료 3점에서 오크라톡신 A가 0.32-5.17 μg/kg 수준으로 검출되었으며, 생강 티백 6점 중 5점에서 아플라톡신 B1이 0.13-1.38 μg/kg 수준으로 검출되었다고 보고하였다(Wen 등, 2014). 터키에서는 생강의 아플라톡신 B1의 오염을 조사한 결과, 75%의 오염율을 나타내었으며, 오염수준은 3.8-23.1 μg/kg으로 높았다고 보고하였다(Tosun과 Arslan, 2013). Koul과 Sumbali(2008)는 인도산 생강 27점에 대해 제랄레논과 데옥시니발레놀을 조사한 결과 2점(7.4%)에서 제랄레논이 13.44-14.51 μg/kg 수준으로 검출되었으며, 데옥시니발레놀은 4점(14.8%)에서 4.85- 10.35 μg/kg 수준으로 검출되었다고 보고하였다. 국외 생강의 곰팡이독소 연구 결과를 비교했을 때 국내 생강의 아플라톡신과 오크라톡신 A의 오염수준은 외국에 비해 낮았으나, 데옥시니발레놀, 니발레놀, 제랄레논의 오염수준은 상대적으로 높은 편이었다. 국내 생강의 Fusarium 독소 오염수준이 외국보다 높은 이유에 대한 추가적인 연구가 필요할 것으로 판단된다.
시료의 곰팡이독소 중복 오염을 조사한 결과, 25.93%의 생강 시료가 두 종 이상의 곰팡이독소에 오염된 것으로 나타났다(Table 3). 특히 니발레놀과 제랄레논의 중복 오염은 중복 오염된 생강시료의 71.43%(5/7)로 대부분을 차지하였다. 생강가루의 곰팡이독소 중복 오염율은 29.41%였으며, 중복 오염된 독소의 조합으로는 데옥시니발레놀과 니발레놀 또는 데옥시니발레놀, 니발레놀, 제랄레논으로 모두 Fusarium 속 곰팡이가 생성하는 독소였다. Fusarium 독소의 경우 한 균주가 다양한 Fusarium 독소를 생성할 수 있기 때문에 중복 오염이 쉽게 발생되며(Smith 등, 2016), 독소가 중복 오염될 경우 위해도가 단일독소보다 높아질 수 있다(Speijers과 Speijers, 2004). 따라서 향후 위해성 평가를 위한 곰팡이독소 모니터링 시 중복 오염 여부를 함께 검토하는 것이 필요할 것으로 판단된다.
국내의 경우 외국과 달리 생강에서 아플라톡신과 오크라톡신 A의 오염이 거의 발생하지 않은 반면 데옥시니발레놀, 니발레놀, 제랄레논의 오염이 주로 발생하였다. 생강은 4월에 파종하여 10월 중순에서 11월 초에 수확하기 때문에 기상 조건이 Aspergillus와 Penicillium의 생장에 적합하지 않은 것으로 판단된다. 그러나 지구 온난화로 인한 연평균 기온 상승 및 잦은 강우 등으로 향후 아플라톡신과 오크라톡신 A의 오염도 발생할 수 있어 이를 대비한 선제적인 오염 모니터링이 필요할 것으로 판단된다. 생강의 국내 곰팡이독소 기준을 살펴보면 아플라톡신(B1, B2, G1 및 G2의 합)에 대해 15.0 μg/kg 기준이 설정되어 있으며(B1은 10.0 μg/kg 이하) 다른 독소에 대해서 기준이 설정되어 있지 않다(MFDS, 2018a). 유럽의 경우 생강은 아플라톡신 B1에 대해 5 μg/kg, 아플라톡신 총합에 대해 10 μg/kg, 그리고 오크라톡신 A에 대해 15 μg/kg의 기준이 설정되어 있다(EC, 2006). 생강은 본 연구에서와 같이 우리나라의 기후 및 생강의 재배 특성상 Fusarium 속 균에 의한 곰팡이독소가 주로 발생할 수 있기 때문에 Fusarium 독소를 중심으로 오염 모니터링을 통한 위해 평가와 관리기준 설정 검토 및 저감화 연구가 진행되어야 할 것으로 생각된다.
Table 4는 생산지역이 서로 다른 생강 시료(A, B)를 세 가지 저장조건에서 6개월 동안 저장하면서 곰팡이독소 오염을 조사한 결과이다. 저장조건에 따른 데옥시니발레놀과 제랄레논의 오염수준은 A와 B시료 모두 14°C/68% 조건에서 가장 높았다. 14°C/68% 조건에서 저장한 B시료의 데옥시니발레놀 오염농도는 저장 2개월 후 최대 955.23 μg/kg으로 가장 높았으며, 제랄레논의 오염농도는 저장 4개월 후 342.74 μg/kg으로 가장 높게 나타났다. 니발레놀은 5°C/73% 조건에서 4개월 동안 저장한 A 시료에서 니발레놀 오염수준은 701.58 μg/kg으로 가장 높았으며, 13°C/96% 조건에서 오염수준이 가장 낮았다. 한편, 아플라톡신과 오크라톡신 A는 저장기간(6개월) 동안 독소가 불검출되었다(Data not shown).
재배기 및 수확기에 감염된 독성곰팡이는 저장 중에도 곰팡이독소를 생성할 수 있다(Marin 등, 2013; Milicevie 등, 2010). 생강은 수확 후 세척 과정 없이 토굴 또는 저온창고에 저장된다. 즉, 흙이 묻어 있는 상태로 저장되기 때문에 미생물이 침입하기 쉬워 환경이 맞지 않으면 저장 중 부패가 쉽게 일어날 수 있다. 생강 저장시 10°C 이하의 온도에서는 저온장해가 발생하여 부패가 촉진되고, 18°C 이상에서는 발아 및 위조현상으로 인해 상품성을 잃을 수 있으며, 90% 이하의 상대습도에서는 곰팡이에 의한 부패율이 늘어난다고 알려져 있다(RDA, 2005). Jeong 등(1998)은 7, 12, 20°C의 온도와 75%, 85%, 95%의 상대습도에서 각각 저장하면서 생강의 품질을 비교한 결과, 7°C와 20°C에서 습도 조건별로 저장한 생강에서는 각각 저온장해와 발아 현상으로 인해 품질저하가 빠르게 진행되었고, 12°C/75%인 경우에는 7°C의 저장 생강과 유사할 정도로 품질변화가 크게 나타난 반면, 12°C/95%에 저장한 생강에서는 중량감소율, 부패율, 발아율 등의 모든 품질적 측면에서 가장 우수한 결과를 나타내었다고 보고하였다. 이는 본 연구에서 13°C/96%에서 저장한 생강이 다른 조건에 비해 데옥시니발레놀과 니발레놀의 오염이 상당히 낮은 결과와 매우 유사하였다. 이 조건은 생강의 부패율과 상품성을 고려한 권장 저장조건이므로 생강을 저장할 때는 13°C/96% 전후의 온․습도에서 보관하는 것이 곰팡이독소를 예방하고 생강의 부패율을 감소시키는 데 도움이 될 것으로 판단된다. 현장에서 사용되는 저온창고 조건은 온도는 적합하나 습도가 70% 이하 수준으로 낮기 때문에 습도를 96% 수준으로 높여서 저장하는 것이 필요할 것으로 판단된다.
Versonder 등(1982)은 옥수수에서 F. graminearum과 F. roseum의 데옥시니발레놀 생성을 위한 최적온도는 각각 29-30°C, 25-26°C였으며, 최저온도는 약 11°C일 것으로 예측하였다. Megan과 Lacey(1984)는 F. culmorum, F. poae, F. avenaceum 종의 최적 생장온도는 20-25°C였고, 5-10°C와 35°C에서는 생장이 감소했다고 하였으며, 최적온도에서 최적수분활성도는 0.98-0.995, 최소수분활성도는 0.90-0.91이었다고 보고하였다. Wawrzyniak 등(2013)은 보리에서 곰팡이의 생장은 저장온도보다 수분활성도가 더 큰 영향을 준다고 보고하였다. 그러나 Hope 등(2005)은 F. culmorum과 F. graminearum를 인공 접종한 밀에서는 온도와 수분활성도가 높을수록 곰팡이의 생장이 증가했다고 보고하였다. Zhang 등(2019)은 밀을 15°C/50%, 20°C/65%, 25°C/75%, 30°C/80% 조건에서 보관하면서 Fusarium 독소의 오염을 조사한 결과, 저장 6개월 후 25°C/75% 조건에서 데옥시니발레놀의 오염 수준은 1,103 μg/kg으로 가장 높았다고 보고하였다. 또한, 저장온도와 상대습도가 낮았을 때 Fusarium 독소 또한 오염수준이 낮았다고 보고하였다. 이러한 결과는 본 연구에서 상대습도가 70% 이하였던 두 조건보다 96%였던 조건에서 생강의 곰팡이독소 오염이 낮았던 결과와 달랐다. 생강의 수분함유량은 83%로 매우 높으며 곡류의 수분함유량은 14-23%로 낮은 편에 속한다(RDA, 2005; RDA, 2018a; RDA, 2018b). 따라서 곰팡이독소 저감 저장조건은 작물의 수분함유량에 따라 달라질 수 있을 것으로 판단된다. 고온성 작물인 생강은 저온에서 장해를 입어 곰팡이 침입이 증가하여 독소가 많이 발생하며 비교적 높은 저장온도인 13°C와 수분 손실이 적은 96% 상대습도에서 품질이 유지되며 곰팡이 발생이 적어 독소도 적게 생성되는 것으로 판단된다.
본 연구 결과를 종합하면 국내 생강의 곰팡이독소 오염실태 모니터링 결과, 외국과 달리 아플라톡신과 오크라톡신 A의 오염은 거의 없었으나 Fusarium 속 곰팡이에 의한 독소인 데옥시니발레놀, 니발레놀, 제랄레논의 오염이 주로 발생하였고 독소의 중복 오염이 관찰되었다. 하지만 생강 및 생강가루의 곰팡이독소 오염수준은 곡류의 곰팡이독소 최대허용량과 비교했을 때 안전한 수준이었다. 또한, 생강의 곰팡이독소 저감화 저장조건을 조사한 결과, 13°C/96% 조건에서 데옥시니발레놀과 니발레놀의 오염이 가장 낮았다. 따라서 생강의 곰팡이독소 예방을 위해 이 조건으로 저장한다면 연간 저장하면서 판매되는 생강의 곰팡이독소 오염을 보다 낮출 수 있을 것으로 생각된다.










