서 론
들깨(Perilla frutescens Britton var. japonica Hara)는 꿀풀과(Labiatae)에 속하는 일년생 초본식물로 한국, 중국, 인도, 일본 등지에 분포하고 있으며, 지질함량이 약 31-44% 함유하고 있어 유지종자로 널리 이용되고 있다(Ahn 등, 1991; Aladedunye 등, 2009). 들깨를 압착하여 얻은 들기름에는 n-3계 고도불포화지방산인 알파리놀렌산(α-linolenic acid, ω3)이 전체 지방산의 60% 이상을 차지하고 있다(Hwang과 Choe, 2011; Song과 Park, 1994). 특히, 에이코사펜타엔산(EPA), 도코헥사엔산(DHA)은 리놀렌산 유래로 뇌, 신경, 망막 등의 구성성분이라는 것이 밝혀짐에 따라 이들 조직의 기능에 필수적인 것으로 보고되고 있으며, 체내에서 합성되지 않는 필수지방산으로 암세포의 증식 억제 효과(Hashimoto 등, 1994), 알레르기 체질 개선(Gatchalian 등, 1994), 혈압 저하 및 혈전증 개선, 망막 및 두뇌 발달과 관련이 있다(Nagatsu 등, 1995). 그러나, 주요 지방산인 알파리놀렌산은 화학구조상 탄소 체인이 2-3개의 이중결합을 가진 고도불포화지방산으로 가공․저장․유통 중에 온도, 빛, 산소, 금속, 수분, 효소 등 다양한 환경 요인들에 의해 쉽게 산패가 일어나는 문제점을 가지고 있다(Belitz, 1999; Channon과 Trout, 2002).
식품의 품질을 저하시키는 주요 요인 중 하나인 산화반응은 주로 지질성분의 산화에서 비롯된다. 지질이 산화되면 자유라디칼(free radical) 연쇄반응에 의해 과산화물과 유리 지방산이 생성되어 산패(rancidity)가 유발된다. 그러나 이 과정에서 산화방지제(antioxidant)를 첨가하게 되면 산화과정 동안 생성된 자유라디칼을 안정화시켜 과산화물 생성 억제를 통해 산패를 방지하는 자유라디칼 억제제 역할을 한다(Choe와 Min, 2005; Choe와 Min, 2007; Min, 1997; Warner, 1997), 일반적으로 유지의 보존성을 연장시키기 위한 수단으로 BHA(butylated hydroxyanisole), BHT(butylated hydroxytoluene), TBHQ(tert-butylhydroquinine) 등 합성항산화제가 사용되어지고 있으나, 최근 합성항산화제의 독성으로 인한 발암물질 유발 등 인체 내 부정적인 영향을 미친다는 연구 결과가 보고되면서 이를 대체하기 위한 천연 항산화제의 발굴 및 연구가 요구되고 있다(Branranen, 1975; Koleva와 van Beek, 2002; Ku와 Kang, 2010; Lorenzo 등, 2018; Yagi, 1987). 천연항산화제가 생체 내에서도 여러 가지 생리적 장애를 억제하는 데 관여한다고 보고되고 있으며(Becker 등, 2004; Cheo와 Min, 2006; Giese, 1996; Kim 등, 2014; Ku와 Kang, 2010), 천연항산화제에 대한 연구로는 대표적으로 caraway(Yu 등, 2005), cumin(Lee 등, 2019), rosemary(Nieto 등, 2018), thyme(Martins 등, 2015), clove(Gulcin 등, 2012) 등이 보고되었으며, 천연항산화제 소재로는 주로 겨자(Rababah 등, 2004), 생강(Chandran 등, 2017), 오리가노(Rojas와 Brewer, 2007) 등 향신료 소재, 인삼(Lee 등, 2006), 왕겨(Ramarathanan 등, 1988), 갓(Kim, 2012), 더덕(Jeon 등, 2013), 칡뿌리(Sultanna 등, 2009)와 같은 각종 식용식물, 해초류(Hermund 등, 2019), 붉나무(Chang 등, 1992)와 같은 한약소재, 동물 근육조직의 carnosine 함유 추출물(O’Neill 등, 1999) 등이 보고되었다.
고추(Capsicum annum L.)는 열대성 식물로 가지과(Solanaceae)에 속하는 한해살이풀로 알려져 있으며(Byyun 등, 2016), 고추추출물의 주요 생리활성은 항당뇨, 항암, 항산화 및 항염증 등의 효과가 있는 것으로 보고되었다(Chen 등, 2012; Kim 등, 2010; Surh 등, 2000; Yoon 등, 2012). 홍고추의 붉은 색소는 carotenoid계 물질로 주로 capsanthin과 capsorubin라고 알려져 있으며(Weissenberg 등, 1997; Uquiche 등, 2004), ascorbic acid, carotenoid, quercetin, kaempferol, luteolin, capsaicinoid와 같은 phenolic 화합물을 다량 함유하고 있어 높은 항산화 활성을 가진다고 보고되었다(Howard 등, 2000; Lee 등, 1995; Miean과 Mohamed, 2001; Song 등, 2010). 솔잎(pine needle)은 소나무(Pinus densiflora S.)의 잎으로 주요생리활성은 동맥경화증, 고혈압, 당뇨병, 신경통 등의 노화 관련 질환예방과 성인병 예방에 도움을 주고, 치료에도 효과가 있다고 보고되었다(Choi, 2009). 주된 물질은 chlorophyll, carotene, terpenoid, quercetin, kaempferol 등의 플라보노이드류, tannin, 알칼로이드 화합물, α-oniene, β-pinene, xamphene 등 정유성분과 다량의 페놀 화합물이 알려져 있다(Lim 등, 2002). 고추와 솔잎은 우수한 천연항산화제 소재임에도 불구하고(Park 등, 2019), 현재까지 고추와 솔잎에 대한 연구는 주로 건조를 통한 품질특성 분석(Kim 등, 2018; Nam과 Lee, 2020), 항미생물 활성(Hung 등, 2018; Kuk 등, 1997), 용매를 달리하여 추출한 추출물의 항산화활성 비교(Kang 등, 1996; Kim 등, 2021), 동물실험을 통한 건강기능적 효과 연구(Song 등, 2011; Yoon 등, 2010) 등 제한적인 실정이다.
이에 본 연구에서는 영양학적, 기능학적으로 우수한 들깨를 저온 압착공정을 이용하여 들기름을 제조하고, 홍고추 또는 솔잎로부터 초임계이산화탄소 추출공정을 통해 천연항산화제 추출물을 제조하여 들기름에 첨가한 후 가속실험을 통해 이화학적 특성 및 저장기간에 따른 산화안정성을 분석하여 천연 지용성 항산화 물질에 관한 기초 연구 자료를 얻고자 하였다.
재료 및 방법
본 실험에서 사용한 들깨는 다유 품종으로 충북농업기술원(Cheongju, Korea)에서 수확한 것을 제공받아 세척 후 들깨의 수분함량이 2%에 도달할 때까지 25°C에서 냉풍건조를 실시하였다(Kim 등, 2018). 들깨의 착유는 들깨를 40°C 이하의 온도에서 착유하여 갈색병에 회수하고, 질소(N2) 치환한 후 4°C에 보관하여 시료로 사용하였다. 고추(Capsicum annuum L.)는 진주시에서 재배된 녹광 품종의 홍고추를 NH마켓(Nonghyup Co., Ltd., Seoul, Korea)에서 구입하여 수세한 후 씨를 제거하고, 과육부분은 동결건조가 용이하도록 4-5등분하여 동결건조하였다. 솔잎은 문경시에서 적송(Korean red pine tree)으로부터 채취하여 ㈜이젠하우스(Ezenhouse Co., Ltd., Moongyeong, Korea)에서 건조분말가공 및 제조한 것을 구입하여 사용하였다. 모든 시료는 초임계이산화탄소 추출 전 표준체 No.30(체눈크기: 0.6 mm)을 통과하고 No.50(체눈크기: 0.3 mm)에 걸리는 것을 취하여 −80°C의 암소에 저장하면서 추출용 시료로 사용하였다.
천연 지용성 항산화물질을 추출하기 위하여 초임계이산화탄소(SC-CO2) 추출장치(SCE-05, ILSHIN AUTOCLAVE Co., Ltd, Daejeon, Korea)를 사용하였다. 이산화탄소는 순도 99.99%를 사용하였다. 추출장치는 추출조, 분리조, 가압펌프, 이산화탄소 저장탱크로 구성되어 있다. 먼저, 추출조의 뚜껑을 열고 동결건조 시료 500 g을 주입하였다. 이산화탄소는 실린더(CO2 gas container)로부터 check valve를 거쳐 고압 피스톤펌프(HP pump)에 의해 가압되었다. 이때 이산화탄소 주입부의 공동화 현상을 방지하기 위하여 냉각조(cooler)를 설치하여 이산화탄소의 기화를 방지하였다. 가압된 이산화탄소는 역압 조절기(BPR)에 의하여 압력이 조절되었고, 압력계(pressure guage)에 의해 압력이 측정되었으며, 추출조로 이송되었다. 추출조의 내용적은 2 L이고, 온도는 비례형 온도조절기에 의하여 조절되었으며, 열전쌍온도계(TC)에 의하여 측정되었다. 각 시료의 추출조건에 따라 추출조를 통해 추출물을 용해한 초임계 이산화탄소는 micro-metering valve를 통해 분리조(separator 1, 2)에서 기체 이산화탄소와 추출물로 분리되었다. 각 시료의 추출조건은 다음과 같다. 고추동결건조 분말은 온도 60°C, 35 MPa에서 2시간 추출하였고(Kwon 등, 2011), 솔잎동결건조분말은 40°C, 40 Mpa에서 2시간 추출하여 회수하였다(Woo 등, 1999). 각 추출물은 −80°C에서 냉동 보관하면서 실험에 사용하였다.
각각의 초임계이산화탄소 식물소재 추출물을 0.1% 첨가한 들기름을 50 mL 시료병에 일정량 넣고, 건식 오븐(JS RESEARCH, JSOF-150, Gongju, Korea)에서 24시간 동안 65°C에서 열산화를 유도하였다. 시료는 0, 3, 6, 12, 24시간 간격으로 채취하고, 15분간 상온의 데시게이터 안에서 방냉 후 분석을 실시하였다(Lee 등, 2020).
가열산화에 따른 점도의 변화를 살펴보기 위하여 시료 30 mL를 튜브에 담고, 25°C에서 Brookfield viscometer(DV Ⅱ+, Brookfield engineering labs, MA, USA)를 사용하였으며, SC4-34 spindle을 이용하였고, spindle speed는 10 rpm, spindle increment는 10 rpm으로 설정하여 상대점도를 측정하였다.
초임계 이산화탄소 추출물이 들기름의 산화안정성에 미치는 영향을 조사하기 위하여 AOCS법(AOAS, 1990)에 의해 산가 및 과산화물가를 측정하였다. 산가는 시료 5 g에 ehthanol: ether를 1:1(v/v) 혼합한 용액 30 mL를 넣어 용해시킨 후, 지시약으로 1% phenolpthalein(100 μL)를 가하여 0.1 N potassium hydroxide(KOH)/ethanol 용액으로 적정하였다. 지시약의 선홍색이 20-30초간 지속할 때를 종말점으로 적정하여 소비된 0.1 N KOH 양으로부터 산가를 계산하였다.
과산화물가는 시료 1 g에 acetic acid:chloroform을 3:2(v/v) 용액 25 mL를 넣어 용해시킨 후, potassium iodide(KI) 용액 1mL를 넣어 1분간 진탕시킨 다음, 1% 전분 용액을 지시약으로 1 mL를 가한 후 0.01 N sodium thiosulfate(Na2S2O3) 용액을 이용하여 반응액이 무색이 될 때를 종말점으로 과산화물가를 측정하였다.
V1: 본 시험의 0.1 N KOH 용액의 적정소비량(mL)
V0: 공시험의 0.1 N KOH 용액의 적정소비량(mL)
F: 0.1 N KOH 용액의 역가
S: 시료채취량(g)
V3: 본 시험의 0.1 N Na2S2O3 용액의 적정소비량(mL)
V2: 공시험의 0.1 N Na2S2O3 용액의 적정소비량(mL)
F: 0.1 N Na2S2O3 용액의 역가
S: 시료채취량(g)
Lee 등(2007)의 방법 시료 50 mg을 0.10 mM DPPH(95% isooctane) 5 mL에 첨가하여 암실에서 30분간 정치시킨 후, UV/VIS-spectrophotometer(UV-1800, Shimadzu Corporation, Kyoto, Japan)로 517 nm에서 흡광도를 측정하였다. DPPH 시료 첨가구와 시료 무첨가구의 흡광도를 이용하여 백분율로 나타내었다.
p-AV는 AOCS법에 의해 측정하였다(AOCS, 1990). 시료 100 mg을 25 mL의 isooctane에 정용하고 UV/VIS-spectrophotometer로 350 nm에서 흡광도를 측정하였다. 이 용액 2.5 mL에 0.25%(w/v) p-anisidine용액 0.5 mL를 혼합하고 15분간 반응시킨 후, 동일 파장에서 흡광도를 측정하고 다음 식에 의해 p-AV를 계산하였다.
As: 아니시딘 시약과 반응한 후의 시료 용액의 흡광도
Ab: 아니시딘 시약과 반응하기 전의 시료 용액의 흡광도
W: 시료 무게(g)
유지시료의 지방산 분석을 위해 Lee 등(2020)의 방법을 사용하였다. 시료 50 mg에 0.5 M KOH/MeOH 9 mL를 혼합하여 90°C 항온수조에서 15분간 추출한 지방산을 methylation 시키기 위하여 methanol에 녹인 boron trifluoride(BF3)를 1 mL 첨가하여 같은 온도에서 2분간 반응시켰다. 냉각 후, 반응액에 포화 NaCl 용액 2.5 mL와 내부표준물질인 5α-cholestane(Sigma-Aldrich, St. Louis, MO, US)을 함유하고 있는 hexane 2 mL를 첨가하였다. 원심분리 후, 분리한 500 μL bis(trimethylsilyl) trifluoroacetamide(BSTFA)을 첨가한 후 70°C에서 20 min 반응시켜 지방산을 유도체시켰다. 유도체된 시료는 DB-5 capillary column(30 m×0.25 mm, 0.52 μm, Agilent J&W, Santa Clara, CA, USA)이 장착된 GC(GC-2010 plus, Shimadzu, Tokyo, Japan)를 이용하여 분석하였다. 이동상으로 헬륨가스를 사용하였으며, 유속은 분당 1 mL, Injection 온도는 200°C로 설정하였다. Oven 온도는 70°C에서 2분간 유지한 후 320°C까지 분당 10°C 간격으로 올린 후 320°C에서 5분간 유지하였다. GC 칼럼을 통해 분리되어 나온 지방산들은 전자 이온화 모드(70 ev)의 질량분석기(GC/MS-TQ 8030, Shiadzu, Tokyo, Japan)로 검출되었다. 질량분석기의 ion source 및 interface 온도는 각각 230°C와 280°C로 설정하였으며, MS 스펙트럼은 m/z 45에서 800까지의 전체 스캔 모드에서 0.3 s의 scan event 시간과 3333 u/s의 스캔 속도로 모니터링되었다.
결과 및 고찰
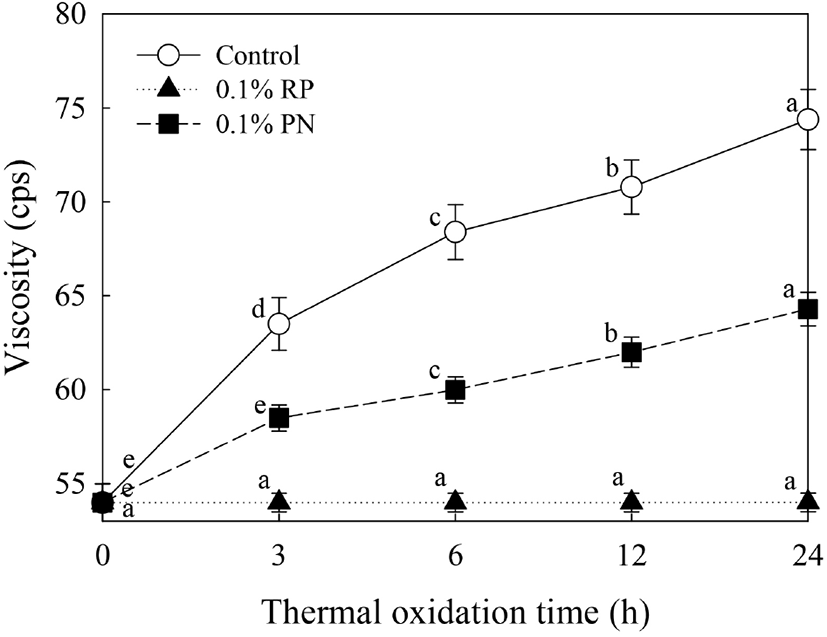
홍고추 또는 솔잎의 초임계 이산화탄소 추출물 첨가에 따른 들기름의 점도를 측정한 결과는 Fig. 1과 같다. 0.1% 홍고추 초임계이산화탄소 추출물 첨가구는 가열 24시간까지 53.98-54.00 cps로 유의적으로 차이가 없는 것으로 나타났다. 반면에, 0.1% 솔잎 초임계 이산화탄소 추출물 첨가구는 53.98-64.29 cps로 가열산화시간이 증가함에 따라 유의적으로 점도가 증가하는 것으로 나타났다(p<0.05). 대조구의 경우, 53.98-74.38 cps로 가열산화 시간이 증가함에 따라 점도값이 급격히 증가하는 것으로 나타났다. 따라서, 초임계이산화탄소 추출물 첨가구에서 가열산화가 진행됨에 따라 점도가 억제되는 것을 확인할 수 있었다. Sharoba 등(2012)은 가열산화에 따른 식용유의 물리화학적 특성변화와 상관관계 조사에서 가열시간이 경과함에 따라 유지의 점도가 증가하였으며, 가열온도가 높을수록 점도 역시 높아진다고 보고하였다. Chammen 등(2015)은 가열유지의 저장조건에 따른 항산화제의 항산화 효과 조사에서 α-tocopherol 처리구가 저장 1-3주차까지 점도 상승이 억제되었다고 보고하였다. 점도는 고분자중합물의 함량과 관련이 있으며, 일반적으로 식용유의 점도는 산화가 진행될수록 증가하고, 점도의 증가는 이중결합의 공액화, cis-형의 trans-형으로의 이성화, 고온에서의 급격한 가열중합반응에 의한 중합체의 형성 등에 기인한다고 보고하였다(Perkins, 1967).
홍고추 또는 솔잎 초임계이산화탄소 추출물 첨가가 들기름의 산가에 미치는 영향을 Fig. 2(A)에 나타내었다. 대조구의 경우, 0.44-3.00 mg KOH/g으로 가열산화가 진행됨에 따라 산값이 급격히 증가하는 것으로 나타났다. 0.1% 홍고추 추출물 첨가구의 경우 0.44-0.44 mg KOH/g 으로 차이가 없었으며, 0.1% 솔잎 추출물 첨가구의 경우 0.44-1.14 mg KOH/g으로 유의적으로 증가하는 것으로 나타났다(p<0.05). 홍고추 또는 솔잎 초임계이산화탄소 추출물 첨가가 들기름의 산가를 억제시키는 것으로 나타났다. 산가는 glyceride에 ester가 결합한 지방산의 분해 정도를 나타내는 것으로 분해 자체가 산패를 뜻함과 동시에 분해됨으로써 자동산화 등 2차적인 산화가 일어남으로 유지의 산도를 측정하는 기준으로 알려져 있다(Yoon 등, 1988). 산가 상승에 영향을 주는 요인으로는 유지의 수분함량, 금속류의 존재 유무, 광선의 조사 유무, 산소와의 접촉, 가열온도 등이 있으며(Jacobson, 1967), 이러한 산가를 측정함으로써 유지의 산패 또는 가열분해 중에 식용유지의 향미에 직접적인 영향, 자동산화의 촉진, 발연점 저하 등의 부수적인 품질저하를 일으키는 유리지방산의 함량 증가를 추적 가능하게 한다(Naz 등, 2004).
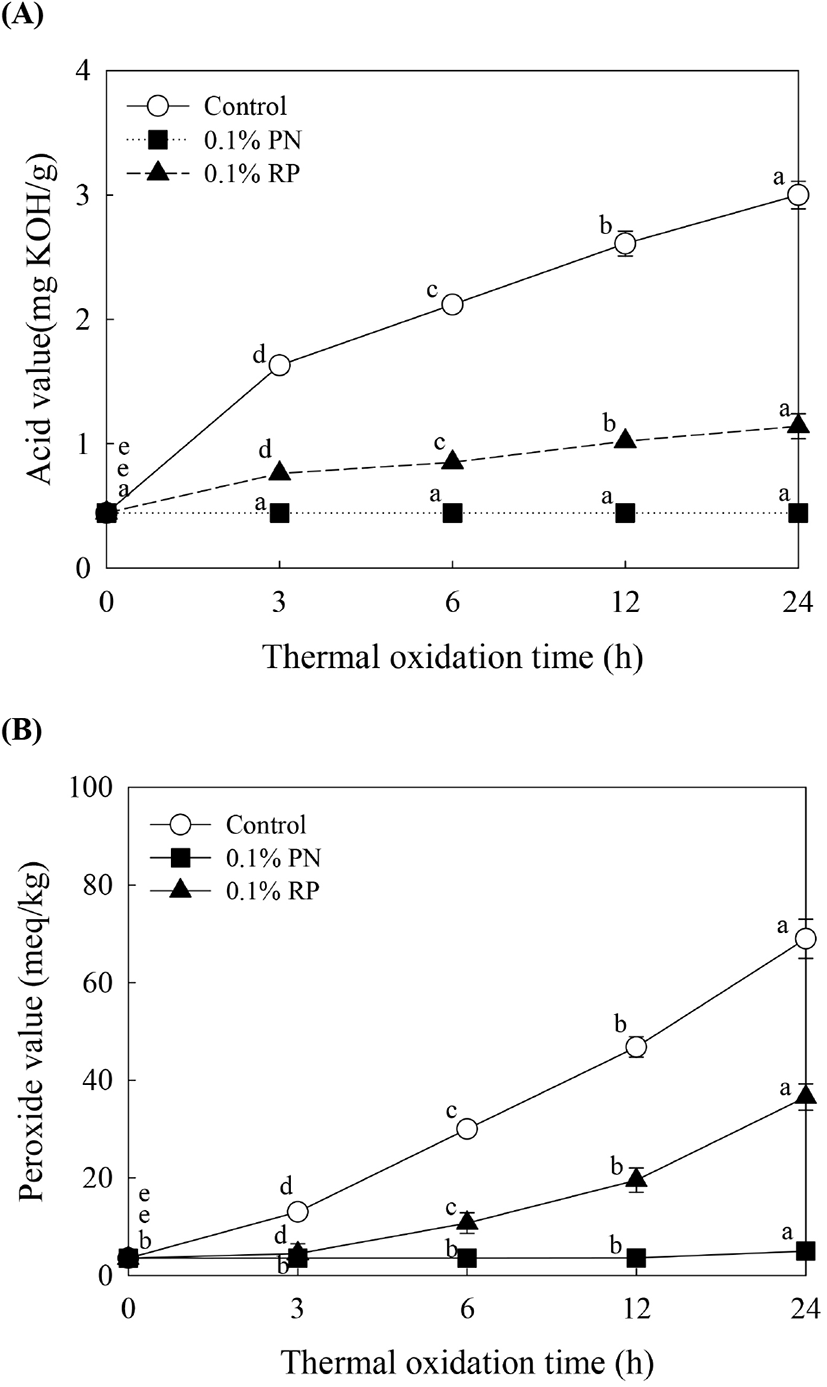
홍고추 또는 솔잎 초임계이산화탄소 추출물 첨가가 들기름의 과산화물가에 미치는 영향을 Fig. 2(B)에 나타내었다. 대조구의 경우, 3.53-69 meq/kg으로 가열산화가 진행됨에 따라 과산화물가가 급격하게 증가하였다. 반면에 초임계이산화탄소추출물 첨가구에서는 과산화물가가 억제되는 것으로 나타났다. 즉, 0.1% 홍고추 추출물 첨가구의 경우 3.53-5.00 meq/kg, 0.1% 솔잎 추출물 첨가구의 경우 3.53-36.54 meq/kg으로 가열산화가 진행됨에 따라 과산화물가가 유의적으로 증가하는 것으로 나타났다(p<0.05). 과산화물가는 유지의 초기 자동산화 정도를 나타내는 지표로서 유지에 함유되어 있는 1차 산화생성물인 지방 하이드로과산화물을 측정하는 것으로 유지의 초기 산패도 및 유도기간을 측정하는 데 사용된다(Jang 등, 2020). Cho 등(2009)은 항산화활성이 낮은 들기름의 경우 과산화물가가 급격하게 증가했다고 보고하였으며, O’Braien(2004)은 항산화제성분은 유지와의 상호작용에 의해 산화안정성을 증가시키는 것으로 보고하였다.
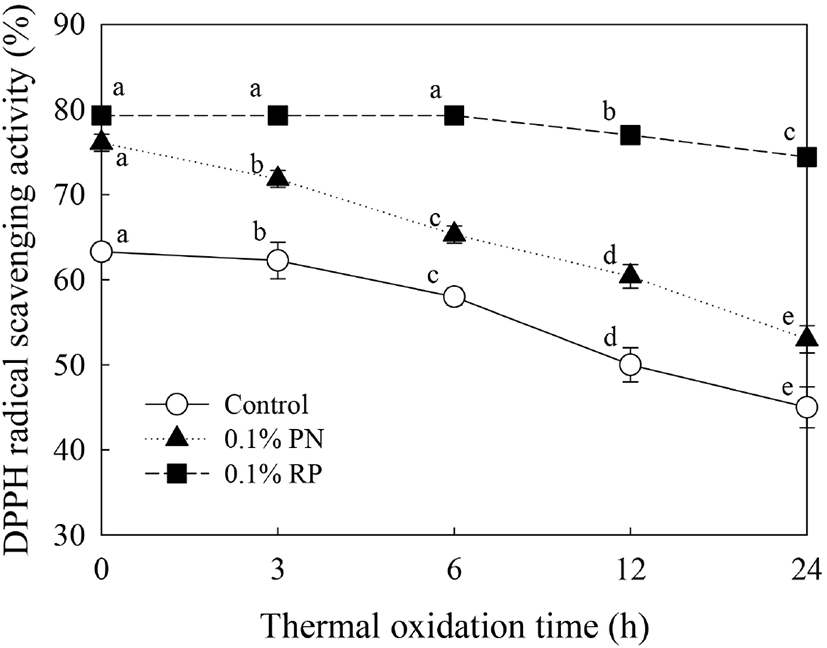
홍고추 또는 솔잎 초임계이산화탄소 추출물 첨가가 들기름의 항산화활성에 미치는 영향을 Fig. 3에 나타내었다. 안정한 라디칼인 DPPH는 산화방지물질로부터 전자 혹은 수소를 제공 받으면 비라디컬로 전환되면서 흡광도가 변화하며, 이 원리로 DPPH법은 천연물의 수용성 혹은 유기용매 추출물의 항산화 활성측정법으로 널리 사용되고 있다. 하지만, DPPH 라디칼은 전자 혹은 수소뿐 아니라, 유지에서 유래된 산화라디컬에 의해서도 비라디컬 형태로 전환될 수 있어, 이 방법으로 유지로부터 생성되는 유지 산화 라디컬을 DPPH 흡광도 변화를 활용하여 직접적으로 측정하여 유지의 산화안정성을 예측하는 데 이용되어진다(Lee 등, 2007). 초기 DPPH 라디컬 소거능을 측정한 결과, 대조구의 경우 63.30% 수준으로 가장 낮은 소거능을 가지는 것으로 나타났다. 반면에 0.1% 홍고추 및 0.1% 솔잎 초임계이산화탄소 추출물 첨가구는 각각 79.32%, 76.11% 수준의 높은 소거능을 가지는 것으로 나타났다(p<0.05). 가열산화시간에 따른 항산화 활성을 분석한 결과, 대조구의 경우 63.30-45.00% 수준으로 감소하였고, 홍고추 추출물 첨가구는 79.32-74.44% 수준이었으며, 솔잎 추출물 첨가구의 DPPH 라디컬 소거능은 76.11-53.00% 수준으로 유의적으로 감소하는 것으로 나타났다(p<0.05). 산패가 진행되지 않은 정제된 식용유 및 lard는 DPPH의 흡광도를 크게 감소시킬 수 없으나, 전자 혹은 수소 제공물질 같은 산화방지물질이 존재 시 흡광도를 감소시키고, 초기시료에 존재하는 전자 혹은 수소공여능을 갖는 산화방지물질의 농도, 산화방지물질의 소진시점 및 소진속도는 열 산화된 유지로부터 발생하는 유지라디컬 생성과 직접적인 관련이 있는 것으로 열 산화가 진행되면, 산화된 유지로부터 라디칼이 발생하게 되고 산화방지물질은 산화유지의 라디컬 생성을 억제하기 위해 소모된다(Lee 등, 2007). Maqsood 등(2017)은 다양한 천연소재로부터 추출한 천연항산화제는 aromatic ring, phenolic ring에 의해 산화방지효과와 더불어 유통기한을 연장하는 데 기여하고, 식용유지의 열 산화 처리된 시료에서 DPPH 라디컬 소거능이 감소하는 주요 원인으로는 열 산화에 의해 감소된 산화방지물질에 기인한 것으로 열 산화가 진행되면 산화된 유지로부터 라디컬이 발생하게 되며, 산화방지물질이 산화유지의 라디컬 생성을 억제하기 위해 소모되기 때문이라고 보고하였다.
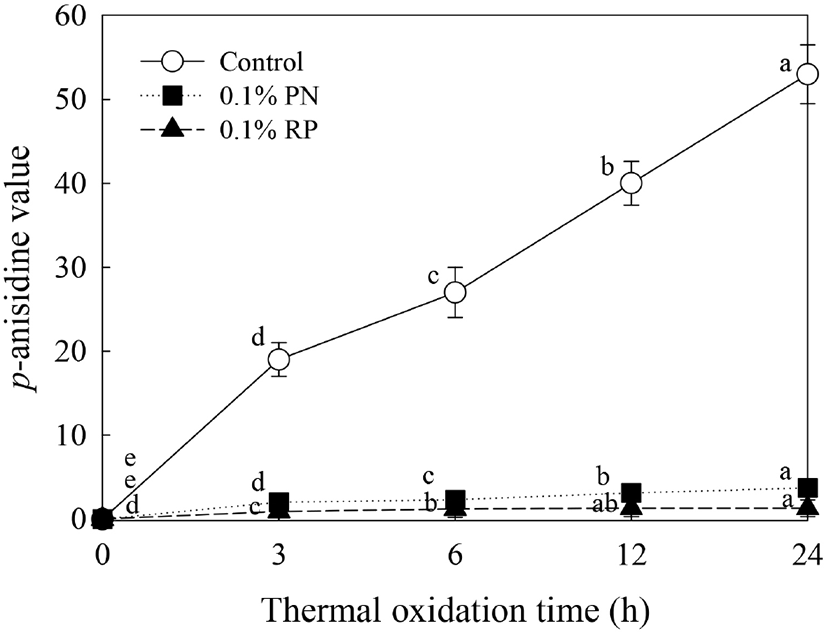
홍고추 또는 솔잎 초임계이산화탄소 추출물 첨가가 들기름의 p-anisidine가에 미치는 영향을 Fig. 4에 나타내었다. 24시간 가열산화에 의해 대조구의 경우 53.00 AnV로 급격히 증가하는 것으로 나타났다(p<0.05). 반면에 0.1% 홍고추 또는 솔잎 추출물의 첨가구의 경우 각각 1.30 AnV, 3.70 AnV로 나타났다(p<0.05). 초임계이산화탄소 추출물 첨가에 의해 들기름의 p-Anisidine가가 억제되는 것을 확인할 수 있었다. p-Anisidine가는 2차 산화생성물인 alkenal류를 측정한 것으로(Min, 1998), 상업적으로 이용되어지는 식용유지의 경우 10 AnV 이하로 규정되어 있다(Multari 등, 2019). Gao 등(2016)은 높은 파라아니시딘가는 산패도와 연관성을 가지며, 유지의 불포화도, 추출과정에서의 산소와의 접촉, 저장․유통 중의 미흡함으로 인하여 발생될 수 있다고 보고하였다.
홍고추 또는 솔잎 초임계이산화탄소 추출물 첨가가 들기름의 지방산조성에 미치는 영향을 Table 1에 나타내었다. 지방산 조성 분석결과, palmitic acid, stearic acid, oleic acid, linoleic acid, linolenic acid가 동정되었고, Gu 등(2019)이 보고한 들기름의 주요 지방산 분포와 유사한 결과를 나타내었다. 들기름의 가장 중요한 지방산인 linolenic acid가 약 60%, oleic acid 약 16%, linoleic acid 약 13%로 나타나 linolenic acid가 주된 지방산으로 나타났다. 0.1% 홍고추 추출물 첨가구의 경우 palmitic acid, stearic acid, oleic acid, linolenic acid 지방산의 경우 유의적으로 차이가 없는 것으로 나타났으며, linoleic acid의 경우 약간 감소하는 것으로 나타났으나 유의적으로 차이가 없는 것으로 나타났다(p<0.05). 0.1% 솔잎 추출물 첨가구의 경우, palmitic acid, oleic acid, linolenic acid는 약간 증가하였고 linoleic acid는 약간 감소하는 것으로 나타났으나, 모든 지방산 조성에서 유의적으로 차이가 없는 것으로 나타났다(p<0.05).










