서 론
In vitro 소화계(in vitro digestive system)는 인체 내의 매우 정교하고 복잡한 소화과정을 최대한 비슷한 유사 환경을 만들어 인체내 소화와 비슷한 결과를 얻어낼 수 있는 연구 방법이다(Hur 등, 2009; Hur 등, 2012). 또한 동물이나 사람을 대상으로 한 식품의 기능성 검증이 가장 정확한 생리활성 결과를 얻을 수 있지만, 시간과 비용이 많이 들어 이러한 in vivo system을 대체할 수 있는 연구방법에 많은 노력과 관심이 집중되고 있다(Boisen과 Eggum, 1991). In vitro 소화계 연구는 생체 내에서 이루어지는 소화과정을 통한 연구보다 신속하고 단순하며, 비용이 적게 들어 경제적이고 동물실험이나 인체 적용시험 등에 의한 생명 윤리 문제에서도 자유로울 수 있다는 장점 등이 있다(Coles 등, 2005). 이러한 체외 소화 모델의 장점을 이용하여 현재 다양한 식품 및 기능성 물질의 개발에 널리 적용되고 있다. 최근 약 40년간 in vitro 소화계를 적용하여 다양한 식품의 분석 및 개발 관련 연구 논문이 다수 발표되었으며, 식품 속 생체 활성 화합물, 생체 접근성 및 항산화 특성에 대한 식품 매트릭스 연구에 효과적이라고 보고되고 있다(Lucas-González 등, 2018). Monro 등(2010)은 in vitro digestion이 생체 내 전분소화율과 혈당 반응에 대한 예측 인자의 역할을 할 수 있음을 보고하였고, 그 외에 Ng와 See(2019)는 기능성 식물성 식품에 적용하여 탄수화물 가수분해 효소 억제 관련 연구를 수행하여 당뇨 예방 기능성 식품 탐색을 발표하는 등 다양한 식품개발 연구에 활발히 이용되고 있다.
또한 식품을 가공 처리하는 방법 중 가장 널리 사용되는 가열법은 식품 속 물리적, 이화학적 변화를 만들어 영양소나 생리활성 물질의 파괴, 생성 및 증가 등의 다양한 변화를 일으키며, 이에 관련한 활발한 연구가 진행 중이다(Cho와 Joo, 2012). 식물 가열처리 시 단백질과 결합된 고분자의 페놀성 화합물의 결합 변화 또는 새로운 페놀성 화합물이 생성되어 총 페놀성 화합물 함량이 증가하게 된다고 보고한 바 있다(Dewanto 등, 2002; Yu J 등, 2005). 이는 가열공정이 식품 개발에 중요한 가공 처리 요소로 특히 곡류 제품 개발에 있어 Schlörmann 등(2020)은 귀리를 가열처리하였을 때 탄수화물과 단백질의 화학적 결합의 변화로 인하여 불용성 식이섬유의 감소와 수용성 식이섬유의 증가가 관찰되었다고 보고하였으며, Majcher 등(2013)은 보리로 만든 시리얼커피를 가열가공하였을 때 열에 의해 화합물이 합성되어 견과류와 커피의 맛을 생성시킨다는 연구를 발표하였다.
메밀(Fagopyrum esculentum)은 중요한 대체 작물 중 하나로, 검은 색 껍질의 삼각형 모양 형태로써 주로 가루로 가공하여 소비되고 있다(Krkošková 등, 2005). 우리나라에서는 밥을 지을 때 섞어서 메밀밥을 하거나 곱게 가루를 내어 메밀묵과 메밀국수, 메밀전병 등을 만드는 데 사용하며, 볶아서 메밀차로도 이용되고 있다. 외국의 경우는 스프, 팬케이크 및 스파게티 등을 만들 때 메밀가루를 밀가루 등에 첨가하여 사용하고 있다(Choi, 2007, Lee 등, 1991; Maeng 등, 1990). 메밀 속에는 다양한 영양소가 존재하며, 그 중 폴리페놀 성분으로는 rutin, quercetin, isoquercetin, myricetin, caffeic acid 유도체 등이 있어, 이들 화합물은 항산화 작용, 항균작용 등 생체조절기능을 가지고 있다고 알려져 있다(Lee 등, 2014).
따라서 본 연구는 곡류의 일종인 메밀에 볶음 조건을 다르게 하여 in vitro 소화계를 적용함으로써 볶음 메밀의 산화 방지 효과와 유지 산화 안정성에 관한 연구를 하고자 하였고, in vitro 소화계를 활용한 식품 개발 산업에 기초자료를 제공하고자 하였다.
재료 및 방법
메밀은 강원도 평창군 봉평읍에서 재배한 보통 메밀(Fagopyrum esculentum)을 구매하여 사용하였다. 메밀을 원두 로스팅 기계(Gene café CBR-101, GENESIS Co., LTD, Ansan, Korea)로 180°C와 200°C에서 각각 10분, 20분 볶음처리를 한 후 분쇄기(SP-7405S, Comac, Seongnam, Korea)를 이용하여 분말 제조하였다.
In vitro digestion은 Werner와 Bohm(2011)의 방법과 Ng와 See(2019)의 방법을 참고하여 진행하였다. 분쇄한 볶지 않은 메밀과 각각의 볶음 메밀 분말 5 g을 각각 삼각플라스크에 넣은 후 0.9% NaCl 30 mL를 취한 후 항온수조(BS-21 JEIO TECH, Daejeon, Korea) 37°C, 200 rpm에서 5분간 혼합시켰다. 그 후 소화기관인 입의 환경을 맞추기 위하여 20 mg/mL α-amylase(Sigma-Aldrich Co., St. Louis, MO, USA)를 2 mL 취한 후 항온수조(37°C, 200 rpm)에서 5분간 혼합하였다. 위의 환경을 조성하기 위해 0.1M HCl(Daejung, Siheung, Korea)를 용매로 pH를 조절하여 사용한 40 mg/mL pepsin(Sigma-Aldrich Co.)을 2 mL 취한 후 항온수조 (37°C, 200 rpm)에서 30분간 혼합하였으며, 소장에서의 소화조건으로 pH 유지를 위하여 0.1 M NaHCO3(Daejung)를 용매로 사용한 2 mg/mL pancreatin(Sigma-Aldrich Co.)과 12 mg/mL bile extract(Sigma-Aldrich Co.) 시약을 9 mL 취한 후 항온수조(37°C, 200 rpm)에서 30분간 혼합하였다. 이후 동결건조(BFD85-F8, IlshinBiobase, Seoul, Korea)하여 분쇄하였으며 이후 80% 에탄올(Daejung)을 이용하여 추출을 실시하였다. 80% 에탄올 추출은 분쇄된 시료와 그 시료 무게의 15배의 80% 에탄올을 혼합하여 진탕기(RS-1, JEIO TECH, Daejeon, Korea)에서 6시간 동안 280 rpm으로 추출하였으며 추출물은 여과지(Whatman No.4, Maidstone, England)로 여과한 후 회전 감압농축(Rotavapor®R-100, BŰCHI, Zollikofen, Switzerland)을 거쳐 동결건조(BFD85-F8, IlshinBiobase) 하였다. 완성된 추출물은 −20°C에서 냉동 보관하며 실험에 사용하였다.
DPPH(2,2-diphenyl-1-picrylhydrazyl) 라디칼 소거 활성은 Kim과 Kim(2020)의 방법을 참고하여 0.1 mM의 DPPH (Sigma-Aldrich Co.) 용액 0.75 mL에 농도로 증류수에 희석한 시료를 각 0.25 mL씩 넣고 10초간 혼합하고 30분간 암실에서 반응시킨 후 UV/VIS spectrophotometer(Mega-U6000, Scinco, Seoul, Korea)를 이용하여 517 nm에서 흡광도를 측정하였다. DPPH 라디칼 소거 활성은 아래 공식으로 계산하였다.
Ac: 대조군의 흡광도
As: 시료의 흡광도
ABTS[2,2'-azino-bis(3-ethylbenzothiazoline-6-sulphonic acid)] 양이온 라디칼 소거 활성은 Re 등(1999)의 방법을 사용하여 7 mM의 ABTS(Sigma-Aldrich Co.)와 2.45 mM potassium persulfate(Sigma-Aldrich Co.)를 1:1로 혼합하여 암실에서 12시간 반응시켜 ABTS 라디칼 양이온을 형성한 후 UV/VIS spectrophotometer(MegaU6000, Scinco)를 이용하여 734 nm에서 흡광도가 0.700(±0.050)이 되도록 에탄올로 희석하여 사용하였다. 농도별 추출물 시료 0.05 mL와 에탄올(Daejung)에 희석된 ABTS 용액 1.9 mL를 혼합한 후 10분간 상온 암실에서 정치한 후 734 nm에서 흡광도를 측정하였다. ABTS 양이온 라디칼 소거 활성은 아래 공식으로 계산하였다.
Ac: 대조군의 흡광도
As: 시료의 흡광도
FRAP(ferric reducing antioxidant power) 환원력은 Benzie와 Strain(1996)의 방법을 사용하여 300 mM sodium acetate buffer (pH 3.6)(Sigma-Aldrich Co.), 40 mM HCl(Daejung)에 용해한 10 mM 2,4,6-tripyridyl-S-triazine(TPTZ)(Sigma- Aldrich Co.)용액과 20 mM FeCl3(Sigma-Aldrich Co.)를 각각 10:1:1(v/v/v)의 비율로 혼합하여 37°C 항온수조에서 15분간 평형시켜 FRAP 시약을 제조하였다. FRAP 시약 0.9 mL와 농도를 다르게 만든 시료 각 0.03 mL를 혼합하여 상온에서 30분간 반응시킨 후 UV/VIS spectrophotometer(Mega- U6000, Scinco)를 이용하여 593 nm에서 흡광도를 측정하였다. 시료의 FRAP 환원력은 표준물질인 L-ascorbic acid (Sigma-Aldrich Co.)의 표준곡선으로부터 계산하였다.
총페놀 함량(total phenolic contents, TPC)은 Folin과 Denis법(1912)을 사용하여 농도별로 희석한 시료 0.05 mL와 증류수 0.8 mL, 증류수와 1:1로 희석한 Folin-Denis 시약(Sigma-Aldrich Co.) 0.5 mL를 30초간 혼합한 후 5분간 정치시켰다. 혼합한 용액에 Sodium carbonate(Sigma-Aldrich Co.) 0.1 mL를 가하여 혼합한 후 상온에서 30분간 정치한 후 UV/VIS spectrophotometer(Mega-U6000, Scinco)를 이용하여 725nm에서 흡광도를 측정하였다. 총페놀 함량은 표준물질인 L-ascorbic acid(Sigma-Aldrich Co.)의 표준곡선으로부터 계산하였다.
ORAC(oxygen radical absorbance capacity)가 측정법은 Prior 등(2003)의 방법을 사용하여 75 mM phosphate buffer (pH 7.0)을 용매로 시료 희석 및 실험에 이용하였다. 300 mM 2,2’azo-bis (2-amidino-propane) dihydrochloride(AAPH) (FUJIFILM Wako Pure Chemical Corporation, Osaka, Japan)와 0.1 mM fluorescein(VWR life science AMRESCO, Solon, OH, USA) 용액, 농도별로 희석한 시료를 75 mM phosphate buffer(Daejung)에 희석하여 사용하였다. 96-well plate에 AAPH 50 μL, fluorescein 용액 150 μL, 농도별 시료 50 μL를 넣어 준 후 fluorescence microplate reader(GeminiXPS, Moleculardevice, San Jose, CA, USA)를 이용하여 excitation 493 nm, emission 515 nm에서 40분간 매분 측정하였으며, 대조군으로는 trolox(Sigma-Aldrich Co.)를 사용하였다. 각 군의 커브면적(area under curve, AUC)을 측정한 후 fold가로 나타내었다.
유지 내에 시료의 고른 분산을 위하여 dimethyl sulfoxide (DMSO)에 녹여 옥수수 기름(Ottogi, Anyang, Korea)과 혼합 후 이를 dry oven(GISICO, Seoul, Korea)에서 각각 3, 6, 9시간 동안 100±5°C의 열로 산화시켜 사용하였으며, 대조군은 DMSO를 첨가하였다. 제조된 시료는 유지 산화를 방지하기 위해 −20°C에서 보관하며 실험하였다.
CDA(conjugated dienoic acid)가는 AOCS(1980) 법을 사용하여 각각의 시료를 산화시킨 유지 시료 0.02 g과 isooctane (Daejung) 5 mL를 혼합시켜 시료를 4,000 ppm의 농도로 희석시켰다. 희석한 시료 0.4 mL에 isooctane 1.6 mL를 넣어 한번 더 희석한 후 UV/VIS spectrophotometer(MegaU6000, Scinco)를 이용하여 233 nm에서 흡광도를 측정하였다.
ρ-AV(ρ-anisidine value)의 경우 AOCS(1990) 법을 사용하여 0.25% ρ-anisidine(Sigma-Aldrich Co.) 용액 0.4 mL와 시료를 4,000 ppm의 농도로 isooctane(Daejung)에 분산시킨 시료 2 mL를 넣고 혼합하여 15분간 암실에서 반응시킨 후 UV/VIS spectrophotometer(Mega-U6000, Scinco)를 이용하여 350 nm에서 흡광도를 측정하여 ρ-AV로 환산하였다.
볶음 조건을 달리한 메밀에 각각 in vitro 소화과정을 적용한 에탄올 추출물의 DPPH 라디칼 소거능은 다음 Fig. 1과 같다. 1 mg/mL의 농도에서 볶지 않은 메밀, 180°C 10분, 180°C 20분, 200°C 10분, 200°C 20분 볶음 군의 DPPH 라디칼 소거능은 각각 13.91%, 15.79%, 14.95%, 21.00%, 12.36%로 나타나, 200°C 10분 볶음군이 유의적으로 가장 높은 라디칼 소거능을 보였는데(p<0.05), 200°C 10분 볶음군이 볶지 않은 메밀군에 비해 33.8%, 180°C 10분 볶음군의 24.8%, 180°C 20분 볶음군의 28.8%, 200°C 20분 볶음군의 41.1%로 소거능이 각각 증가되어 다양한 볶음 조건 중 200°C 10분이 유의적으로 라디칼 소거능이 가장 우수한 것으로 관찰되었다(p<0.05).
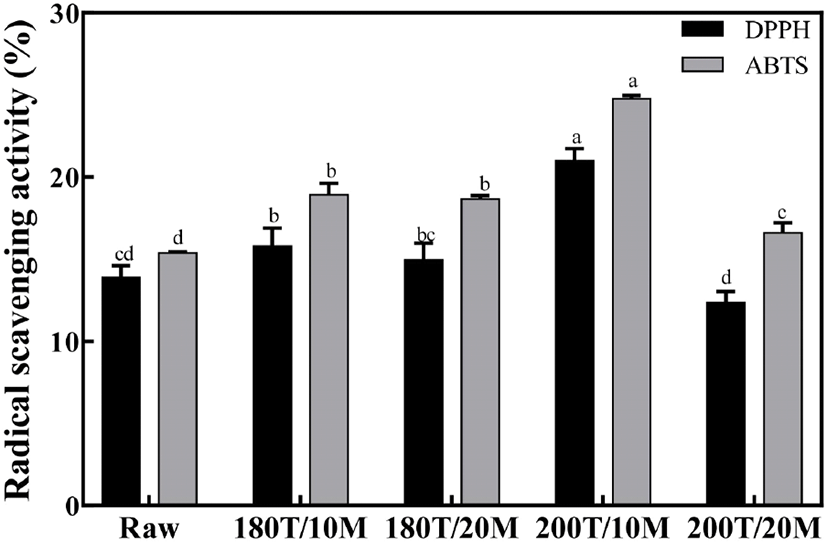
또한 ABTS 양이온 라디칼 소거능의 경우, 볶지 않은 메밀군, 180°C 10분, 180°C 20분, 200°C 10분, 200°C 20분 볶음군이 각각 15.39%, 18.92%, 18.67%, 24.76%, 16.61%로 나타나 DPPH 라디칼 소거능의 결과와 비슷한 경향을 보여 200°C 10분 볶음군이 유의적으로 가장 높은 양이온 라디칼 소거 활성을 보였다(p<0.05). 볶음 처리를 하지 않은 메밀보다 볶음 처리 공정을 진행한 메밀이 라디칼 소거능이 전반적으로 증가함을 확인할 수 있었으며, 가열 온도와 시간이 증가함에 따라 대체로 라디칼 소거능이 증가하는 것을 알 수 있었다. 이러한 볶은 메밀의 라디칼 소거능에 대한 Ko 등(2012)의 연구에 의하면 볶음 공정을 가한 온도와 시간이 증가함에 따라 전자공여능이 증가하는데, 이는 가공 공정에 따른 증가된 melanoidin에 의한 것으로 나타났다고 보고하였으며, Liu 등(2010)은 다양한 색상을 가진 품종의 밀과 페놀성 화합물의 항산화 활성을 조사하여 밀의 페놀성 화합물은 주로 페놀산, 플라보노이드 및 안토시아닌으로 구성되어 있으며, 이런 곡물의 페놀함량이 항산화 활성과 상관관계가 있다고 보고하였다. Lee 등 (2014)의 연구에 의하면 타타리 메밀을 가열처리했을 때 가열시간이 증가함에 따라 라디칼 소거능이 증가하는 양상을 보였지만, 200°C를 초과한 온도에서는 소거능이 유의적으로 감소되었다고 보고하였으며, Bhinder 등(2019) 또한 가열처리한 타타리 메밀의 가열온도가 증가함에 따라 총 항산화 활성이 감소하는 것을 관찰하였다. Ng와 See(2019)의 연구에서는 in vitro 소화과정을 가한 12가지 기능성 식물성 식품의 다수가 라디칼 소거활성이 증가되어, in vitro 소화과정이 식물성 식품의 총 항산화 활성을 강화할 수 있을 것이라고 보고하였다. 본 연구에서 메밀의 가열 조건 중 200°C 10분 볶음군이 가장 우수한 라디칼 소거 활성을 보여 일정한 온도와 시간 내에서의 가열이 항산화 활성을 높일 수 있다는 것을 알 수 있었으며, 이를 통해 선행 연구들과 본 연구의 경향이 일치하는 것을 확인하였다.
총페놀 함량(TPC) 및 FRAP 환원력 결과는 Table 1과 같다. 두 실험 모두 시간과 온도가 증가할수록 유의적으로 증가하였다가 감소하는 경향을 나타내었다. TPC 측정 결과, 볶지 않은 메밀군 9.61, 180°C 10분 볶음군 9.86, 180°C 20분 볶음군 7.58, 200°C 10분 볶음군이 13.14, 200°C 20분 볶음군 9.71 μmol tannic acid equivalent/g extract로 총페놀 함량이 다양한 볶음 조건 중에서 200°C 10분이 유의적으로 가장 높은 함량을 보이는 것으로 관찰되었다(p<0.05). 또한 FRAP 환원력의 경우는 볶지 않은 메밀군, 180°C 10분 볶음군, 180°C 20분 볶음군, 200°C 10분 볶음군, 200°C 20분 볶음군은 각각 43.35, 38.00, 36.31, 56.49, 50.79 μmole ascorbic acid equivalent/g extract로 관찰되어 TPC와 동일하게 200°C 10분 볶음군이 유의적으로 높은 환원력을 나타내었다(p<0.05). Ismail 등(2004)의 연구에 따르면 비가열과 가열처리한 여러 종류의 채소의 페놀성 화합물을 비교하였을 때 가열 처리시 총 페놀성 화합물이 증가하며, Hong 등(1998)의 볶음처리에 따른 치커리의 항산화 관련 연구에서 가열 처리에 인한 페놀성 화합물 함량이 증가하였는데, 이는 고분자 불용성 페놀 화합물로부터 분리된 유리 페놀성 화합물이 생성되었기 때문이라고 보고하였다. 또한 Chen 등(2020)은 in vitro 소화과정을 가한 볶은 참깨의 총페놀 함량과 총플라보노이드 함량이 크게 증가하였으며, 이는 체외소화로 인해 페놀과 플라보노이드의 화학적 결합의 변화를 일으킨 것으로 예측하였다. Prajapati 등(2013)은 5가지 곡물을 조리할 때 항산화력과 페놀, 폴리페놀 및 플라보노이드 함량이 향상되었으며, 화학 추출물보다 체외 소화를 이용한 추출물에서 총페놀 함량, 총플라보노이드 함량, FRAP 환원력이 높았다고 보고하였다. 이와 같이 본 연구 결과를 종합해 보면 200°C 10분이 볶음조건이 가장 효과적이었으며, 페놀 함량의 변화는 식품 속 페놀성 화합물이 가열에 의한 열과 in vitro 소화과정을 통한 소화효소의 물리화학적 반응을 통해 일어난 것으로 판단된다. 이러한 페놀성 화합물의 변화가 FRAP 환원력에도 영향을 준 것으로 사료되며, 페놀성 화합물을 효과적으로 증가시키기 위해서 효율적인 열처리 온도와 시간 등의 조건이 필요하다는 것을 알 수 있었다.
2) FRAP, ferric reducing antioxidant power.
2) Symbols were listed in the legend of Fig. 1. Each value is mean±SD (n=3). Different letters are significant differences at p<0.05.
페록시 라디칼(peroxyl radical, ROO·)을 이용하여 형광물질인 fluorescence의 감소를 측정하는 방법으로 사람의 생체 반응 조건(37°C, pH 7)으로 식품의 항산화 능력을 평가하기 위한 표준 방법으로 제안된 분석법이다(Prior 등, 2005). ORAC가 결과는 다음 Fig. 2와 같다. 시료 25 μg/mL 농도에서 시료 무첨가 대조군에 비해 볶지 않은 메밀군은 1.72배, 180°C 10분 볶음군은 1.12배, 180°C 20분 볶음군은 1.38배, 200°C 10분 볶음군은 1.35배, 200°C 20분 볶음군에서 1.42배로 항산화력을 관찰할 수 있었다. ORAC가의 경우, 볶지 않은 메밀군이 유의적으로 가장 높은 항산화력을 보였다(p<0.05). 또한 ORAC가 측정을 통해 대조군과 비교하였을 때 볶음 조건은 180°C 20분, 200°C 10분, 200°C 20분에서 유의적으로 항산화력이 증가하는 것으로 나타났다(p<0.05).
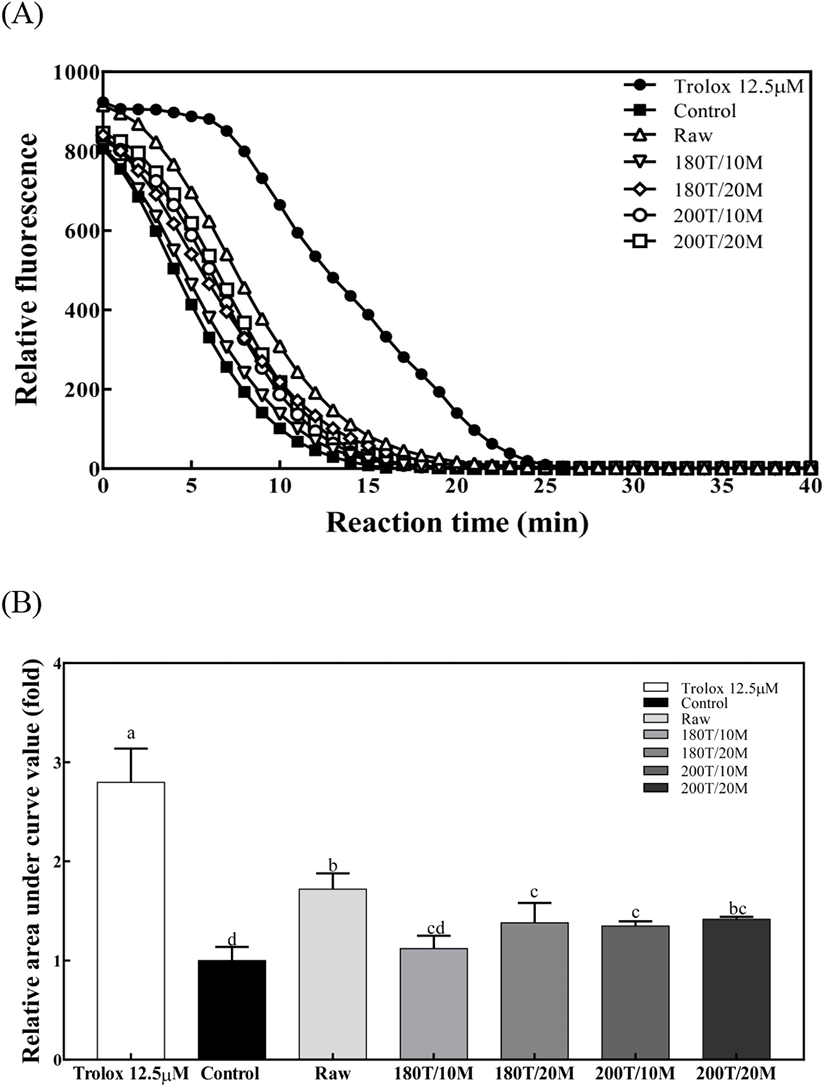
Małgorzata 등(2016)은 메밀 가루의 가열처리 시간에 따른 ORAC가를 측정하였을 때 메밀 가루를 30분 이상 가열하였더니, 오래 볶을수록 항산화 능력이 떨어졌다고 보고하였으며, Jin 등(2015)의 연구에 의하면 열풍건조한 다래가 생과에 비해 ORAC가가 23% 감소되었다고 보고하였다. 또한 볶은 카카오닙스의 ORAC가가 볶지 않은 카카오닙스에 비해 10% 감소됨을 보고한 바 있다(Mazor 등, 2011). 반면, Song 등(2018)은 가열 처리 시간이 증가할수록 심황색소의 AAPH peroxyl 라디칼 소거활성이 증가된다는 보고도 있었는데, 이와 같이 가열조건에 따른 ORAC가에 미치는 영향은 다양한 결과를 보이고 있다. 또한 본 연구에서 다른 항산화 분석법과는 달리 볶지 않은 메밀군의 ORAC가가 높게 나타났는데, 이는 항산화물질이 직접적으로 발색에 영향을 미치는 기존의 항산화측정 방법과는 달리 ORAC가 분석법의 경우 실시간 형광물질의 변화를 간접측정하여 항산화력을 확인하는 것(Prior 등, 2003)으로 원리적인 차이가 있어 이로 인한 것으로 사료된다.
항산화 성분과 활성의 상관관계 분석의 결과는 Table 2와 같다. 총폴리페놀 함량과 DPPH 라디칼 소거능, ABTS 양이온 라디칼 소거능, FRAP 환원력은 각각 R2=0.729(p<0.001), R2=0.716(p<0.001), R2=0.824(p<0.001)로 가장 많은 분석과 양의 상관관계를 가지고 있었으며, DPPH 라디칼 소거능은 ABTS 양이온 소거능과 R2=0.913(p<0.001)으로 가장 높은 양의 상관관계를 나타내었다. 총폴리페놀 함량 측정과 DPPH, ABTS, FRAP 환원력에서의 양의 상관관계는 열처리로 인하여 항산화 효과가 있는 대표적인 물질인 페놀성 화합물의 증가로 기인한 것으로 생각되며, 이는 Kwak 등(2013)의 열처리한 현미 추출물에 관한 연구에서 일정한 열처리를 실시한 시료가 항산화 활성과 총플라보노이드 함량의 변화가 생겼으며 이는 총페놀 함량 분석 결과와 높은 상관관계가 있었다고 보고한 연구와 유사한 경향을 보였다.
| Factor | Pearson’s correlation coefficients (r) | ||||
|---|---|---|---|---|---|
| DPPH | ABTS | TPC | FRAP | ORAC | |
| DPPH | 1 | ||||
| ABTS | 0.913** | 1 | |||
| TPC | 0.729** | 0.716** | 1 | ||
| FRAP | 0.418 | 0.497 | 0.824** | 1 | |
| ORAC | −0.234 | −0.436 | −0.099 | 0.155 | 1 |
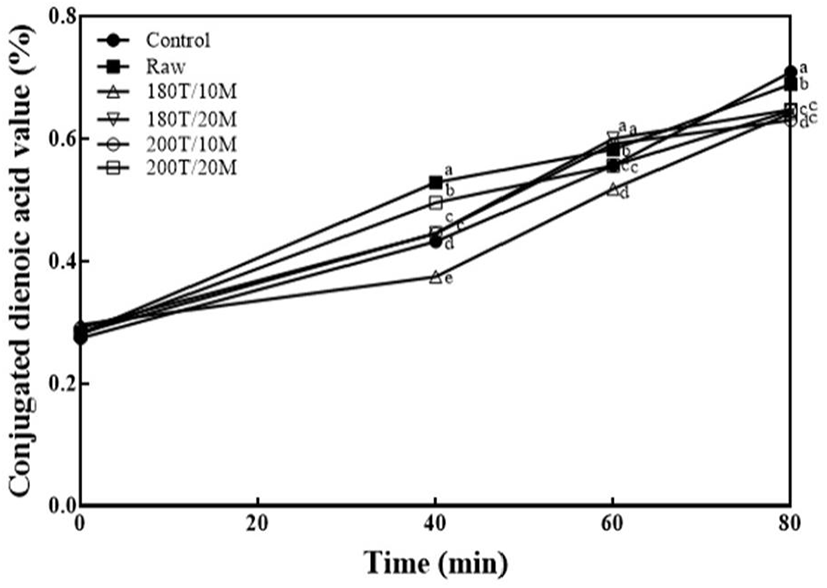
유지가 산화되면서 생성되는 공액 이중결합을 측정하는 방법인 CDA가 측정 결과는 Fig. 3과 같다. 1,000 mg/kg 농도에서 180°C에서 40분, 60분, 80분을 산화시켰을 때, 전반적으로 40분, 60분까지는 시료를 첨가하지 않은 대조군에 비해 시료 첨가군들이 유지산화 안정에 영향을 미치지 않는 것으로 나타났으나, 80분에서는 대조군에 비해 시료 첨가군들이 유의적으로 유지산화를 안정화시키는 경향을 보였다(p<0.05). 80분에서 최종 CDA가는 시료 무첨가 대조군은 0.71%, 볶지 않은 메밀은 0.69%, 180°C 10분 볶음 군은 0.64%, 180°C 20분 볶음 군은 0.65%, 200°C 10분 볶음 군은 0.63%, 200°C 20분 볶음 군은 0.65%로 나타났다. 시료 무첨가 대조군에 비해 볶지 않은 메밀, 180°C 10분, 180°C 20분, 200°C 10분, 200°C 20분 볶음 군이 각각 2.82%, 9.86%, 11.27%, 8.45% 감소된 값을 관찰할 수 있었으며, 볶지 않은 메밀군과 볶음군 모두 유의적으로 감소를 보였다(p<0.05). 이를 통해 다양한 볶음 조건 중에서도 200°C 10분이 유지 산화물인 공액 이중결합이 가장 적게 생성됨을 알 수 있었다.
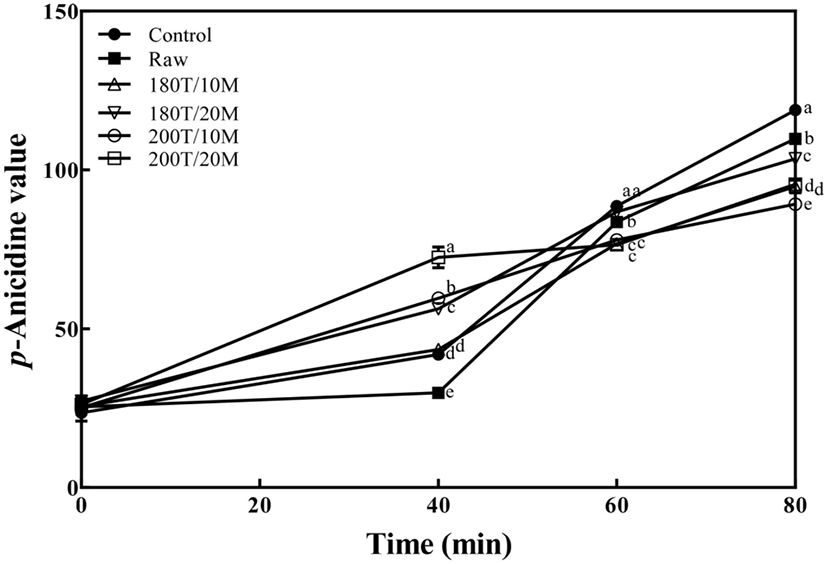
또한, 산화된 유지의 이차 산화 생성물을 측정하는 ρ-AV의 실험결과는 Fig. 4와 같다. CDA와 마찬가지로 동일한 1,000 mg/kg 농도에서 180°C에서 40분, 60분, 80분을 산화시켰을 때, 40분에서는 시료 첨가군이 시료를 첨가하지 않은 대조군과 비교하였을 때, 전반적으로 높은 값을 보였으나, 60분과 80분에서는 시료 첨가군이 대조군보다 전체적으로 낮은 값을 보여 유지산화 안정성에 유의적인 영향을 관찰할 수 있었다(p<0.05). 시료 무첨가 대조군에 비해 볶지 않은 메밀, 180°C 10분, 180°C 20분, 200°C 10분, 200°C 20분 볶음 군이 각각 118.85, 109.78, 94.80, 103.50, 89.25, 95.50로 나타나, CDA 실험결과와 비슷한 양상을 나타내어 200°C 10분처리로 인해 가장 우수한 이차 유지 산화생성물 억제를 관찰할 수 있었다(p<0.05).
이러한 식품모델의 유지산화 안정성에 관한 연구를 살펴보면, Hęś 등(2017)은 메밀 껍질 추출물이 첨가된 미트볼을 기름에 튀겨 장시간 냉동보관 후 지질 산화를 측정하여 산화방지제인 BHT(butylated hydroxytoluene)와 비교하였을 때 우수한 과산화물 및 TBARS 억제력을 보여주었으며, 이러한 결과는 메밀 껍질 추출물에 존재하는 페놀성 화합물과 연관이 있다고 보고하였다. Suri 등(2019)은 블랙커민 종자를 가열 처리하면서 lipase와 lipoxygenase를 비활성화시켜 산패 지표인 산가(acid value)를 감소시킨 것을 관찰하였다. 또한 Lee 등(2010)의 연구에 의하면 온도와 시간별로 볶음 처리한 참깨에서 추출한 기름의 산화안정성을 측정하였을 때 대부분의 볶음 처리군에서 온도가 높고 시간이 길어질수록 볶음처리하지 않은 실험군보다 높은 산화안전성을 나타냈다고 보고하였다. Sun과 Ho(2005)는 메밀 추출물 속 천연산화방지제가 합성산화방지제를 대체하여 지질 식품의 산화를 방지할 수 있을 것이라고 보고하였다. 이를 통해 본 연구의 결과는 메밀 속 페놀성 화합물이 유지의 산화를 지연시키는 것으로 판단된다.










