서 론
모든 세포는 생명 유지를 위한 에너지 생성과정에서 산소를 필요로 하는데, 에너지 대사에 사용되는 산소 중 일부는 부산물인 활성산소(reactive oxygen species, ROS)로 전환이 된다(Kim 등, 2016). ROS에는 superoxide anion, hydrogen peroxide 및 hydroxyl radical 등이 있으며(Lee 등, 2011), 이들은 세포 내 신호 및 면역반응에 기여하지만 과도하게 생성될 경우, 세포 내 소기관들을 공격하여 질병을 일으킬 수 있다(Cho 등, 2008). 생체는 이러한 활성산소종의 생성을 차단 및 감소시키기 위한 항산화 시스템을 가지고 있는데, 정상적인 상태에서는 생체의 항산화 시스템에 의해 산화작용에 대한 방어 작용을 한다. 그러나 환경 및 질병 등에 의해 산화 및 항산화 작용의 평형이 깨지게 되면, 산화적 스트레스가 발생하게 되고, 이것은 세포내 지질, 단백질, 또는 DNA 손상을 일으켜 정상적인 신체 기능을 억제하게 된다(Jo 등, 2010; Koh 등, 2008).
한편, 경제의 발전 및 삶의 질 향상으로 비만은 전세계적인 사회적 문제로 간주되고 있다. 비만은 체내 지방이 과도하게 축적된 상태를 의미하며, 고혈압, 당뇨, 고지혈증 및 대사증후군을 일으키는 주된 원인이다(Lee 등, 2014). 최근 지방세포 내 생성된 ROS가 지방세포의 분화와 밀접한 연관을 갖는다고 보고되었다(Park 등, 2013). 특히 지방세포가 비대해질 경우, 정상 세포에 비하여 많은 유리지방산을 생성하며, 증가한 유리지방산은 활성산소종의 생성을 촉진시켜 염증, 암 및 심혈관계 질환 등의 질병을 유발하게 된다(Choi 등, 2013; Lee 등, 2011).
해양은 지구 표면적의 70%를 차지하고 있으며, 지구 생물종의 80% 이상이 서식하고 있다. 또한, 해양에는 막대한 자원을 보유하고 있다고 보고되어, 육상 생물자원을 대체할 중요한 식량자원으로 주목을 받고 있다(Kim 등, 2013). 우리나라는 삼면이 바다로 둘러싸여 있어 다양한 해양생물을 획득하기에 용이하며, 특히 예로부터 김, 미역, 다시마 등과 같은 해조류를 다양한 방법으로 섭취해 왔다(Kim 등, 2015a). 또한 해양식물은 육상식물과 다른 대사과정 및 생육환경으로 인하여 특이적으로 생리활성을 나타내는 유효성분들을 다량 함유하고 있어 식․의약품 기능성 연구로 가치가 높은 소재로 평가된다(Kim 등, 2013; Kim 등, 2016; Kwon과 Youn, 2017). 그 중, 모자반(Sargassum)은 모자반목(Fucales) 모자반과(Sargassaceae)에 속하는 갈조류의 일종으로 우리나라의 동남해안에서 쉽게 채취되며, 400여 개의 다양한 종이 존재하는 것으로 알려져 있다(Oak과 Lee, 2005; Yeon 등, 2010). 예로부터 모자반은 한국과 중국에서 약용 및 식용으로 이용되어 왔으며, 다양한 생리활성 물질을 함유하고 있는 것으로 기록되었다(Choi 등, 2019; Koo 등, 2001). 따라서 본 연구에서는 모자반의 건강기능성 소재로서의 가능성을 평가하기 위하여 19종의 모자반 에탄올 추출물이 함유하는 페놀 함량을 확인하였으며, 자유라디칼 소거능, 지질축적억제능 및 세포 내 NO 생성억제능을 평가하였다.
재료 및 방법
페놀 함량 및 라디칼 소거능 측정에 사용된 Folin-Ciocalteu reagent, 1-1-diphenyl-2-picrylhydrazyl(DPPH), 2,2’-azinobis-bis(3-ethylbenzothiazoline-6-sulfonic acid)(ABTS) 시약은 Sigma-Aldrich Chemical Co.(St. Louis, MO, USA)에서 구입하여 사용하였다. 세포 배양에 사용한 Dulbecco’s modified Eagle’s medium(DMEM), phosphate buffered saline(PBS), fetal bovine serum(FBS), 0.25% trypsin-EDTA 및 penicillin/streptomycin은 WellGENE(Daegu, Korea)에서 구입하였다. Insulin, 3-isobutyl-1-methylxanthine(IBMX), dexamethasone (DEX), Oil Red O, dimethyl sulfoxide(DMSO)는 Sigma-Aldrich Co.(USA)에서 구입하여 사용하였다.
본 연구에서 사용된 모자반 추출물은 제주생물종다양성연구소에서 제공받았으며, 갈래잎모자반(Sargassum pinnatifidum Harvey), 경단구슬모자반(Sargassum muticum (Yendo) Fensholt), 고사리모자반(Sargassum filicinum Harvey), 괭생이모자반(Sargassum horneri (Turner) C. Agardh), 꼬마모자반(Sargassum nipponium Yendo), 꽈배기모자반(Sargassum siliquastrum (Mertens ex Turner) C. Agardh), 큰열매모자반(Sargassum macrocarpum C. Agardh), 비틀대모자반(Sargassum sagamianum Yendo), 쌍발이모자반(Sargassum patens C. Agardh), 알쏭이모자반(Sargassum confusum C. Agardh), 외톨개모자반(Myagropsis myagroides (Martens ex Turner) Fensholt), 잔가시모자반(Sargassum micracanthum (Kützing) Enflicher), 지충이(Sargassum thunbergii (Mertens es Roth) Kuntze), 짝잎모자반(Sargassum hemiphyllum (Turner) C. Agardh), 큰잎모자반(Sargassum coreanum J. Agardh), 큰잎알쏭이모자반(Sargassum pallidum (Turner) C. Agardh), 큰톱니모자반(Sargassum giganteifolium Yamada), 톱니모자반(Sargassum serratifolium C. Agardh), 톳(Sargassum fusiformis (Harvey) Setchell)을 포함한 총 19개의 추출물은 DMSO에 stock하여 증류수로 농도에 맞게 희석하여 실험에 사용하였다.
총페놀 함량 측정은 Folin-Denis 방법(Folin과 Denis, 1912)을 이용하여 측정하였다. 즉, 모자반 추출물 70 μL에 2 N Folin-Ciocalteu 용액 70 μL를 가하여 3분간 반응시킨 후 2% Na2CO3 70 μL를 첨가하여 1시간 상온에 방치 후 spectrophotometer(SpectraMax M2, Molecular Decives, San Jose, CA, USA)를 이용하여 760 nm에서 흡광도를 측정하였다. 표준물질로는 gallic acid를 이용하였으며, 시료와 동일한 방법으로 분석하여 작성한 표준곡선으로부터 총페놀 함량을 산출하였다.
모자반 추출물의 DPPH 라디칼 소거 활성은 Ramos 등(2003)의 방법을 본 시료에 맞게 변형하여 측정하였다. 각 추출물과 0.2 mM DPPH 용액을 30분 동안 반응시킨 후 spectrophotometer를 이용하여 515 nm에서 흡광도를 측정하였다. DPPH 라디칼 소거 활성은 아래 식을 이용하여 계산하였다.
A: absorbance of the blank
B: absorbance of the sample
ABTS 라디칼 소거 활성은 Re 등(1999)의 방법을 본 시료에 맞게 변형하여 측정하였다. ABTS stock 용액 제조를 위하여 7.4 mM ABTS와 2.6 mM potassium persulfate를 혼합하여 암소에서 24시간 동안 방치하였다. 이후 735 nm에서 흡광도가 0.7-0.8이 되도록 ABTS stock 용액을 phosphate buffer saline(PBS, pH 7.4)로 희석하였다. 희석한 ABTS reagent 150 μL에 추출물을 50 μL 가하여 5분간 방치하였으며, 735 nm에서 흡광도를 측정하였다. ABTS 라디칼 소거 활성은 아래의 식을 이용하여 계산하였다.
A: absorbance of the blank
B: absorbance of the sample
실험에 사용한 마우스 유래 macrophage 세포주인 RAW 264.7 및 3T3-L1 preadipocyte는 한국세포주은행(KCLB, Seoul, Korea)에서 분양받아 사용하였다. RAW 264.7 세포의 배양은 10% FBS와 1% penicillin/streptomycin이 첨가된 DMEM 배지를 사용하였으며, 37℃, 5% CO2 incubator (MCO-15AC, SANYO, Osaka, Japan)에서 배양하였다. 3T3-L1 preadipocyte는 10% FBS와 1% penicillin/streptomycin이 함유된 DMEM을 이용하여 37℃, 5% CO2 incubator에서 배양하였으며, 세포는 2일마다 계대 배양하였다. 3T3-L1 preadipocyte의 분화를 유도하기 위하여 세포가 100% confluency 된 2일 후, 분화유도물질(0.5 mM IBMX, 0.5 μM DEX, 10 μg/mL Insuline, MDI)이 함유된 배지와 추출물을 2일간 교체하며 세포를 배양하였다. 분화유도 후, 추출물과 10 μg/mL의 insulin이 포함된 배지로 교환하여 배양하였다.
모자반 추출물의 세포 독성 실험은 MTT assay를 이용하여 측정하였다. MTT 용액은 3-(4,5-dimethylthiazol-2-yl)-2,5-diphenyltetrazolium bromide을 5 mg/mL의 농도로 PBS에 녹여 사용하였다. 세포를 1.0×105 cells/well의 농도로 96-well plate에 분주하고 24시간 동안 배양한 후, 추출물을 처리하여 24시간 동안 배양하였다. 배양 후, MTT 용액 20 μL를 처리한 후 5% CO2 incubator에서 4시간 배양시켰으며, 배지를 제거하고 남은 formazan을 DMSO로 용해시켜 570 nm에서 흡광도를 측정하였다. 세포 생존율은 대조군 대비 백분율로 나타내었다.
지방세포 분화 과정 중 형성된 지질의 축적량은 Oil Red O 염색법을 이용하여 측정하였다. 8일 동안 분화한 세포의 배지를 제거한 뒤, PBS로 세포를 2회 세척한 다음, 10% formalin 용액으로 상온에서 30분간 고정하였다. 고정된 세포를 PBS로 세척한 뒤, Oil Red O 용액을 각 well에 첨가하여 실온에서 1시간 동안 염색하였다. 염색된 세포의 lipid droplet의 함량을 측정하기 위하여 세포를 PBS로 세척한 다음 염색된 Oil Red O를 100% isopropyl alcohol을 이용하여 용해한 후 510 nm에서 흡광도를 측정하였다. 지질 축적량은 정상 대조군 대비 백분율로 나타내었다.
LPS로 유도된 RAW 264.7 세포에서 모자반 추출물의 NO 생성억제능을 측정하기 위하여 Griess assay를 이용하여 세포 배양액의 NO 생성량을 측정하였다. RAW 264.7 세포를 1×105 cell/well의 농도로 96 well plate에 분주하여 24시간 동안 37℃, 5% CO2 incubator에서 배양하였다. 배양한 세포에 추출물을 처리하여 6시간 동안 배양한 뒤, LPS를 1 μg/mL 첨가하여 24 h 배양하였다. 96-well plate에 세포배양 상등액 100 μL와 동량의 Griess 시약을 혼합하여 상온에서 10분 동안 반응시킨 후 540 nm에서 흡광도를 측정하였다. NO 생성량은 정상 대조군 대비 백분율로 나타내었다.
결과 및 고찰
식품 속에는 생리활성을 나타내는 phytochemical이 있으며, 그 중 tannin, procyanidin, flavonoid, phenolic acid와 같은 페놀 화합물은 식물 속에 가장 많이 함유되어 있는 2차 대사산물이다(Choi 등, 2010; Park 등, 2015). 이들의 방향족 고리 구조에 붙어있는 다수의 phenolic hydroxyl기는 단백질, 효소단백질 및 기타 거대분자들과 쉽게 결합하는 성질을 가지고 있어 항균, 항산화 및 항염 효과가 뛰어난 것으로 보고되었다(Cho 등, 2018; Kim 등, 2012). 식물의 다양한 생리활성은 식물이 함유하고 있는 페놀성 화합물의 함량과 비례적으로 증가하는 경향이 있다고 보고되었다. 따라서 식물이 함유하고 있는 페놀 함량은 천연물이 나타내는 항산화 활성을 평가하는 기초자료로 활용이 될 수 있다(Kim 등, 2013).
모자반 19종의 총폴리페놀 화합물 함량은 Fig. 1에 제시하였다. 총페놀 함량을 분석 결과, 1.34-36.67 mg/g extract의 함량 범위로 나타났으며, 꽈배기모자반(36.67 mg/g extract), 고사리모자반(26.87 mg/g extract), 큰열매모자반(22.31 mg/g extract) 순으로 높은 함량을 나타냈다. 반면, 가장 낮은 페놀 함량을 나타낸 모자반은 쌍발이모자반(1.34 mg/g extract)으로 나타났다. Son 등(2016)은 해조류를 대상으로 페놀 함량을 분석하였으며, 꽈배기 모자반이 실험에 사용된 모자반 중 가장 높은 함량을 보여 본 연구와 유사한 결과를 나타냈다. 한편, Cho 등(2007)은 꽈배기 모자반 에탄올 분획 추출물의 페놀 함량이 127.3 mg/g으로 본 연구와 비교했을 때 상당히 높은 페놀 함량을 나타냈는데, 이러한 결과는 해조류의 자생 지역, 시기 및 추출 방법의 차이 때문인 것으로 사료된다.
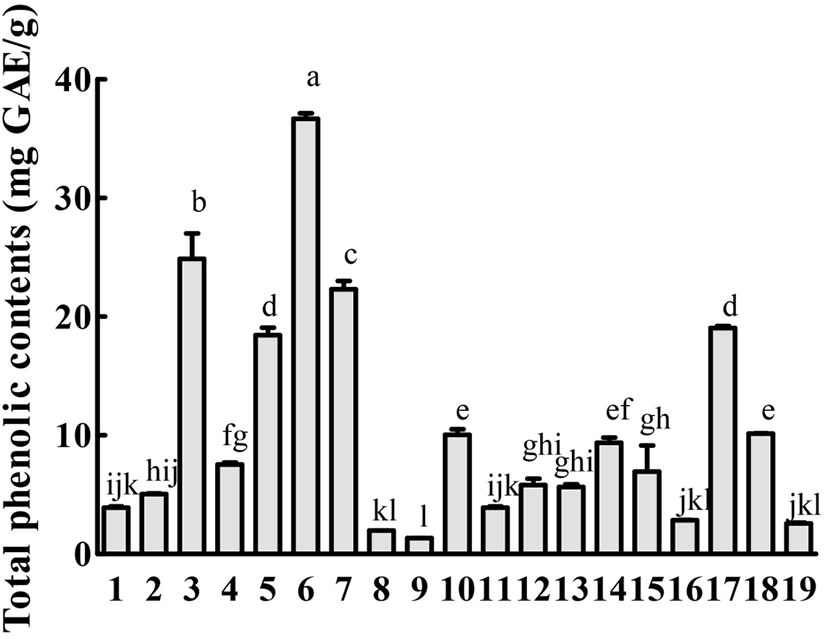
해조류는 녹조류(Chlorophyceae), 갈조류(Phaeophyceae) 및 홍조류(Rhodophyceae)로 분류가 되는데, 그중 모자반이 속한 갈조류가 녹조류 및 홍조류에 비하여 우수한 생리활성을 나타낸다고 보고되었다(Kim 등, 2013; Oh와 Lee, 2015). 갈조류에는 플로로탄닌(phlorotannin)을 다량 함유하고 있는 것으로 알려져 있다. 플로로탄닌은 플로로글루시놀[phloroglucinol(1,3,5-trihydroxybenzene)]을 단량체로 구성된 폴리페놀계 화합물로, 항산화능, 혈압강하, 콜레스테롤 저하, 간 보호, 항바이러스 및 항박테리아, 항암, 항염 등의 다양한 생리활성을 나타낸다고 보고되었다(Lee 등, 2020). 본 연구에서는 19종 모자반의 총페놀 함량을 확인하였으며, 상기 실험 결과를 바탕으로 각 모자반의 라디칼 소거능, 지질축적억제능 및 NO 생성억제능을 평가하였다.
19종의 모자반 추출물의 항산화 활성을 확인하기 위하여 DPPH 및 ABTS 라디칼 소거능을 측정하였다. DPPH는 보라색을 띄는 비교적 안정한 free radical로, 항산화 작용이 뛰어난 물질들에 의해 환원되어 노란빛으로 탈색이 되는 특성을 가지고 있다. 따라서 DPPH의 보랏빛이 항산화 물질에 의해 탈색되는 정도에 따라 물질의 항산화능을 확인할 수 있다(Kwak과 Lee, 2014). ABTS 라디칼 소거능은 potassium persulfate와 ABTS가 반응하여 생성된 양이온 라디칼이 항산화 활성을 가진 물질에 의해 소거되어 본래의 청록색이 탈색되는 원리를 이용하여 항산화력을 측정하는 방법이다(Cho 등, 2012).
각 모자반 추출물은 1 mg/mL의 농도로 희석하여 측정하였으며, 결과는 Fig. 2에 제시하였다. 모자반 19종의 DPPH 라디칼 소거능을 확인한 결과, 꽈배기모자반(73.10%), 큰열매모자반(71.01%), 큰톱니모자반(66.91%) 순으로 높게 나타났다. ABTS 라디칼 소거능을 확인한 결과에서는 꽈배기모자반(88.75%), 큰열매모자반(84.41%), 고사리모자반(74.60%) 순으로 높게 나타났다.
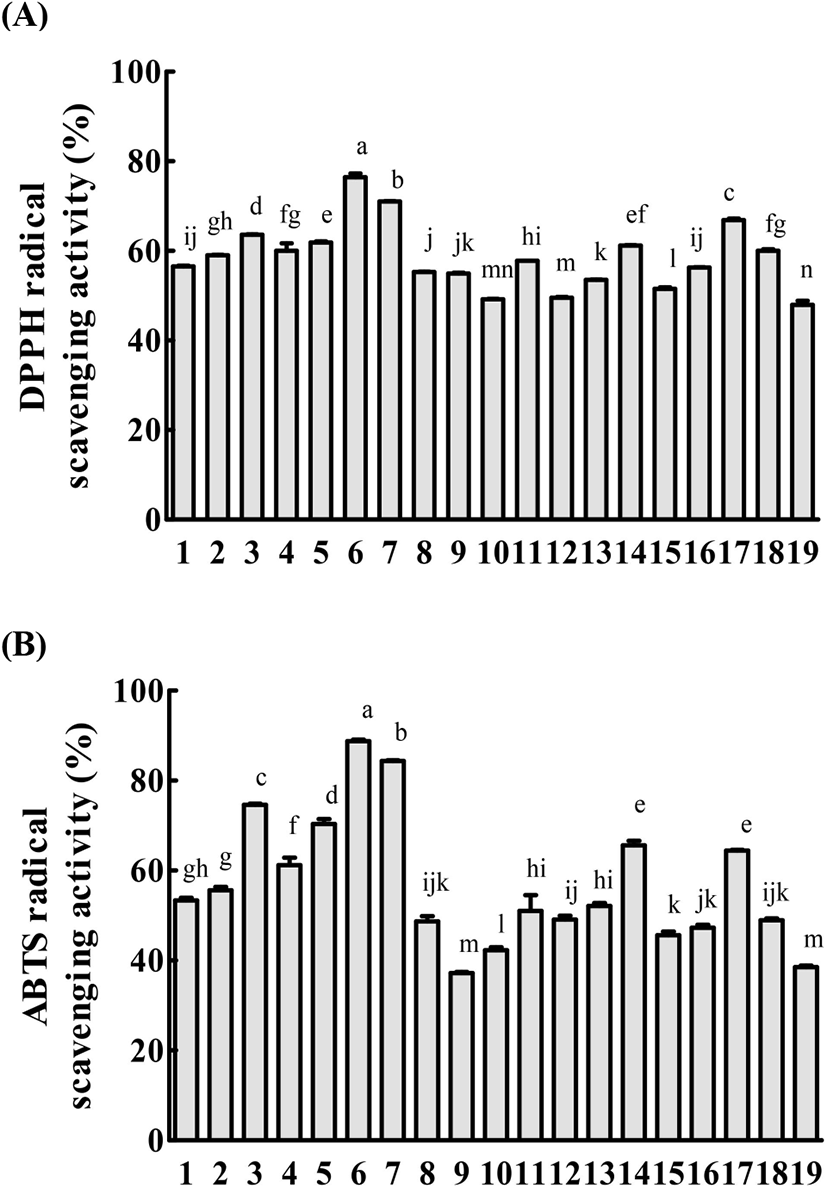
기존에 DPPH 및 ABTS 라디칼 소거능은 페놀 화합물 함량과 밀접한 관계가 있다는 연구가 다수 보고되었다(Boo 등, 2009; Jung 등, 2017). Kwak과 Lee(2014)는 식용 해조류 5종을 이용하여 항산화 활성을 평가하였으며, 해조류 추출물에 함유되어 있는 총페놀 함량에 비례하여 라디칼을 효과적으로 제거하는 결과를 나타내었다. 19종의 모자반 추출물의 총페놀 함량과 라디칼 소거능의 상관관계를 분석한 결과(Table 1), 페놀 화합물의 함량이 증가할수록 DPPH 및 ABTS 라디칼 소거능이 증가하는 경향을 보여 높은 정의 상관관계(r2= 0.808, p<0.01; r2=0.883, p<0.01)를 나타내었으며, 기존 연구결과와 일치하는 결과를 보였다. 특히, 가장 높은 페놀 함량을 나타낸 꽈배기모자반 추출물에서 가장 높은 라디칼 소거 활성을 나타냈는데, 이러한 결과는 Cho 등(2007)의 37종의 해조류 추출물 중 꽈배기모자반이 가장 높은 항산화 활성을 나타냈다는 기존 연구결과에서도 확인할 수 있다. 이와 같이 우수한 꽈배기 모자반의 항산화 활성은 추출물이 함유하고 있는 페놀성 물질에 기인한 것으로 사료된다.
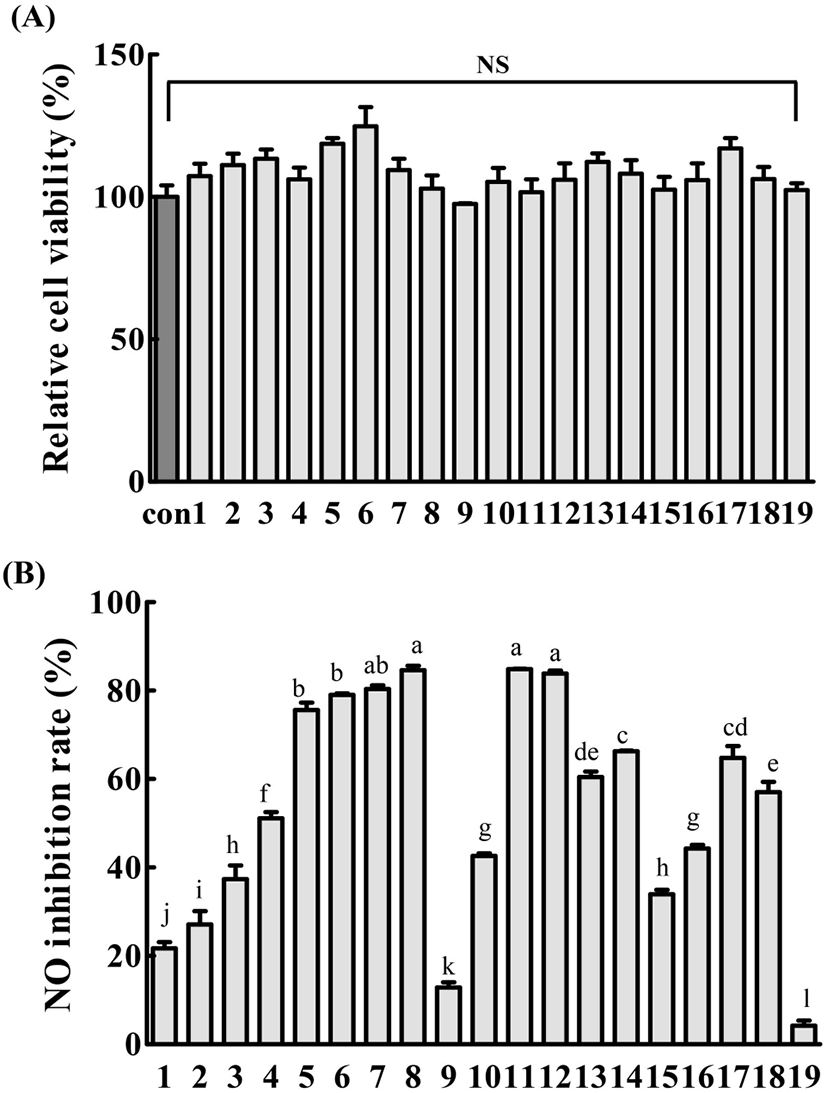
19종의 모자반 추출물이 3T3-L1 및 RAW264.7 세포의 생존에 미치는 영향을 확인하기 위하여 MTT assay를 수행하였으며, 결과는 Fig. 3A와 Fig. 4A에 제시하였다. 모자반 추출물을 100 μg/mL 농도로 3T3-L1 및 RAW264.7 세포에 처리한 결과, 무처리군에 비하여 세포 생존율은 유의적인 차이를 보이지 않았다(p<0.05).
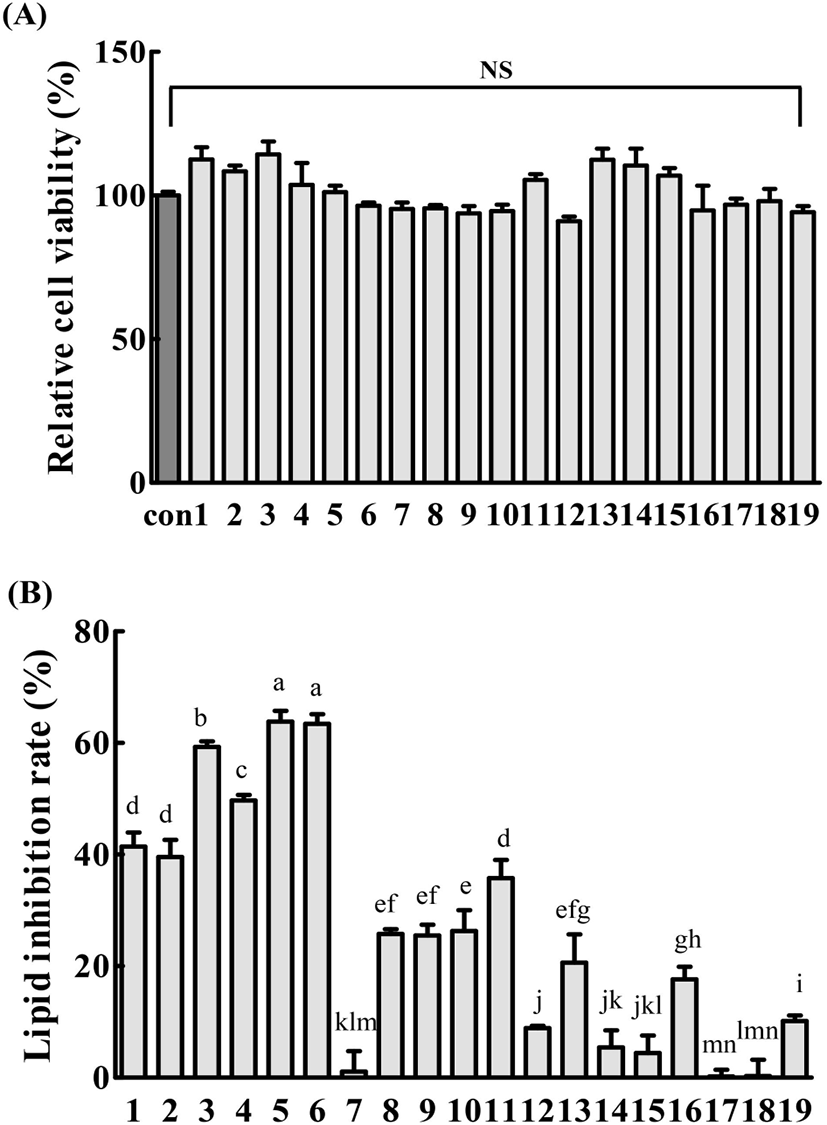
지방전구세포인 3T3-L1은 in vitro에서 분화유도물질을 첨가하였을 때 지방세포로 전환되며, 세포내 지방을 축적(adipogenesis)한다. 지방세포로의 분화가 유도되는 동안 CCAAT/enhancer-binding proteins(C/EBP) family와 peroxisome proliferator-activated receptorγ(PPARγ)와 같은 전사인자들이 활성화되는데, 이들은 지방생성 조절 인자들의 상호작용을 유도함으로써 지방세포 분화를 유도하는 것으로 알려져 있다(Oh와 Lee, 2015; Park 등, 2014). 19종의 모자반 추출물이 3T3-L1 preadipocyte의 지방구 형성에 미치는 영향을 확인하기 위하여 지방전구세포의 분화를 유도하였다. 그 후, lipid droplet만을 특이적으로 염색시키는 Oil red O 염색법을 통하여 지방 세포로의 분화억제 효과를 확인하였으며, 결과는 Fig. 3B에 나타내었다. 모자반 추출물 100 μg/mL 농도에서 꽈배기 모자반이(63.60%) 가장 효과적으로 지방 축적을 억제하였으며, 꼬마모자반(63.42%) 그리고 고사리모자반(59.28%) 순으로 높은 지방 축적억제효과를 보였고, 그 이외에는 50% 이하의 효과를 보였다.
기존에 모자반류를 이용한 3T3-L1의 지방세포 분화억제 연구가 다수 보고되었다. Lee 등(2012)은 잔가시모자반 추출물이 100 μg/mL의 농도에서 약 49% 세포 내 지질축적을 억제하였다고 보고하였으며, Kwon 등(2019)의 연구에서는 괭생이모자반 추출물이 250 μg/mL의 농도부터 유의적으로 지질축적을 억제하였다. Kong 등(2015)은 꽈배기모자반 추출물이 500 μg/mL부터 유의적으로 지방세포의 분화와 세포 내 중성지질 축적을 억제한다고 보고하였다. 본 연구에 사용된 모자반 추출물은 대부분 100 μg/mL의 낮은 농도에서도 지질축적억제 효과를 보여 기존의 연구들보다 우수한 효과를 나타내었다. 또한, 기존 연구들에 사용된 모자반 추출물들은 공통적으로 지방세포가 분화하는 데 관여하는 전사인자인 PPARγ 및 C/EBPα의 발현을 효과적으로 저해하였는데, 본 연구에서 나타낸 모자반 추출물의 지질 축적억제효과는 모자반 추출물이 지방 생성 조절관련 인자들의 발현에 관여하기 때문인 것으로 판단된다.
전지방세포는 성숙된 지방세포로 분화가 되는 과정에서 지방합성을 필요로 하는 NADPH를 생성하는데, NADPH는 NADPH 산화효소(NADPH oxidase, NOX)와 같은 oxidant enzyme에 의해 활성산소종(reactive oxygen species, ROS)을 생성하여 산화 스트레스를 유발한다(Lee 등, 2012; Yoon 등, 2012). 본 연구에서 모자반류가 함유하고 있는 총 폴리페놀의 함량과 지질축적억제 효과는 직접적인 상관관계가 나타나지 않았지만(Table 1), 폴리페놀이 지방세포 분화 과정에서 생성되는 ROS를 소거하는 효과를 기대해 볼 수 있을 것으로 사료된다.
지방 세포 내 과도하게 생성된 활성산소종은 지방전구세포의 분화를 촉진시키거나 지방세포 주변에 위치한 macrophage를 자극하여 다른 활성산소종을 생성함으로 비만의 주요 원인으로 작용한다(Choi와 Kim, 2014). Nitric oxide(NO)는 체내의 염증 및 면역과 밀접한 관련이 있는 반응성이 높은 자유라디칼로서 대식세포에서 주로 생성되며, 생체 내 염증반응, 신경독성, 신호전달 및 체내방어 기능에 중요한 부분을 차지한다고 알려져 있다(Lee 등, 2006). NO는 매우 불안정한 화합물로서 염증 상태이거나 세균에 의해 방출된 내독소에 의해 NO 합성 효소인 inducible nitric oxide synthase(iNOS)가 활성화되어 대량의 NO가 생성된다(Cheon 등, 2017; Lee 등, 2016). NO는 분자상의 산소가 활성산소종으로 변하여 다른 염증성 질환이나 자가 면역질환, 유전자 변이, 신경 및 조직의 손상을 일으킬 수 있다. 따라서 과도한 NO의 생성억제는 질병 예방을 위해 중요하다(Choi 등, 2020).
최근 과도한 영양소 및 대사물질의 공급이 염증 반응을 일으킨다는 ‘meta-inflammation’이라는 용어가 사용되면서, 비만과 만성 염증과의 밀접한 관계에 대한 관심이 증가하고 있다(Park 등, 2014). 염증상태는 지방조직 내에서 TNF-α, MCP-1 및 NO와 같은 염증매개체를 분비함으로써 면역세포들과의 상호작용에 의해 심각한 대사성 질환(제2형 당뇨 및 심혈관계 질환) 및 합병증을 유발하는 것으로 알려져 있다. 따라서 비만과 염증, 지방조직과 면역체계, 지방세포와 면역세포와 관련된 연구가 필요하다.
19종의 모자반 추출물의 항염증 활성을 확인하기 위하여 RAW264.7 세포주에 19종의 모자반 추출물을 처리하였으며, LPS를 처리하여 NO 생성을 유도하였고, 각 모자반 추출물의 처리를 통한 NO 생성억제효과를 확인하였다. 실험결과(Fig. 4B), 비틀대모자반(85.44%), 외톨개모자반(84.73%), 잔가시모자반(83.42%), 큰열매모자반(81.20%), 그리고 꽈배기모자반(80.13%) 순으로 NO 생성을 80% 이상억제하는 우수한 효과를 보였다. Jeong 등(2014a)의 연구에서 잔가시모자반은 LPS로 염증을 유도한 대식세포의 NO 방출량을 80% 이상 감소시켰으며, cytokine 역시 눈에 띄게 감소시키는 결과를 보였다. 또한, 기존에 잔가시모자반(Jeong 등, 2014b)과 외톨개모자반(Kim 등, 2015b)이 아토피 피부 염증을 완화하고, 큰열매모자반이 Raw 264.7에 대한 우수한 항염증 활성을 나타낸다고 보고하였는데(Cheon 등, 2017), 기존 보고들로 미루어 볼 때, 모자반 추출물들이 염증 매개물질의 조절에 중요한 역할을 하는 것으로 사료된다.
한편, 높은 항산화 활성 및 지질 축적억제 효과를 보였던 꽈배기 모자반의 경우, 70% 이상의 높은 NO 생성억제능을 보여 항염 효과 또한 우수함을 나타내었는데, 꽈배기모자반이 함유한 페놀성 물질 분석과 다양한 생리활성 매커니즘에 대한 추가 연구가 요구된다.










