서 론
복숭아(Prunus persica L.)는 장미과(Rosaceae), 자두 속(Prunus), 복숭아과 속(Amygdalus)에 속하는 온대 낙엽성 과수로 약 3,000종의 품종이 있으며, citric acid, malic aicd 등의 organic acid를 많이 함유하고 있다고 알려져 있다 (18,19). 한국농촌경제연구원 농업관측본부에 따르면 복숭아 재배면적은 2007년 1만 3,338 ha에서 2017년 2만 214 ha로 51.6% 증가하였고, 연평균 4.2%씩 증가한 것으로 추정된다. 다른 과실에 비해 상대적으로 결과지 수가 많은 사과, 복숭아 등은 과다 결실에 의한 품질 저하가 우려되고 있어 고품질 재배의 효율을 높이기 위해 적과 작업을 생산에서 가장 중요한 작업 중 하나로 꼽고 있다. 복숭아의 경우 수정 여부가 확인되는 만개 후 20일 시기부터 예비 적과를 실시하며, 예비적과에서 본적과, 수정적과까지 약 10-20%의 과실을 적과하도록 권장하고 있다.
적과 시 발생하는 미숙 복숭아는 성숙과에 비해 여러 가지 성분 함량의 차이를 가져 유기산 물류, 무기물 등이 많이 존재하며, 미숙 과실 중에는 폴리페놀류 함량도 높게 존재하는 것으로 알려져 있다. 주요 유기산 성분으로는 oxalic acid, citric acid, malic aicd, tartaric acid 순으로 알려져 있으며 외피, 과육, 전체에서 가장 높은 양의 oxalic acid가 각각 47.5%, 39.3%, 31.4%를 차지하고 있고 이는 항산화, 항암, 구취제거, 미백 등에 효능이 있는 물질로 알려져 있다(7,12,13,15,20).
재배과정에서 전량 폐기되고 있는 적과 된 미숙과에 대한 연구는 다방면으로 진행되고 있으며 식품 및 화장품 산업 소재로서의 가치가 있다고 판단되어 연구가 활발히 진행 중인 것으로 보인다고 하였다(3,10,11,14,22,32). 그러나 적과 시기에 맞추어 수확한 복숭아를 기능성 화장품 소재로 효능 가치를 규명한 사례는 없다. 이에 본 연구는 매년 적과 작업으로 발생하고 폐기되는 미숙 복숭아를 이용하여 기능성 물질을 추출하고 이의 구조분석 탐색과 추출조건별로 이용 가치를 규명함으로써 활용가치를 높이고 기능성 소재로서의 가능성을 알아보고자 한다.
재료 및 방법
본 연구에 사용된 적과 복숭아는 경상북도 청도군에 위치한 복숭아 농가에서 채취하여 세척 후 씨를 분리하여 동결건조하고 20 mesh 이하로 분쇄 후 4℃에 보관하여 사용하였다. 첫 번째 추출조건으로 분쇄 분말 1 g 에 30배 중량의 물을 첨가하였으며, 60℃에서 24시간 추출하여 3회 반복 추출하였다. 두 번째 추출조건으로 분쇄 분말 1 g에 30배 중량의 70% 에탄올을 첨가하였으며, 24℃에서 24시간 추출하여 3회 반복 추출하였다. 세 번째 추출조건으로 분쇄 분말 1 g 에 30배 중량의 1, 5, 10% Surfactants(Polyoxyethylene Laurylether: Polysorbate 20 = 1:1 in water)를 첨가하여 각각 상온과 60℃에서 24시간 추출하여 상등액과 침전물을 분리하여 3회 반복 추출하였다. 이후 총 8가지 추출조건으로 추출된 추출액을 4℃ 냉장실에 보관하여 본 실험의 시료로 사용하였으며 아래 Table 1에 표기하였다.
핵자기공명분광분석에 사용된 기기 중 column chromatography 용 충진제는 Sephadex LH-20(10-25 μm, GE Healthcare Bio-Science AB, Sweden), ODS-SM-50B(50 μm, YAMAZEN, Osaka, Japan)을 사용하였으며, thin layer chromatography(TLC) plate는 TLC silica gel 60(Merck, Darmstadt, Germany)를 사용하였다. Medium pressure liquid chromatography(MPLC)는 Buchi(Sepacore 50, Swiss)를 이용하였고 컬럼은 glass column(26 mm×300 mm, 50 mm×600 mm)을 사용하였으며, 1H-,13C-NMRspectra는 AVANCE III HD 600(Bruker Biospin GmbH, Rheinstetten, Germany)로 측정하였다.
균주 배양에 사용된 배지는 BD/Difco Co.(Sparks, MD, USA)의 제품이며, 항균 활성 분석에 사용된 paper disc는 ADVANTEC Inc.(thickness 8 mm, CA, USA)에서 구입하였다. 그 외 실험에 사용된 모든 시약은(Sigma-Aldrich Co. st. Louis, MO, USA)로부터 구입하였다.
항산화 및 주름개선 시험에 사용된 기기는 UV spectrophotometer(Hitachi, Tokyo, Japan), rotary vacuum evaporator (Rikakikai Co., Tokyo, Japan), centrifuge(Hitachi, Tokyo, Japan), freeze drier(Ilsin, seoul, Korea), microscope(Olympus, Tokyo, Japan), CO₂incubator (Hanbaek Scientifc Co., Bucheon, Korea), BOD Inaubator(Hanbaek Co., Bucheon, Korea), autoclave (Hanbaek Scientfic Co., Bucheon, Korea), Western imaging system(CAS-400SM, Davinch-K, Seoul, Korea), ELISA reader(Molecular Devices, CA, USA), pH meter(Metrohm, Herisau, Switzerland)를 사용하였다.
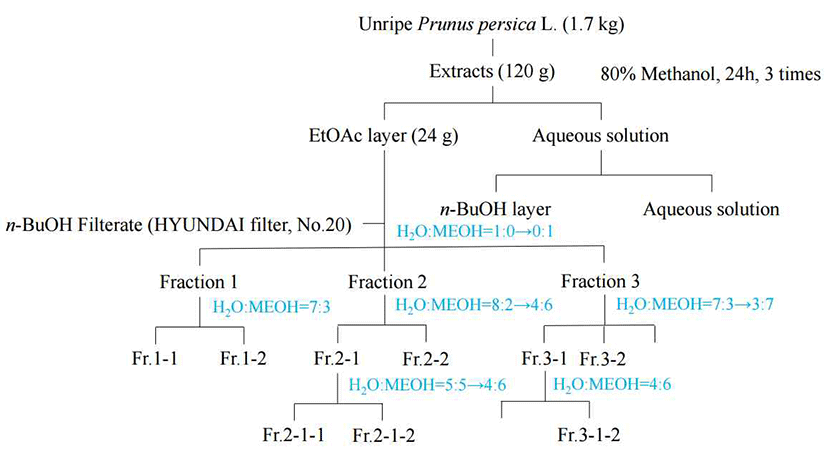
적과 복숭아 건조 시료 1.7 kg에 80% 메탄올 3 L을 넣고 24시간 동안 3회 침지 추출하였다. 추출액은 filter paper로 여과한 후 회전식 감압 농축기로 농축하였다. 제조한 분말 120 g을 증류수 1 L에 현탁시킨 후에 ethyl acetate(EtOAc) 1 L씩 3회, n-BuOH 1 L씩 3회 그리고 물 층으로 계통 분획하여 분획물을 얻는다. 분리 흐름도는 Fig. 1에 표기하였다.
1H-NMR(600 MHz, MeOD): δ 7.61(1H, d, J = 15.6 Hz, H-7), 7.06(1H, d, J = 2.4 Hz, H-2), 6.95(1H, d, J = 7.8, H-5), 6.78(1H, dd, J = 2.4, 7.8 Hz, H-6), 6.34(1H, d, J = 15.6 Hz, H-8), 5.42(1H, s, H-5'), 4.03(1H, brs, H-4'), 3.79(1H, brs, H-3'), 2.10 – 2.14(4H, m, H-2', 6'),
13C-NMR(150 MHz, MeOD): δ 167.3(COO), 148.0 (C-4),145.4(C-3), 145.3(C-7), 126.5(C-1), 121.5(C-6), 115.1(C-2), 114.3(C-5), 113.7(C-8), 74.6(C-1'), 72.3(C-3'), 71.0(C-4'), 40.5(C-2'), 35.8(C-6').
1H-NMR(600 MHz, MeOD): δ 7.33(2H, d, J = 7.2 Hz, H-2', H-6'), 6.83(2H, d, J = 7.2 Hz, H-3', H-5'), 6.21(1H, brs, H-8), 6.20(1H, brs, H-6), 6.87(1H, d, J = 8.4 Hz, H-5'), 5.39(1H, d, J = 10.8 Hz, H-2), 4.98(1H, d, J = 6.6 Hz, H-1''), 3.89-3.40(sugar moiety), 3.17(1H, dd, J = 16.8/13.2 Hz, H-3ax), 2.76(1H, dd, J = 15.6/1.8 Hz, H-3eq),
13C-NMR(150 MHz, MeOD): δ 198.1(C-4), 166.5(C-7), 164.2(C-5,C-9), 158.6(C-4'), 130.4(C-1'), 128.7(C-2',C-6'), 115.9(C-3',C-5'), 104.5(C-10), 97.6(C-6), 96.4(C-8), 80.2(C-2), 43.7(C-3), 100.7(C-1''), 77.8(C-5''), 77.3(C-3''), 74.2(C-2''), 70.7(C-4''), 61.8(C-6'').
1H-NMR(600 MHz, MeOD): δ 8.08(2H, d, J = 7.8 Hz, H-2', H-6'), 6.91(2H, d, J = 9.0 Hz, H-3', H-5'), 6.39(1H, brs, H-6), 6.20(1H, brs, H-8), 5.13(1H, d, J = 6.6 Hz, H-1''), 4.53(1H, brs, H-1'''), 1.13(3H, s, H-6'''), 3.27-3.96(sugar moiety).
13C-NMR(150MHz, MeOD): δ 181.1(C-4), 165.8(C-7), 163.5(C-5), 160.1(C-4'), 159.4(C-9), 158.7(C-2), 134.0(C-3), 130.9(C-2',C-9'), 121.3(C-1'), 114.7(C-3',C-5'), 103.2(C-10), 104.6(C-1''), 101.1(C-1'''), 101.0(C-6), 98.9(C-8), 76.7(C-3'''), 75.8(C-5''), 74.4(C-2''), 103.2(C-10), 104.6(C-1''), 101.1(C-1'''), 101.0(C-6), 98.9(C-8), 76.7(C-3'''), 75.8(C-5''), 74.4(C-2''), 74.3(C-4'''), 72.4(C-3'''), 70.8(C-2'''), 70.6(C-4''), 70.0(C-5'''), 68.3(C-6''), 16.5(C-6''').
1H-NMR(600 MHz, MeOD): δ 7.72(1H, brs), 7.60(1H, d, J = 6.0, H-6'), 6.87( 1H, d, J = 8.4, H-5') 6.41(1H, d, J = 1.8, H-8), 6.21(1H, brd, H-6), 5.18(1H, d, J = 6.6 Hz, H-1''), 3.87-3.40(sugarmoiety),
13C-NMR(150 MHz, MeOD): δ 180.0(C-4), 166.7(C-7), 163.6(C-9), 158.9(C-5), 158.9(C-2), 150.4(C-4'), 146.3(C-3'), 136.2(C-3), 123.4(C-6'), 123.3(C-1'), 118.2(C-5'), 116.5(C-2'), 106.5(C-10), 105.9( C-1''), 100.4(C-6), 95.1(C-8), 78.8(C-3''), 77.6(C-4''), 76.1(C-2''), 71.6(C-5''), 62.3(C-6'').
1H-NMR(600 MHz, MeOD): δ 8.08(2H, d, J = 8.4 Hz, H-2', C-6'), 6.91(2H, d, J = 8.4 Hz, H-3', H-5'), 6.41(1H, d, J = 1.2 Hz, H-8), 6.21(1H, J = 1.2 Hz, H-6), 5.28 (1H, d, J = 6.6, H-1'), 3.97-3.22(sugar moiety).
13C-NMR(150 MHz, MeOD): δ 178.1(C-4), 164.9(C-7), 160.1(C-4'), 157.1(C-2), 133.9(C-3), 130.8(C-2',C-6'), 121.3(C-1'), 114.6(C-3',C-5'), 105.4(C-10), 102.6(C-1''), 98.3(C-6), 93.3(C-8), 77.0(C-2''), 76.6(C-4''), 74.3(C-5''), 69.9(C-3''), 61.2(C-6'').
폴리페놀 정량은 100배 희석한 시료 용액 3 mL에 Folin-Ciocalteu phenol reagent 시약 1 mL를 가하고, 1N HCl 0.2 mL을 넣은 후, 포화용액 Na2CO3 1 mL을 가하여 혼합한 후 1시간 실온에서 방치하고, 640 nm에서 흡광도를 측정한 후, 표준물질인 tannic acid을 이용한 표준곡선으로부터 함량을 산출하였다.
플라보노이드 함량은 적과 복숭아 추출물을 시료액 0.1 mL에 10% aluminum nitrate 0.1 mL, 1 M의 potassium acetate 0.1 mL 그리고 80% ethanol 4.7 mL을 가하여 25℃에서 40분간 반응시킨 후 415 nm에서 흡광도를 측정하였다. 총 플라보노이드 정량은 quercetin(Sigma Co.,USA)을 이용하여 최종 농도가 0-500 μg/mL가 되도록 취하여 위와 동일한 방법으로 측정한 검량선으로부터 산출하여 함유된 플라보노이드 함량을 구하였다.
1,1-Diphenyl-2-picrylhydrazyl(DPPH) radical 소거능은 Blois 법(1)을 변형하여 측정하였다. 각 시료 용액 100 uL에 0.2 mM의 1,1-diphenyl-2-picryl-hydrazyl(DPPH) 50 μL 가하고 차광 상태에서 37℃에서 30분간 반응시켰다. 반응 후 517 nm에서 흡광도를 측정하였다. DPPH radical 소거능은 시료를 첨가하지 않은 대조 그룹과 흡광도 차이를 비교하여 free radical의 제거 활성을 백분율로 나타내었다.
ABTS+ radical 소거능 측정은 Roberta 등(26)의 방법으로 측정하였다. 이 실험에서, ABTS+ radical 소거능 측정은 7 mM ABTS와 2.4 mM potassium persulfate(K2S2O8)을 1:1로 혼합하여 암실에서 실온으로 24시간 동안 반응하였다. 사용 전에 ABTS+ 용액을 에탄올에 희석하여 734 nm에서 흡광도 값이 0.706±0.001이 되게 하여 사용하였다. ABTS+ radical 소거능은 시료를 첨가하지 않은 대조 그룹과 흡광도 차이를 비교하여 free radical의 제거 활성을 백분율로 나타내었다.
SOD 유사활성 측정은 Marklund 등(23)의 방법에 따라 시료 0.2 mL에 Tris-HCL Buffer 2.6 mL와 7.2 mM pyrogallol 0.2 mL을 가하고 37℃에서 10분간 방치한 후 1 N HCl 0.1 mL로 반응을 정지시킨 후 420 nm에서 흡광도를 측정하였다.
Hydrogen peroxide 저해활성 측정은 Jayaprakasha 등(9)의 방법을 변형하여 측정하였다. PBS로 희석한 40 mM H2O2 용액을 동량의 시료와 혼합하여 37℃에서 10분간 반응한 후 230 nm에서 흡광도를 측정하였다.
Elastase 저해능 실험은 Cannell 등(2)의 방법을 변형하여 측정하였다. 추출물을 일정 농도가 되도록 조제하여 0.5 mL씩 시험관에 취하고, 50 mM tris-HCI buffer(pH. 8.6)에 녹인 porcine pancreas elastase(2.5U/mL)용액 0.5 mL을 가한 후 50 mM tris-HCI buffer(pH 8.6)에 녹인 기질 N-succinyl-(L-Ala)3-p-nitroanilide(0.5 mg/mL)을 첨가하여 20분간 반응시켜 기질로부터 생성되는 p-nitroanilide의 생성량을 405 nm에서 측정한다. Elastase 저해 활성은 시료용액의 첨가구와 무첨가구의 흡광도 감소율로 나타낸다.
Collagenase 저해능 실험은 Cannel 등(2)의 방법을 변형하여 측정하였다. 반응구는 0.1 M tris-HCI buffer(pH 7.5)에 4 mM CaCl2를 첨가하여, 4-phenylazobenzylozycarbonyl–pro-Leu-Gly-pro-D-Arg(0.3mg/mL)를 녹인 기질액 0.25 mL 및 시료 용액 0.1 mL의 혼합액에 collagenase(0.2mg/mL) 0.15 mL를 첨가하여 실온에서 20분간 정치한 후 6% citric acid 0.5 mL을 넣어 반응을 정지시킨 후, ethyl acetate 1.5 mL을 첨가하여 320 nm에서 흡광도를 측정한다. Collagenase 저해 활성은 시료 용액의 첨가구와 무첨가구의 흡광도 감소율로 나타낸다.
Astringent(수렴) 활성 측정은 Lee 등(21)의 방법을 변형하여 측정하였다. 피부 단백질과 유사한 혈액 단백질 (hemoglobin)을 사용하여, 원심분리 용기에 각각의 시료 용액과 헤모글로빈 용액을 1:1로 넣어서 진탕 혼합한 다음 1,500 rpm에서 3분간 원심분리 후 407 nm에서 흡광도를 측정하였다. Astringent 활성 측정은 시료 용액의 첨가군과 무첨가군의 흡광도 감소율로 나타내었다.
항균 활성실험에 사용된 균주는 KRIBB(Daejeon, Korea) 구입한 것을 사용하였다. 전 배양 및 실험을 위해 액체배지는 Escherichia coli, Staphylococcus epidermidis 및 Pseudomonas aeruginosa의 액체 배지로서 nutrient broth(NB)를 사용하였으며, Staphylococcus aureus의 액체배지로서 tryptic soy broth(TSB)를 사용하였다. 고체배지는 상기의 액체배지에 agar를 넣어 BOD incubator에서 37℃로 배양한다. 또한, Candida albicans의 액체배지로서 YM boroth를 사용하며, 고체배지는 YM agar를 사용하여 BOD incubator에서 25℃로 배양하였다.
항균력을 pater disc 법으로 측정하였다. 평판 배지에 배양된 각 균주를 1 백금 이량 취하여 액체배지 10 mL에서 18-48시간 배양한 후, 액체배지 10 mL에 0.1 mL 접종하여 3-6시간 본 배양하였다. 평판 배지에 멸균 면봉으로 균주를 균일하게 도말한 후 멸균된 8 mm의 filter paper disc를 고체 평판 배지에 올려놓았다. 시료를 농도별로 filter paper disc에 흡수시켜 37℃ 또는 25℃에서 18-48시간 배양하여 disc 주위의 clear zone(mm)의 직경을 측정하였다.
결과 및 고찰
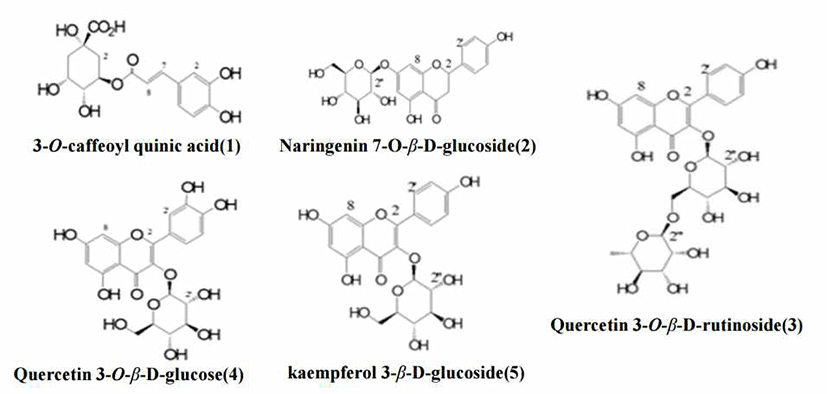
NMR분석에서 시그널 적분 강도는 해당 시그널에 나타나는 핵의 수에 비례하고 스펙트럼의 모든 양성자의 감도가 동일하여 검교정이 필요 없다는 장점이 있어 정량분석을 간편하고 효율적인 수단으로도 사용되고 있다(24). NMR 분석을통해 동정한 5가지 구조의 결과는 Fig. 2으로 나타났다.
화합물 1은 1H-NMR 데이터 해석으로 ABX-type의 방향 족 signal이 δ 7.06(1H, d, J = 2.4 Hz, H-2), 6.95(1H, d, J = 7.8 Hz, H-5), 6.78(1H, dd, J = 7.8, 2.4 Hz, H-6)이 관찰되었으며, trans-olefin signal이 δ 7.61(1H, d, J = 15.6 Hz, H-7) 및 6.34(1H, d, J = 15.6 Hz, H-8)이 관찰되었다. 또한 3개의 oxygenated proton signal이 δ 5.42(1H, s, H-5'), 4.03(1H, brs, H-4'), 3.79(1H, brs, H-3')와 함께 두 개의 methylene signal이 δ 2.01 - 2.14(4H, m, H-2',6')에서 관찰되었다. 13C-NMR 데이터 해석으로 한 개의 carbonyl carbon signal이 δ 167.3(COO)에서 관찰되었으며, 그 외 quinic acid 유래의 carbon signals이 δ 35.8-74.6 까지 관찰되었다. 이상 1H 및 13C NMR 데이터 해석 및 표품과의 HPLC 직접 비교분석으로 화합물 1은 quinic acid의 6번 위치에 caffeic acid가 ester 형태로 결합한 chlorogenic acid로 구조를 동정하였다.
화합물 2는 1H NMR 데이터 해석으로 A2B2 type의 방향족 signal이 δ 7.60(2H, d, J = 9.0 Hz, H-2',6') 및 6.87(2H, dd, J = 9.0 Hz, H-3',5')가 관찰되었으며, meta-coupled된 방향족 signal이 δ 6.41(1H, d, J = 1.8 Hz, H-8) 및 6.21(1H, d, J = 1.8 Hz, H-6)에서 관찰되었다. 추가적으로 δ 5.18(1H, d, J = 7.8 Hz, H-1'')의 anomer proton이 관찰되었으며, δ 3.87-3.40에 6개의 glucose유래의 oxygenated proton이 관찰되었으며, δ 5.49(J2,3eq = 1.8Hz, J2,3ax = 10.8Hz, H-2)의 doublet과 equatorial 및 axial proton으로 추정되는 δ 2.71과 3.30 (each 1H, each dd, Jab=15.6, 1.8Hz, H-3eq과 16.8, 13.2 Hz, H-3ax)이 관찰되었다. 13C NMR 데이터 해석에서도 15개의 방향족 carbon signal과 함께 6개의 glucose carbon signal이 관찰되었다. 이상 1H 및 13C NMR 데이터 해석 및 표품과의 HPLC 직접 비교분석으로 화합물 2은 naringein의 7번 위치에 gluose가 결합된 형태인 naringein 7-O-β-D-glucose로 구조를 동정하였다.
화합물 3은 1H-NMR spectrum에서는 δ 8.01(1H, d, J = 7.8 Hz, H-2', H-6')와 δ6.83(1H, d, J = 7.8 Hz, H-3', H-5')에서 A2B2 type의 aromatic proton이 존재하는 것을 확인하였다. 또한, δ 6.39와 δ 6.20 ppm에서 나타나는 각각의 broad singlet은 flavonoid A-ring의 H-8과 H-6이 meta-coupling이 이루어져 있는 flavonol moiety로 추정된다. δ 5.22(1H, d, J = 7.2 Hz, H-1'')에 관찰되는 β-glucose의 anomeric proton signal로 관찰되고, δ 5.13 ppm(1H, d, J = 1.2 Hz, H-1''')의 anomeric proton과 δ 1.14 ppm(1H, d, J = 6.6 Hz, H-1''')의 singlet proton이 관찰되어 α-rhamnose가 존재하는 것으로 확인되었다. 이상의 1H- 및 13C-NMR 데이터 해석 및 표품과의 HPLC 직접 비교로 화합물 3은 kaempferol의 3번 위치에 rutinoside가 결합된 kaempferol 3-O-rutinoside으로 구조를 동정하였다.
화합물 4는 1H-NMR에서 화합물 3과 매우 비슷한 signal들이 나타냈으며 δ 5.18에서 anomeric proton(J = 6.6 Hz, H-1'')와 δ 3.87-3.40에서 β-glucose에 해당하는 proton signal이 관찰되었고, ABX-type의 방향족 signal이 δ 7.06(1H, d, J = 2.4 Hz, H-2), 6.95(1H, d, J = 7.8 Hz, H-5), 6.78(1H, dd, J = 7.8, 2.4 Hz, H-6)이 관찰되었다. 이상의 1H 및 13C-NMR의 data와 표품과의 HPLC 직접 비교분석으로 quercetin의 3번 위치에 β-D-glucose가 결합된quercetin 3-O-β-D-glucose)로 구조 동정하였다.
화합물 5은 1H-NMR spectrum에서는 화합물 3과 매우 비슷한 signal들이 나타내었으나, 화합물 3에 측정된 rhamoside의 signal이 화합물 5에서는 관찰되지 않았다. 이상의 데이터 해석 및 HPLC 직접비교로 화합물 5는 kaemferol의 3번 위치에 glucose가 결합한 kaempferol 3-O-β-D-glucoside로 구조를 동정하였다.
폴리페놀 화합물은 다양한 구조와 분자량을 가지며, 단백질 및 기타 거대 분자들과 결합하는 성질을 가지고 항산화 효과 등의 생리 활성 효과를 가지는 것으로 알려져 있다. 표준물질인 tannic acid로 미리 작성한 표준 곡선의 흡광도 값과 비교하여 폴리페놀 함량을 측정한 결과는 아래 Table 2와 같다. 추출조건에 따른 적과 복숭아 추출물 중 surfactant 5% 이상의 용매로 추출한 sample에서 80.00 mg TAE/g 이상의 함량을 보이며 물과 에탄올을 용매로 한 추출물 보다 약 8배 이상의 함량을 나타내었다. Surfactant 10% 용매로 24℃, 60℃ 조건에서 추출한 sample에서 각각 117.67 mg TAE/g, 119.58 mg TAE/g 의 최고 함량을 나타내었다.
플라보노이드 함량은 적과 복숭아 추출물을 시료액 0.1 mL에 10% aluminum nitrate 0.1 mL, 1 M의 potassium acetate 0.1 mL 그리고 80% ethanol 4.70 mL을 가하여 25℃에서 40분간 반응시킨 후 415 nm에서 흡광도를 측정하였다. 총 플라보노이드 정량은 quercetin(Sigma Co.,USA)을 이용하여 최종 농도가 0-500 ug/mL가 되도록 취하여 위와 동일한 방법으로 측정한 검량선으로부터 산출하여 함유된 플라보노이드 함량을 구하였다. 함량 결과는 아래 Table 2 에 함께 표기하였다. 적과 복숭아 추출물의 플라보노이드 함량은 Surfactant 10%를 용매로 24℃, 60℃ 조건에서 추출한 sample에서 각각 117.67 mg TAE/g, 119.58 mg TAE/g 의 최고함량을 나타냈었다.
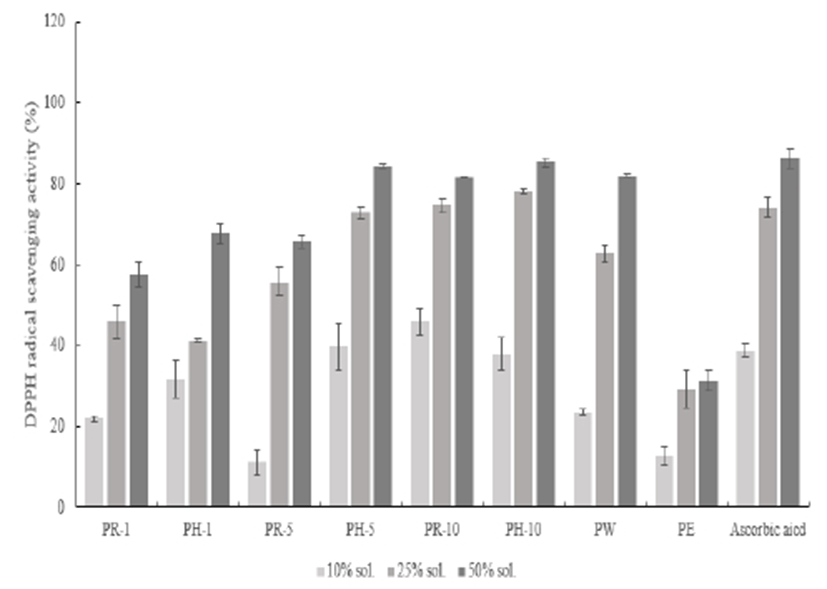
DPPH radical은 보랏빛을 나타내는 라디칼 물질로 항산화제와 반응하면 노란색으로 변하며 탈색 과정을 거친다. 일종의 전자 공여능을 측정하는 방법으로써 환원력이 클수록 강력한 항상화제가 된다고 볼 수 있어 항산화능을 측정하는 대표적인 방법으로 사용되고 있다(15). DPPH radical 소거능은 Fig. 3에서와 같이 나타내었다. 적과 복숭아를 각 8가지 용매로 추출하여 항산화능을 측정하였을 때, 각 추출조건에서 농도 의존적으로 증가하는 것이 측정되었다. 그중 PH-5, PR-10, PH-10, PW 최고 농도에서 80% 이상의 활성도를 나타내었다. 대조군으로 사용한 ascorbic acid의 99.81%와는 다소 차이가 있으나 적과 복숭아 추출물이 평균치 이상의 전자 공여능을 가지고 있다고 판단할 수 있다.
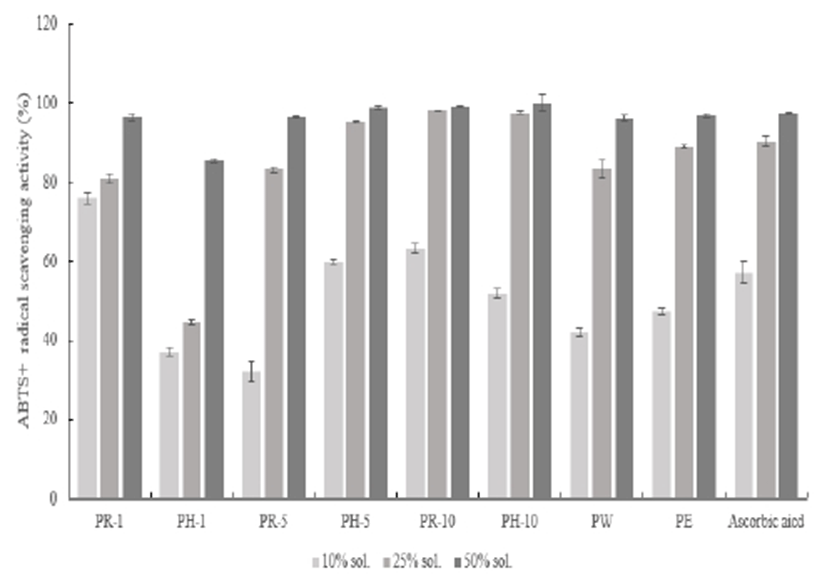
ABTS+ radical 소거능은 2,2’-Azino-bis(3-ethylbenzothiazoline-6-sulfonic aicd) diammonium salt(ABTS)와 potassium persulfate와의 반응으로 라디칼이 생성되어 청록색을 띠게 된다. 이 라디칼과 항산화제가 반응하면 연한 녹색으로 탈색 과정을 보인다 (26). ABTS+ radical 소거능은 Fig. 4에서와 같이 나타내었다. 적과 복숭아 추출물의 항산화능은 모든 추출조건에서 농도 의존적으로 나타내었으며, 대부분대조군인 ascorbic acid의 99.91%와 유사한 활성도를 나타내었다. 그중 페놀화합물 측정에서 높은 값을 보인 surfactant를 용매로 한 sample은 열수와 에탄올 추출물보다 더 높은 100% 이상의 값을 보이며 항산화제로서의 가능성이 있다고 판단된다.
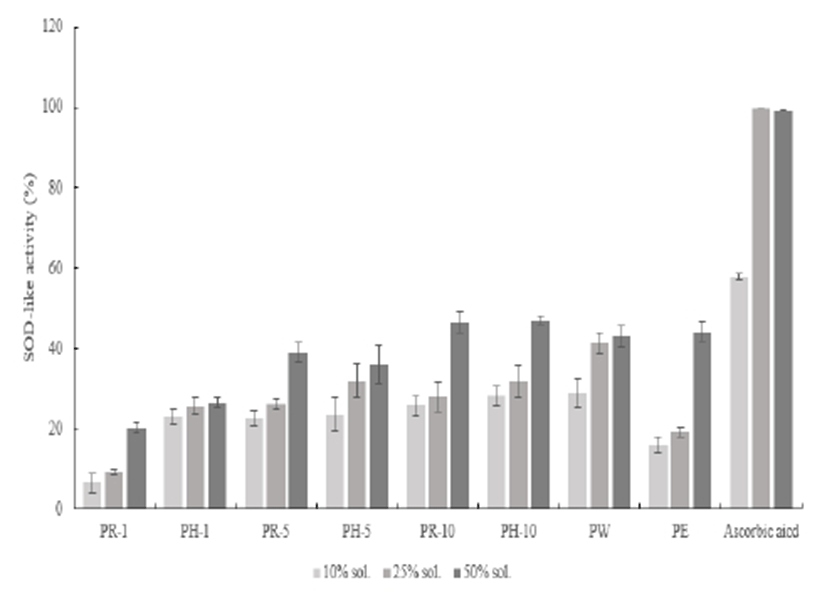
SOD 유사 활성 측정값은 Fig. 5에서와 같이 나타내었다. 대조 물질인 ascorbic aicd의 경우 최고 농도에서 99.23%의 활성을 나타내었으며, 샘플 군의 PR-10과 PH-10 추출조건에서 각 46.44%, 47.03%의 활성을 보였다.
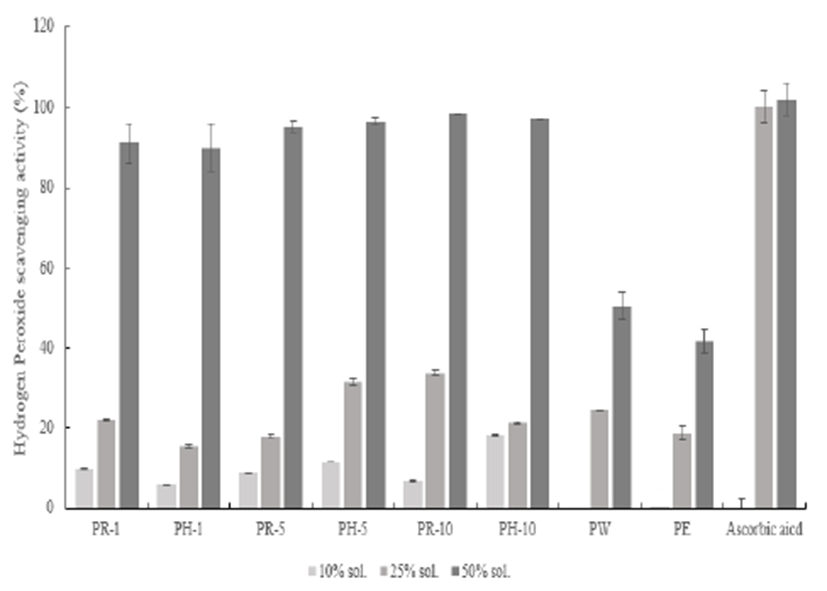
Hydrogen peroxide 저해 활성은 항산화제가 pro-oxidants의 함량을 감소시키는 정도를 항산화력으로 판단하여 실행되는 방법으로 유용하게 사용되고 있다(17). H2O2 저해 활성 측정값은 Fig. 6에서와 같이 나타내었다. Ascorbic acid를 대조물질로 사용하였으며 모든 추출조건에서 농도 의존적으로 저해활성도가 측정되었다. 추출조건별로 값을 분석한 결과, 열수와 에탄올을 용매로 한 적과 복숭아 추출물은 최고 농도에서 각각 50.47%, 41.67%의 저해 활성을 보였으나, PR-10의 최고 농도에서 98.51%의 저해 활성을 보이며 대조군과 유사하게 우수한 저해활성도를 보였다.
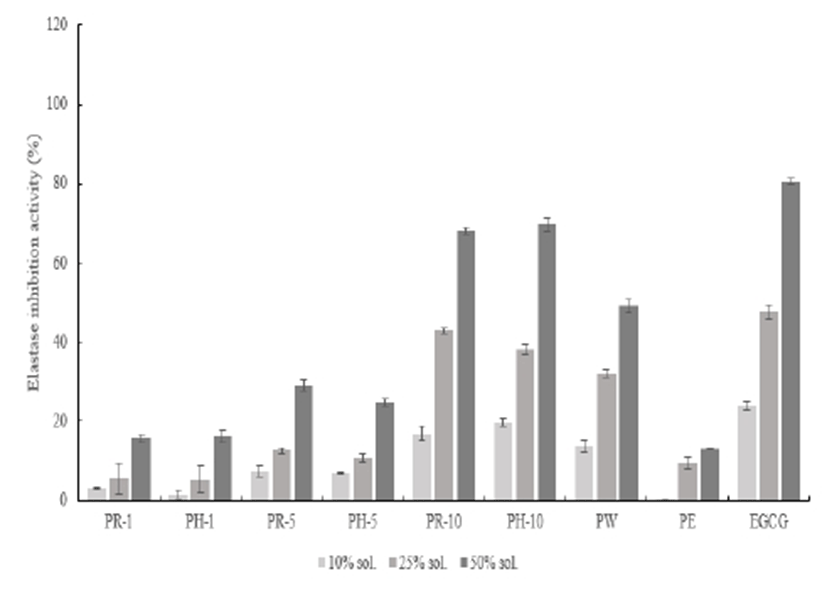
피부의 진피층에 존재하는 matrix-metalloproteinases (MMPs)는 피부 노화와 관련하여 특히 주름 생성과 밀접한 관계가 있다고 알려져 있다. MMPs를 이루는 주요성분으로는 collagenase, gelatinase 및 elastase 등이 있으며, 피부 속에서 이 단백질들이 외부 또는 내부적 스트레스로 인해 증가하게 되면 피부 노화 및 주름 생성에 관여하게 된다. 따라서 주름 생성에 관련된 elastase의 발현을 감소하는 것은 안티에이징에서 중요한 요소이며, 적과 추출물의 elastase 억제 작용에 관한 한 결과를 Fig. 7으로 나타내었다. 적과 복숭아 추출물은 모든 추출조건에서 농도 의존적으로 증가하는 결과 값을 보였으며, 열수와 에탄올 추출물에 비해 surfactant를 용매로 한 sample에서 저해능이 상대적으로 높게 측정되었다. surfactant 용매 sample과 대조군으로 사용한 EGCG (epigallocatechin gallate)의 활성도를 최고 농도에서 비교하면 약 10%의 낮은 저해 활성을 나타내었다.
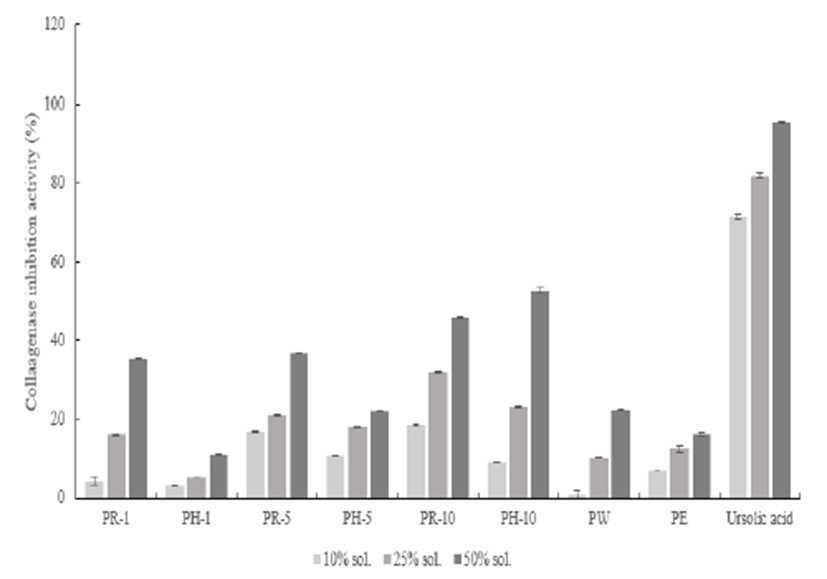
Collagenase은 진피층의 90% 이상의 상당 부분을 차지하고 있으며 피부의 주름과 보습에 관해 중요한 역할을 한다. 성장기를 거쳐 노화기에 들어 생합성이 감소하는 시기에 따라 감소하는 대표적인 물질이다. collagen을 분해하는 효소 중 대표적인 적인 collagenase이며 이 효소의 저해 정도를 나타낸 Fig. 8의 결과 값을 분석한 결과, 적과 복숭아 추출물은 모든 추출조건에서 농도 의존적으로 증가하는 반응을 보였으며, elastase 저해 활성 값과 유사하게 surfactant를 용매로 한 추출물이 다른 추출조건보다 저해능이 상대적으로 높게 측정되었다. 대조군으로 사용한 ursolic acid와 비교하였을 때 약 40%의 낮은 저해능을 보였다.
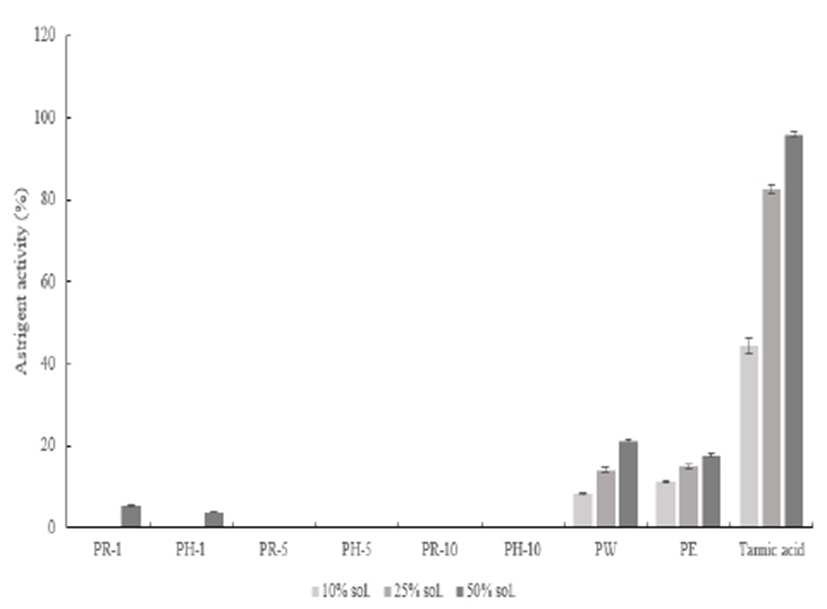
적과 복숭아 추출물의 astringent(수렴) 활성 측정은 추출조건별로 Fig. 9에 나타내었다. 수렴 활성은 열수와 에탄올을 용매로 한 추출물에서 각각 21.30%, 17.71%의 활성도를 나타내었으며, 그 외 추출조건에서는 활성도가 보이지 않았다. 대조군으로 사용한 tannic acid에서 95.91%의 값으로 비교하면 적과 복숭아 추출물의 수렴 활성은 미미한 것으로 판단된다.
적과 복숭아 추출물의 항균력 효과를 검토하기 위해서 Escherichia coli, Staphylococcus epidermidis, Staphylococcus aureus, Pseudomonas aeruginosa, Candida albicans 5개 균주에 대한 clear zone 형성을 관찰한 결과 Fig. 10에 나타내었다. 모든 균주에서 항균 반응이 나타나지 않았으며, 항균 활성에 대한 적과 복숭아의 효과는 미미한 것으로 보인다.

요 약
본 연구는 복숭아 재배 시에 발생하는 폐기물인 적과 복숭아를 화장품, 식품 등의 바이오 산업군에서 활용 가능한지를 연구하고자 적과 복숭아 추출물의 유용성 물질 분석, 항산화능, 피부 주름생성 저해능, 항균력을 알아보았다. 적과 복숭아를 NMR 분석법으로 동정한 결과, 3-O-cafffeoyl quinic acid, naringenin 7-O-β-D-glucose, kaempferol 3-O-rutinoside, quercetin 3-O-β-D-glucose, kaempferol 3-β-D-glucoside으로 총 5가지의 구조를 동정하였다. 그중 3-O-caffeoyl quinic acid 물질이 가장 많이 관찰되었으며, 이 구조 물질은 폴리페놀 화합물인 클로로겐산(Chlorogenic acid)이며, 항산화제의 속성을 가지고 라디칼 생성에 관여하는 효소를 억제한다고 알려져 있다(31). 선행연구결과를 바탕으로 본 화합물을 지표 성분으로 설정하여 기능성 화장품 소재로 활용 가능할 것으로 보인다.
적과 복숭아를 여러 가지 조건으로 추출하여 폴리페놀 및 플라보노이드 함량, 항산화, 주름생성 저해 활성, 항균 활성을 확인한 결과 PR과 PH(10% surfactant, 24℃ 또는 60℃) 조건으로 추출한 추출물이 가장 높은 폴리페놀 및 플라보노이드를 함유하였으며, 항산화능과 주름생성 저해 활성 또한 다른 추출조건에 비해 높을 것을 확인하였다. DPPH radical 소거능 실험에서는 PH-10에서 85.04%의 활성을 보였고, ABTS+ radical 소거능 실험에서 PH-10 에서 100.09%로 양성대조군인 ascorbic acid 보다 항산화능이 높았다. Superoxide dismutase 유사 활성 모든 추출조건에서 최고 활성 47.04%로 대조군에 비해 낮은 저해 활성을 나타내었지만, hydrogen peroxide 저해 활성실험에서는 PR-10에서 98.51%의 활성을 보이며 열수 및 에탄올 추출물보다 저해능이 높았다. 피부의 주름 형성에 관여하는 elastase와 collagenase 저해율을 측정한 결과 PH-10에서 각 69.75%, 52.72%로 최고 활성을 보였다.
따라서 본 연구에서 적과 복숭아 추출물의 항산화 물질의 함량이 높은 것과 항산화 효능을 지니는 것으로 확인됨으로써 항산화 화장품 및 건강기능식품 등의 소재로서 유용하게 사용될 수 있을 것으로 사료된다.