서 론
사과는 장미과의 낙엽교목의 식물인 사과나무(Malus pumila)의 열매이다(1). 전 세계적으로 많이 생산되는 과실 중 하나로 주로 중국, 미국, 터키, 폴란드, 이탈리아 등 북반구 온대지역에서 재배된다(1). 한국에서는 연간 약 50만 톤 정도 생산되고 있으며, 품종 개량 및 재배기술의 향상 등을 통해 한국에서 가장 많이 생산되는 과실 중 하나이다(2,3). 그 중 1988년 보급된 이후 재배면적이 꾸준히 증가하고 있는 홍로는 스피어리블레이즈에 스퍼골든데리셔스를 교배하여 개발한 사과 품종으로, 조직이 치밀하고 과즙이 많아 맛이 좋으며 단단하여 먼 거리를 수송가능하다는 장점이 있다(4).
사과에는 procyanidin, epicatechin, catechin, p-coumaroyl quinic acid, chlorogenic acid, rutin, quercetin, phloridzin 등의 다양한 종류의 폴리페놀 성분이 존재하며(5), 사과의 품종에 따라 폴리페놀 성분의 조성 및 함량에서 차이를 보이고 있다(6). 이러한 폴리페놀 성분으로 인해 in vitro에서 과산화수소에 의한 산화반응이 억제되는 것으로 입증되었다(7). 폴리페놀 성분은 활성산소에 의한 지질막 산화반응을 억제하여 암, 동맥경화증, 고혈압, 당뇨, 염증 및 노화 예방에 효능이 있다고 알려져 있으며 이에 대한 많은 연구가 진행되고 있다(8). 미숙상태의 사과인 풋사과는 성숙과에 비해 여러 가지 성분상의 차이를 가져 유기산, 아미노산, 칼슘이온 등이 많이 존재하며, 또한 폴리페놀 성분이 성숙과보다 10배 이상의 농도로 존재한다(9). 이러한 풋사과는 매년 재배과정 중에 5월 말에서 6월에 걸쳐 20-30%의 미숙과가 적과되어 폐기처분 되는 실정이며, 이는 경제적, 환경적 문제를 야기하므로 풋사과의 활용도 증진이 절실히 요구되어지고 있다.
일반적으로 사과와 같은 과실류에는 식이섬유, 폴리페놀 성분과 같은 활성 성분 외에도 상당량의 당분을 함유하고 있다(10). 그러므로 추출물에서 폴리페놀 성분을 농축하고 당분 및 고분자성 다당체 등을 효과적으로 제거할 수 있는 정제가 반드시 필요하다. 블루베리 추출물로부터 다공성 흡착제를 이용하여 폴리페놀 성분을 분리한 결과, chlorogenic acid 및 플라보노이드 성분 함량이 20배 이상 증가하였다고 보고된 바 있다(11). 다공성 흡착제는 비교적 저렴하고, 시료의 전처리 및 회수가 용이하며 대량 생산이 가능하여 최근 다양한 천연물에서 생리 활성 성분의 분리 및 정제에 사용되고 있다(12).
따라서 본 연구에서는 홍로 품종의 풋사과에서 폴리페놀 성분을 효율적으로 추출하고 분리하였으며, 항산화성과 항균성을 조사하고 폴리페놀 성분 조성을 분석하여 기능성 소재로의 활용성을 탐색하였다.
재료 및 방법
풋사과(Hongro, Samyoung F&B, Youngju, Gyeongsangdo, Korea)는 만개일로부터 51일이 지난 것을 실험에 이용하였으며, 직경 38.48±1.76 mm, 중량 27.02±3.30 g인 시료를 사용하였다.
풋사과로부터 폴리페놀 성분의 추출 효율을 높이기 위해 당분해효소인 Viscozyme L을 가하여 효소전처리를 하였다. 실험에 사용한 Viscozyme L(Viscozyme®L, 100 FBG/g)은 Novozyme Co.(Bagsvaerd, Denmark)로부터 구입하였다. 2,2-diphenyl-1-picrylhydrazyl(DPPH), 2,2′-azino-bis(3-ethylbenzothiazoline-6-sulfonic acid) diammonium salt(ABTS), 2,4,6-tris(2-pyridyl)-1,3,5-triazine(TPTZ), ferric chloride(FeCl3·6H2O), gallic acid, trolox, (±)-catechin, chlorogenic acid, caffeic acid, phloridzin은 Sigma-Aldrich Co.(St. Louis. MO, USA)의 제품을 사용하였고, Diaion HP-20은 Mitsubishi Chemical Co.(Tokyo, Japan)의 제품을 사용하였다. Acetonitrile은 HPLC용으로, 기타 용매 및 시약은 분석용 일급 시약으로 Duksan Co.(Seoul, Korea)에서 구입하였다.
폴리페놀 성분의 추출 및 분리 과정은 Fig. 1에 나타낸 것과 같다. 풋사과로부터 폴리페놀을 추출하기 위한 전처리로 당분해효소인 Viscozyme L을 이용하여 풋사과 추출물을 제조하였다. 당분해효소는 식물 세포벽 성분인 cellulose, hemicellulose 및 pectin 등을 분해하는 효소로 발효를 위한 당을 생산하거나 부산물에서 기능성 물질을 추출하기 위해 이용되고 있다(13). 또한 당분해효소는 식물 세포벽에 배당체로 존재하는 폴리페놀 성분을 가수분해하여 그 추출 효율을 증진시킬 수 있다(14). Viscozyme L은 cellulase, hemicellulase, β-glucanase, xylanase, arabanase로 구성된 다중효소복합체로 황기(15), 배(16) 등에서 우수한 폴리페놀 및 플라보노이드 추출 효율과 항산화성 증대 효과를 보였다.
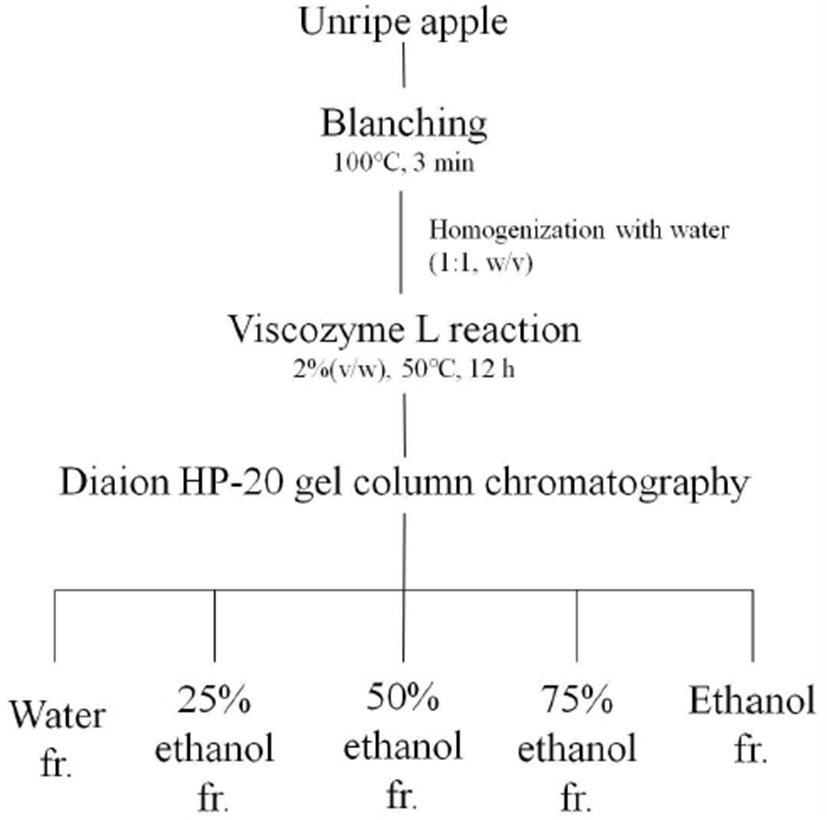
풋사과의 갈변을 방지하기 위하여 50 g의 풋사과를 사등분하여 100℃에서 3분간 스팀처리를 하였고, 그 후 50 g의 물을 첨가하여 블렌더(HB715, Tefal, Rumilly, France)를 이용하여 마쇄하였다. 적정 추출 조건을 설정하기 위하여 풋사과 마쇄물에 대한 Viscozyme L의 농도를 1%, 2%, 3%(v/w)로 달리 처리하고, 6 시간, 12 시간, 18 시간 동안 반응시키며 추출한 후, 총 페놀 함량을 측정하였다. 이 때 효소 반응은 50℃에서 120 rpm으로 교반하며 실시하였다. 그 후, 효소 불활성화를 위해 95℃에서 5 분간 열처리하였으며, 8,000 rpm에서 20 분 동안 원심분리 후 상등액을 감압 여과하여 실험에 사용하였다.
풋사과 추출물에서 폴리페놀을 분리하기 위해 HP-20 gel column chromatography를 실시하였다. 다공성 흡착 수지인 Diaion HP-20을 충진 시킨 column(26×500 mm)에 풋사과 효소 추출물을 흡착시켰다. 그 후, water, 25% ethanol, 50% ethanol, 75% ethanol, 100% ethanol을 순서대로 이동상 용매로 하여 500 mL씩 2.5 mL/min의 유속으로 통과시켜 각각의 용리액을 얻었다. 각 용리액은 농축하여 얻은 건고물에 증류수를 가하여 20 mg/mL의 농도로 재용해하여 실험에 사용하였다.
항산화 활성 및 항산화성분은 시료를 1 mg/mL의 농도로 희석하여 측정하였다. DPPH 라디칼 소거 활성은 Blois(17)의 방법을 응용하여 측정하였다. 시료 20 μL에 200 μM DPPH solution 180 μL를 가하여 30 분 동안 암실에서 반응시킨 다음, 517 nm에서 흡광도를 측정하였다. Gallic acid의 검량선의 회귀식을 이용하여 mM GAE로 나타내었다. ABTS 라디칼 소거 활성은 Re 등(18)의 방법을 응용하여 측정하였다. 시료 20 μL에 7.4 mM ABTS와 2.45 mM potassium persulfate를 1:1로 혼합하여 제조한 ABTS solution을 180 μL를 가하여 5 분 동안 암실에서 반응시킨 다음, 734 nm에서 흡광도를 측정하였다. Trolox의 검량선의 회귀식을 이용하여 mM TE로 나타내었다. FRAP 활성은 Benzie와 Strain(19)의 방법을 이용하여 측정하였다. Acetate buffer(300 mM, pH 3.6)와 10 mM TPTZ solution 및 20 mM ferric chloride solution을 10:1:1의 비율로 혼합하여 cocktail solution을 만들었다. 시료 25 μL에 cocktail solution 175 μL를 가하여 30 분 동안 암실에서 반응시킨 다음, 590 nm에서 흡광도를 측정하였다. Trolox의 검량선의 회귀식을 이용하여 mM TE로 나타내었다.
총 페놀 함량은 Folin-Ciocalteu 방법(20)을 이용하여 측정하였다. 시료 100 μL에 Folin-Ciocalteu regent 50 μL와 20% sodium carbonate 300 μL를 가하여 15 분간 반응시켰다. 증류수 1 mL를 가한 후, 원심분리하여 상등액을 725 nm에서 흡광도를 측정하였다. Gallic acid의 검량선의 회귀식을 이용하여 mg%로 나타내었다. 총 플라보노이드 함량은 Jia 등(21)의 방법을 응용하여 측정하였다. 시료 70 μL에 50% ethanol 430 μL와 5% sodium nitrate 50 μL를 가하여 5 분간 반응시켰다. 10% aluminium nitrate nonahydrate 50 μL를 가해 6 분간 반응시킨 후, 1 N sodium hydroxide를 500 μL 가하여 510 nm에서 흡광도를 측정하였다. (±)-catechin의 검량선의 회귀식을 이용하여 mg%로 나타내었다.
항균 활성은 Agar diffusion method(22)로 측정하였다. 균주는 2종의 그람 양성균(Bacillus cereus ATCC 14579, Staphylococcus aureus ATCC 6538)과 2종의 그람 음성균(Escherichia coli O157 ATCC 43894, Salmonella typhimurium KCCM 40253)을 사용하였다. 실험을 위해서 trypticase soy broth(TSB, Difco Laboratories Inc., Sparks, MD, USA)에 균주를 배양해 1×108 CFU/mL로 희석한 현탁액 200 μL를 trypticase soy agar(TSA)에 분주하였으며, 멸균한 paper disc(8 mm. Advantec Co., Tokyo, Japan)를 표면에 부착시키고 20 mg/mL의 시료를 50 μL만큼 흡수시켰다. 그 후, 18-24 시간 동안 B. cereus는 30℃에서 배양시켰으며 S. aureus와 E. coli, S. typhimurium은 37℃에서 배양시켰다. Positive control로 1 mg/mL 농도의 ampicillin(Sigma-Aldrich Co.), negative control로 50% ethanol을 사용하였다. Paper disc 주위의 inhibition zone(mm)을 측정하여 항균 활성을 비교하였다.
분리된 각 획분의 폴리페놀 성분은 thin layer chromatography(TLC)와 high performance liquid chromatography(HPLC, 1260 infinity quaternary LC system, Agilent Technologies, Santa Clara, CA, USA)를 이용하여 분석하였다.
TLC는 Silica gel 60 TLC plates(20×20 cm, Merck, Darmstadt, Germany)에 시료를 점적하여 혼합용매를 이용해 전개하였다. 혼합용매로는 dichloromethane/methanol/ formic acid(100/9/4, v/v/v)와 ethyl acetate/water/formic acid(13/4/3, v/v/v)을 사용하였다. 10% 황산 용액(v/v)을 분무하여 발색시킨 후 표준물질(caffeic acid, chlorogenic acid, phloridzin)과의 retention factor (Rf) 수치를 비교하였다.
HPLC는 5 mg/mL의 시료를 0.45 μm membrane filter(DISMICⓇ-25HP, Advantec Co., Ltd., Tokyo, Japan)로 여과하여 실험에 사용하였다. Develosil ODS-HG-5 column(150×4.6 mm, Nomura Chemical Co., Ltd, Seto, Japan)을 이용하여 분석하였고, column 온도를 35℃로 유지하였다. 이동상은 2% acetic acid in water(solvent A)와 0.5% acetic acid in 49.5% acetonitrile(solvent B)을 이용하여 gradient elution 조건으로 분석하였다. 이동상의 유속은 1.0 mL/min, 시료주입량은 20 μL이었으며, 290 nm에서 측정하였다. 폴리페놀 성분의 함량 측정은 표준물질(caffeic acid, chlorogenic acid, phloridzin, p-coumaric acid)을 이용하여 작성한 검량곡선의 회귀식을 이용하여 구하였다.
결과 및 고찰
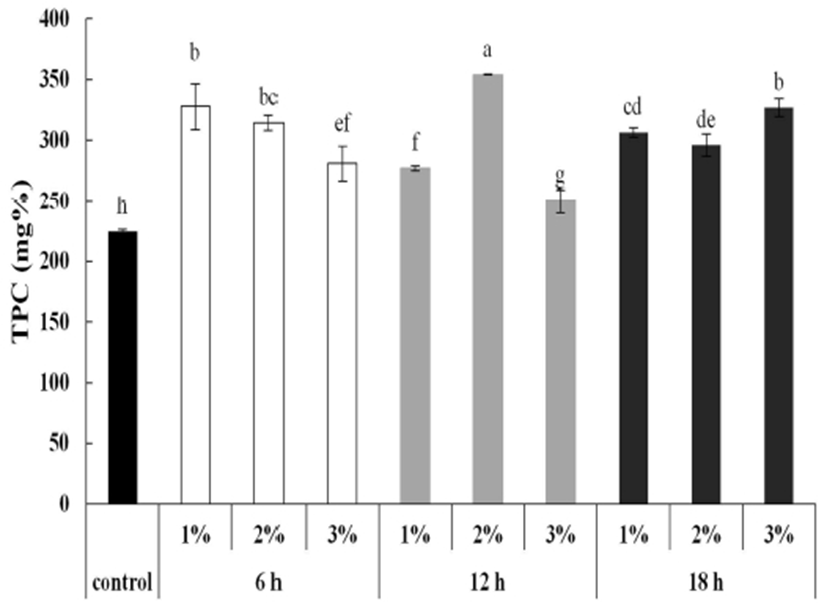
풋사과에 당분해효소 Viscozyme L을 기질에 대한 효소 농도(1, 2, 3%)와 효소 반응시간(6, 12, 18 h)을 달리하여 추출하였을 때, 총 페놀 함량을 측정한 결과는 Fig. 2와 같다. 기질에 대한 효소 농도 2%(v/w), 효소 반응시간 12 시간에서 354.01 mg%로 가장 높은 총 페놀 함량을 나타내어 이를 적정 효소처리 조건으로 설정하였다(p<0.05). 적정 효소처리 조건에서 반응시켰을 때 효소를 처리하지 않은 대조군에 비해 총 페놀 함량이 높아졌다(p<0.05). Park과 Kim(13)에 따르면 당분해효소인 Viscozyme L과 Pectinase를 사과껍질에 2%의 농도로 12 시간 처리하였을 때 항산화능이 증진되었음을 밝히고 있으며, 또한 Zheng 등(23)의 연구 결과에서 풋사과에 Viscozyme L을 1.92% 농도로 처리하여 47.12℃에서 12.52 시간 반응하였을 때 최적의 효소 반응을 나타내어 본 결과와 유사함을 보였다.
앞서 설정한 조건으로 추출한 풋사과 효소 추출물을 Diaion HP-20 gel column chromatography를 이용하여 water, 25% ethanol, 50% ethanol, 75% ethanol, 100% ethanol로 용출시켜 5가지 획분을 얻었다. Diaion HP-20은 비극성 흡착 수지로 구형 입자를 가지며, 천연물에서 이차 대사산물을 추출하고, 당을 제거하며 중금속 이온을 분리하는 데 가장 효과적인 흡착제이다(24).
풋사과 효소 추출물과 HP-20 chromatography 획분의 항산화 활성을 측정한 결과를 Table 1에 나타내었다. DPPH 라디칼 소거 활성, ABTS 라디칼 소거 활성 및 FRAP 활성 모두 50% ethanol 획분에서 가장 높았다(p<0.05), 풋사과 효소 추출물에 비하여 25% 및 50% ethanol 획분에서 항산화 활성이 모두 높아졌으며, 이는 오가피 추출물의 20% 및 40% ethanol 획분에서 우수한 DPPH 및 superoxide radical 소거능을 보인 것과 유사한 결과이다(25). 풋사과 효소 추출물과 HP-20 chromatography 획분의 항산화성분을 총 페놀 함량 및 총 플라보노이드 함량으로 측정한 결과는 Table 2와 같다. 50% ethanol 획분에서 총 페놀 함량 및 총 플라보노이드 함량이 가장 높았다(p<0.05). 풋사과 효소 추출물에 비하여 25%, 50%, 75% ethanol 획분에서 항산화성분 함량이 높아졌으며, 이는 HP-20 chromatography로 인해 추출물에 함유된 과당 및 비폴리페놀 성분이 효과적으로 제거되고 폴리페놀 및 플라보노이드 성분의 분리 및 정제가 이루어졌다고 사료된다. 이와 유사하게 HP-20 수지에 의해 복분자 딸기 추출물에서 폴리페놀 성분이 분리되고 항산화 효과가 증진되었다는 연구보고가 있었다(10).
풋사과 효소 추출물과 HP-20 chromatography 획분의 항균 활성은 Table 3과 같다. B. cereus, S. aureus 및 E. coli O157에 대해 50% ethanol 획분에서 12.33 mm, 12.83 mm, 9.83 mm로 가장 넓은 inhibition zone을 확인할 수 있었으며(p<0.05), 25% ethanol 획분에서 10.33 mm, 9.33 mm, 9.83 mm로 나타났다. 효소 추출물에서 항균 활성을 보이지 않은 반면, gel column chromatography를 통하여 얻은 50% ethanol 획분에서는 매우 뚜렷한 저해활성을 나타내었다. 식물 추출물의 항균 활성은 페놀성 물질과 상관관계가 있으며(26), 플라보노이드 함량이 높을수록 항균효과가 높다고 보고되어 있다(27). 50% ethanol 획분에서 폴리페놀 성분이 분리되었을 것으로 사료되며, 이를 이용하여 항균활성을 가지는 기능성 폴리페놀 소재로의 활용가능성을 제고하였다.
풋사과 효소 추출물과 HP-20 column chromatography 획분의 폴리페놀 성분을 TLC로 확인하였다. Dichloromethane/methanol/formic acid(100/9/4, v/v/v)로 전개하였을 때, caffeic acid의 Rf 값은 0.32로 25%, 50% ethanol 획분에서 검출되었다. Ethyl acetate/water/formic acid(13/4/3, v/v/v)로 전개한 결과, chlorogenic acid의 Rf 값은 0.60으로 25% ethanol 획분에서 확인할 수 있었으며, 다른 획분에서는 확인되지 않았다. Phloridzin의 Rf 값은 0.79로 25%, 50% ethanol 획분에서 관찰되었다.
풋사과 효소 추출물과 HP-20 column chromatography 획분의 폴리페놀 성분을 HPLC를 이용해 확인한 결과는 Table 4 및 Fig. 3과 같다. Retention time 9.23 분에서 chlorogenic acid가 검출되었고, 10.09 분에서 caffeic acid, 16.06 분에서 p-coumaric acid, 그리고 32.68분에서 phloridzin이 검출되었다. 50% ethanol 획분에서 가장 폴리페놀 성분 함량이 많았으며, 풋사과 효소 추출물에 비해 높은 값을 나타냈다(p<0.05). 풋사과 효소 추출물에 함유된 당이 water 및 25% ethanol 획분에서 제거되었으며, 50% ethanol 획분에서 가장 많은 폴리페놀이 분리되었음으로 사료된다. 50% ethanol 획분에서 caffeic acid의 함량은 387.88 μg/mL, p-coumaric acid는 226.34 μg/mL, phloridzin는 187.33 μg/mL으로 나타났으며, caffeic acid, p-coumaric acid, phloridzin 순으로 높은 함량을 보였다.
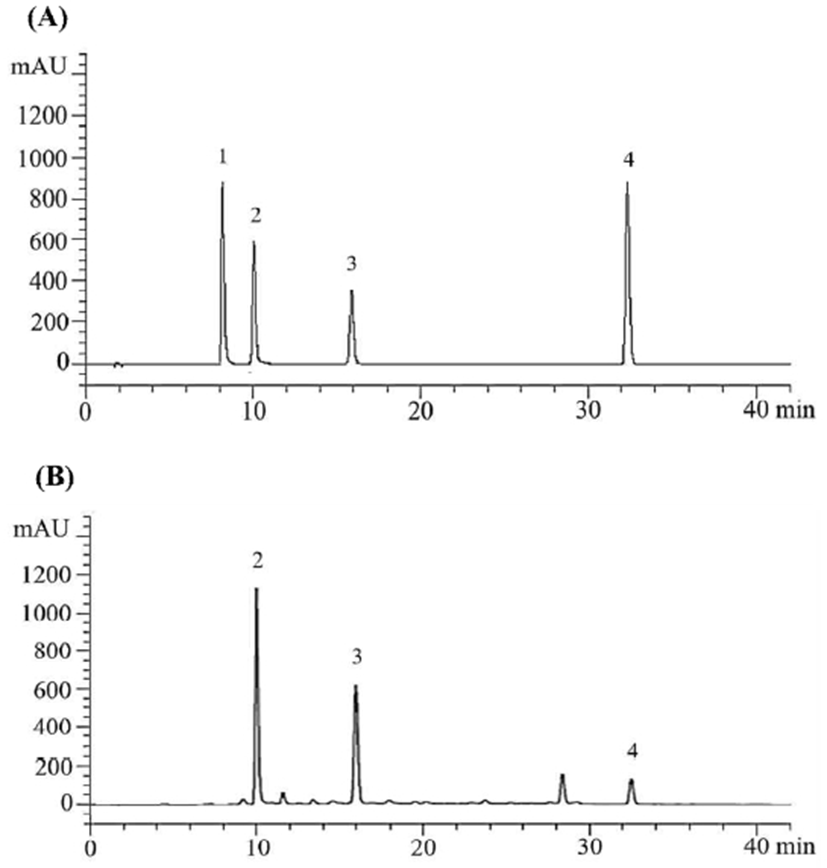
풋사과 효소 추출물 및 HP-20 column chromatography 획분에서 caffeic acid의 함량이 chlorogenic acid의 함량보다 높게 나타났으며(p<0.05), 풋사과 추출물에서 caffeic acid 함량이 chlorogenic acid보다 낮은 다른 연구결과와 차이를 나타냈다(3,28). 이는 caffeic acid 및 quinic acid의 에스테르 화합물인 chlorogenic acid가 풋사과 추출 시 첨가한 당분해 효소에 의해 분해되어 caffeic acid가 증가하였음으로 사료된다(29).
요 약
본 연구에서는 홍로 품종의 풋사과에서 폴리페놀 성분을 효율적으로 추출하고 분리하여 항산화성과 항균성, 폴리페놀 성분 조성을 분석함으로써 기능성 폴리페놀 소재로의 활용 가능성을 탐색하고자 하였다. 풋사과를 100℃에서 3 분간 스팀처리를 하여 갈변을 억제한 후, Viscozyme L 효소처리 조건을 총 페놀 함량이 우수하였던 기질에 대한 효소 농도 2%(v/w), 반응시간 12 시간으로 설정하여 풋사과로부터 폴리페놀을 추출하였다. 이 때 총 페놀 함량은 354.01 mg%였으며, 이는 효소를 처리하지 않은 대조군의 총 폴리페놀 함량에 비해 높은 값을 나타냈다(p<0.05). 풋사과 추출물에서 폴리페놀 성분을 분리하기 위해 풋사과 효소 추출물을 Diaion HP-20 gel column chromatography를 이용하여 water, 25, 50, 75, 100% ethanol로 용출하였다. 각 용매에 대한 획분을 얻었으며, 각 획분의 항산화 활성 및 성분을 조사한 결과, 50% ethanol 획분에서 가장 높은 항산화 활성과 항산화 성분을 보였다(p<0.05). 항균 활성 또한 50% ethanol 획분에서 가장 컸다(p<0.05). 이를 통해 50% ethanol 획분에서 항산화 및 항균 활성을 나타내는 폴리페놀의 분리가 이루어진 것으로 사료된다. 풋사과에서 분리된 폴리페놀 성분을 HPLC를 이용해 확인한 결과, 50% ethanol 획분에서 가장 폴리페놀 성분 함량이 높았으며(p<0.05), caffeic acid, p-coumaric acid, phloridzin을 확인할 수 있었다. 따라서 풋사과 효소 추출물의 50% ethanol 획분을 이용하여 기능성 폴리페놀 소재로의 활용이 가능할 것으로 사료되며, 향후 연구가 심도 있게 진행되어야 할 것이다.










