서 론
복잡한 사회경제 구조에 따른 과도한 경쟁과 스트레스로 인한 고도음주자가 늘어나면서 이들의 심각한 건강문제로 인해 천연물로 제조된 건강기능성 식품이나 약용식물로 만든 담금주에 대한 관심이 높아지고 있다. 만성적으로 다량의 알코올을 섭취 할 경우 면역기능 손상, 고지혈증, 위장장애 이외에 지방간을 포함한 알코올성 간질환이나 여러 종류의 건강장해가 유발된다(1,2). 특히, 고용량의 알코올에 노출될 경우 기억력을 관장하는 해마 및 대뇌피질의 GABA와 glutamate의 불균형으로 알코올성 블랙아웃(black out)과 같은 알코올성 기억장애 및 알코올성 치매 등 뇌 질환을 일으켜서 개인의 건강과 삶의 질을 떨어뜨려 사회적으로 큰 문제가 되고 있다(3,4). 현재까지 알코올에 의한 신경계 독성의 원인 및 작용 기전에 대해서는 명확히 밝혀지지 않고 있으나 nitric oxide(NO)의 과다 생성과 같은 산화적 스트레스가 원인으로 알려져 있다(5).
알코올에 의한 산화적 스트레스는 알코올 자체뿐만 아니라 알코올 대사산물인 acetaldehyde와 활성산소(reactive oxygen species, ROS)와 같은 자유라디칼(free radicals)의 과도한 생성으로 유발된다. 그 결과 과산화지질의 증가나 항산화 활성의 손상 등으로 인해 뇌 세포 손상과 기억력 저하가 일어나는 것으로 보고되고 있다(6,7). 그러나 알코올의 산화적 스트레스에 대한 생체 방어로는 superoxide dismutase(SOD), glutathione peroxidase(GSH-Px), catalase 등의 효소적 방어체계 및 비타민 A, E, C 등의 항산화 비타민 및 polyphenol, flavonoid 등의 생리활성 물질인 비효소적 방어체계가 있다(1,8). 최근에는 flavonoid의 신경계에 대한 보호효과에 관한 연구에 대해 활발히 진행되고 있으며, 그 기전으로 flavonoid는 산화적 스트레스에 의한 자유라디칼의 효과적인 제거를 통해 일어나는 것으로 알려지고 있다(9).
천연물 중 백하수오(Cynanchi wilfordii radix) 뿌리에서 추출된 시난콜(cynanchol), 사코스틴(sarcostin) 등의 생리활성물질과 배당체(gagaminine) 성분은 자유라디칼 소거 기능을 통하여 과산화지질 생성과 acetaldehyde의 산화 활성을 저해시킨다(10). 이러한 기전을 통해 백하수오는 항노화, 자양강장, 보혈작용 이외에도 동맥경화 억제 효과, 고지혈증 및 당뇨 예방 개선 효과, 혈관이완 효과를 보이는 것으로 밝혀졌다(11). 그 반면에, anthraquinone 화합물인 chrysophanol, emodin, rhein, physcion 및 2,4,6,4'-tetrahydroxystilbene-2-Ο-β-D-glucoside를 비롯한 배당체를 함유하고 있는 적하수오(Polygoni multiflori radix)는 항균(12), 항암(13), 항산화(14), 항염증(15) 및 신경보호(16) 효과 등이 보고되었다. 백하수오에 대한 생체 효능 연구결과로는 분쇄된 백하수오 2 kg을 80% 에탄올로 추출한 추출물을 Sprague-Dawley (SD) 흰쥐에게 투여하였을 때, 혈압 저하 작용과 함께 지질대사 개선 효과를 보였다(17). 또한 고지방식이를 섭취한 실험동물에게 ethyl acetate로 추출한 백하수오 추출물을 6주간 공급한 결과, 과산화지질 억제와 항산화 효소 활성을 유의하게 증가시키는 것으로 나타났다(18). 이외에도 고지방 식이 공급으로 혈관 손상이 유도된 실험동물에게 백하수오 추출물을 공급한 결과, 백하수오의 구성성분인 gagaminine, wilfoside 등에 의해 항산화 효과 및 비정상적 혈관 생성의 억제로 혈관 기능이 개선되었다고 보고되었다(19).
허혈성 뇌손상을 억제하고 산화적 손상에 의한 동맥경화 예방작용 및 학습 능력과 기억력 개선 효과가 있는 적하수오를 수준별로 첨가하여 만든 약용주에서는 발효 기간이 증가하면서 총 phenol 함량의 증가현상이 관찰되었다(20). 치매환자 등에 대한 기억력 개선 약물로는 뇌 조직의 신경 전달물질인 acethylcholine의 분해 효소인 acethylcholin esterase(ACh-E) 효소 활성을 억제하여 뇌 속의 acethylcholine 농도를 증가시키는 방법이 이용되고 있다(21). Won 등(22)은 ACh-E 효소 활성 억제 효과는 미나리 추출물의 flavonoids와 phenol 성분에 의한 것이며, 그 기전은 이들 성분의 항산화 활성을 통해 산화적 스트레스를 감소시킴으로써 기억력을 개선시키는 것으로 설명하고 있다. 그러나 현재까지 동물 및 임상 연구영역에서 하수오의 항산화 활성이나 기억력 개선 효과에 대한 미흡한 실정이다.
본 연구진의 선행된 연구(7)에서는 백하수오 및 적하수오 담금주를 섭취했을 때 담금 소주를 섭취한 경우 보다 혈청과 뇌 조직 내의 acethylcholine 농도는 높은 반면에, ACh-E 효소는 억제효과를 보였다. 이러한 결과는 담금 소주보다는 백하수오 담금주나 적하수오 담금주를 마셨을 때 기억력 손상을 감소시킬 수 있을것으로 기대된다. 이에 본 연구에서 백하수오와 적하수와 담금주의 섭취에 따른 기억력 손상에 대한 조절기전으로서 하수오 담금주의 항산화력을 규명하기 위하여 하수오 담금주를 섭취한 흰 쥐의 혈청과 뇌 조직의 과산화지질 함량 및 항산화 효소 활성을 분석하였다.
재료 및 방법
본 실험에서는 경상남도 하동에서 직접 채취한 백하수오와 적하수오 뿌리를 사용하였다. 하수오 담금주 제조는 Hwa(23)의 제조방법에 의거하였으며, 구체적인 제조 방법으로는 백하수오와 적하수오 뿌리를 일반 음용수로 깨끗이 세척한 다음 그늘에서 일정 시간 동안 수분을 제거하였다. 그런 다음 백하수오와 적하수오 뿌리를 각각 95 g씩 취한 다음 일반가정에서 사용하는 30% 담금 소주(참이슬 담금주, Jinro, Changwon, Korea)를 넣어 1 L가 되도록 하였다. 이렇게 제조된 담금주는 밀봉용기에 담은 다음 음지에서 6년 정도 숙성시킨 후 개봉하였다. 개봉된 하수오 담금주의 알코올 함량를 주정계(ATAGO, Tokyo, Japan)로 측정한 결과, 백하수오 담금주는 30.5%, 적하수오 담금주는 31.0%이었다. 각각의 하수오 담금주에 증류수를 가하여 25% 알코올 농도로 희석 한 다음 액체 실험식이(liquid diet)로 만들어서 실험동물에게 공급하였다.
체중이 300-350 g 정도의 생후 10주령이 된 수컷 SD계 흰쥐를 효창사이언스(Hyochang Science, Daegu, Korea)에서 구입하여 사용하였다. 실험동물의 사육실 환경온도는 22±1℃, 상대습도는 65±5%, 명암은 12시간 주기(09:00-21:00)로 조절하였다. 2주 적응기간 동안 실험동물은 일반배합 고형사료(Jeil, Feed Co., Ltd. Korea)와 음용수를 자유롭게 섭취하였다. 그런 다음 난괴법에 의거하여 4개의 실험군으로 무알코올 섭취군(C), 25% 담금 소주 섭취군(A), 백하수오 담금주 섭취군(WA), 적하수오 담금주 섭취군(RA)으로 나눈 다음, 각 처리 군당 10마리씩 각각의 cage에서 6주 동안 알코올이 함유된 액체 실험식이를 공급하였다. 액체 실험식이는 Table 1과 같이 무알코올 섭취군은 설탕으로, 알코올 섭취군은 25% 알코올(담금 소주, 백하수오 담금주, 적하수오 담금주)를 각각 첨가하여 증류수로 용해시켜 제조하였다. 이때 액체 실험식이는 1 mL당 1 kcal 열량을 공급할 수 있도록 조제하였으며, 알코올 섭취량은 전체 열량의 12%로 조정하였다(24). 액체 실험식이와 물은 자유로이 섭취할 수 있게 하였으며, 실험기간 중 식이조제는 매일 제조하여 냉장보관하여 신선한 상태로 공급하였다. 본 연구에서의 모든 실험동물의 구입과 사육의 모든 과정은 대구한의대학교 동물실험윤리위원회의 승인 하에 실시되었다(DHU 2015-045).
실험동물은 12시간 절식시킨 후, CO2로 가볍게 마취시켜 개복한 즉시 복부대동맥에서 재취한 혈액을 실온에서 약 30분간 방치한 후 3,000 rpm에서 15분간 냉장상태에서 원심분리하여 얻은 혈청을 실험에 사용하였다. 뇌 조직은 단두법으로 처리하여 적출한 즉시 여과지로 물기를 제거한 다음 무게를 측정한 후, 알루미늄 호일로 포장하여 액체 질소로 급속 냉동시켜 -70℃에서 냉동보관하여 실험에 사용하였다. 실험 사용 직전 뇌 조직의 일부를 취해서 조직균질기(HS-30E, DAEHAN Scientific, Wonju, Korea)를 사용하여 냉장 상태에서 1.15% KCl 완충용액을 이용하여 10%(w/v) 마쇄 균질액을 만들었다. 그런 다음 Mitochondria/cytosol fractionation kit(#K256-25, Biovision, St. Louis, MO, USA)를 이용하여 미토콘드리아와 사이토졸 분획을 획득하였다. 분리한 미토콘드리아 균질액은 과산화지질(malodialdehyde, MDA), NO 생성능, total antioxidant capacity(TAC) 수준 및 catalase와 GSH-Px 활성 측정에 이용하였으며, 사이토졸 균질액은 superoxide dismutase(SOD) 및 glutathione-s-transferase(GST) 활성 측정에 이용하였다.
과산화지질 함량은 혈청과 뇌 미토콘드리아 균질액 10 μL를 시료로 취하여 thiobarbituric acid(TBA)와 반응하여 생성된 물질을 정량하는 MDA 정량용 kit(#CAK1011, Biovision, St Louis, MO, USA)로 측정하였다. 시료 10 μL에 42 mM H2SO4 500 μL와 phosphotungstic acid 125 μL를 가하여 잘 섞어준 다음 실온에서 5분 동안 방치한 뒤 13,000 ×g에서 3분 동안 원심분리하였다. 그런 다음 상층액 100 μL을 취한 후 H2O 100 μL를 첨가하였다. 그 후 TBA 600 μL를 넣고 95℃에서 60분 동안 방치 한 다음 ice bath안에서 10분 동안 냉각시킨 반응 혼합물을 각각의 well에 200 μL씩을 넣고 microplate reader(N10583, Thermo Scientific, Waltham, MA, USA) 사용하여 532 nm에서 측정하였다.
Nitric oxide 생성능은 Griess 용액을 이용하여 NO로부터 생성된 nitrate 및 nitrite 함량을 측정하는 NO 정량용 kit(#K262-200, Biovision, St Louis, MO, USA)를 이용하였다. 혈청과 뇌 조직 균질액의 상층액 10 μL 취한 후 assay buffer 85 μL와 assay buffer 115 μL를 가하여 최종적으로 200 μL로 채웠다. 그런 다음 시료가 담긴 96-well plate에 nitrate reductase mixture와 enzyme cofactor 용액을 각각 5 μL씩 첨가 한 후 1시간 동안 실온에서 반응시켰다. 그 후 각각의 well에 enhancer 5 μL 첨가 후 실온에서 10분간 방치 다음 Griess reagent 50 μL씩 넣었다. 그런 다음 실온에서 10분간 둔 다음 microplate reader(N10583, Thermo Scientific)를 이용하여 540 nm에서 흡광도를 측정하였다.
Superoxide dismutase 활성 측정은 O2-에 의하여 WST-1(2-(4-idophenyl)-3-(4- nitrophenol)-5-phenyl tetrazoliumchloride)을 WST-1 formazan으로 환원시키는데, 이때 SOD 효소가 이 반응을 저해한다는 원리를 이용한 SOD 효소 활성 측정용 kit(#K335-100, Biovision, St Louis, MO, USA)를 이용하여 측정하였다. 시료 10 μL에 증류수 20 μL를 넣은 다음 각각의 well에 WST working solution 200 μL를 첨가하였다. 그런 다음 dilution buffer 20 μL와 enzyme working solution 20 μL를 첨가하였다. 이 혼합액을 37℃ 인큐베이터(VS-1205SW1, Vision Scientific Co, Daejeon, Korea)에서 20분 동안 배양하고 microplate reader(N10583, Thermo Scientific)를 이용하여 450 nm에서 흡광도를 측정하였다. 효소의 활성단위(unit)는 WST-1 formazan의 환원을 50% 저지하는 SOD량으로 계산하여 단백질 값으로 보정하여 나타내었다.
Catalase 활성은 H2O2의 가수분해 정도를 측정한 catalase 측정용 kit(#K773-100, Biovision, St Louis, MO, USA)를 이용하였다. 각각의 시료를 catalase assay buffer로 희석하여 원심분리 한 후 상층액을 시료로 이용하였다. Catalase 활성은 각각의 well에 1 mM H2O2 12 μL를 넣고 25℃에서 30분 동안 배양한 후 stop solution을 첨가하여 측정하였다. 시료 10 μL, assay buffer 46 μL, OxiRedTM Probe 2 μL, HRP solution 2 μL를 첨가한 후 잘 섞은 다음 25℃에서 10분간 배양하고 microplate reader(N10583, Thermo Scientific)를 이용하여 570 nm에서 H2O2 분해에 따른 흡광도를 측정하였다. 효소의 활성단위(unit)는 H2O2를 분해시킬수 있는 효소의 양을 단백질 1 mg 당 1분간 반응 정도로 나타내었다.
Glutathione-2-transferase 활성은 환원형 glutathione(GSH)와 GST 기질인 CDNB(1-chloro-2,4-dinitrobezene) 반응을 유도하여 생성된 GS-DNB(2,4-dinitrobenzene glutathione) 화합물을 생성하는 nitrobenzene 효소 활성을 측정하는 GST activity assay kit(#K263-100, Biovision, St Louis, MO, USA)를 이용하여 측정하였다. 10 μL 시료에, GST assay buffer 40 μL를 넣고 총 용량을 50 μL로 맞춘 다음 각각의 well에 GSH 용액 5 μL을 첨가 하였다. 그런 다음 GST assay buffer 45 μL와 GST substrate(CDNB) solution 5 μL을 넣어 혼합한 후 microplate reader(N10583, Thermo Scientific)를 이용하여 340 nm에서 흡광도를 측정하였다. 효소의 활성단위(unit)는 1분 동안 단백질 1 mg이 생성한 GS-DNB의 340 nm에서의 흡광계수로 환산하여 나타내었다.
Glutathione-peroxidase 활성은 NADPH 감소로 효소 활성을 측정하는 GSH-Px activity assay kit(#K261-100, Biovision, St Louis, MO, USA)를 이용하여 측정하였다. 시료는 PBS로 재현탁 한 후 glutathione buffer 80 μL를 넣고 10분간 냉동 상태에서 배양한 후 5%의 sulfosalicylic acid 20 μL를 첨가 하였다. 그리고 10분 동안 8,000 ×g에서 원심분리 한 후 상층액을 시료로 사용하였다. 각 well에 NADPH generating mixture 20 μL, glutathione reductase 20 μL, glutathione reaction buffer 120 μL를 넣고 실온에서 10분간 반응시켜 NADPH를 생성하였다. 그런 다음 1% sulfosalic acid를 첨가하고 시료 100 μL를 넣고 10분간 배양한 후 substate solution 20 μL를 첨가하여 실온에서 10분 배양한 다음 microplate reader(N10583, Thermo Scientific)를 이용하여 405 nm에서 흡광도를 측정하였다. GSH-Px 효소 활성은 1분 동안 1 μM NADPH를 산화시키는 효소의 양을 1 unit로 계산하였으며, 단백질 값으로 보정하였다.
Total antioxidant capacity 측정은 trolox equivalent antioxidant capacity법에 따라 분석하는 TAC 측정용 kit(#K274-100, Biovision, St Louis, MO, USA)를 이용하여 분석하였다. 10 μL 시료에 0, 4, 8, 12, 16, 20 nmol의 trolox 표준용액을 각각 10 μL 취한 다음 모든 well에 H2O 100 μL를 첨가한 후 Cu2+ working solution 100 μL 첨가하여 1.5시간 정도 상온에 방치한 후 micro plate reader(N10583, Thermo Scientific)를 이용하여 570 nm에서 흡광도를 측정하였다.
결과 및 고찰
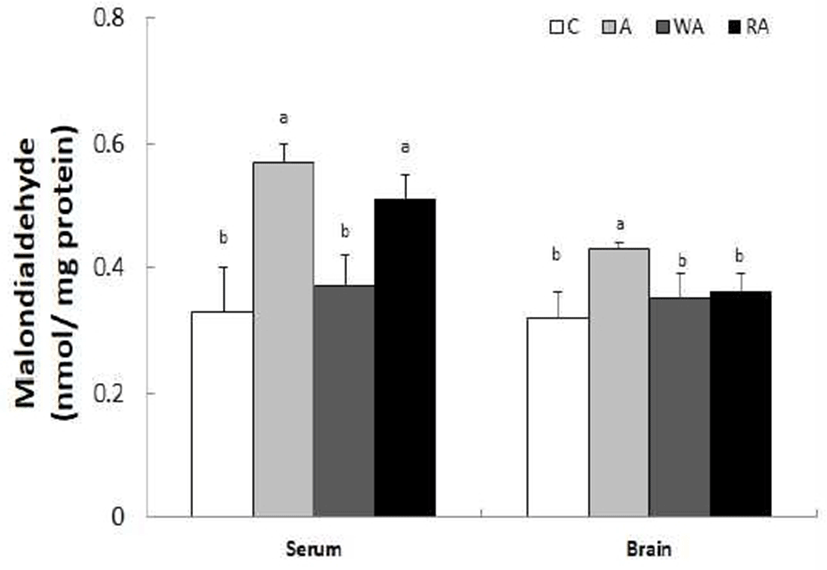
혈청과 뇌 조직의 MDA 수준은 Fig. 1과 같다. 혈청의 MDA 함량은 C군, A군, WA군, RA군은 각각 0.33, 0.57, 0.37, 0.51 nmol/mg protein으로 C군에 비해 A군에서 p<0.05 수준에서 72.7%의 유의적인 증가를 보였으나, WA군과는 유의적인 차이가 없었다. 뇌 조직의 MDA 함량은 C군, A군, WA군, RA군은 각각 0.32, 0.43, 0.35, 0.36 nmol/mg protein 수준으로 C군에 비해 A군에서 p<0.05 수준에서 유의적으로 높았으며, WA군과 RA군과는 유의적인 차이가 없었다.
백하수오와 적하수오는 기원식물과 유기성분도 다르다. 백하수오는 박주과리과(Asclepiadaceae) 식물의 덩이뿌리로서 steroids, alkaloids, terpenes, flavonoids, steroidal glycosides 등의 생리활성 성분을 함유하고 있다(25). 적하수오는 마디풀과(Polygonaceae) 식물의 덩이뿌리로서 적하수오 뿌리에는 anthraquionone 화합물인 chrysophanol, emodin, rhein physcion 및 이들의 배당체인 2,3,5,4'-tetrahydroxystibene 2-O-β-D-glucopyranoside 및 2'-O-mongalloyl ester 등이 함유되어 있다. 이들 성분 가운데 항산화 효능으로 알려져 있는 emodin의 함량이 많을수록 적하수오의 품질이 우수한 것으로 평가되고 있다. 이외에도 하수오의 항산화력은 유기성분 중 총 polyphenol과 총 flavonoid 함량에 따라 항산화 활성력이 좌우된다(26). Seo 등(27)의 보고에 의하면 백하수오와 적하수오의 총 polyphenol과 flavonoid 함량 및 ABTS radical 소거능에서도 백하수오에 비해 적하수오에서 우수한 것으로 나타났다. 동물실험에서는 백하수오 및 적하수오는 사염화탄소 및 고콜레스테롤 식이로 산화 스트레스를 가한 쥐의 간 조직 내에서 자유라디컬 소거능, MDA 생성 저하, 이상지질혈증 및 혈당 대사 조절을 통해 간 손상 보호 효과가 있으며(28,29), 사염화탄소로 간 독성이 유도된 흰쥐의 간 독성 완화 효과는 적하수오 보다 백하수오가 더 우수한 것으로 보고되었다(30).
본 실험에서 알코올의 섭취에 따른 산화적 스트레스을 평가하기 위해 지표물질인 과산화지질인 MDA 수준을 분석한 결과, 담금 소주를 섭취 한 실험동물의 혈청과 뇌 조직에서 MDA 수준이 증가 되었다. 그러나 혈액 내 MDA 함량은 담금 소주 대신에 백하수오 담금주를 섭취했을 때, 뇌 조직의 MDA 함량은 백하수오 및 적하수오 담금주의 섭취로 비슷한 감소 효과를 얻을 수 있었다.
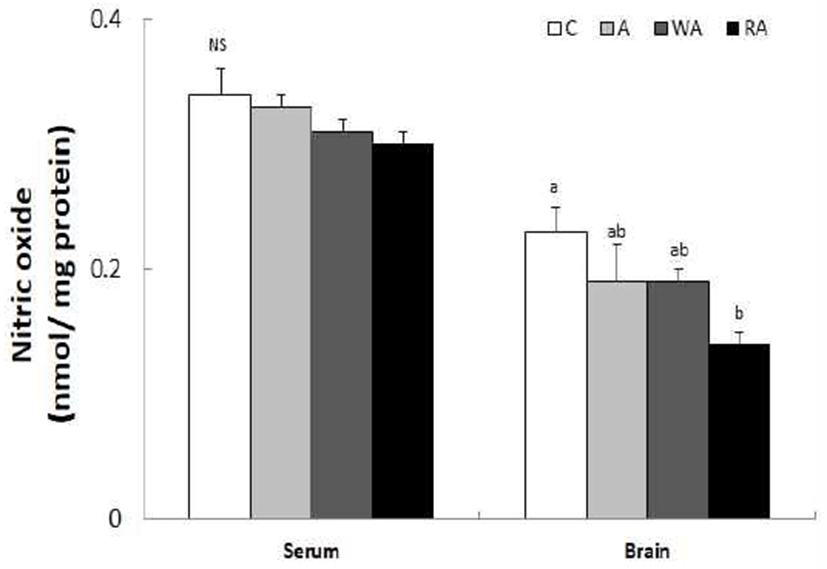
혈청과 뇌 조직의 NO 수준 결과는 Fig. 2와 같다. 혈청의 NO 생성능은 C군, A군, WA군, RA군에서 각각 0.34, 0.33, 0.31, 0.30 nmol/well protein으로 모든 군 간에 유의적인 차이가 없었다. 뇌 조직에서는 C군, A군, WA군, RA군은 각각 0.23, 0.19, 0.19, 0.14 nmol/well protein으로 C군에 비해 RA군에서 유의적인 감소를 보였다(p<0.05). 생체 내에서 NO은 중요한 생리적 조절인자로 작용하지만 NO 수준에 따라 이중적 생물학적 기능을 보인다. 인체 내 저 수준의 NO는 신경전달물질 등의 작용을 보이지만, 과도한 NO 생성은 ROS와 반응하여 ONOO- 라디칼과 같은 반응성 산화물질을 생성하여 ONOO- 라디칼에 의한 조직의 병적인 산화적 손상을 유발하여 급·만성 염증을 일으킨다(31). 그러나 DPPH, ABTS 및 hydroxyl radical 소거능 효과가 증명된 법제 적하수오 메탄올 추출물을 산화적 스트레스가 가해진 LLC-PK1 cell에 투여한 결과, 과잉의 NO로부터 생성된 ONOO- 라디컬과 같은 반응성 질소 매개체 소거능으로 산화적 스트레스에 대한 개선 효과를 보였으며, 이때 적하수오의 유효성분은 2,3,5,4’-tetrahydroxystilbene 2-O-β-D-glucoside로 보고되었다(32). 본 연구에서 알코올 섭취에 따른 산화 스트레스로 NO 생성능을 측정한 결과, 혈장의 NO 생성능은 모든 실험군 간에 유의적인 차이는 없었으나 뇌 조직에서는 무알코올 섭취군에 비해 적하수 담금주 섭취군에서 NO 생성능 저해에 긍정적인 효과를 보였다.
혈청과 뇌 조직의 SOD 활성은 Fig. 3과 같다. 혈청에서는 C군, A군, WA군, RA군은 각각 69.7, 79.7, 85.2, 76.2 unit/mg protein로 C군에 비해 A군과 WA군의 SOD 활성은 높았으나(p<0.05), RA군과는 유의적인 차이는 없었다. 그러나 뇌 조직에서의 SOD 활성은 C군, A군, WA군, RA군은 각각 105.6, 91.7, 94.4, 103.2 unit/mg protein로 혈청과는 반대로 C군에 비해 A군과 WA군에서 낮았으나(p<0.05), RA군과는 유의적인 차이는 없었다.
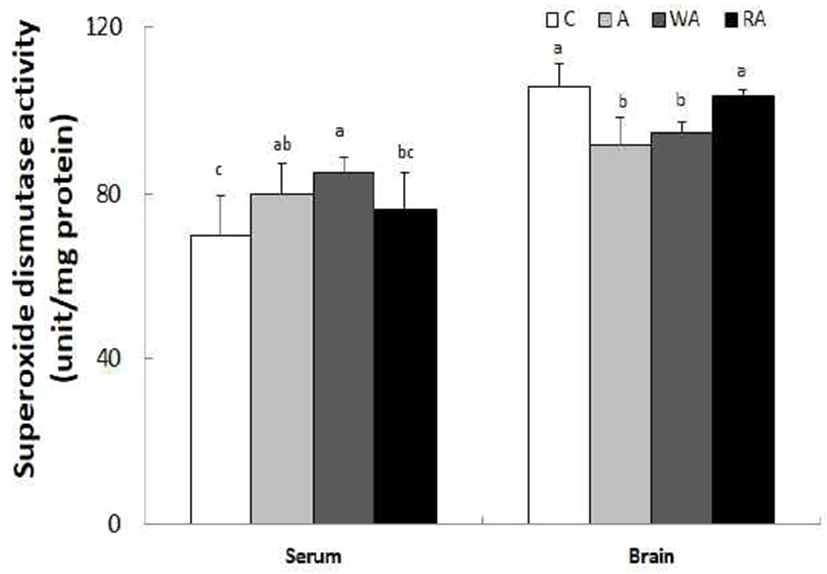
Keen 등(33)은 급성 및 만성적으로 알코올을 공급하였을 때, 미토콘드리아에서 O-2의 생성과 함께 SOD의 활성이 증가되었으며, Hilton 등(34)은 알코올 섭취로 인한 SOD 활성의 증가 반응은 알코올 공급으로 생성된 O-2를 제거하려는 생리적응 현상의 하나로 설명하였다. 그 반면에 20% 알코올 액체식이를 공급할 경우, 시간이 경과함에 따라 체내 O-2 대사에 SOD 효소가 작용하여 SOD 효소 활성이 저하되었다는 상반된 연구결과도 있다(35). 알코올의 산화적 스트레스 반응에 대한 SOD 활성의 상반된 반응 결과는 생체 조직에서의 O-2의 생성 정도, 항산화 영양소 및 생리활성 성분인 polyphenol이나 flavonoid이나 알코올 종류, 생체 조직 부위 및 항상성 조절 능력 등에 따라 다양한 반응을 보이는 것으로 추측된다. 그러나 본 실험에서 알코올 섭취에 대한 SOD 항산화 방어 효소 활성은 무알코올 섭취군에 비해 담금 소주와 백하수오 담금주를 섭취했을때 혈장에서 유도된 반면에, 뇌 조직에서는 낮은 효소 활성을 보였다. 그러나 적하수오 담금주를 섭취했을때 SOD 활성은 혈장과 뇌 조직 모두에서 무알코올 섭취군 수준으로 나타났다.
혈청과 뇌 조직의 catalase 활성은 Fig. 4와 같다. 혈청에서는 C군, A군, WA군, RA군은 각각 3.71, 3.71, 4.32, 4.12 unit/mg protein로 나타났다. C군 및 A군에 비해 WA군의 catalase 활성은 p<0.05 수준에서 유의적으로 높았으나, WA군과 RA군 간의 catalase 활성은 유의미한 차이는 없었다. 뇌 조직의 catalase 활성은 C군, A군, WA군, RA군은 각각 4.09, 1.84, 0.98, 0.95 unit/mg protein로 C군에 비해 A군은 55.0%, WA군은 76.3%, 그리고 RA군은 76.8% 정도 유의적으로 낮은 효소 활성을 보였다(p<0.05).
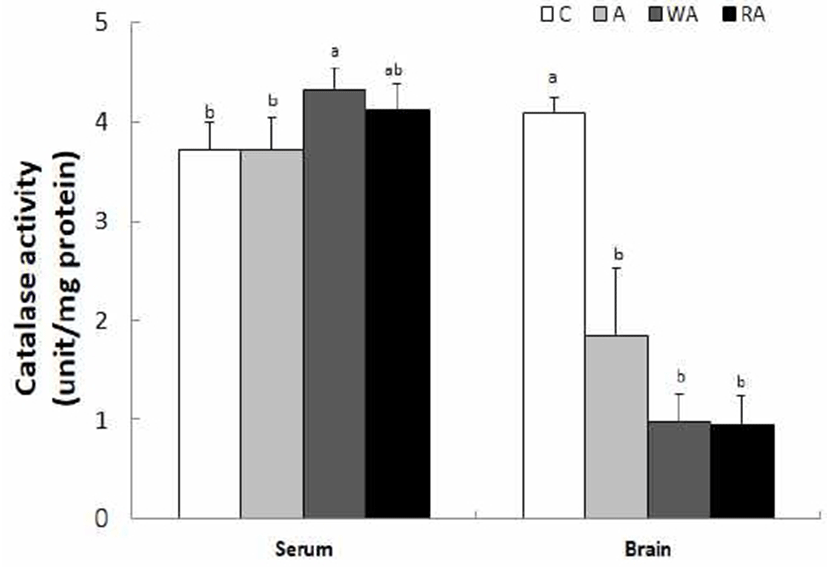
체내 항산화 효소로 SOD는 반응성이 크고 독성이 강한 O2-을 H2O2로 바꾸는 작용을 하며, 이 과정에서 생성된 H2O2와 MDA로부터 생체를 보호하기 위해서 catalase나 GSH-Px 효소는 H2O2와 MDA를 H2O로 무독화 시킨다. 급만성적으로 섭취된 알코올은 생체 내에서 catalase 활성을 유도하여 MDA를 분해하거나 알코올의 대사과정에서 만들어진 H2O2를 제거함으로써 알코올 섭취에 따른 산화 스트레스에 대한 항상성을 유지한다(36). 본 실험의 연구결과에서도 혈청 내 catalase 활성 수치가 가장 높은 WA군에서 catlase 효소에 의한 MDA의 분해 작용으로 MDA 함량이 낮은 것으로 추측된다. 또한 catalase 효소는 알코올을 acetaldehyde로 분해시키는 반응에도 관여하며, Yun 등(37)의 보고에서는 천마침출약용주를 6주 동안 섭취시킨 SD 흰쥐의 catalse 활성은 알코올 섭취량이 높을수록 증가한 반면에, 담금 소주의 알코올 섭취량이 높을수록 catalase 활성은 낮은 경향을 보였다. 또한 Kinard 등(38)의 연구에 의하면 만성적 알코올 투여로 catalase 활성이 유의적으로 유도되지만, 만성적 혹은 고용량의 급성적 알코올의 섭취가 catalase 활성 유도에 별다른 영향을 주지 못했다는 상반된 보고도 있다(39).
본 실험에서 6주간의 만성적 알코올 섭취에 대한 항산화 효소로 catalase 활성은 무알코올이나 담금 소주 섭취군에 비해 혈장에서는 백하수오 담금주 섭취군에서 유도된 반면에, 뇌 조직에서는 알코올을 섭취한 모든 군에서 무알코올 섭취군에서 비해 낮은 catalase 활성을 보였다. 이때 혈장과 뇌 조직 모두에서 백하수오와 적하수오 담금주 섭취군 간에 비슷한 catalase 활성을 보였다.
혈청과 뇌 조직의 GST 활성은 Fig. 5와 같다. C군, A군, WA군, RA군의 GST 활성은 각각 0.58, 0.56, 0.54, 0.47 unit/mg protein로 C군과 A군 간의 GST 활성은 유의한 차이는 없었다. 그러나 C군의 GST 활성에 비해 WA군과 RA군에서 유의적으로 낮은 GST 활성을 보였다(p<0.05). 뇌 조직에서 C군, A군, WA군, RA군의 GST 활성은 각각 1.42, 1.74, 1.59, 1.57 unit/mg protein로 C군의 GST 활성에 비해 A군에서는 18.4%, WA군에서는 22.5%, RA군에서는 12.0% 정도의 활성이 유도되었다(p<0.05).
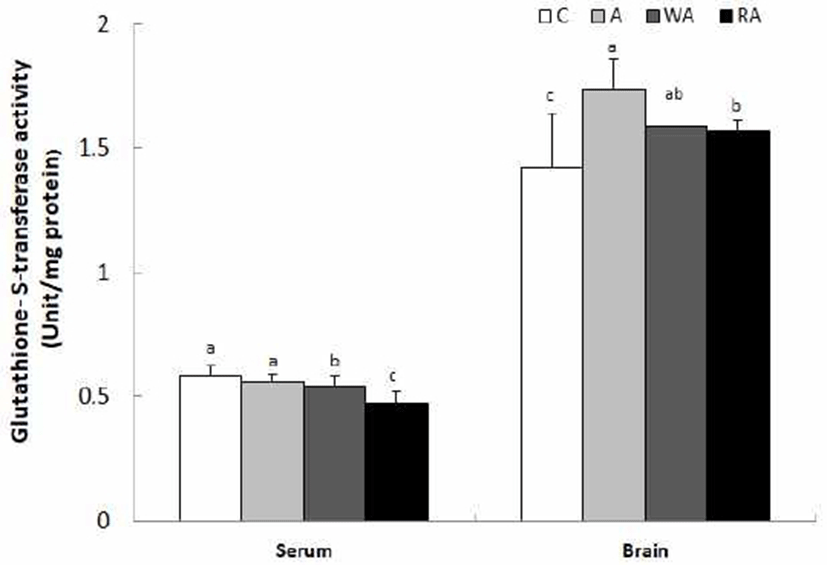
Glutathione-s-transferase는 체내에서 알코올과 같은 산화적 스트레스가 가해질 때, GSH와 GSH-Px 활성과 함께 유도되어 자유라디칼 제거 반응으로 산화적 세포 손상에 대한 방어작용을 나타내는 효소로서, MDA의 제거 및 무독화 반응에 관여하는 중요한 효소이다(40). GST는 생체막에 결합된 MDA 제거를 위해 catalase 효소와 함께 활성 증가가 유도된다고 Aykac 등(39)은 보고하였으며, Yoon 등(41)은 SD 흰쥐에게 6% 알코올 및 6% 알코올과 동시에 2 g/kg B.W.의 구기자 에탄올 추출물을 2개월간 음용시킨 실험동물의 간 조직에서 GST 활성을 분석한 결과, 알코올만 섭취한 실험군에 비하여 항산화 활성이 있는 구기자 에탄올 추출물을 투여한 실험동물에서 GST 활성 유도 현상을 관찰하였다. 본 연구에서 산화적 손상에 대한 항산화 방어 효소로 GST 활성은 혈청에서는 무알코올 섭취군에 비해 백하수오 및 적하수오 담금주 섭취군에서 낮은 활성을 보였다. 그러나 뇌 조직에서는 무알코올 섭취군에 비해 MDA 수준이 높은 담금 소주, 백하수오 및 적하수오 담금주를 섭취군에서 GST 효소의 활성이 유도된 것으로 나타났다.
혈청과 뇌 조직의 GSH-Px 활성은 Fig. 6과 같다. 혈청에서의 GSH-Px 활성은 C군, A군, WA군, RA군은 각각 34.1, 43.8, 42.1, 39.3 unit/mg protein으로 C군에 비해 A군과 WA군에서 p<0.05 수준에서 유의적인 증가를 보였다. 그러나 뇌 조직의 GSH-Px 활성은 C군 A군, WA군, RA군은 각각 3.09, 1.64, 2.85, 2.97 unit/mg protein으로 C군에 비해 A군에서 p<0.05 수준에서 유의적으로 낮은 활성을 보인 반면에, C군, WA군 및 RA군의 GSH-Px 활성은 유의적인 차이가 없었다.
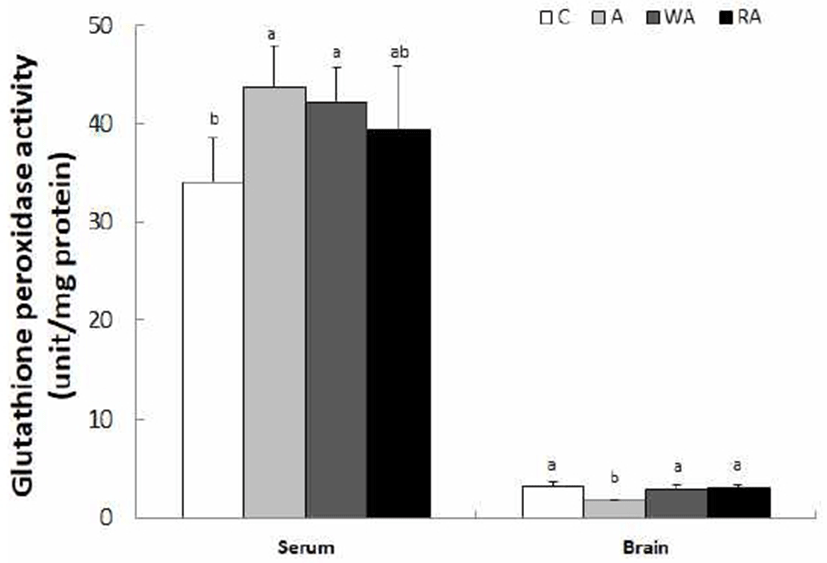
Glutathione peroxidase는 DNA 합성물질 이동, 효소 활성 조절 및 GSH를 전자공여제로 이용하여 H2O2를 환원시켜 제거함으로서 세포 손상의 예방 등에 직‧간접적으로 작용한다(42). GSH-Px는 Se를 함유하는 항산화계 효소로서 MDA와 H2O2의 무독화를 촉매하며 철분, 비타민 E 및 필수지방산의 결핍 시 그 활성이 감소되고 산화 스트레스로 그 활성이 증가하는 것으로 알려져 있다(43). 급성 알코올을 투여한 실험에서 간 조직에서 알코올에 의한 독성으로 인하여 GSH 수준을 증가시킨다고 보고하고 있으며, 그 중 GSH의 직접적인 전구물질인 S-adenosyl methionine의 경구 투여는 만성 알코올 섭취로 인한 손상된 간 조직 내에서 GSH의 활성을 회복시키는 것으로 보고하였다(44). 본 실험에서 세포 손상에 대한 항산화 방어 효소로 혈청 내 GSH-Px 활성은 무알코올 섭취군에 비해 담금 소주와 백하수오 담금주 섭취군에서 유도되었으며, 뇌 조직에서는 담금 소주 섭취군에 비해 백하수오 담금주 및 적하수오 담금주 섭취군에서는 GSH-Px 효소의 높은 활성을 보였다.
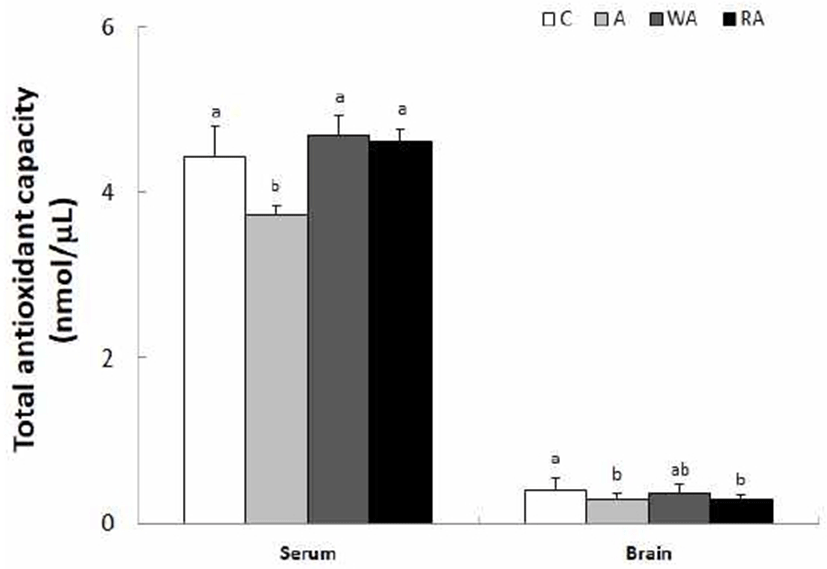
혈청과 뇌 조직의 TAC는 Fig. 7과 같다. 혈청은 C군, A군, WA군, RA군은 각각 4.44, 3.73, 4.70, 4.61 nmol/μL로 C군의 TAC에 비해 A군이 유의적으로 낮았다(p<0.05). 그러나 C군, WA군, RA군 간의 TAC는 유의한 차이가 없었다. 뇌 조직에서 TAC는 C군, A군, WA군, RA군은 각각 0.40, 0.30, 0.36, 0.29 nmol/μL로 C군의 TAC에 비해 A군과 RA군에서 유의적으로 낮아지만(p<0.05), C군과 WA군 간의 TAC는 유의한 차이는 없었다. 알코올에 의한 산화적 스트레스는 항산화 효소의 활성 또는 전자전달계의 환원력 등 세포의 항산화력에 의해 조절되며, TAC는 식사를 통해 섭취한 flavonoid, carotenoid 등의 phytochemical과 비타민 A, 비타민 C, 비타민 E 등 항산화 비타민의 체내 항산화력에 대한 포괄적 능력 지표로서 중요한 의미를 가지고 있다(45). 2010년 국민건강영양조사에 근거한 매실가공품 섭취로부터 한국인의 일인당 하루 총 phenol, 총 flavonoid 및 항산화능 섭취량으로 TAC를 추정할 수 있는 Lee 등(45)가 있다. 본 연구 결과에서 알코올 섭취에 대한 총 항산화 방어력으로 혈청에서 담금 소주 섭취군에 비해 백하수오 및 적하수오 담금주 섭취군에서 TAC가 높았으며, 이는 담금 소주는 갖고 있지 못한 총 phenol과 총 flavonoids를 백하수오 담금주 및 적하수오 담금주가 함유하고 있는 결과 때문인 것으로 추측된다. 그러나 뇌 조직에서는 담금 소주, 백하수오 담금주 및 적하수오 담금주 간의 TAC에 유의한 차이가 없는 것은 체내 MDA 수준이나 항산화 효소 활성 등 체내 산화 및 항산화 물질의 수준 차이에 따른 결과로 추측된다.
요 약
본 연구는 백하수오와 적하수오 담금주가 흰쥐의 혈청과 뇌 조직의 MDA 수준 및 항산화 활성에 미치는 영향을 알아보고자 10주령의 수컷 SD 흰쥐를 이용하여 전체 실험식이의 열량에 12%가 담금 소주, 백하수오 및 적하수오 담금주가 포함된 액체식이를 제조하여 6주간 공급하였다. 실험군은 무알코올 섭취군(C)군, 담금 소주 섭취(A)군 그리고 백하수오 담금주 섭취(WA)군, 적하수오 담금주 섭취군(RA)군으로 나누었으며, 그 결과는 다음과 같다. 혈청의 MDA 함량은 C군과 WA군에서 유의한 차이가 없었으며, 뇌 조직에서 MDA 함량은 C군, WA군 및 RA군 간에 유의한 차이가 없었다. 뇌 조직에서의 NO 생성능은 실험군 중에서 RA군에서 유의미한 낮은 수치를 보였다. 항산화 효소 중에서 SOD는 혈청에서는 C군에 비해 A군과 WA군에서 높은 활성을 보였으며, 뇌 조직에서는 C군에 비해 A군과 WA군에서 낮은 활성을 보였다(p<0.05). Catalase 활성은 C군에 비해 혈청에서는 WA군에서 높은 활성 수치를 보인 반면에, 뇌 조직에서는 A군, WA군 및 RA군에서 낮은 활성을 보였다(p<0.05). GSH-Px은 C군에 비해 A군과 WA군에서 높은 활성을 보였으나(p<0.05), 뇌 조직에서는 C군에 비해 A에서 낮은 활성을 보였다(p<0.05). 혈청에서의 TAC는 A군에 비해 WA군과 RA군에서 높았다.
이상의 연구 결과에서는 생체 내 혈청과 뇌 조직 부위에 따른 차이는 있으나 하수오 담금주의 섭취가 MDA 수준 및 NO 생성 억제와 TAC 유도에 긍정적인 영향을 미친것으로 보여진다. 또한 항산화 효소 중에서 혈청 내 SOD, catalse 및 GSH-Px 효소는 적하수오 섭취군에 비해 백하수오 섭취군에서 유의미하게 높은 활성을 보여 주었다. 그러나 향후 산화적 손상에 대한 뇌 조직에서 보호효과를 얻기 위한 올바른 약용주 섭취를 위해서는 약용주의 유효성분과 이들 함량과 체내 과산화지질 수준, 항산화 효소 활성 및 항산화 영양소와의 관련성 등에 대한 세밀한 연구가 필요한 것으로 사료된다.










