서 론
상황버섯(Phellinus baumii)과 영지버섯(Ganoderma lucidum)은 대표적인 약용버섯으로, 상황버섯은 면역증진(1), 항암(2), 항산화(3), 혈당상승억제(4), 지방소화효소 억제 효과(5)가 보고 된 바 있으며, 영지버섯 또한 항염증(6), 항암(7), 항산화(8) 항돌연변이(9), 항비만 효과(10), 혈당 조절 작용(11)이 보고된 바 있다. 상황버섯은 소나무비늘버섯과 진흙버섯속에 속하며 주로 뽕나무와 활엽수의 줄기에 자생하는 다년생 버섯이다(4). 상황버섯에 대한 연구는 주로 목질진흙버섯(Phellinus linteus)에 집중되어 있으나, 한국의 대표적인 재배종은 장수상황버섯(P. baumii)으로 전체 상황 재배농가의 98% 이상을 차지한다(12). 영지버섯은 구멍장이버섯과 영지속에 속하며(13), 활엽수 뿌리에서 발생하여 땅위로 돋는 1년생 버섯이다(14). 특히 면역증진, 항염증, 항암 활성은 주로 다당류의 일종인 β-glucan 성분에 기인한다(15). 버섯의 β-glucan은 β-(1,3)-glucan을 기본골격으로 하여 β-(1,4)와 β-(1,6) 결합의 곁가지를 갖는 분자량 250,000의 포도당 중합체이다(16). 이는 암세포를 직접 공격하기 보다는 정상적인 면역세포의 기능을 활성화시켜 암세포 및 염증을 억제하는 것으로 알려져 있다(17). 버섯의 β-glucan은 불용성 성분임에도 불구하고, 국내에서는 대부분 단순 열수 추출 방법에 의하여 추출하고 있어 효율이 0.5 이하로 보고되었다(18). 이러한 문제를 해결하고자 상황버섯의 가열 처리(19), 영지버섯의 마이크로웨이브 처리 및 초음파 처리(20), 상황버섯과 영지버섯의 원적외선 처리(21) 등의 전처리에 따른 버섯 추출물의 특성이 조사된 바 있으며, 영지버섯(22)와 상황버섯(23)을 각각 효소 전처리하여 β-glucan 추출 효율이 증대된 것이 보고 된 바 있다. 전통적으로 생약재는 효능을 증진시키기 위하여 주로 복합 추출물의 형태로 사용되고 있으며, 최근에는 생약 복합제가 건강기능식품의 기능성 원료로 인정된 바 있다(24). 복합 추출물이 상호작용을 통해 더욱 유효한 효과를 나타낸다는 점에서, 생약재들을 배합하여 상승효과를 내는 복합 추출물의 개발이 필요하다(24).
따라서 본 연구에서는 상황버섯과 영지버섯의 β-glucan 성분을 효율적으로 추출하기 위하여 버섯의 비율과 Viscozyme L의 농도, 반응시간을 다르게 하여 열수추출하여 추출물과 정제물의 특성과 생리활성을 조사하였다.
재료 및 방법
시료 약용버섯은 상황버섯(Phellinus baumii)과 영지버섯(Ganoderma lucidum)을 사용하였으며, 상황버섯은 경상북도 안동시 임하면에 위치한 류충현 약용버섯에서 재배된 2년산 상황버섯, 영지버섯은 경상북도 칠곡군 왜관읍에 위치한 유학 영지버섯에서 재배된 것을 구입하여 사용하였다. 상황버섯과 영지버섯을 절단 및 분쇄하여 25 mesh 이상의 분말을 실험에 사용하였다. 당분해 효소로 100 Fungal Beta-glucanase (FBG)/g의 활성을 가지는 복합효소인 Viscozyme® L(Novozyme Co., Bagsvared, Denmark)을 사용하였으며, ferric chloride, sodium acetate, citric acid, sodium hydroxide, gallic acid, trolox, (+)-catechin, 2,2′-azino-di-3-ethylbenzothiazoline-sulfonic acid(ABTS) 2,2-diphenyl-1-picrylhydrazyl(DPPH), 2,4,6-tris(2-pyridyl)-1,3,5-triazine(TPTZ) 은 Sigma chemical Co.(St. Louis. Mo, USA)에서 구입하였다. 그 외의 용매 및 시약은 일급 시약(Duksan Co., Seoul, Korea)을 사용하였다.
효소 반응시간, 효소 농도, 버섯 비율에 따른 추출 수율 및 β-glucan 함량을 통해 적정 추출 조건을 설정하였으며, 이는 Bae 등(3)과 Kim 등(8)의 상황버섯과 영지버섯 열수추출물의 pH 및 추출 시간에 따른 추출 수율 및 β-glucan 함량을 비교한 연구를 바탕으로 하였다.
버섯 분말과 증류수를 1:20(w/v)의 비율로 설정하고, Viscozyme L의 최적조건인 pH 4 및 50℃에서 효소 반응 후 pH 10으로 조정하여 90℃에서 12시간 환류냉각추출 하였다. 이때 1 N sodium hydroxide와 0.1 N citric acid를 이용하여 pH를 조절하였으며, 효소는 정치 반응으로 실시하였고, 아래의 추출조건 설정에서도 동일한 방법을 사용하였다. 효소 반응시간은 8시간이고 기질에 대한 효소 농도는 6%(v/w)이며, 상황버섯과 영지버섯 분말의 비율을 0:100, 25:75, 50:50, 75:25, 100:0(w/w)으로 달리하였다. 다음으로 상황버섯과 영지버섯 분말의 비율은 50:50, 효소 반응시간은 8시간이며, 기질에 대한 효소 농도를 0, 2, 4, 6, 8, 10%(v/w)로 달리하여 적정 추출조건을 설정하였다. 마지막으로 상황버섯과 영지버섯 분말의 비율은 50:50, 기질에 대한 효소 농도는 10%(v/w)이며, 효소를 2, 4, 6, 8, 10시간별로 반응시켜 적정 추출조건을 설정하였다.
버섯 분말과 증류수를 1:20(w/v)의 비율로 앞서 설정한 적정 추출 조건(효소 반응시간 8시간, 효소 농도 6%(v/w), 상황버섯과 영지버섯 분말 비율 50:50(w/w))으로 효소 반응 후 pH 10으로 12시간 환류냉각추출 하였다. 약용버섯 β-glucan 추출물(Phellinus baumii and Ganoderma lucidum β-glucan extract, PGBE)을 정제하기 위해 이에 3배량의 ethanol을 첨가하여 4℃에서 24시간 정치하였다. 이후 감압농축 및 원심분리(11,355 × g, 10 min, 4℃) 하여 침전물을 동결건조한 정제물(Phellinus baumii and Ganoderma lucidum β-glucan purification, PGBEP)을 실험에 사용하였다.
추출 수율은 dry oven에서 105℃로 각 추출물의 일정량을 증발건고 하였으며, 그 무게를 측정하여 원시료량에 대한 백분율(%)로 나타내었다.
β-glucan 함량 측정은 β-D-glucan assay kit(Megazyme, Wicklow, Ireland)를 사용하였다(25). β-glucan 함량은 total glucan 함량에서 α-glucan 함량을 제외하여 구하였다.
약용버섯 β-glucan 복합물의 구조를 확인하기 위하여 적외선 분광광도계(Frontier, PerkinElmer, Waltham, MA, USA)를 사용하여 4,000-650 cm-1의 범위에서 spectrum을 측정하였다.
항산화성분으로 총폴리페놀 함량과 총플라보노이드 함량을 측정하였다. 총폴리페놀 함량은 Folin-Ciocalteu 방법(26)으로 측정하였으며, gallic acid 검량선의 회귀식에서 mg%로 나타내었다. 총플라보노이드 함량은 Jia 등(27)의 방법에 따라 측정하였으며, catechin 검량선의 회귀식에서 mg%로 나타내었다.
항산화 활성은 DPPH 라디칼 소거 활성과 ABTS 라디칼 소거 활성, FRAP 활성을 측정하였다. DPPH 라디칼 소거 활성은 Blois(28)의 방법으로 측정하였으며, gallic acid 검량선의 회귀식에서 gallic acid equivalent mM(mM GAE)로 나타내었다. ABTS 라디칼 소거 활성은 Re 등(29)방법으로 따라 측정하였으며, trolox 검량선의 회귀식에서 trolox equivalent mM(mM TE)로 나타내었다. FRAP 활성은 Benzie와 Strain(30)의 방법으로 측정하였으며, trolox 검량선의 회귀식에서 trolox equivalent mM(mM TE)로 나타내었다.
암세포주는 한국세포주은행에서 분양받은 B16F10 murine melanoma cell을 사용하였다. 이를 10% fetal bovine serum(FBS), 1% penicillin/streptomycin을 첨가한 Dulbeco’s Modified Eagle’s Medium(DMEM)을 사용하여 37℃의 5% CO2 incubator(MCO-18AIC, SANYO Electric Biomedical Co., Ltd., Osaka, Japan)에서 배양하였다.
세포 독성은 3-(4,5-dimethylthiazol-2-yl)-2,5-diphenyltetrazolium bromide(MTT) assay(31)를 이용하여 세포 독성을 측정하였다. 이때 사용된 시료의 농도는 1, 3, 10, 30, 100 μg/mL이며, 세포 독성은 대조구에 대한 세포 생존율(%)로 나타내었다.
암세포 생육저해 활성은 in vitro wound healing assay(32)를 이용하여 측정하였다. 이 때 사용된 시료의 농도는 1, 3, 10, 30 μg/mL이며, 0, 6, 12시간 마다 저해활성 정도를 현미경(ECLIPSE TE2000-U, Nikon, Tokyo, Japan)으로 관찰하였다. 암세포 생육저해 활성은 각 처리구의 0시간에 대한 wound의 거리를 백분율(%)로 나타내었다.
결과 및 고찰
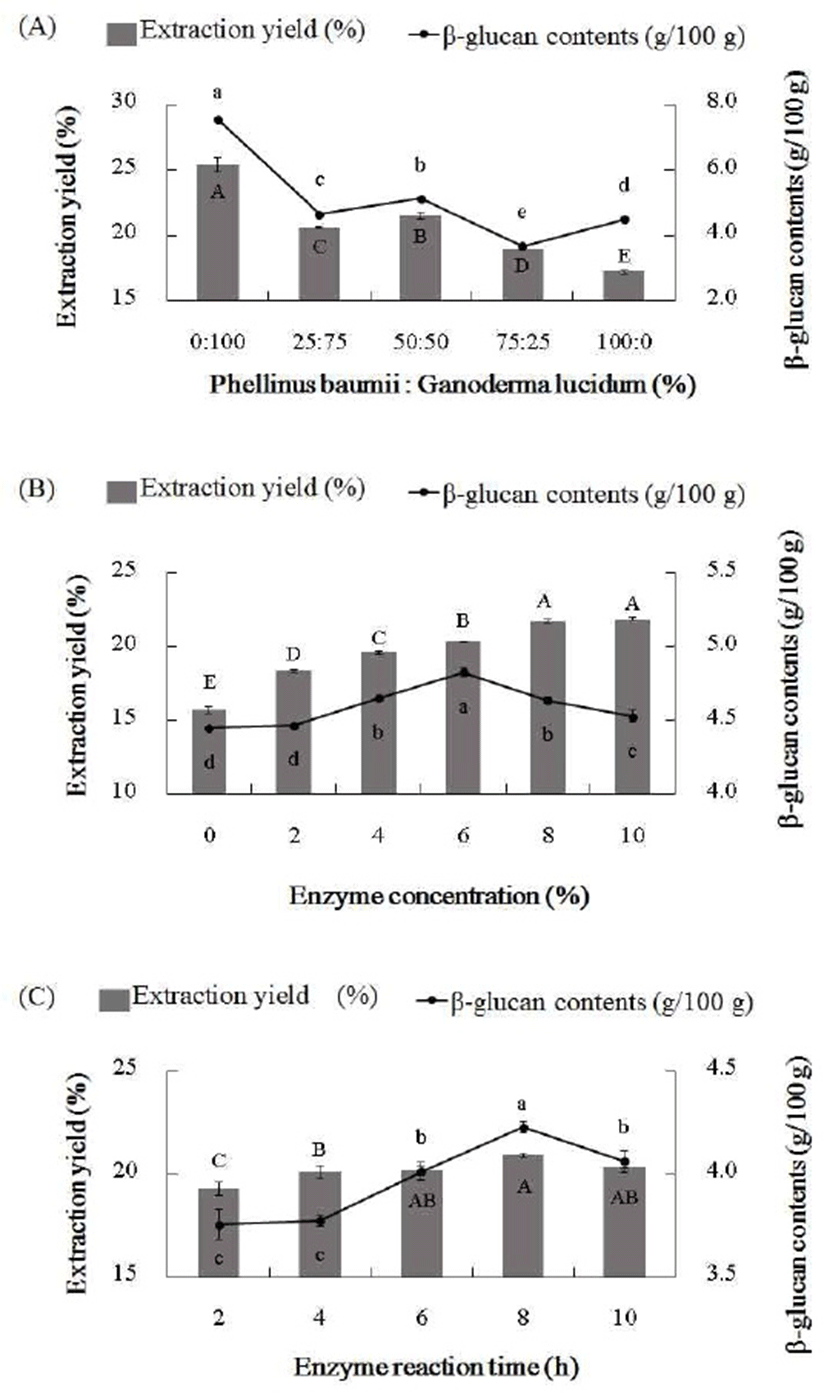
상황버섯과 영지버섯의 β-glucan 성분을 효율적으로 추출하기 위하여, 버섯의 비율과 Viscozyme L의 농도, 효소 반응시간을 다르게 하여 열수추출하였다. 추출 조건에 따라 추출 수율과 β-glucan 함량을 측정한 결과는 Fig. 1과 같다. 상황버섯과 영지버섯의 단일 분말이 아닌 복합 분말의 비율 중 50:50에서 수율과 β-glucan 함량이 가장 높았으며, 효소 처리 농도의 경우 8%와 10%에서 높았으나 추출 수율은 감소하여, 수율을 고려한 β-glucan 함량은 효소 농도 6%에서 가장 높았다. 마지막으로 효소 반응시간은 8시간에서 추출수율과 β-glucan 함량이 가장 높게 나타났다. 따라서 β-glucan 함량이 높은 적정 추출 조건을 상황버섯과 영지버섯의 혼합 비율 50:50(w/w), 기질에 대한 효소 농도 6%(v/w), 효소 반응시간 8시간으로 설정하여 약용버섯 β-glucan 추출물(PGBE)을 조제하고, 이에 3배량의 에탄올을 첨가해 24시간 정치하고 감압농축 및 원심분리 후 침전물을 동결건조하여 정제물(PGBEP)을 만들었다.
PGBE와 PGBEP의 추출 수율, β-glucan 순도(%) 및 β-glucan 함량(g/100 g)을 측정한 결과는 Table 1과 같다. 추출물인 PGBE가 정제 과정을 거치며 추출 수율은 감소하였으나, β-glucan 순도가 26.70%에서 40.19%로 약 1.5배 증가하였다. 이는 Choi(33)의 연구에서 상황버섯 추출물이 에탄올을 이용한 정제 과정을 거침에 따라 다당체 함량이 증가하는 것과 유사하였다.
| Samples | PGBE1) | PGBEP |
|---|---|---|
| Extraction yield (%) | 19.57±0.01*2) | 6.40±0.00* |
| β-glucan purity (%) | 26.70±0.21* | 40.19±0.17* |
| β-glcuan contents (g/100 g) | 5.23±0.04* | 2.57±0.01* |
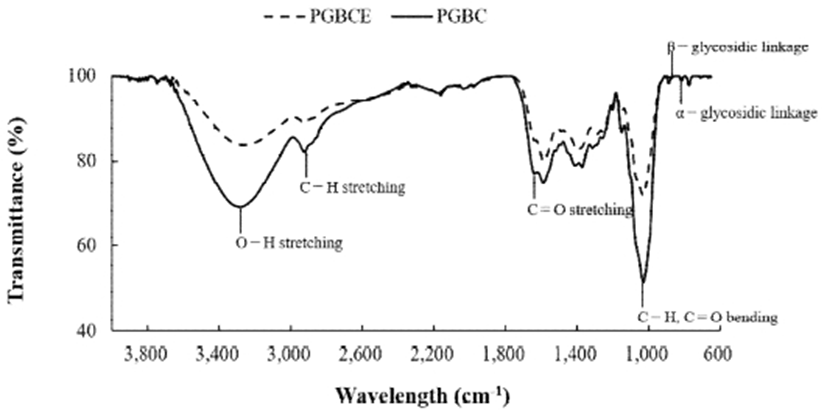
약용버섯 β-glucan의 추출물과 정제물을 적외선분광광도계로 흡광스펙트럼을 측정하여 Fig. 2에 나타내었다. β-glucan 추출물과 정제물의 흡광스펙트럼은 3,300 cm-1 부근에서 OH 신축 진동이 일어났으며, 2,900 cm-1 부근에서 CH 신축 진동이, 1,650 cm-1에서 C=O 신축 진동이, 1,000 cm-1 부근에서 CH와 C=O의 굽힘 진동으로 인한 흡수대가 확인되었다(34). 특히, 1,000 cm-1 부근은 다당류를 포함하는 탄수화물의 전문영역으로 알려져 있다(34). 또한 Vlasta 등(35)은 약 70여 종의 다양한 버섯의 FT-IR spectrum에서 890 cm-1 영역이 β-glycosidic linkage를 나타내며, 822 cm-1 영역이 α-glycosidic linkage를 나타낸다고 보고하였다. 한편, O-H 신축 진동(3,300 cm-1 부근)의 흡수 강도가 PGBE에 비하여 PGBEP가 작았는데, 이는 정제 과정 중에 β-glucan이 일부 분해되었기 때문으로 사료된다.
PGBE와 PGBEP의 항산화성분과 항산화 활성을 측정한 결과는 Table 2와 같다. 추출물인 PGBE가 정제물인 PGBEP에 비하여 총폴리페놀 함량 및 총플라보노이드 함량이 약 1.5배 가까이 높게 측정되었다(p<0.05). 이는 상황버섯 물 추출물(pH 10)의 총폴리페놀 함량이 0.35 g/L, 총플라보노이드 함량이 0.28 g/L라고 보고한 Bae 등(3)의 결과에 비해 낮은 값이다.
DPPH 라디칼 소거 활성은 PGBE는 0.68 mM GAE, PGBEP는 0.26 mM GAE, ABTS 라디칼 소거 활성은 PGBE는 2.05 mM TE, PGBEP는 1.46 mM TE, FRAP 활성의 경우 PGBE는 2.93 mM TE로, PGBEP는 1.83 mM TE로 나타났다. 항산화성분 함량의 결과와 유사하게, 모든 항산화 활성에서 추출물인 PGBE가 정제물인 PGBEP에 비하여 더 높게 측정되었다(p<0.05). Kim 등(8)은 영지버섯 물 추출물(pH 10)의 DPPH 라디칼 소거 활성이 0.10 mM GAE, FRAP 활성이 0.84 mM TE라고 보고한 바 있다.
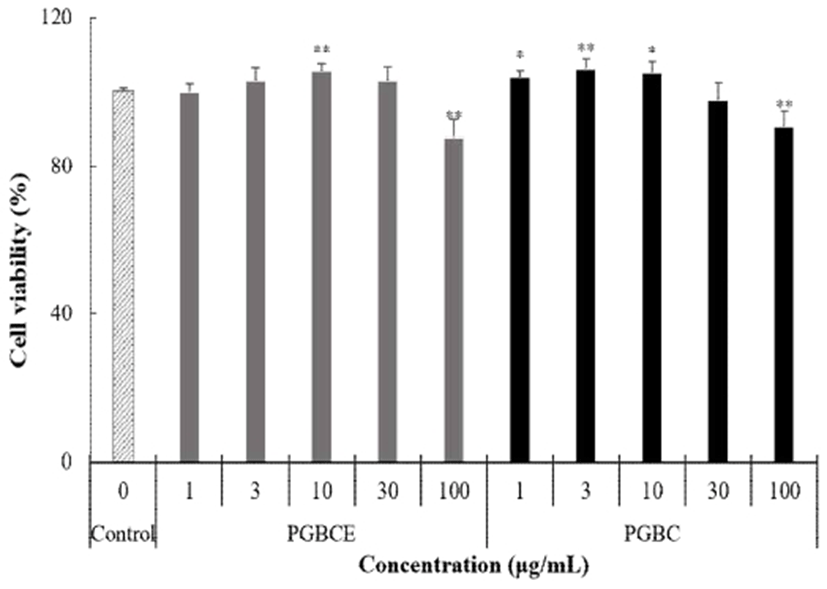
B16F10 murine melanoma cell을 사용하여 PGBE와 PGBEP의 MTT assay에 의한 세포독성을 측정한 결과는 Fig. 3와 같다. 세포독성은 독성판정기준에 따라 추출액의 세포독성이 200 μg/mL에서 IC50 이하일 경우 무독성으로 판정하고 있다(36). 본 연구에서는 PGBE와 PGBEP의 100 μg/mL을 제외한 모든 농도에서 세포생존율이 98~106%의 범위를 보였으나, 100 μg/mL에서는 PGBE와 PGBEP의 세포생존율이 각각 87%, 90%로 세포생존율의 저하를 보였다. 따라서 세포에 영향을 미칠 수 있을 것으로 사료되어 1, 3, 10, 30 μg/mL 농도로 wound healing assay를 진행하였다.
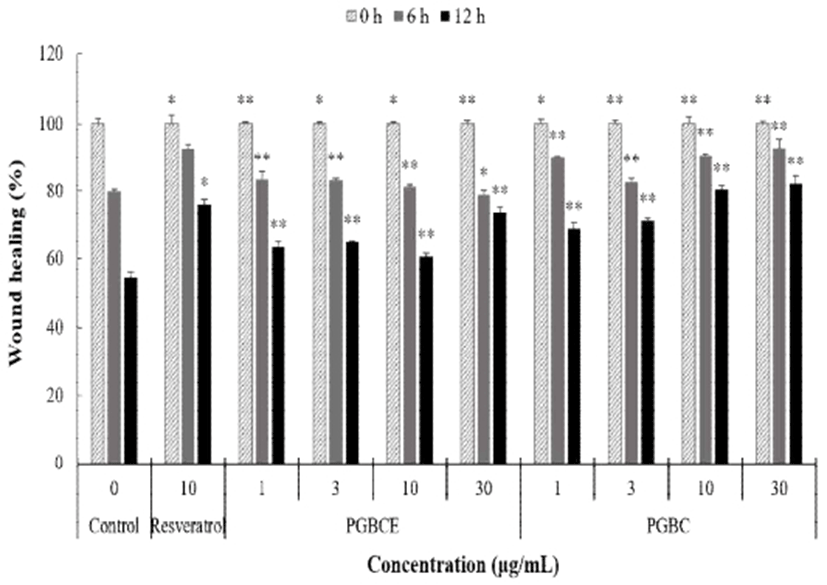
B16F10 murine melanoma cell을 사용하여 PGBE와 PGBEP의 wound healing assay에 의한 암세포 생육억제 활성을 측정한 결과는 Fig. 4와 같다. 모든 농도에서 PGBEP가 PGBE에 비하여 암세포 생육억제 활성이 높았으며, 특히 30 μg/mL의 PGBEP(82.32%)에서는 양성대조구인 10 μg/mL resveratrol(76.25%)보다 높았다(p<0.05). 한편 상황버섯(23)과 영지버섯(20)의 효소처리에 의해 암세포 생육 억제활성이 증가했다는 보고에 따라서, 약용버섯의 효소적 처리가 암세포 생육 억제활성을 증가시킨다고 사료된다.
요 약
상황버섯과 영지버섯의 β-glucan을 viscozyme L 처리하여 추출하고 정제하여 이화학적인 특성과 항산화활성, 암세포생육억제활성을 조사하였다. β-Glucan의 적정 추출 조건은 Viscozyme L 반응시간 8시간, 기질에 대한 효소 농도 6%(v/w), 상황버섯과 영지버섯의 혼합 비율 50:50(w/w)이었다. 정제물인 PGBEP(40.19%)의 β-glucan 순도는 추출물인 PGBE(26.70%)에 비하여 약 1.5배 높았으나, 추출 수율이 약 3배 낮아, 이를 고려한 β-glucan 함량은 추출물인 PGBE(5.23 g/100 g)가 정제물인 PGBEP(2.57 g/100 g)에 비하여 약 2배 높았다. 적외선흡수스펙트럼에서 β-glucan의 α-glycosidic linkage와 β-glycosidic linkage를 확인하였다. 항산화성분 함량과 항산화 활성은 추출물인 PGBE가 정제물인 PGBEP에 비하여 더 높게 나타났다. MTT assay에 의한 세포독성은 PGBE와 PGBEP 모두 나타나지 않았다. Wound healing assay로 측정한 암세포생육억제활성은 정제물인 PGBEP가 추출물인 PGBE보다 높았으며, 양성대조구인 resveratrol(10 μg/mL)보다 높았다(p<0.05).










