서 론
최근 들어서 식량문제의 심각성이 대두됨에 따라 식량을 소재로 하는 연구가 활발히 진행되고 있는 추세다. 새로운 생물 자원으로 곤충들의 우수한 영양학적 가치에 관한 연구가 많이 진행되고 있으며(1), 실제로 대체 식량 및 새로운 생물 자원 등 다양한 분야에서 활용될 것으로 기대되고 있다(2). 현재 국내에서 식용, 약용으로 사용되는 곤충으로는 누에, 번데기, 메뚜기, 흰점박이 꽃무지 유충(굼벵이) 등이 있으며 그 중에 굼벵이는 항산화력 뿐만 아니라 단백질이 풍부하며, 간 기능 개선에 효과가 있다고 알려져 있다(3). 또한 굼벵이는 일반적으로 약리학적 효과가 있다고 알려져 있으며 이러한 굼벵이의 효능에 기초하여, 건강기능식품으로도 활용될 수 있다고 사료된다(4). 이러한 곤충 소재를 가지고 발효과정을 거쳐 생성되는 새로운 생리활성 물질 증가 및 여러 가지 유용 성분 증가 등의 효과를 기대하며 본 연구를 진행하였다.
오래 전부터 우리나라에서는 김치, 청국장(5), 간장, 고추장 등의 발효 식품(6)을 많이 선호해왔으며 최근까지도 유용 미생물을 이용해서 만드는 자연 친화적인 제품의 선호도가 매우 높다. 유산균, 효모, 세균 등의 유익한 미생물을 이용하여 발효를 함으로써 알려진 기존 효능에서 새로운 생리 활성 부여 및 여러 가지 유용 성분증가(7) 등 다양한 이점을 부각시키는 연구가 활발히 진행 중이다.
본 연구에서 발효 균주로 사용된 Bacillus subtilis는 콩 발효식품(8)에서 많이 사용되는 호기성 균이다. 발효 과정 중 균주가 생산하는 분비 효소의 작용으로 가용성 추출물의 함량 증가 및 유기산 생성을 촉진하여 장을 자극해 소화 활동(6)을 활발하게 해준다. 또한 고분자형태의 단백질을 저분자 단백질로 분해하여 다양한 생리활성 물질이 생성되어 기존 소재에 비해 기능성이 향상된 식품재료로 인식 되고 있다(9). 곤충 분말을 가지고 생리활성 작용이 우수한 B. subtilis로 발효 시킨 누에 분말 연구에서도 단백질 농도가 증가하였으며, 항산화 작용뿐만 아니라 생리활성작용이 기존의 소재보다 증가한다는 결과를 밝힌 바 있고(9) 단백질 분해력이 높은 균주를 이용하여 발효시킨 곤충 발효물에서 항산화작용, 항혈전작용이 있는 것으로 보고됨에 따라 향후 건강식품 소재로 사용될 가치가 기대된다(10).
본 연구에서는 흰점박이 꽃무지 유충(굼벵이)분말을 생리활성작용이 뛰어난 B. subtilis KACC 91157 균주를 이용하여 발효 기간에 따른 결과물로부터 단백질 농도 변화, 단백질 패턴 변화, 항산화 활성 및 혈전용해 활성을 측정하여 최적 발효 조건을 검토하였다.
재료 및 방법
본 연구에서 실험 재료로 사용한 건조 굼벵이는 2017년 6월 경상북도 경주 토종 마을에서 구입하여 사용하였다. 발효 균주로는 본 연구실 내 보관 중인 균주로, Bacillus subtilis KACC 91157를 사용하여 건조 굼벵이 분말을 발효시켜 실험재료로 사용하였다. 대두 5%(w/w)를 이용해 만든 천연배지에 전 배양 시킨 B. subtilis를 원심 분리를 통해서 10%(v/w) 수준의 균체만 얻은 후 건조 굼벵이 분말에 잘 섞은 후 37℃에서 10일간 고상발효시켰다. 발효과정 중간에 발효물의 건조를 막기 위해 멸균된 증류수로 촉촉하게 버무려 주었으며, 발효시키면서 1일 간격으로 사용할 발효물을 취하여 50℃에서 5시간 열풍 건조한 후 분말화하여 냉장 보관하였다.
본 연구에서 사용한 굼벵이 분말 및 발효 굼벵이 분말 100 g을 각각 취해 10배의 정제수를 가한 후 37℃ 항온수조에서 3시간씩 교반하면서 3회 반복 추출하였다. 얻은 추출액은 Adventec 110 mm No.2 여과지(Toyo 2A, Toyo Roshi, Tokyo, Japan)로 여과하여 실험재료로 사용하였다.
당도는 시료 500 μL를 취하여 당도계(Hand refractormeter, Kruss, Hamburg, Germany)를 사용하여 total soluble solids(°Brix)를 측정하였다. 굼벵이 분말과 발효 굼벵이 분말을 수용성으로 추출한 추출물의 pH는 pH meter (SevenCompactTM pH/Ion S220, Mettler-Toledo Ag, Greifensee, Switzerland)로 측정하였다. 적정 산도는 100 mL 삼각 플라스크에 25 mL 눈금까지 3차 정제수를 넣은 후 시료를 100 μL 가한 후 1% phenolphthalein 용액 3방울 떨어뜨리고 0.1 N NaOH로 적정한 후 그 소모량을 총 산도로 환산하였다. 추출물의 총 산도는 acetic acid 값인 0.0006을 계산식에 적용하였다.
발효 굼벵이분말의 단백질 농도는 Lowry 방법(11)을 이용하여 540 nm에서 분광광도계로 bovine serum albumin을 표준품으로 단백질 량을 측정하였다.
발효 굼벵이분말의 단백질 패턴 분석은 Weber와 Osborn 방법(12)에 준하였다. SDS-PAGE의 조성은 10% acrylamide, 1.5 M Tris-HCl buffer(pH 8.8), 0.4% SDS(sodium dodecyl sulfate), 10% 과산화암모늄 및 0.05% TEMED로 만들어 사용하였다. 농축 gel 조성은 5% acrylamide, 0.5 M Tris-HCl(pH 6.8), 0.4% SDS, 0.05% TEMEN였다. 시료단백질의 SDS 처리는 최종농도 2% SDS, 14.4 Mm b-mercaptoethanol, 60 mM Tris-HCl buffer(pH 6.8), 25% glycerol 및 0.1% BPB 혼합액에서 100℃로 5분간 열처리 하였다. 전기영동은 Tris-glycine 완충액(25 mM Tris, 192 mM glycine, pH 8.3) 하에서 130-150 mA/gel(cm)의 정전류를 통하여 1시간 30분간 하였다. 전기영동 후 gel은 고정액 methanol:acetic acid:water(10:10:80, v/v/v)에 1% coomassie brillian blue R-250을 첨가하고 10시간 염색한 후 탈색액 methanol:acetic acid:water(10:10:80 , v/v/v)으로 충분히 탈색시켜 건조 및 사진촬영하였다.
발효 굼벵이분말의 단백질 패턴은 Davis 방법(13)에 따라 slab-type Native PAGE(sodium dodecyl sulfate polyacrylamide gel electrophoresis)의 gel의 농도는 7.5%를 사용하였다. 즉 분리 gel은 30% acrylamide, 0.8% bis-acrylamide, 1.5 M Tris-HCl buffer(pH 8.8), 0.05% TEMED 및 10% 과산화암모늄을 혼합하여 1 mm 두께로 만들어 사용하였다. 분리 gel 위에는 5% 농축 gel(30% acrylamide, 0.8% bis-acrylamide, 0.5 M Tris-HCl buffer(pH 6.8), 50% glycerol, 0.05% bromophenol blue) 용액에 혼합한 시료를 농축 gel 내에 성형된 wall에 일정량씩 주입하였다. 전기영동은 Tris-glycine 완충액(25 mM Tris, 192 mM glycine, pH 8.8) 하에서 1.5 mA/gel(cm)의 정전류를 통하여 행하고, 4℃ 저온에서 2시간 통전시켰다. 전기영동이 완료된 gel은 7% 초산 액에 용해한 1% coomassie brilliant blue R-250으로 염색한 후 7% 초산 액으로 충분히 탈색시켜 건조 및 사진촬영을 하였다.
페놀성 화합물의 함량은 Folin-Ciocalteu’s phenol reagent를 이용하여 페놀성 물질이 phosphomolybdic acid와 반응하여 청색으로 변함으로써 값을 비교하는 원리인 Folin-Denis법(14)로 spectrophotometer(Spectramax Plus 384, Molecular Devices Corp., Sunnyvale, CA, USA)의 760 nm에서 흡광도를 측정하였다. 이 때 표준 곡선 함량은 tannic acid를 일정 농도(0-500 μg/mL)로 하여 시료와 동일한 방법으로 측정하여 작성한 표준곡선으로부터 mg/100 g로 나타내었다.
Flavonoid 함량은 Jia 등(15)의 방법에 따라 각 시료의 용매별 추출물 1% (w/v) 농도에 정제수와 5% NaNO2 용액 및 10% AlCl3·6H2O를 잘 혼합하여 반응시킨 용액을 spectrophotometer(Spectramax Plus 384, Molecular Devices Corp.)의 510 nm에서 흡광도를 측정하였다. 이 때 함량은 표준 물질로서 (+)-catechin hydrate을 일정 농도(20-200 μg/mL)로 시료와 동일한 방법으로 측정하여 작성한 표준 곡선으로부터 mg/100 g로 계산하여 나타내었다.
굼벵이 분말과 발효 굼벵이 분말 추출물의 항산화 활성 측정은 Blois 방법에 따라(16) 각 시료 추출물 1%의 농도 시료 용액에 DPPH(α,α’-diphenyl-β-picrylhydrazyl) 반응 용액을 넣어 실온에서 20분간 반응시킨 후 흡광도를 측정하였다. DPPH free radical scavenging 활성은 spectrophotometer (Spectramax Plus 384, Molecular Devices Corp.)(17)의 528 nm에서 흡광도 감소를 측정하여 굼벵이 분말 및 발효 굼벵이 분말 추출물의 흡광도차를 백분율(%)로 표시하였다. 이때 양성대조군으로 사용한 합성 항산화제 Butylated hydroxytoluene(BHT)를 0.05% 농도로 첨가하여 시료와 동일한 방법으로 측정하였다.
굼벵이 분말과 발효 굼벵이 분말 추출물의 ABTS radical 소거능은 Biglari 등(18)의 방법을 변형하여 측정하였다. 7 mM 2,2-azobis(2-aminopropane) dihydrochloride(AAPH)는 2.45 mM의 ABTS와 혼합한 후 23℃의 암소에서 16시간 동안 반응시켰다. ABTS 용액의 농도는 734 nm에서 흡광도가 0.700±0.005가 되도록 조정한 후 농도 별로 희석한 시료 0.1 mL와 3.9 mL ABTS 용액을 혼합한 후 실온에서 6분 간 반응시켰다. 반응 종료 후 734 nm에서 UV/Vis-spectrophotometer(Hitachi, Tokyo, Japan)로 흡광도를 측정한 후 다음과 같은 식에 따라 ABTS radical 소거능을 계산하였다.
Cu-환원력 측정은 굼벵이 분말 및 발효 굼벵이 분말 추출물 1% 농도의 시료 용액에 0.01 M CuCl2, 7.5 mM ethanolic neocuprorine solution, 1 M NH4OAc buffer를 혼합하여 상온에서 30 min 반응시킨 후 420 nm에서 흡광도를 측정하였다. 이 때 환원력 비교를 위해 사용한 합성 항산화제 BHT를 각각 1.00%, 0.50%, 0.01%, 0.05%, 0.01% 5개의 농도로 동일한 방법으로 spectrophotometer(Spectramax Plus 384, Molecular Devices Corp.)에서 450 nm에서 흡광도를 측정하였다. Cu-환원력 실험은 시료 반응액에서 흡광도가 증가함에 따라 진한 orange/ yellow 색을 나타내어 강한 환원력을 나타내어 준다.
굼벵이 분말과 발효 굼벵이 분말 추출물의 혈전 용해 효소 활성은 fibrin plate법(19)을 변형하여 lysed zone으로 측정하였다. 0.06% fibrinogen(Sigma, St. Louis, MO, USA)을 0.2 M sodium borate buffer(pH 7.5)에 37℃에 1시간 용해시킨 후 petri dish에 10 mL씩 분주하고, thrombin(1,000 unit, Sigma)을 40 unit/mL의 농도로 희석 한 후 총 20 unit가 되도록 가하여 균일하게 혼합하기 위해서 잘 흔들어준다. 15 min 정도 굳힘 과정을 거친 뒤 fibrin clot을 형성시킨 후에 사용하였다. Fibrin 배지에 paper disc를 얹고, 10% 추출물을 50 μL씩 점적하여 37℃ incubator에서 반응시켜 일정한 시간 간견을 두고 최대 6시간까지 fibrin이 분해되어 생기는 환의 면적을 측정하였다. 직경은 서로 수직인 두 개의 지름을 측정하였고, 투명대가 타원인 경우에는 가장 긴 지름과 가장 짧은 지름을 측정하여 투명대의 면적을 구하였다.
실험에 사용된 인체 간암세포주인 HepG2는 한국세포주은행(KCLB)에서 분양 받았으며 100 unit/mL의 Antibiotic Antimycotic(GIBCO® Thermo Fisher Scientific, MA, USA)와 10% fetal bovine serum(FBS)가 첨가된 DMEM을 이용하여 37℃, 5% CO2 incubator(Thermo Scientific, MA, USA)에서 계대배양하여 사용하였다. 5×104/mL의 세포를 24-well plate에 seeding하여 24시간 동안 배양한 후 0.5% 농도의 굼벵이 분말과 발효 굼벵이 분말 추출물을 4시간 동안 처리한 후 5 mM의 Et-OH이 함유된 배지로 교체하였다. 이후 5일간 CO2 incubator에 배양하며 중성지질축적을 유도하였다.
세포 내 중성지질축적을 확인하기 위하여 Oil red O 염색을 실시하였다. 배양된 HepG2 간암세포에 4% paraformaldehyde를 500 μL씩 첨가하여 30분간 고정시킨 후 Oil red O 염색약을 200 μL 처리하여 암실에서 1시간 동안 염색하였다. 이후 염색약을 PBS로 세척하고 HepG2 간암세포 내 중성지질 염색 유무를 200 배율의 광학현미경(Leica Microsystems, Wetzlar, Germany)을 이용하여 관찰한 후 사진을 촬영하였다. 이를 정량하기 위해 60% isopropanol 200 μL를 첨가하여 세포 내 염색약을 추출한 후 96-well plate로 옮겨 microplate reader(Titertek Multiscan Plus, Labsystems, Sdpoo, Vantaa, Finland)를 사용하여 540 nm에서 흡광도를 측정하였다.
실험으로부터 얻어진 결과는 one-way ANOVA 검정에 의한 평균치와 표준 오차(mean±SE)로 표시하였고, 각 실험 군 간의 유의성 검증은 Duncan’s multiple range test로 나타내었다(20).
결과 및 고찰
굼벵이 분말과 발효 굼벵이 분말 추출물의 경시적 변화를 당도, pH, 적정산도 측정을 통해 알아보았다(Table 1). 굼벵이 분말의 당도 1.6 °Brix에 비해 발효 굼벵이 분말 추출물의 당도는 평균 4.5 °Brix로 증가하였다. 발효 7일 차까지 계속 증가하는 양상을 보였으며, 당도가 5.6 °Brix로 발효 7일 차가 가장 높았다.
1)SN, P. brevitarsis seulensis larvae fermented using Bacillus subtilis for 0 day; SF1, P. brevitarsis seulensis larvae fermented using Bacillus subtilis for 1 day; SF2, P. brevitarsis seulensis larvae fermented using Bacillus subtilis for 2 days; SF3, P. brevitarsis seulensis larvae fermented using Bacillus subtilis for 3 days; SF4, P. brevitarsis seulensis larvae fermented using Bacillus subtilis for 4 days; SF5, P. brevitarsis seulensis larvae fermented using Bacillus subtilis for 5 days; SF6, P. brevitarsis seulensis larvae fermented using Bacillus subtilis for 6 days; SF7, P. brevitarsis seulensis larvae fermented using Bacillus subtilis for 7 days; SF8, P. brevitarsis seulensis larvae fermented using Bacillus subtilis for 8 days; SF9, P. brevitarsis seulensis larvae fermented using Bacillus subtilis for 9 days; SF10, P. brevitarsis seulensis larvae fermented using Bacillus subtilis for 10 days.
굼벵이 분말 및 발효 굼벵이 분말 추출물의 pH 변화에서는 발효 일수에 따른 큰 차이는 보이지 않았으나, 대체적으로 증가하는 양상을 보였다. 굼벵이 분말과 발효 굼벵이 분말 추출물의 적정산도는 굼벵이 분말 추출물이 0.44%에 비해 발효 굼벵이 분말 추출물은 0.53-1.13%로 전체적으로 증가하였고, 그 중에서도 발효 5일 차 발효 굼벵이 분말 추출물에서 급격히 증가하였으며, 이후에는 유의적인 차이를 보이지 않았다.
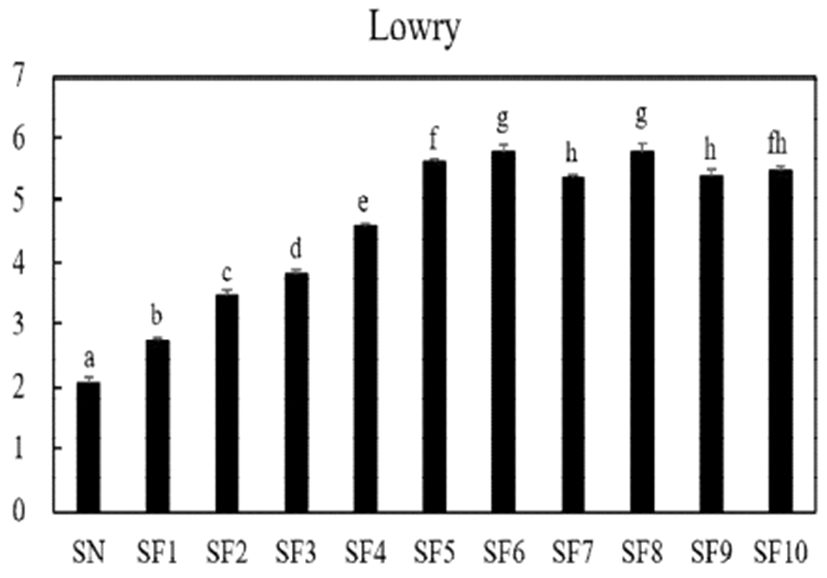
발효 굼벵이 분말 추출물의 발효 일수에 따른 경시적인 단백질 패턴을 알아보기 위해서 10일 차까지 고상발효를 실시한 결과(Fig. 1), 굼벵이 분말의 단백질 농도에 비해 발효 굼벵이 분말의 단백질 농도는 증가하였고, 발효 기간에 지남에 따라 6일 차까지 증가하며, 그 이후에는 유의적인 차이를 보이지 않았다. 한편, Cha 등(9)의 연구에서도 B. subtilis로 발효한 곤충을 발효 기간에 따라 단백질 농도를 측정한 결과, 일정기간까지 유용미생물과 곤충소재간의 상호작용이 어우러져 발효가 잘 이루어짐으로써, 단백질 농도가 증가되는 경향을 보인다는 결과를 도출되었다는 점과 비슷한 결과를 나타내었다.
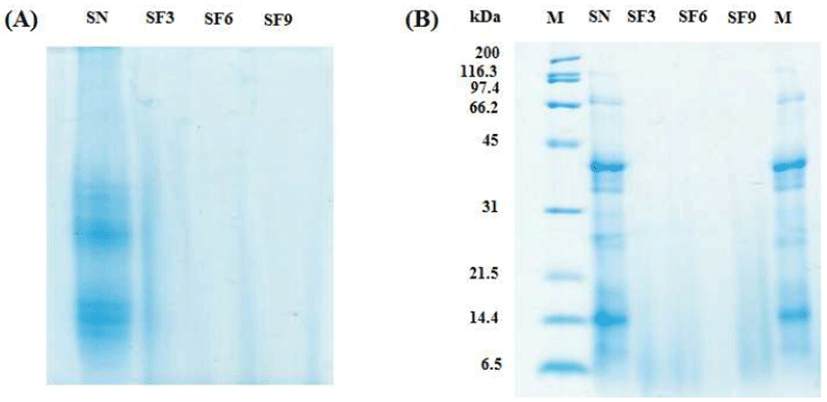
Native-PAGE는 SDS-PAGE와 달리 단백질 변성을 주지 않고, 단백질 복합체를 고유의 전하에 의해서만 분리하는 방법으로 본 연구에서는 발효됨에 따라 분해된 단백질의 패턴을 분석하였다. 굼벵이 분말 및 발효 굼벵이 분말을 Native-PAGE로 전기영동 하여 비교분석 한 결과(Fig. 2A), B. subtilis로 발효한 굼벵이 분말에서는 발효 3일 차부터 대부분 분해되어 단백질들의 분포가 거의 보이지 않는 것으로 나타났다. 누에 분말을 B. subtilis로 발효한 누에 분말에서도 발효를 함으로써 대부분 분해되어 저분자화 된 결과와 다소 일치하였다(9). SDS-PAGE를 이용하여 확인하고자 하는 단백질 분자량의 범위 내에서 발효 굼벵이의 발효 정도를 형태학적으로 확인할 수 있다. 굼벵이 분말 및 발효 굼벵이 분말을 SDS-PAGE로 전기영동하여 단백질 패턴을 비교분석 한 결과(Fig. 2B), 굼벵이 분말에서 116.3 kDa, 67.4 kDa, 31-45 kDa, 21.5-31 kDa, 14.4 kDa의 밴드를 확인할 수 있었으나, 발효 굼벵이 분말 3일 차부터 기존 굼벵이가 가지고 있던 밴드는 관찰할 수 없었다. 이는 B. subtilis 의 단백질 분해 효소에 의해 대부분 분해된 것으로 보여진다. 한편, 곤충 소재로 한 연구에서 B. subtilis로 발효한 누에 분말을 기간에 따라 단백질 패턴을 분석한 결과, 발효 기간이 경과할수록 단백질 밴드가 대부분 분해가 되는 결과와 비슷한 경향을 보였다(9). 따라서 굼벵이를 B. subtilis로 발효시킴으로써 분해된 아미노산 및 펩타이드와 같은 기능성 유효 물질을 획득할 수 있을 것으로 사료된다.
식물들은 자외선뿐만 아니라 병원균, 공기오염, 급격한 온도 변화 등 여러 극한 상황(21)에서 살아남기 위해 자신의 바깥 부분에 스스로 버틸 수 있게 도움을 주는 영양소를 만들게 된다. 이들 중에 대표적인 수산기(-OH)를 가지고 있는 폴리페놀은 식물계에 널리 분포되어 있는 2차 대사산물 중(22)의 하나로 항암작용, 심장 보호 작용, 항산화, 환원제 등 다양한 기능을 가진다(23). 본 실험에서 사용한 굼벵이 분말 및 발효 굼벵이 분말 추출물의 polyphenolic compounds 함량을 측정한 결과(Table 2), 굼벵이 분말 추출물이 9.89 mg/100 g 에 비해 발효 굼벵이 분말 추출물은 평균 28.26 mg/100 g으로 발효에 의해 약 3배가량 polyphenolic compounds 함량이 높아졌다. 발효 2, 3일 차 굼벵이 분말 추출물에서 polyphenolic compounds 가장 크게 증가하였으며, 5일 차 발효 굼벵이 분말 추출물에서 높은 polyphenolic compounds 함량을 보였으나, 이후 발효 기간 동안에는 유의적인 변화는 없었다(Table 2).
1)SN, P. brevitarsis seulensis larvae fermented using Bacillus subtilis for 0 day; SF1, P. brevitarsis seulensis larvae fermented using Bacillus subtilis for 1 day; SF2, P. brevitarsis seulensis larvae fermented using Bacillus subtilis for 2 days; SF3, P. brevitarsis seulensis larvae fermented using Bacillus subtilis for 3 days; SF4, P. brevitarsis seulensis larvae fermented using Bacillus subtilis for 4 days; SF5, P. brevitarsis seulensis larvae fermented using Bacillus subtilis for 5 days; SF6, P. brevitarsis seulensis larvae fermented using Bacillus subtilis for 6 days; SF7, P. brevitarsis seulensis larvae fermented using Bacillus subtilis for 7 days; SF8, P. brevitarsis seulensis larvae fermented using Bacillus subtilis for 8 days; SF9, P. brevitarsis seulensis larvae fermented using Bacillus subtilis for 9 days; SF10, P. brevitarsis seulensis larvae fermented using Bacillus subtilis for 10 days.
천연항산화제인 플라보노이드는 식물체에서 2차 대사산물로 구분되는 폴리페놀류에 속하며, 항염증 작용, 항알레르기, 항암 및 항산화와 같은 여러 가지 흥미로운 이점을 가지고 있다(24). 플라보노이드 함량을 측정한 결과(Table 2), 굼벵이 분말 추출물이 7.24 mg/100 g에 비해 발효 굼벵이 분말 추출물은 평균 22.03 mg/100 g 으로 발효 전에 비해 플라보노이드 함량이 약 3배 이상 증가하였다. 발효 1일 차 14.20 mg/100 g에서 발효 3일 차 24.82 mg/100 g 로 가장 급격히 증가하는 경향을 보였으나, 이후로는 유의적인 변화는 없었다. 발효 일수가 증가함에 따라 플라보노이드 함량도 유의적으로 증가한 것으로 사료된다.
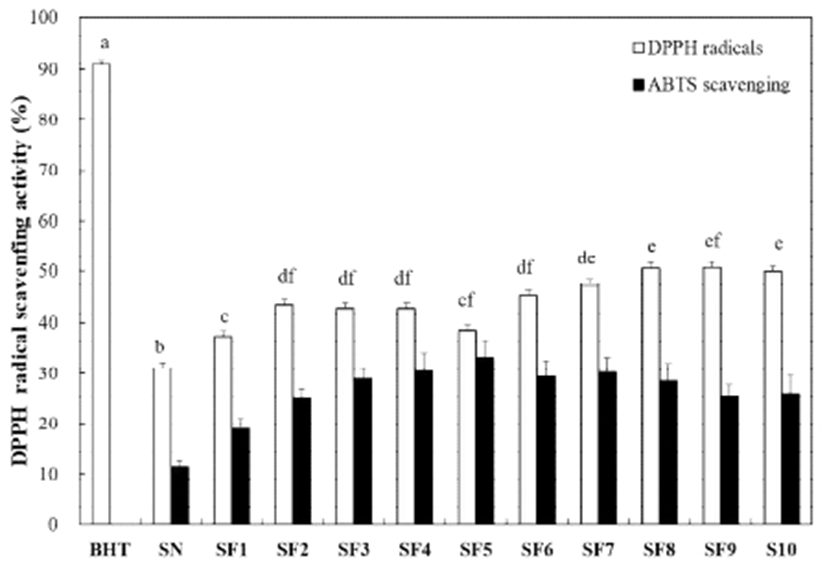
DPPH는 안정된 free radical을 가지며, 식물체에 존재하는 quercetin, flavonoid와 같은 polyphenol 화합물(25)에 있는 전자나 수소원자에 의해 비라디칼 형태를 띄어 특유의 짙은 자주색에서 노란색으로 탈색되는 정도를 흡광도를 통해서 항산화 능력을 측정한다(26). 굼벵이 분말 및 발효 굼벵이 분말 추출물(1%)의 DPPH free radical scavenging activity를 측정한 결과 대조군으로 사용된 합성 항산화제인 butylated hydroxytoluene(BHT)는 약 90%의 라디칼 소거 활성에 비해 굼벵이 분말 및 발효 굼벵이 분말 추출물은 다소 낮은 라디칼 소거 활성을 나타내었다(Fig. 4). 하지만, 굼벵이 분말 추출물이 31.14%에 비해 발효 굼벵이 분말 추출물의 라디칼 소거 활성이 평균 44.95%로 증가하는 긍정적인 결과를 나타내었다. 발효 2일 차부터 증가하였으며 그 이후에는 비슷한 양상을 보이며 유의적인 변화는 보이지 않았다. 한편, B. subtilis를 이용한 누에발효물의 항산화 활성이 발효 기간이 길어지면서 비례적으로 증가한다는 결과(9)와 다소 상이한 결과를 보였다.
ABTS는 짙은 청록색의 자유라디칼로서 항산화 능력이 있는 시료와 만나면 색이 옅어지는 성질을 이용하여 항산화 활성을 측정한다. 굼벵이 분말 및 발효 굼벵이 분말 추출물 (1%)의 ABTS 라디칼 소거활성을 측정한 결과 BHT군과 비교하여 다소 낮은 ABTS 라디칼 소거활성을 보였으나, 발효 일수가 증가함에 따라 활성이 증가하는 경향을 확인하였다. 굼벵이 분말 추출물과 비교하여 1일 차 발효 굼벵이 분말 추출물부터 10일 차 추출물까지 각각 7.56, 13.59, 17.64, 19.10, 21.82, 17.95, 18.81, 17.23, 14.07, 및 14.69% 우수한 ABTS 라디칼 소거활성을 나타내었다(Fig. 4).

본 연구의 결과는 발효 굼벵이 분말 추출물에서 굼벵이 분말 추출물보다 페놀성 화합물 및 플라보노이드 함량이 증가하였던 결과와 유사한 경향을 보였다(Table 2). 이는 B. subtilis를 이용한 누에발효물의 항산화 활성이 발효 기간이 길어지면서 비례적으로 증가한다는 보고(9)와 유사하였으며, 이는 발효를 통해 천연물 내 단백질, 지방 및 다당류 등의 고분자 물질이 분해되며 기능성 펩타이드, 지방산, 당류 및 폴리페놀 함량이 증가함으로써 생리활성 효능이 향상되기 때문인 것으로 사료된다(27,28).
Cu 환원력 실험은 Cu2+에서 Cu+로 환원시키는 정도 즉, 금속 이온을 환원시키는 정도를 흡광도 값으로 나타낸다(9). 유리 라디칼의 연쇄반응으로 환원시키는 정도가 셀수록 진한 yellow/orange 색을 나타낸다. 따라서 환원력의 세기가 높을수록, 색이 진해질수록 항산화 활성이 높음을 알 수 있다(29). 굼벵이 분말 추출물(1%)의 Cu 환원력은 0.32로, 대조군인 BHT 0.1%의 0.39 수치보다 조금 낮은 값을 보였다. 한편 발효 3일 차까지 증가하는 경향을 보였으나, 이후로는 유의적인 차이는 보이지 않았고, 굼벵이 분말 추출물에 비해 발효 굼벵이 분말 추출물에서는 평균 0.47로 발효 일수에 따라 증가하였다(Table 3).
2)SN, P. brevitarsis seulensis larvae fermented using Bacillus subtilis for 0 day; SF1, P. brevitarsis seulensis larvae fermented using Bacillus subtilis for 1 day; SF2, P. brevitarsis seulensis larvae fermented using Bacillus subtilis for 2 days; SF3, P. brevitarsis seulensis larvae fermented using Bacillus subtilis for 3 days; SF4, P. brevitarsis seulensis larvae fermented using Bacillus subtilis for 4 days; SF5, P. brevitarsis seulensis larvae fermented using Bacillus subtilis for 5 days; SF6, P. brevitarsis seulensis larvae fermented using Bacillus subtilis for 6 days; SF7, P. brevitarsis seulensis larvae fermented using Bacillus subtilis for 7 days; SF8, P. brevitarsis seulensis larvae fermented using Bacillus subtilis for 8 days; SF9, P. brevitarsis seulensis larvae fermented using Bacillus subtilis for 9 days; SF10, P. brevitarsis seulensis larvae fermented using Bacillus subtilis for 10 days.
체내에서 thrombin에 의해 fibrinogen이 fibrin으로 전환되어 혈관 속의 혈전을 생성하게 된다(30). 혈액 속에 많은 혈전이 생기게 되면 문제를 야기할 수 있는데, 여러 가지 원인들로 생겨난 fibrin을 가수분해하여 혈전증을 완화시킬 수 있다(31). 최근에는 각종 천연물 또는 발효물에서 혈전 용해 활성 물질을 탐색하는 연구가 활발히 진행되고 있다.
Fibrin plate 위에 paper disc를 올려놓은 뒤 수용성 10% 추출한 굼벵이 분말 추출물 및 발효 굼벵이 분말 추출물을 50 μL씩 점적하여 1시간마다 분해환 크기를 확인 한 결과, 2시간 정도 후에 정확하게 환 크기 측정이 가능했다(Fig. 5). 본 실험에서 굼벵이 분말 및 발효 굼벵이 분말의 경시적인 혈전용해능을 조사한 결과(Table 4), 대체적으로 시간이 경과함에 따라 발효 굼벵이 분말 추출물의 혈전용해능이 증가하였으며, 특히 3, 5일 차에 67.9 unit로 가장 높았다.
1)SN, P. brevitarsis seulensis larvae fermented using Bacillus subtilis for 0 day; SF1, P. brevitarsis seulensis larvae fermented using Bacillus subtilis for 1 day; SF2, P. brevitarsis seulensis larvae fermented using Bacillus subtilis for 2 days; SF3, P. brevitarsis seulensis larvae fermented using Bacillus subtilis for 3 days; SF4, P. brevitarsis seulensis larvae fermented using Bacillus subtilis for 4 days; SF5, P. brevitarsis seulensis larvae fermented using Bacillus subtilis for 5 days; SF6, P. brevitarsis seulensis larvae fermented using Bacillus subtilis for 6 days; SF7, P. brevitarsis seulensis larvae fermented using Bacillus subtilis for 7 days; SF8, P. brevitarsis seulensis larvae fermented using Bacillus subtilis for 8 days; SF9, P. brevitarsis seulensis larvae fermented using Bacillus subtilis for 9 days; SF10, P. brevitarsis seulensis larvae fermented using Bacillus subtilis for 10 days.
한편, 굼벵이 분말 및 발효 1, 2일 차 발효 굼벵이 분말 추출물에서는 혈전 용해 활성이 나타나지 않았다. 기존의 흰점박이 꽃무지 애벌레 추출물에서 분리 정제한 혈전 용해 효소 단백질은 비교적 높은 혈전 용해능을 갖고 있다는 결과와는 조금 다른 경향을 보였다(31). 따라서 발효 굼벵이 분말의 혈전 용해 효소 활성을 갖는 발효 산물을 얻기 위해서는 최소 3일의 발효 기간이 필요한 것으로 사료된다.
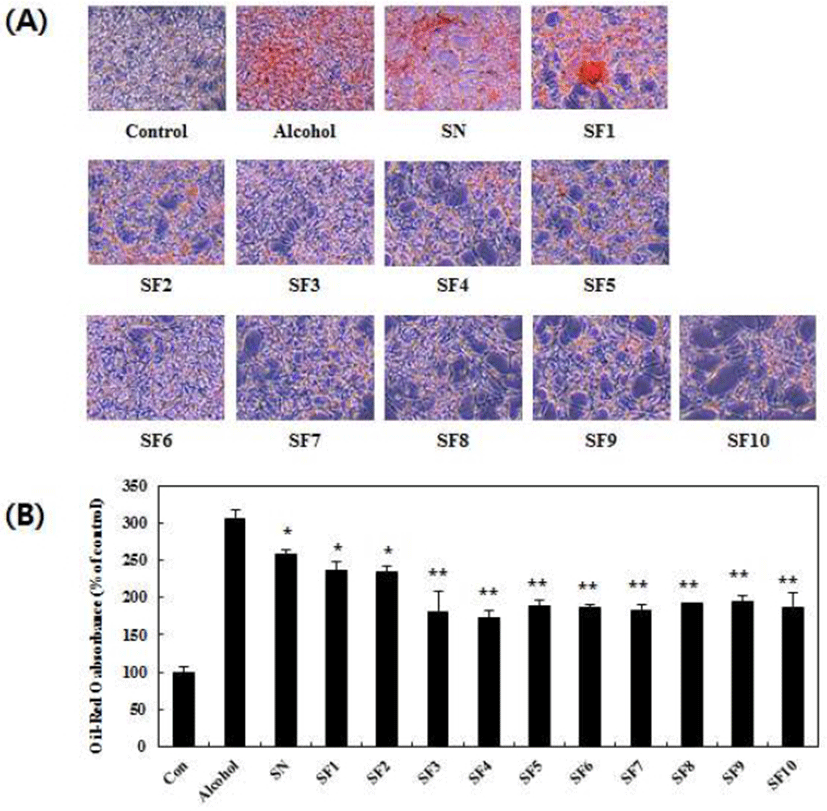
굼벵이 분말 및 발효 굼벵이 분말 추출물의 알코올성 지방축적에 대한 억제효능을 알아보기 위하여 HepG2 인체 간세포에 알코올을 처리하고 Oil Red O 염색시약으로 지방축적 유무를 관찰 및 정량한 결과는 Fig. 5와 같다. 알코올을 처리하지 않은 대조군과 비교하여 알코올 처리군에서 세포 내 중성지질 함량이 약 305.76% 증가하는 것으로 확인되었으며 이는 굼벵이 분말 및 발효 굼벵이 분말 추출물을 처리하였을 때 유의적으로 감소하는 것으로 나타났다(Fig. 5A, B). 특히, 굼벵이 분말 추출물과 비교하여 1일 차 발효 굼벵이 분말 추출물부터 10일 차까지 각각 22.01, 22.93, 77.98, 86.23, 68.80, 70.64, 76.14, 66.05, 63.30, 및 70.64% 가량 낮은 세포 내 중성지질 함량을 보였다(Fig. 5B). 이를 통해 발효 굼벵이 분말 추출물은 발효 3일 차부터 HepG2 인체 간세포에서 유의적인 알코올성 중성지질 축적 억제효과를 보인다는 것을 확인하였고 이는 발효일수가 늘어나더라도 큰 변화가 없는 것으로 나타났다. Nardelli 등(32)은 taurine 아미노산의 섭취가 비만 쥐의 혈중 지질 함량을 감소시키는 것을 확인하였으며, Wu 등(33)은 폴리페놀이 풍부한 뽕잎추출물의 처리가 인체 간세포의 지질 축적을 억제하는 것으로 보고하였다. 본 연구결과는 굼벵이 분말 추출물에 비해 발효 굼벵이 분말 추출물에서 총 폴리페놀 및 플라보노이드 함량이 높았던 Table 2의 결과와 유사한 경향을 나타내었다. 기존의 연구보고들과 본 연구의 결과들을 종합하면 HepG2 인체 간세포에서 발효 굼벵이 분말 추출물이 굼벵이 분말 추출물보다 알코올 유도 지질 축적 억제효과가 높은 것으로 보아 발효를 통해 발생한 다량의 아미노산, 지방산, 당류 및 폴리페놀 등에 의해 중성지질축적 효능을 보이는 것으로 판단된다.
요 약
본 연구는 Bacillus subtilis KACC 91157를 이용하여 발효한 굼벵이 분말을 수용성 용매에 추출하여 항산화 효능을 포함한 생리활성 및 이화학적 특징을 비교하였다. 먼저, 발효물의 기본데이터를 확립하기 위해 당도, pH 및 산도를 확인한 결과, pH 및 산도는 유의적인 차이를 확인할 수 없었으며, 당도에서 발효 7일 차부터 증가함을 확인하였고, 그 이후 감소하는 결과를 보였다. 단백질 농도는 발효기간에 따라 점점 증가하여 발효 6일 차에 최대치를 보이며, 그 이후부터는 감소하는 경향을 보였다. SDS-PAGE상의 단백질 패턴 분석 결과, 116.3 kDa, 67.4 kDa, 31-45 kDa, 21.5-31 kDa, 14.4 kDa 크기의 단백질 밴드가 B. subtilis발효에 의해 대부분 분해됨을 확인하였다. 총 폴리페놀 함량및 플라보노이드 함량은 기존의 굼벵이 분말에 비해 대체적으로 증가하였으며, 발효초기 3일 차부터 증가함을 확인하였다. 항산화 활성능 확인하고자 DPPH 자유 라디칼 소거능 및 환원력 실험을 수행한 결과, 발효 3일 차에 대체로 높은 활성을 가지며, 그 이후 발효 기간 동안의 유의적인 변화는 없었다. 혈전 분해 활성 또한 발효 3일 차 가장 크게 증가함을 볼 수 있었다.
따라서, B. subtilis로 발효한 굼벵이 분말의 경시적 생리활성 및 이화학적 특성을 관찰한 결과, B. subtilis 발효 굼벵이 분말은 발효 3일 차에 가장 긍정적인 결과를 도출함을 확인하였다.










