서 론
경제성장과 국민소득의 증가로 인하여 항산화, 항암 및 면역, 각종 질병 예방 등의 기능성을 강조한 식품에 대한 국민들의 소비가 증가되고 있다(1). 그 중에서도, 포도주 소비와 심혈관계질환 발병 비율의 상관성이 알려진 이후 과실주에 대한 관심이 증대해 왔다(2,3). 머루(Vitis amurensis)는 포도나무과 덩굴성 목본식물로 직경 8 mm 정도의 작은 검붉은색 열매를 생산한다(4). 품종, 숙성기간 및 재배환경에 따른 차이가 있지만, 머루에는 칼슘, 인 및 철 등의 무기질과, 비타민 B1, B2, B3 및 비타민 C가 풍부하며, 다양한 항산화 물질들이 포함되어 있다(3,5). 국내에서 생산되는 머루는 과실대비 씨앗의 크기가 큰 이유로 생식용보다는 대부분 머루와인(Moru wine) 제조용으로 소비된다(3,5). 최근에는 식품의 이화학적 특성과 기능성은 유지하면서 위해성을 제거한 제품에 대한 소비자들의 요구가 증가하고 있다(6). Moru wine에서 건강의 위해요소로 작용하는 알코올은 증류에 의하여 Moru wine에서 선별적으로 제거할 수 있다.
국내 증류주 제조는 감압증류방식 또는 상압증류방식으로 제조된다(7,8). Cho 등(9)은 마가목 열매, 사과 및 감귤 등의 과실원료별, 증류방식별로 초류, 본류 및 후류로 구분지어 증류한 후, 증류주의 증류효율과 주요 향기성분 비교 시에 상압증류와 감압증류의 유의적인 차이를 보고하였다. 하지만 Moru wine을 활용한 무알코올 음료제조 및 해당 제품의 성분 분석에 관한 연구는 전무한 실정이다. 이에 본 연구에서는 Moru wine을 상압증류법과 감압증류법으로 알코올을 증류시켜 무알코올 와인을 제조한 후, Moru wine과 2종 무알코올 Moru wine의 성분과 항산화물질의 정성 및 정량 분석을 시도하였다.
재료 및 방법
Acetic acid, sodium hydroxide 및 sodium nitrate은 Showa Chemical Industry Co.(Tokyo, Japan)사 제품을, sodium carbonate은 Samchun Chemical(Pyeongtaek, Korea)사 제품을, Folin-Ciocalteu’s reagent, aluminum nitrate, 2,2'-azino-bis(3-ethylbenzothiazoline-6-sulphonic acid)(ABTS), potassium persulfate 및 항산화활성 실험용 표준물질인 gallic acid, protocatechuic acid, chlorogenic acid, vanillic acid, syringic acid, p-coumaric acid, t-ferulic acid, naringin, t-cinnamic acid, naringenin, kaempferol, caffeic acid, epicatechin 및 (+)catechin은 Sigma-Aldrich(St. Louis, MO, USA)사 제품을, rutin은 Wako Pure Chemical Industries(Osaka, Japan)사 제품을 사용하였다. HPLC분석에 사용한 water, methanol, acetonitrile은 Fisher Scientific(Fairlawn, NJ, USA)사 제품을 사용하였다.
Moru wine은 Lee 등(3)의 방법으로 실험실에서 자체양조하였다. 파쇄한 머루 15 L를 25 L용량의 플라스틱 발효조에 투입하고, 설탕으로 보당하여 24 °Brix로 조절하였다. 여기에 살균을 목적으로 K2S2O5 2 g을 첨가하여 상온에서 16시간 동안 정치하였다. 정치 후 Novozyme사(Bagsvaerd, Denmark)의 pectinase인 Pectinex 100 L(5,000 FDU/mL, 55℃)을 5 mL 가한 후 여기에 다시 Saccharomyces cerevisiae(Red Star Premier cuvee, LeSaffre, Marcq-en-Baroeul, France) 5 g을 첨가하여 23℃에서 2주 동안 발효하였다. 발효주를 거름망을 통과시켜 고체성분을 제거한 후 Moru wine으로 사용하였다. 무알코올 Moru wine의 제조를 위하여 상압증류법과 감압증류법을 적용하였다. 상압증류법을 사용한 시료제조를 위하여 Moru wine 500 mL을 100℃으로 설정된 히팅맨틀(Model ES4, Misung Scientific Co., Seoul, Korea)로 가열하여 연속적으로 증류하였고, 감압 증류법을 사용한 시료제조를 위하여 Moru wine 500 mL을 압력 80 mbar, 온도 55℃로 설정된 회전증발농축기(R-100, BŰCHI, Zollikofen, Switzerland)로 Moru wine을 연속적으로 증류하여 알코올을 제거하였다. 증류과정 중 Moru wine 시료의 알코올 함량을 Alcolyzer wine(Anton paar, Graz, Austria)으로 측정하였으며, 시료의 알코올 함량이 1% 이하가 되었을 때 증류를 종료하였다. 2종 무알코올 Moru wine 시료들의 최종 부피는 360 mL였다. 분석에는 증류 전 시료인 머루와인(Moru wine), 상압증류법으로 알코올을 비롯한 휘발성 성분을 제거한 무알코올 Moru wine(non-alcoholic Moru wine produced by atmospheric distillation, NA-AD) 및 감압증류법으로 제조한 무알코올 Moru wine(non-alcoholic Moru wine produced by vacuum distillation, NA-VD) 등 총 3종 와인시료들을 사용하였다.
시료의 pH 측정에는 pH meter(model 725p, Istek, Seoul, Korea)를 사용하였다. 산도측정을 위하여, 시료액 10 mL를 비이커에 담고 페놀프탈레인 지시약 1-2방울을 떨어뜨린 후, 0.1 N NaOH를 천천히 첨가하여 혼합물의 핑크색이 30초 동안 유지되는 점을 종말점으로 하고, 종말점까지 소모된 NaOH 양을 측정하여 주석산(tartaric acid) 함량으로 계산하였다. 가용성 고형분 함량은 와인을 굴절당도계(Model N-1α, ATAGO, Tokyo, Japan)를 이용하여 측정하였다. 시료의 알코올 함량은 Alcolyzer wine(Anton paar)을 사용하여 측정하였다.
총 플라보노이드 함량 측정은 Zhishen 등(10)의 방법을 변형하여 다음과 같이 실시하였다. 시료 300 μL에 증류수 300 μL를 첨가한 후 여기에 다시 5% sodium nitrite 30 μL를 가하여 5분 동안 반응시킨 후 추가로 10% aluminium nitrate 60 μL를 첨가하여 6분 동안 방치하였다. 반응액에 1 N NaOH 200 μL를 가하여 microplate reader(Eon, BioTek, Winnoski, VT, USA)로 510 nm 파장에서 흡광도를 측정하였다. 총 플라보노이드 함량은 (+)카테킨(catechin)을 표준물질로 사용하여 검량선의 회귀식에서 카테킨 당량((+)catechin equivalent, CE)으로 환산하여 나타내었다. 페놀성 화합물(total phenolic contents) 함량은 Folin-Ciocalteu’s reaction 발색법(11)을 이용하여 다음과 같이 측정하였다. 시료 200 μL에 Folin-Ciocalteu’s reagent 200 μL를 가하여 5분 동안 반응시킨 후 추가로 20% sodium carbonate 400 μL를 가하여 실온에서 90분 동안 반응시켜 microplate reader로 765 nm파장에서 흡광도를 측정하였다. 총 폴리페놀 함량은 갈산(gallic acid)을 표준물질로 사용하여 gallic acid equivalent(GAE mg/L)로 환산하여 나타내었다. ABTS 라디칼 소거능 활성(12)은 다음과 같이 측정하였다. ABTS 라디칼 생성을 위해 7.4 mM ABTS와 2.6 mM potassium persulfate을 혼합한 용액을 암실에서 24시간 방치하여 라디칼을 생성하였다. 생성된 ABTS 라디칼을 734 nm에서 흡광도를 측정하여 0.7이 되도록 희석하여 사용하였다. 희석한 ABTS 용액 950 μL에 시료 50 μL를 넣어 30분 동안 반응시킨 후 734 nm에서 흡광도를 측정하였다.
시료 전처리를 위하여 Sep-Pak C18 Vac cartridge(Waters, Milford, MA, USA)에 methanol 5 mL를 흘려주어 활성화시킨 다음, 초순수 water 5 mL로 세척하였다. 이어 시료 2 mL을 주입한 후 1% acetic acid(in 50% methanol) 10 mL로 용출하여 색소, 당류 및 유리당 등을 제거하였다. 용출된 시료 10 mL를 농축하여 50% 메탄올 2 mL로 용해하여 0.2 μm PTFE syringe filter로 여과하고 HPLC 분석에 사용하였다(13). 폴리페놀 분석용 표준물질들은 메탄올에 녹여 HPLC 분석에 사용하였다. ABTS 라디칼은 ABTS과 potassium persulfate이 각각 2 mM와 3.5 mM이 되도록 녹여 갈색병에 담아 물로 30배 희석한 후 24시간 반응시켜 ABTS 라디칼이 생성되도록 하였으며 이를 ABTS 시약으로 사용하였다. 온라인 HPLC 항산화 분석법(14)으로 ABTS 라디칼 제거능을 가진 페놀성 물질들을 아래의 분석조건하에서 정성 및 정량분석하였다. Quaternary pump, variable wavelength detector(VWD), diode array detector(DAD) 및 Agilent Zorbax Eclipse plus C18 컬럼(4.6×250 mm ID, Agilent Technology, Santa Clara, CA, USA)이 장착된 HPLC(Agilent 1200 series, Agilent Technology)로 온라인 HPLC 항산화 분석을 실시하였다. 시료의 주입량은 20 μL였으며, 이동상은 용매 A(0.1% acetic acid in water)와 용매 B(0.1% acetic acid in acetonitrile)를 95:0(0 min), 70:30(30 min), 65:35(50 min), 95:5(60 min)의 조건에서 0.4 mL/min의 유속으로 공급하였다. 첫 번째 검출기의 파장은 280 nm였다. 첫 번째 검출기를 통과한 혼합용매는 T자 관에서 0.2 mL/min 유속으로 공급되는 ABTS 시약과 합류하여 radical 소거반응이 진행되었으며 이후 두 번째 검출기에서 ABTS radical 소거능을 734 nm에서 측정하였다.
결과 및 고찰
머루와인(Moru wine), 상압증류 무알코올 Moru wine(NA-AD) 및 감압증류 무알코올 Moru wine(NA-VD) 시료들의 pH, 산도 및 가용성고형분 함량분석 결과는 Table 1과 같다. 3종 시료들의 pH는 Moru wine, NA-AD 및 NA-VD 시료들에서 각각 3.96±0.02, 3.94±0.01 및 3.94±0.01로 유의적인 차이가 없었다. 산도의 경우 Moru wine, NA-AD 및 NA-VD 시료들에서 각각 0.76±0.01, 0.89±0.03 및 1.02±0.10%로 나타났다(p<0.05). 이러한 결과는 Lee 등(3)이 보고한 Moru wine의 산도(1.1%)와 비슷한 값을 나타내고 있다. 또한 Ji 등(15)이 보고한 Moru wine의 산도 범위인 0.94-1.18%와도 유사하였다. Sung 등(16)은 산도는 와인의 품질에 영향을 미치는 중요한 요인으로 산도가 낮으면 와인은 특색 없는 맛을 내고, 반대로 높으면 강한 신맛을 내므로, 포도와인의 적정산도는 0.56-0.96%로 제안하였다. 본 연구에서 증류법(감압증류 및 상압증류)으로 제조한 무알코올 Moru wine 시료들의 산도는 일반적인 포도와인의 적정산도 범위와 비슷하거나 약간 높게 나타났다. 일반적으로 pH와 산도는 유사한 경향성이 나타나는데 반하여 본 연구에서는 다르게 나타난 것은 증류에 따른 성분의 변화로 추측되나 추가적인 분석은 시도하지 않았다. 가용성 고형분 함량은 Moru wine, NA-AD 및 NA-VD 시료들에서 각각 8.40±0.17, 6.00±0.00 및 6.00±0.00 °Brix로 나타나서 Moru wine에서 가장 높았다(p<0.05). 굴절당도계에 의한 가용성 고형분 함량 측정에는 당 성분 이외에도 단백질, 에탄올 함량 등이 복합적으로 영향을 주어 °Brix 값에 반영된다(3). Table 2에서는 2종 무알코올 Moru wine 시료들이 증류에 따른 시료의 농축효과로 가용성 고형분 함량이 증가가 예상됨에도 불구하고 실제 측정에서는 증류한 시료들에서 가용성 고형분 함량이 감소되었다. 이러한 상반된 이유로는 증류로 제거된 성분들 중 상당부분이 에탄올이며, 제거된 에탄올 성분으로 인하여 증류한 시료들에서 가용성 고형분 함량이 낮게 측정된 것으로 추측된다.
| Analysis | Moru wine | NA-AD1) | NA-VD2) |
|---|---|---|---|
| pH | 3.96±0.023) | 3.94±0.01 | 3.94±0.01 |
| Titratable acidity (%) | 0.76±0.01c4) | 0.89±0.03b | 1.02±0.11a |
| Soluble solids (°Brix) | 8.40±0.17a | 6.00±0.00b | 6.00±0.00b |
3종 시료들의 총 플라보노이드 함량, 총 페놀화합물 함량 및 ABTS 라디칼 소거능을 분석한 결과는 Table 2에 나타내었다. Moru wine, NA-AD 및 NA-VD의 총 플라보노이드 함량은 각각 956.29±20.34, 1,832.13±104.66 및 1,028.44±39.10 μg/mL로 측정되어 NA-AD가 가장 높았고, Moru wine에서 가장 낮았다. 본 연구의 결과는 Moru wine의 총 플라보노이드 함량을 567-1,092 μg/mL로 보고한 Kang 등(17)의 연구결과와 비교 시 Moru wine과 NA-VD 시료에서는 유사하였으나 NA-AD는 높게 나타났다. 총 페놀화합물 함량은 Moru wine, NA-AD 및 NA-VD에서 각각 1,955.00±75.35, 3,345.14±65.72 및 2,194.44±96.21 μg/mL로 측정되었다. Moru wine의 총 페놀화합물 함량을 분석한 연구에서 Kim 등(18)은 2,669.37-2,765.67 μg/mL로, Kang 등(17)은 2,100-4,817 μg/mL로 보고하여 본 연구에서 측정된 Moru wine의 총 페놀화합물 함량 결과와 큰 차이가 없었다. 하지만, NA-AD군 시료에서 다른 2종 시료들보다 총 페놀화합물 함량이 유의적으로 높았다(p<0.05). ABTS 라디칼 제거능은 Moru wine이 92.61±0.1%로 가장 낮았고(p<0.05), NA-AD와 NA-VD는 각각 98.11±0.16와 98.16±0.24%로 나타나서 두 시료들 사이에는 유의적인 차이가 없었다. Kim 등(19)은 적포도주는 가열처리 후에도 포도주의 주요성분인 유기산과 페놀화합물은 소실되지 않았다고 보고하였다. 따라서 본 연구에서 측정된 시료들 간 총 플라보노이드, 총 페놀화합물 함량 및 ABTS 라디칼 소거능의 차이는 무알코올 Moru wine을 제조하기 위한 증류 과정에서 알코올과 일부 수분의 증발로 인한 농축효과로 예상할 수 있다. 이를 확인하기 위하여 온라인 HPLC로 Moru wine, NA-AD 및 NA-VD의 페놀화합물의 조성을 분석하였다.
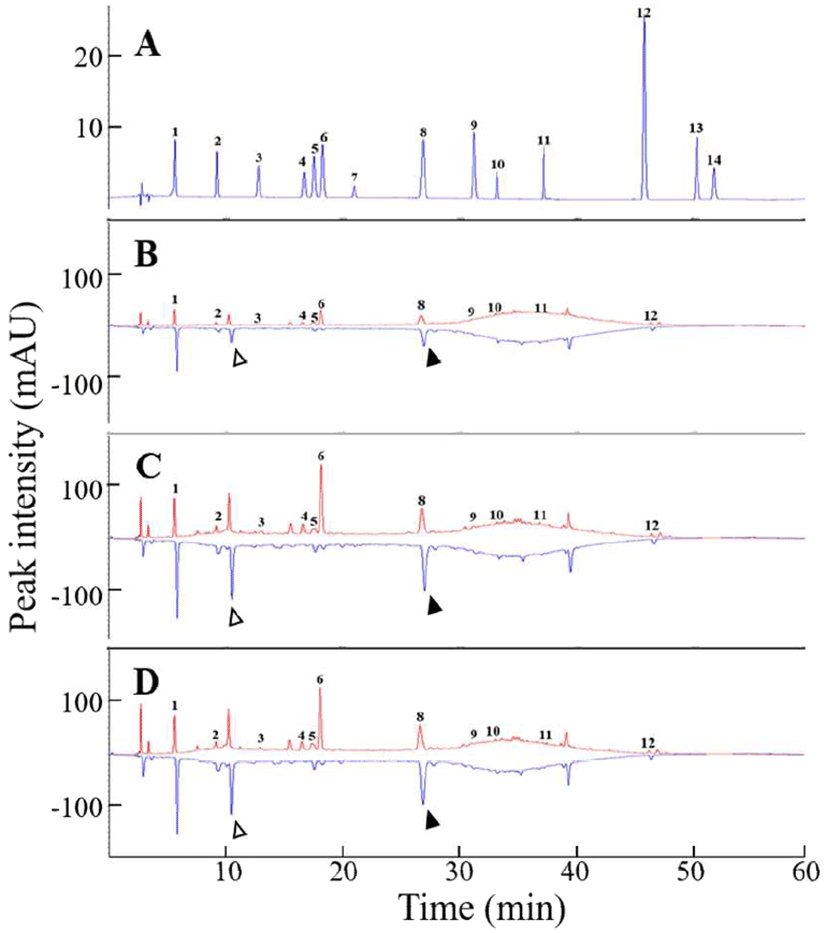
3종 시료들의 항산화 활성과 활성화 성분을 온라인 HPLC-ABTS법으로 분석하였다. 폴리페놀 표준물질들에 대해 정량 분석한 결과는 Fig. 1과 Table 3에 나타내었다. 표준물질들과 시료에서 측정된 페놀성 물질들에 대한 크로마토그램은 Fig. 1와 같다. Moru wine에서 검출된 주요 페놀성 물질들은 gallic acid가 10.35±0.01 μg/mL로 가장 높게 나타났고, syringic acid 9.29±0.02 μg/mL, vanillic acid 3.38±0.03 μg/mL, caffeic acid 2.42±0.00 μg/mL, rutin 2.32±0.20 μg/mL, protocatechuic acid 2.02±0.00 μg/mL 순으로 나타났다. 이외에도 미확인된 물질들(RT값 10분대와 39분대)이 함께 검출되었다. Kwon(20)은 본 연구에서 검출된 물질 이외에도 머루에 함유된 주요 항산화물질이 malvidin, petunidin, delphinidin, peonidin, cyanidin 및 resveratrol 등이 포함되어 있다고 보고하고 있다. 따라서 본 연구에서 나타난 미확인 물질들은 이들 물질을 비롯한 다양한 종류의 생리활성물질일 것으로 생각되며 이들 물질들에 대한 추가적인 분석이 필요할 것으로 생각된다. NA-AD에서는 syringic acid가 43.98±0.05 μg/mL 로 가장 높게 나타났으며, gallic acid 및 vanillic acid 등의 순으로 나타났고, NA-VD에서는 syringic acid, gallic acid 및 vanillic acid 순으로 나타났다. Koh(21)의 연구에 따르면 HPLC로 페놀성 물질을 분석한 결과 Moru wine에는 gallic acid가 8.8-53 μg/mL로 가장 높았고, chlorogenic acid, caffeic acid, protocatechuic acid, p-coumaric acid 및 syringic acid 순으로 나타났다. 본 연구와 타 연구에서 확인된 함량차이는 머루의 재배지역, 숙성기간 및 양조기술 등에 의한 차이로 사료된다. 3종 시료들에서 각각 합산된 페놀성 물질들의 총 함량은 Moru wine은 31.88 μg/mL, NA-AD는 100.29 μg/mL, NA-VD는 96.80 μg/mL로 나타나서 NA-AD, NA-VD, Moru wine 순으로 높았다(p<0.05). 시료 간 총 페놀성물질 함량 차이는 증류과정중의 열처리에 의하여 농축효과 이외에도 증류과정에서 적용된 시료 전처리 조건이 영향을 주었을것으로 추측할 수 있다. 본 연구에서는 무알코올 Moru wine 시료들인 NA-AD와 NA-VD 시료 350 mL 제조를 위하여 Moru wine 시료 500 mL를 사용하였다. 따라서, Moru wine 시료(500 mL) 대비 무알코올 Moru wine 시료들의(350 mL) 시료 농축효과를 감안하더라도 Table 3에서 정량된 총 페놀성 화합물 함량 차이는 증류에 따른 Moru wine 화합물들의 구조적 변화 가능성을 의미한다. 과일의 폴리페놀 화합물들은 배당체 형태로 다량 존재하며 산처리나 효소반응에 의하여 가수분해되어 구조적으로 변화된 비배당체 형태로 변환된다(22). NA-AD와 NA-VD시료들에 측정된 상대적으로 높은 총 페놀성 화합물 함량은 증류조건에서 적용된 조건들이 비배당체 형태의 폴리페놀성 화합물 생성을 촉진한 것으로 예상된다. 본 연구에서는 총 페놀성 화합물 함량 측정에 적용한 분광광도계 측정값과 HPLC 측정값 간에 차이가 나타났다. 이러한 차이는, Folin-Ciocalteu’s reaction법은 페놀성 물질들의 중합도에 관계없이 정량성을 나타내므로 Folin-Ciocalteu’s 시약과 반응할 수 있는 다양한 종류의 물질들로 인하여 간섭요인들이 발생된 반면(13), 온라인 HPLC 항산화 분석법은 특정물질에 국한되어 결과로 반영되므로 총 함량에서 차이가 나는 것으로 사료된다. 734 nm 파장에서 측정된 3종류 와인 시료들에 존재하는 물질 각각의 ABTS 라디칼 제거 정도를 negative peak area(mAU)의 면적으로 비교하였다(Fig. 1, Table 4). Moru wine군 시료에서는 ABTS 라디칼 제거능을 보이는 물질은 gallic acid, protocatechuic acid 및 rutin 순으로 나타났으며, NA-AD군 및 NA-VD군에서는 gallic acid, protocatechuic acid 및 caffeic acid 순으로 나타났다. 또한, Moru wine보다 무알코올 Moru wine인 NA-AD와 NA-VD 시료들에서 ABTS 라디칼 소거능이 더 뛰어난 것을 확인할 수 있었다. 이러한 결과는 분광광도계로 측정한 ABTS 라디칼 소거능 결과(Table 3)와 유사한 경향을 보였다. Choi 등(23)은 포도주의 항산화력과 항산화성분 간의 상관분석 결과 총 안토시아닌 함량과 항산화력 간에는 어떠한 상관성도 존재하지 않은 반면, 총 폴리페놀 성분과 ABTS 라디칼 제거능, 2,2-diphenyl-1-picrylhydrazyl(DPPH) 라디칼 제거능 및 환원력에는 상당한 상관성이 존재한다고 보고하여 Moru wine의 항산화력 또한 포도주와 유사하게 폴리페놀 물질과의 연관성이 높다고 생각된다. 포도주의 항산화활성 측정을 위하여 인위적으로 만들어낸 라디칼을 제거하는 능력을 소거시키는 능력을 분광광도계를 사용하여 측정하는 방법이 이용되고 있으며 여기에는 ABTS 라디칼 제거능 측정법과 DPPH 라디칼 제거능 측정법이 포함된다(24). 하지만 이러한 방법들은 시료에 들어있는 항산화 물질들을 여러 방법으로 분리한 후 각 물질들의 항산화도를 개별적으로 측정하기 때문에 번거롭고, 많은 시간이 소요된다(25). 이러한 불편한 점들을 해결하기 위하여 측정하고자 하는 물질들의 분리와 동시에 각 물질들의 라디칼 제거능을 측정할 수 있는 온라인 HPLC 항산화 분석법(14)을 본 연구에 적용하였다. 본 연구의 결과로는 그 중 gallic acid와 syringic acid가 Moru wine 및 무알코올 Moru wine의 항산화능에 큰 기여를 하는 물질들로 나타났다.
결론적으로, Moru wine을 증류시켜 무알코올 Moru wine 제조 시, 산도와 가용성 고형분 함량에서는 차이가 있었으며, 특히 페놀성물질의 함량이 증류과정에서 증가하는 것으로 나타났다. 무알코올 Moru wine은 Moru wine에 비교하여 높은 함량의 폴리페놀 화합물에 의한 강력한 항산화활성을 지닌다는 장점이 있음을 확인하였음으로 무알코올 Moru wine의 관능적인 개선이 담보된다면 건강지향적 소비자들의 요구에 부합되는 식품으로 개발가능성이 높을 것으로 생각된다.
요 약
본 연구에서는 Moru wine, 상압증류법 및 감압증류법으로 제조한 무알코올 Moru wine의 이화학적 특성 및 항산화활성을 비교하였다. 무알코올 Moru wine 제조를 위하여 Moru wine을 상압증류(NA-AD) 또는 감압증류(80 mbar, 55℃, NA-VD)하였다. 3종 시료들 중에서 산도는 NA-VD에서 가장 높았고, 가용성 고형분값은 Moru wine 시료에서 유의적으로 높았다(p<0.05). 무알코올 Moru wine 시료인 NA-AD의 총 플라보노이드 함량, 총 페놀 함량 및 ABTS 라디칼 소거능이 가장 높았다(p<0.05). 온라인 HPLC 항산화 분석 시 Moru wine과 무알코올 Moru wine 시료들 간에 폴리페놀 물질 조성에서 뚜렷한 차이가 있었다. 최소 10종 이상(gallic acid, protocatechuic acid, chlorogenic acid, vanillic acid, cafferic acid, syringic acid, t-ferulic acid, rutin, naringin 및 t-cinnamic acid)의 다른 폴리페놀 물질들이 Moru wine과 무알코올 Moru wine에서 확인되었다. Gallic acid(10.35-24.69 μg/mL)와 syringic acid(9.29-43.98 μg /mL)가 주요 폴리페놀 물질로 판명되었다.










