서 론
산화적 스트레스의 직접적 원인이 되는 활성산소종(reactive oxygen species, ROS)은 불안정하고 반응성이 높아 여러 생체물질과 쉽게 반응하고(1), 체내고분자들을 공격하여 세포와 조직에 비가역적인 손상을 일으켜 돌연변이, 세포독성 및 발암 등을 초래한다(2). 이러한 활성산소종에서 유발되는 각종 질환을 예방하기 위해서 항산화 물질을 충분히 섭취하는 것이 도움이 되며, 식물성 식품에 함유된 페놀성 화합물은 항산화, 항염증, 항암 효과 등이 알려지면서 기능성 소재로서 주목을 받고 있다(3).
커피는 꼭두서니과(Rubiaceae) 코페아속(Coffea)에 속하고 아프리카의 에티오피아가 원산지로 현재는 아프리카, 남아메리카, 인도네시아, 베트남 등지에서 널리 재배되고 있으며(4), 쓴맛, 신맛, 떫은맛 및 고소한 맛 등의 특유한 맛과 향이 조화되어 만들어진 전세계 사람들이 즐겨마시는 대표적인 기호음료이다(5). 커피의 품종은 Coffea arabica(아라비카종), Coffea canephora(로부스타종) 및 Coffea liberica(리베리카종) 등 3가지 품종으로 구분되며(6), 아라비카 종과 로부스타종이 전 세계 산출량의 대부분을 차지하고 있다(7). 커피 생두의 주요 성분은 생산지, 품종 및 재배 지역에 따라 약간의 차이는 있으나 일반적으로 수분 10-13%, 탄수화물 37-60%, 지방 9-18%, 단백질 11-13%, 무기질 3.0-4.5%, 카페인 0.9-2.4%와 클로로겐산(chlorogenic acid) 5.5-10%이다(4). 또한 커피 생두는 항산화 기능을 가진 폴리페놀의 일종인 클로로겐산(chlorogenic acid)과 알칼로이드의 일종인 카페인(caffeine) 및 트리고넬린(trigonellien)을 포함하여 다양한 생리활성물질들을 포함하고 있다(8). 커피에 대한 연구로는 커피의 배전 정도에 따른 분석(9), 커피의 종류에 따른 이화학적 성분 및 GC에 의한 향기성분 분석(10), 추출수율에 관한 분석(11), 가용성 커피에 관한 분석(12), 커피 보관 시 산패에 따른 향미 변화(13) 등 다양한 연구가 보고되어 있다. 또한 다양한 음료에서 페놀 화합물의 함량을 측정한 결과 레드와인보다 커피의 페놀 함량이 높은 것으로 나타났으며, 커피의 섭취가 LDL의 산화에 대한 감수성을 줄임으로서 LDL-콜레스테롤과 Malondialdehyde(MDA)를 줄인다는 보고가 있다(14). 이처럼 커피 원두 관련 항산화 연구는 꾸준히 진행되고 있으나, 최근에 많이 소비되고 있는 커피 생두에 관한 연구는 부족한 실정이다.
따라서 본 연구에서는 전 세계적으로 가장 많이 사용되고 있는 로부스타 및 아라비카 커피 생두의 다양한 항산화 활성과 폐정상세포인 L-132 세포를 이용한 세포보호 효과를 조사하여 커피 생두의 산업적 이용 증대 및 기능성 식품 소재로서의 활용 가능성을 조사하고자 하였다.
재료 및 방법
본 실험에 사용된 커피 생두는 베트남산 로부스타(Coffea canephora) 및 아라비카(Coffea arabica)종으로 경상북도 문경시 소재 (주)루왁코리아로 부터 제공받아 사용하였다. 커피 생두를 자연 건조하여 수분함량이 10% 이하가 되도록 한 후 분쇄기(RT-04, Hanil Co., Sejong, Korea)로 분쇄하여 60 mesh를 통과한 분말을 -70℃ 이하의 암소에 보관하면서 추출용 시료로 사용하였다.
커피 생두 추출물은 생두 분말 30 g에 10배의 증류수, 80% 에탄올 및 80% 메탄올을 첨가하여 100℃ 및 80℃에서 4시간 동안 환류냉각추출기(CA-1112, Eyela Co., Tokyo, Japan)를 이용하여 추출하였고 각각의 추출물은 불순물을 제거하기 위하여 여과지(No.2, Whatman Intermational Ltd., Leicestershire, England)를 이용하여 여과하였다. 여과된 추출물은 감압농축기(Model N-1N, Eyela Co., Tokyo, Japan)로 농축한 다음, 동결건조기(Free Zone 2.5, Labconco Co., Kansas, MO, USA)로 건조하여 -70℃ 이하의 암소에서 보관하면서 분석용 시료로 사용하였다.
추출수율은 추출물을 동결건조한 다음 건물 중량을 구하였고 추출물 제조에 사용한 원료 건물량에 대한 백분율로 나타내었다.
총 당 함량 분석은 Saha와 Brewer(15)의 방법에 따라 phenol-sulfuric acid법으로 분석하였다. 1 mL 5% phenol 과 5 mL sulfuric acid를 1 mL 시료와 반응시킨 후 분광광도계(Ultraspec 2100 pro, Biochrom Ltd., Uppsala, Sweden)를 사용하여 525 nm에서 흡광도를 측정하고 glucose(Sigma-Aldrich Co., St. Louis, MO, USA)를 이용하여 작성한 표준곡선으로부터 계산하였다.
가용성 단백질 함량은 Lowry 등(16)의 방법으로 측정하였으며 bovine serum albumin(BSA, Sigma-Aldrich Co.)을 이용하여 작성한 표준곡선으로부터 계산하였다.
총 폴리페놀 함량은 Folin-Denis법(17)에 따라 1 mL 시료 에 1 mL 1 N Folin Ciocalteu reagent를 첨가하고 충분히 혼합한 다음, 1 mL 20% Na2CO3를 첨가하여 실온의 암소에서 30분간 반응시킨 후 분광광도계(Ultrospec 2100 pro, Biochrom Ltd.)를 이용하여 725 nm에서 흡광도를 측정하였다. 총 폴리페놀 함량은 gallic acid(Sigma-Aldrich Co.)를 이용하여 작성한 표준곡선으로부터 계산하였다.
총 플라보노이드 함량은 Jia 등(18)의 방법을 응용하여 측정하였다. 1 mL 시료에 150 μL 5% NaNO2를 혼합하여 실온에서 6분간 반응시킨 다음 300 μL 10% AlCl3과 혼합하여 다시 실온에서 5분간 반응시킨 후, 1 mL 1 N NaOH와 혼합하여 분광광도계(Ultrospec 2100 pro, Biochrom Ltd.)를 이용하여 510 nm에서 흡광도를 측정하였다. 총 플라보노이드함량은 rutin(Sigma-Aldrich Co.)을 이용하여 작성한 표준곡선으로부터 계산하였다.
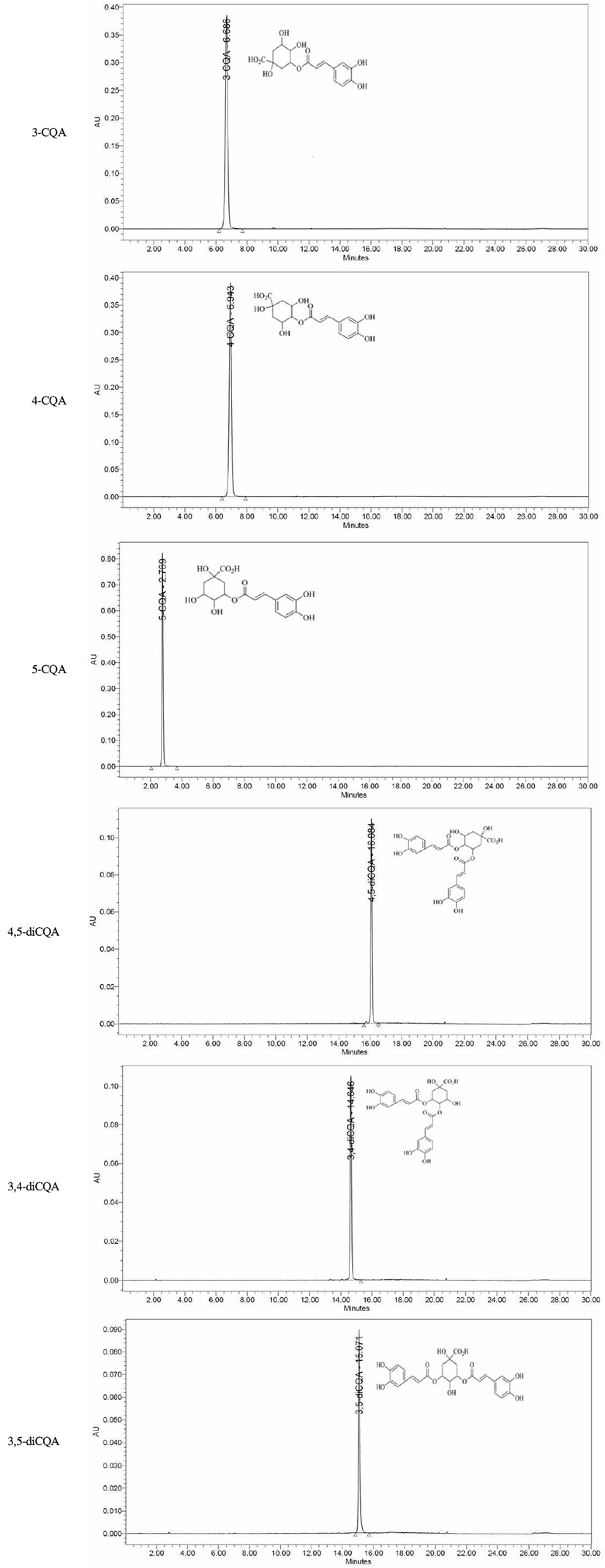
커피 생두 추출물의 chlorogenic acid 함량은 Kintex C18 column(5 μm, 4.6 mm×100 mm, Phenomenex Co.)이 부착된 Alliance HPLC system(Waters 2695, Waters Co., Milford, MA, USA)을 이용하여 분석하였다. 컬럼의 온도는 45℃로 조절하였고, 검출기는 photodiode array detector(Waters 2996, Waters Co.)를 사용하였다. 이동상은 Water: Trifluoroacetic acid(99.9:0.1, v/v)와 100% acetonitrile로 유속은 1.5 mL/min, 시료주입량은 3 μL로 분석하였다. Chlorogenic acid의 표준물질(Fig. 1)은 3-caffeoylquinic acid, 4-caffeoylquinic acid, 5-caffeoylquinic acid, 4,5-dicaffeoylquinic acid, 3,4-dicaffeoylquinic acid 및 3,5-dicaffeoylquinic acid 6종을 Sigma-Aldrich Co.로부터 구입하여 사용하였고, 시료에 함유된 chlorogenic acid의 함량은 표준물질의 머무름 시간을 비교하여 분석하였다.
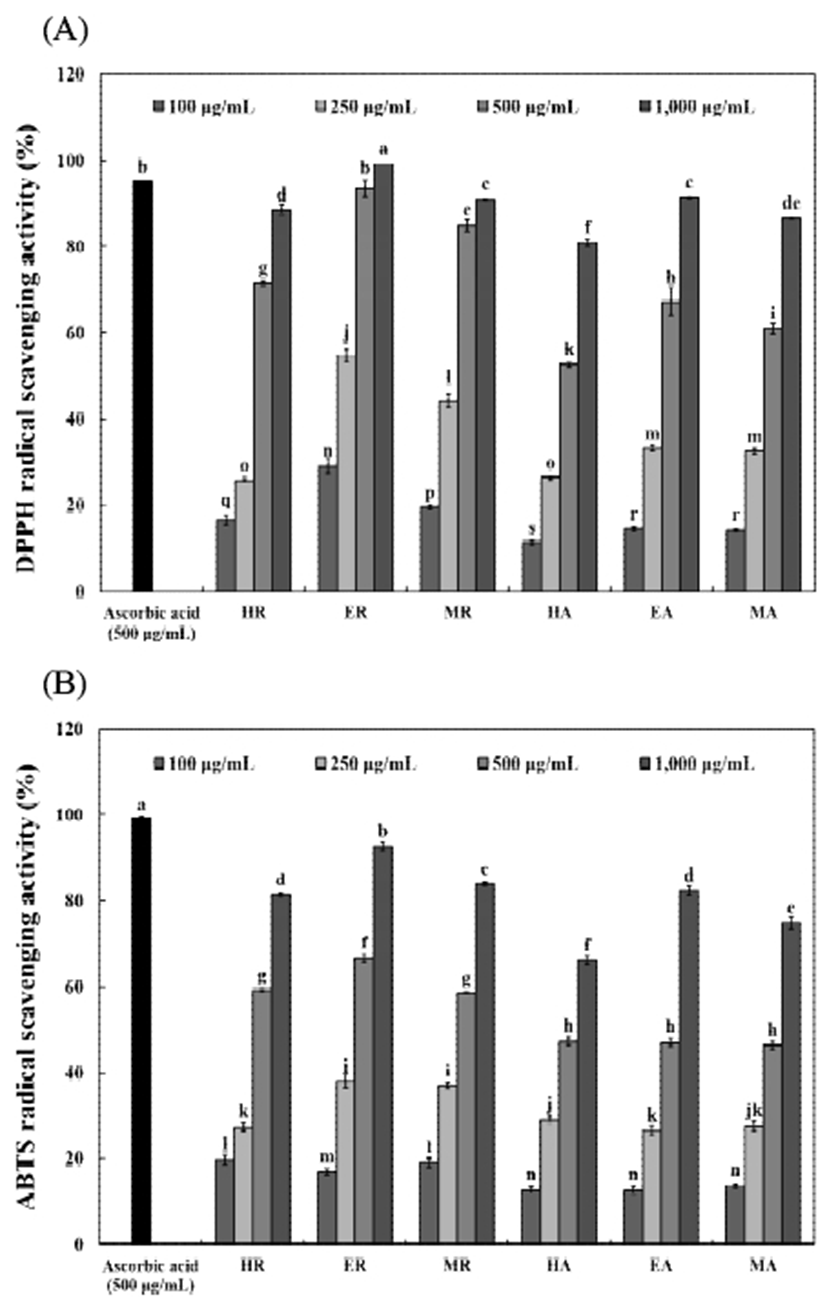
DPPH radical 소거활성은 1,1-diphenyl-2-pycrylhydrazyl (DPPH, Sigma-Aldrich Co.)의 환원력을 이용하여 측정하였다(19). DPPH reagent는 12 mg DPPH를 100 mL absolute ethanol에 용해한 후 100 mL 증류수를 첨가하여 흡광도를 517 nm에서 약 1.5로 조정하여 제조하였다. 0.5 mL 시료에 5 mL DPPH reagent를 혼합하여 실온에서 15분간 반응시킨 후 분광광도계(Ultrospec 2100pro, Biochrom Ltd.)로 흡광도를 측정하고 아래와 같이 계산하였다.
2,2'-Azino-bis(3-ethylbenzothiazoline-6-sulfonic acid (ABTS) radical 소거활성(20)은 7.4 mM ABTS(Sigma-Aldrich Co.)와 2.45 mM potassium persulfate를 최종 농도로 혼합하여 실온인 암소에서 24시간 동안 방치하여 ABTS+을 형성시킨 후 732 nm에서 흡광도 값이 0.70±0.02가 되게 phosphate buffer saline(PBS, pH 7.4)으로 희석하였다. 희석된 용액 180 μL에 시료 20 μL를 혼합하여 1분간 반응시킨 다음 분광광도계(Ultraspec 2100pro, Biochrom Ltd.)를 이용하여 732 nm에서 흡광도를 측정하였다. ABTS radical 소거활성은 시료의 첨가 전과 후의 차이를 아래와 같이 백분율로 나타내었다.
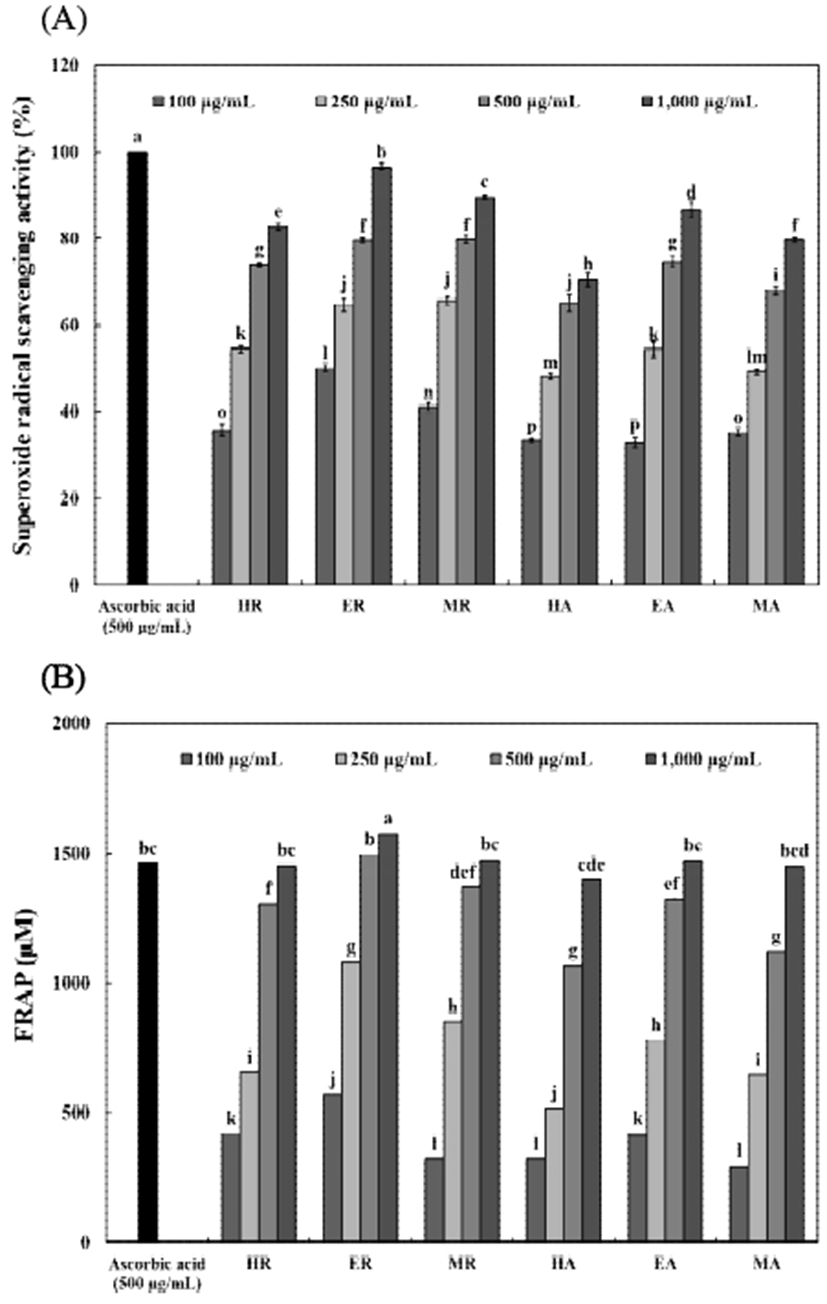
Superoxide radical 소거활성은 Nishikimi 등(21)의 방법에 따라 다음과 같이 측정하였다. 시료 500 μL에 100 μL 0.1 M Tris-HCl 완충용액(pH 8.5) 및 200 μL 100 μM phenazine methosulfate(PMS, Sigma-Aldrich Co.)를 혼합하여 반응 시킨 후, 500 μM nitro blue tetrazolium(NBT, Sigma- Aldrich Co.) 200 μL 및 400 μL 500 μM β-nicotinamide adenine dinucleotide(NADH, Sigma-Aldrich Co.)를 첨가하여 실온에서 10분간 반응시킨 다음 분광광도계(Ultraspec 2100pro, Biochrom Ltd.)를 이용하여 560 nm에서 흡광도를 측정하였다. Superoxide radical 소거활성은 시료의 첨가 전과 후의 차이를 아래와 같이 백분율로 나타내었다.
FRAP는 Benzie와 Strain의 방법(22)에 따라 다음과 같이 측정하였다. FRAP reagent는 25 mL acetate buffer(300 mM, pH 3.6)를 37℃에서 가온한 후, 40 mM HCl에 용해한 10 mM 2,4,6-tris(2-pyridyl)-s-triazine(TPTZ, Sigma-Aldrich Co.) 2.5 mL와 20 mM ferric chloride(FeCl3) 2.5 mL를 첨가하여 제조하였다. 시료 30 μL에 제조된 FRAP reagent 900 μL와 증류수 90 μL를 넣은 후, 37℃에서 10분간 반응시켜 분광광도계(Ultraspec 2100pro, Biochrom Ltd.)를 이용하여 510 nm에서 흡광도를 측정하였다. FRAP는 FeSO4·7H2O (Sigma-Aldrich Co.)을 이용하여 작성한 표준곡선으로부터 계산하였다.
실험에 사용한 인간 폐상피세포주인 L-132 세포는 한국세포주은행(KTCC, Seoul, Korea)에서 분양받아 사용하였다. 세포배양은 Dulbecco's modified eagle's medium (DMEM) (Welgene, Daegu, Korea)를 이용하여 각각 10% fetal bovine serum(Gibco BRL Co., Grand Island, NY, USA) 및 1% penicillin streptomycin(Gibco BRL Co.)을 첨가하여 배양하였다. 세포는 37℃, 5% CO2 incubator (MCO-18AIC, Sanyo Co., Osaka, Japan)에서 배양하였다.
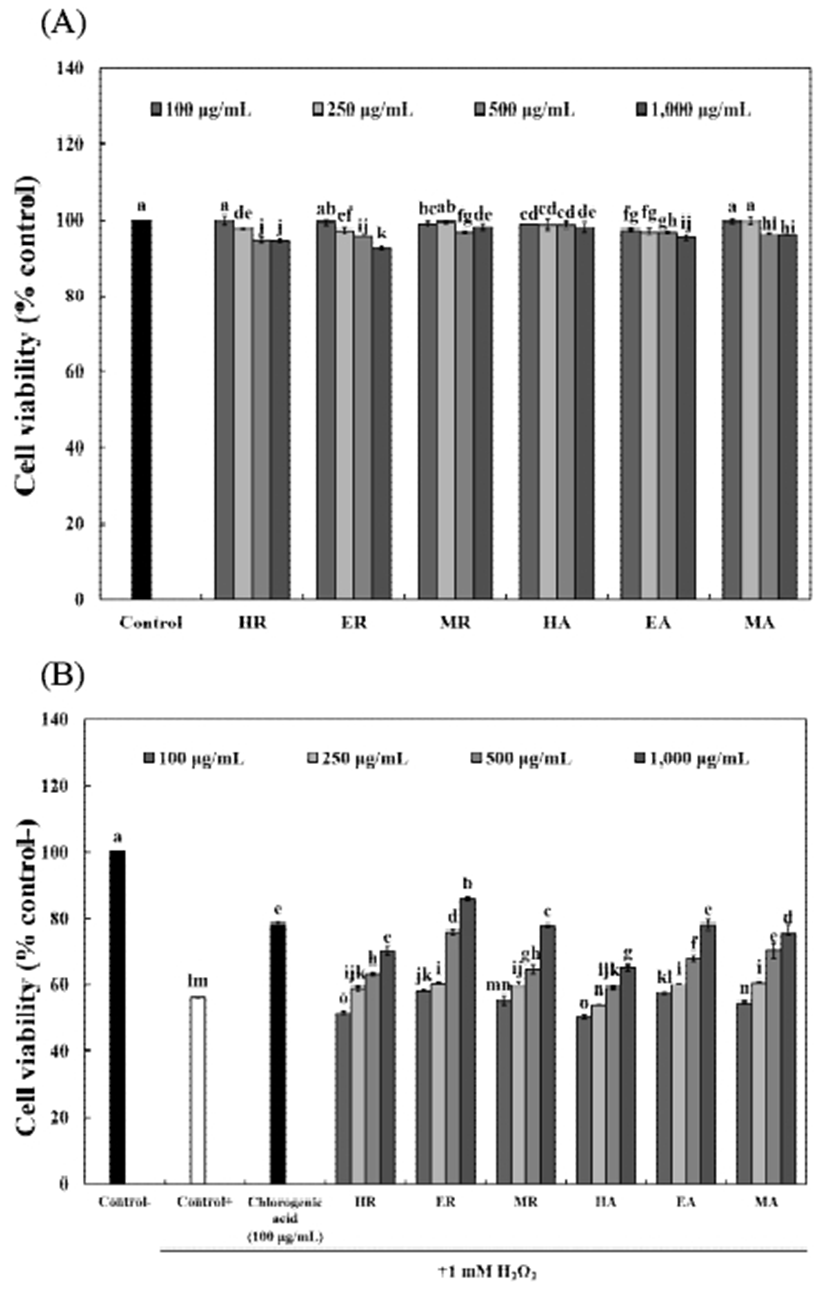
세포독성은 3-(4,5-dimethylthiazol-2-yl)-2,5-diphenyltetrazolium bromide(MTT) assay로 측정하였다. 배양된 세포주를 1×104 cell/well의 농도로 96-well plate에 100 μL씩 첨가하여 24시간 배양하고, 이후 새로운 배지에 시료를 농도별로 처리한 다음 24시간 동안 배양하였다. 배양 후 PBS 완충용액에 녹인 MTT(5 mg/mL, Sigma-Aldrich Co.) 용액을 각 well에 10 μL씩 첨가하고 다시 4시간 동안 배양하여 MTT가 환원되도록 하였다. 이후 상등액을 완전히 제거하고 dimethyl sulfoxide(DMSO, Jensei Chemical Co., Tokyo, Japan) 100 μL를 각 well에 첨가한 후, 10분간 반응시켜 formazan 결정을 완전히 용해한 다음 microplate reader(UVM-340, Asys Co., Biochrom, Cambridge, UK)를 이용하여 540 nm에서 흡광도를 측정하였다.
L-132 세포를 이용한 세포보호 효과는 Hwang(23)의 방법을 응용하여 측정하였다. 배양된 L-132 세포를 1×104 cell/well의 농도로 96-well plate에 100 μL씩 첨가하여 24시간 배양하고, 이후 새로운 배지로 교환한 다음 1 mM H2O2(Duksan pure chemicals Co., Ltd., Ansan, Korea) 및 시료를 농도별로 처리하여 12시간 동안 배양하였다. 배양 완료 후, PBS 완충용액에 녹인 MTT(5 mg/mL, Sigma-Aldrich Co.) 용액을 각 well에 10 μL씩 첨가하고 4시간 동안 배양하여 MTT가 환원되도록 하였다. 이후 상등액을 완전히 제거하고 DMSO(Junsei Chemical Co.) 100 μL를 각 well에 첨가한 후, 10분간 반응시켜 formazan 결정을 완전히 용해한 다음 microplate reader(UVM-340, Asys Co.)를 이용하여 540 nm에서 흡광도를 측정하였다.
결과 및 고찰
커피 생두 추출물의 추출수율, 총 당 및 가용성 단백질 함량은 Table 1과 같다. 추출용매에 따른 추출수율은 로부스타 및 아라비카 커피 생두가 열수추출물에서 각각 20.2% 및 23%로 가장 높았으며, 80% 메탄올 추출물에서 각각 15.53% 및 16.2%로 가장 낮게 나타났다. Han 등(24)은 추출용매에 따른 무순 추출물의 추출수율을 측정한 결과 물, 에탄올 및 메탄올 순으로 나타났다고 보고하여 본 연구의 결과와 유사하였으며, Kwon 등(25)은 추출용매의 극성이 증가할수록 식물체에 존재하는 수용성 폴리페놀 화합물과 방향족 아민 등의 용출이 증가하여 극성용매에서의 추출수율이 높게 나타난 것이라고 보고하였다. 총 당 함량은 각각의 추출물에서 유의적인 차이를 나타내었는데, 로부스타 및 아라비카 커피 생두 모두 열수추출물에서 각각 50.17 g/100 g 및 58.45 g/100 g으로 가장 높은 함량을 나타내었으며, 80% 에탄올 추출물에서 각각 38.58 g/100 g 및 44.84 g/100 g으로 가장 낮았다. Kim과 Han(14)은 커피의 생산지, 품종, 재배 등에 따라 약간의 차이는 있으나 일반적으로 커피 생두에는 약 37-60%의 당이 함유되어 있다고 보고하여 본 연구의 결과와 유사하였다. 가용성 단백질 함량은 로부스타 및 아라비카 커피 생두 열수추출물에서 각각 21.26 g/100 g 및 23.04 g/100 g으로 가장 많이 함유되어 있었으며 80% 에탄올 추출물에서 가장 낮은 함량을 나타내 총 당 함량과 유사한 경향을 나타내었다. Kim(26)은 두부, 두유, 비지 등 여러 대두 식품들의 가용성 단백질 함량을 분석한 결과 두유에서 204.8 mg/g으로 가장 높았다고 보고하였다.
폴리페놀 화합물은 식물계에 널리 분포되어 있는 2차 대사 산물의 하나로 ROS에 의한 세포 수준이나 DNA 등의 손상을 억제하기 위한 방어 메커니즘을 제공한다고 알려져 있다(27). 커피 생두 추출물의 총 폴리페놀 및 총 플라보노이드 함량은 Table 2와 같다. 총 폴리페놀 함량은 20.37-35.03 g/100 g으로 추출용매 및 커피 품종에 따라 유의적인 차이를 나타내었으며, 로부스타 및 아라비카 커피 생두 80% 에탄올 추출물이 각각 35.03 g/100 g 및 29.38 g/100 g으로 다른 용매 추출물에 비해 페놀성물질의 함량이 높은 것을 확인하였다. 총 플라보노이드 함량은 로부스타 및 아라비카 커피 생두 80% 에탄올 추출물에서 각각 12.14 g/100 g 및 8.20 g/100 g으로 가장 많이 함유되어 있었으며, 80% 메탄올 및 열수추출물 순으로 높은 함량을 나타내었다. Cho 등(28)은 현재 시판되고 있는 커피에 함유된 폴리페놀 함량을 측정한 결과 18.88-43.90 mg/mL로 보고하였으며, Park과 Hong(29)은 추출방법에 따른 상지추출물의 폴리페놀 함량을 분석한 결과, 50% 에탄올로 추출하였을 때 가장 높은 함량을 나타내어 본 연구 결과와 유사하였다. 이는 물과 유기용매가 혼합되어있어 시료에 함유되어 있는 페놀성물질의 용출이 용이하기 때문이라고 보고하였다.
Chlorogenic acid(CGA)는 quinic acid에 caffeic acid가 에스테르 결합을 하고 있으며, caffeoylquinic acid(CQA), dicaffeoylquinic acid(diCQA) 및 feruloylquinic acid(FQA) 등 3개의 이성질체를 가지고 있다(30). 또한 배전공정 중 화학적으로 쉽게 분해되어 여러종류의 페놀화합물을 생성하며 이러한 페놀화합물은 커피의 맛과 향에 많은 영향을 주기 때문에 커피의 품질을 평가하는 중요한 성분으로 알려져 있다(31). 커피 생두 추출물의 CGA 함량을 측정한 결과는 Table 3과 같다. CGA 함량은 로부스타 커피 생두 80% 에탄올 추출물이 가장 많이 함유하고 있었으며, 두 품종 모두 80% 에탄올, 80% 메탄올 및 열수추출물 순으로 높은 CGA 함량을 나타내었다. 각 추출물의 CGA 함량은 5-caffeoylquinic acid(5-CQA), 3-caffeoylquinic acid(3-CQA), 4-caffeoylquinic acid(4-CQA), 3,4-dicaffeoylquinic acid(3,4-diCQA), 4,5-dicaffeoylquinic acid(4,5-diCQA) 및 3,5-dicaffeoylquinic acid(3,5-diCQA) 순으로 나타났으며, 5-CQA는 CGA의 주된 형태로 전체 CGA 중 약 36-42%를 차지한다고 알려져 있는데(32), 본 연구에서도 모든 추출물에서 5-CQA가 1.04-3.18 g/100 g으로 가장 높은 함량을 나타내었다. Farah와 Donangelo(33)는 CGA는 항산화작용을 비롯하여 간 보호효과, 혈당강하, 항바이러스 효과 등의 다양한 생리기능성을 가진다고 보고하였으며, Park(34)은 벤젠 고리에 hydroxyl 라디칼이 결합된 CQAs가 다른 CGA 유도체보다 우수한 항산화 활성을 나타냈다고 보고하여 CQAs의 함량이 가장 높았던 로부스타 커피 생두 80% 에탄올 추출물에서 항산화 활성이 우수할 것으로 사료된다.
1)HR, hot water extracts from Coffea Canephora; ER, 80% ethanol extracts from Coffea Canephora; MR, 80% methanol extracts from Coffea Canephora; HA, hot water extracts from Coffea Arabica; EA, 80% ethanol extracts from Coffea Arabica; MA, 80% methanol extracts from Coffea Arabica.
커피 생두 추출물의 DPPH 및 ABTS radical 소거활성은 Fig. 2와 같다. DPPH radical 소거활성(Fig. 2A)은 모든 시료에서 농도 의존적으로 증가하였으며, 로부스타 및 아라비카 커피 생두 80% 에탄올 추출물이 1,000 μg/mL 농도에서 각각 99.17% 및 91.26%로 다른 용매 추출물보다 우수한 활성을 나타내었고, 로부스타 커피 생두 추출물이 아라비카 커피 생두 추출물보다 높은 활성을 나타내었다. Kim(35)은 커피 품종별 원두 열수추출물의 DPPH radical 소거활성을 조사한 결과, 4 mg/mL 농도에서 약 84-87%의 소거활성을 나타낸다고 보고해 커피 생두 추출물이 커피 원두 추출물보다 DPPH radical 소거활성이 높음을 확인하였고, Park(34)은 3-CQA, 4-CQA, 5-CQA의 DPPH radical 소거활성은 유도체별로 유의적인 차이를 나타내지 않아 CGA 구조 내의 에스테르 결합 위치가 활성에 큰 영향을 미치지 않는다고 보고하였다. ABTS radical 소거활성(Fig. 2B)은 80% 에탄올 추출물이 12.85-92.61%로 가장 높게 나타났으며, 로부스타 커피 생두 추출물이 100-1,000 μg/mL 농도에서 16.91-92.61%로 아라비카 커피 생두 추출물보다 우수한 항산화 활성을 나타내 DPPH radical 소거활성과 유사한 경향을 나타내었다. Woo(36)의 연구에서 커피 품종별 ABTS radical 소거활성을 조사한 결과, 1,000 μg/mL 농도에서 약 90% 이상의 소거활성을 보여 본 연구의 결과와 유사하였다. 총 폴리페놀 및 총 플라보노이드 함량이 높게 나타난 로부스타 커피 생두 80% 에탄올 추출물이 DPPH 및 ABTS radical 소거활성에서도 높은 활성을 나타내었는데, 이는 페놀성 화합물의 함량이 커피의 항산화력과 밀접한 관련을 보인다고 보고한 Lee 등(37)의 결과와 유사하였다.
커피 생두 추출물의 superoxide radical 소거활성 및 FRAP 활성은 Fig. 3과 같다. Superoxide radical 소거활성(Fig. 3A)은 로부스타 및 아라비카 커피 생두 80% 에탄올 추출물이 1,000 μg/mL 농도에서 96.47% 및 86.60%로 가장 높은 활성을 나타내었으며, 80% 메탄올 및 열수추출물 순으로 활성이 높았다. FRAP 활성(Fig. 3B)은 모든 시료에서 농도 의존적으로 FRAP 활성이 증가됨을 확인하였으며, 80% 에탄올 추출물이 418.27-1,572.23 μM로 나타나 다른 용매 추출물보다 높은 활성을 나타내었다. 로부스타 및 아라비카 커피 생두 추출물이 100-1,000 μg/mL 농도에서 각각 321.91-1,572.23 μM, 291.61-1,470.40 μM로 나타나 로부스타 커피 생두 추출물이 아라비카 커피 생두 추출물보다 우수한 FRAP 활성을 나타내었다. Kang 등(38)은 커피와 커피박 침출주의 FRAP 활성을 조사한 결과 1,000 μg/mL 농도에서 1,743-1,851 μM을 나타내 로부스타 및 아라비카 커피 생두 추출물보다 다소 높은 FRAP 활성을 나타내었다.
커피 생두 추출물을 폐 정상세포(L-132)에 농도별로 처리하여 MTT assay 방법으로 세포 독성을 측정한 결과, 추출물 100-1,000 μg/mL 농도까지 유의적인 세포 사멸이 나타나지 않아 세포 독성이 없음을 확인하였고(Fig. 4A), 100-1,000 μg/mL 농도로 하여 L-132 세포의 세포보호 효과를 측정한 결과는 Fig. 4B와 같다. 인체 내 대사과정에서 생성되는 다양한 활성산소종은 흡연, 음주, 자외선 등의 외적 요인에 의해 생성될 수 있으며(39), 그 중 H2O2는 원형질막의 통과가 쉬워 생리학적 및 병리학적 조건에서 산화적 손상을 주는 독성 물질로 이용되고 있다(40). 이러한 산화적 손상에 대한 커피 생두 추출물의 세포보호효과를 확인한 결과, 모든 시료에서 1 mM H2O2 첨가구와 비교하여 활성이 유의적으로 증가함을 확인하였다. 추출용매에 따른 커피 생두 추출물의 세포보호효과는 80% 에탄올 추출물이 78.14-85.82%로 다른 용매 추출물보다 높게 나타났으며, 80% 메탄올 및 열수추출물 순으로 나타났다. 또한 로부스타 커피 생두 추출물은 100-1,000 μg/mL 농도에서 51.55-85.82%로 나타나 아라비카 커피 생두 추출물보다 높은 세포보호효과를 나타내었다. Anggreani와 Lee(41)의 연구에서 CGA는 활성산소종의 축적을 조절하고 세포 사멸에 관여하는 주요 단백질과 효소의 발현을 조절함으로써 자유라디칼에 의한 세포 사멸을 약화시킬 수 있다고 보고하였으며, Kwak 등(42)은 산화적 손상에 의해 유도된 신경세포 독성에 대한 검정콩 추출물의 신경세포 보호효과를 확인한 결과, 500 μg/mL 농도에서 76.0%의 생존률을 나타내 커피 생두 추출물과 유사한 활성을 나타내었다.