Article
건조방법에 따른 포도 송이가지의 항산화 효과 및 생리활성 특성
윤광섭1
,2
,*

Comparison of the antioxidant effects and physiological activities of grape fruit stem extracts derived with different drying methods
Kwang-Sup Youn1
,2
,*

Author Information & Copyright ▼
1Department of Food Science and Technology, Daegu Catholic University, Gyeongsan 38430Korea
2Institute of Food Science and Technology, Daegu Catholic University, Gyeongsan 38430Korea
Copyright ⓒ The Korean Society of Food Preservation. This is an Open-Access article distributed under the terms of the Creative Commons Attribution Non-Commercial License (http://creativecommons.org/licenses/by-nc/3.0/) which permits unrestricted non-commercial use, distribution, and reproduction in any medium, provided the original work is properly cited.
Received: Apr 11, 2018; Revised: Jun 14, 2018; Accepted: Jun 20, 2018
Abstract
This study was conducted to examine the utilization potential of grape stems as nutritional supplements, and the physiological functionalities of 70% ethanol extracts from grape fruit stem (GFS) were investigated. Each experimental group was prepared with different methods and included GFSF (GFS prepared with freeze drying), GFSI (GFS prepared with infrared drying), GFSH (GFS prepared with heat air drying), and GFSS (GFS prepared with sun drying). The respective yields of freeze-dried powders for the GFSF, GFSI, GFSH, and GFSS were 59.27%, 57.13%, 58.57%, and 58.87%, respectively. Total polyphenol contents in the GFSF were significantly greater than those in the other extracts, whereas total flavonoid contents in the GFSI were higher than those in the other extracts. The contents of proanthocyanidin-related substances were ranked in the order of GFSF > GFSI > GFSH > GFSS. The thin layer chromatograph (TLC) analysis of catechin showed that the GFSF, GFSI, GFSH, and GFSS were detected in the same band. The electron donating ability with 500 µg/mL (w/v) solutions of GFSF, GFSI, GFSH, and GFSS amounted to 93.14%, 93.07%, 92.64%, and 86.95%, respectively, and the reducing powers (OD 700) were 1.933, 1.765, 1.455, and 1.200 absorbance units, respectively. Additionally, the ABTS radical scavenging ability showed the same tendency that was observed with the electron donating ability and reducing power. The angiotensin-converting enzyme (ACE) inhibitory activity and tyrosinase inhibitory activity with 500 µg/mL (w/v) solutions of GFSF and GFSI were higher than those of GFSH and GFSS. In conclusion, the infrared drying technique is the superior method for the enhancement of biological activity for by-product utilization.
Keywords: grape fruit stem; drying method; physiological; functionalities
서 론
노화란 세포와 신체조직 전 기관에 걸쳐 일어나는 기능적, 구조적, 생화학적 변화에 의하여 체내의 항상성이 붕괴되는 과정을 말한다. 그 원인으로 피부의 구조적 변화와 생리적 기능이 감소하여 나타나는 자연적 노화(intrinsic aging), 그리고 외부 자극 등 산화적 스트레스에 의한 광노화(photoaging)로 구분된다. 산화적 스트레스의 경우 free radical의 일종인 활성산소종(reactive oxygen species, ROS)에 의하여 발생되며 이들은 생체막에 존재하는 불포화 지방산을 산화시켜 세포의 불활성화를 일으키는 작용을 통하여 노화 및 각종 질병 발생에 기여하게 된다(1). 노화와 성인병 질환의 원인이 활성산소라는 학설이 인정되면서 butylated hydroxyanisole(BHA), butylated hydroxytoluene(BHT) 등과 같은 합성 항산화제 개발 연구가 진행되어 왔으나 이들의 경우 항산화능은 우수한 반면 독성이 지적됨에 따라 보다 안전하고 효능이 우수한 천연 생리활성물질 개발이 요구되고 있다.
최근 국민 식생활 수준의 개선과 가공 산업의 발달로 각종 농산 생산물들의 상당량이 산업적으로 가공처리 되고 있으나 제조 과정 중에 대량의 부산물이 발생하고 있으며, 이들 대부분은 폐기되고 있어 이를 자원화 하려는 연구가 다각적으로 이루어지고 있다(2). 특히 천연물의 미량 원소 중 폴리페놀성 화합물 항산화제가 질환의 예방 및 치료제로서 관심을 끌고 있으며 부산물을 활용한 고부가가치의 기능성 소재로 이용될 수 있는 천연신소재 발굴이 주목을 받고 있다.
포도는 갈대나무목(Rhamnales) 포도과(Vitis vinifera)에 속하는 덩굴성과수로, 포도과에는 11속 700여종이 있으며 주로 열대 및 아열대 지역에서 자생하고 일부는 온대지방에 분포한다. 전 세계적으로 광범위하게 재배되고 있으며 세계 과일 생산량의 약 30%를 차지하고 국내에서는 연간 40만 톤의 포도가 생산되고 있다(3). 포도에는 전화당을 비롯한 유기산과 미네랄, 탄닌, 각종 비타민 외에 인체에 유익한 작용을 하는 플라보노이드계 식물화학 성분이 있으며, 주요 페놀성 화합물 구성 요소로는 procyanidins, anthocyanins, viniferine 및 resveratrol 등이 알려지고 있다(4). 특히, resveratrol(trans-3,5,4-trihydroxystilbene, C14H12O3)은 phytoalexin 계열의 폴리페놀 물질로서 지방 과산화 억제, 항산화, 항콜레스테롤, 항염증, 항암, 혈소판 응집 억제, 심혈관계 질환 방지, 신경보호작용 및 수명연장 등의 효과가 보고되고 있으며(5,6) 그 함량은 과육에 비하여 버려지는 포도 송이가지에 가장 많이 함유되어 있다고 알려진 바 있다(7).
건조 및 가공방법에 따른 Campbell Early 종의 포도에서 폴리페놀, 플라보노이드 함량 및 항산화능의 차이를 나타내는 것으로 보고하여 고부가가치 가공품 개발에 가능성을 제시한 바 있어(8,9), 본 연구에서는 포도 부산물의 활용을 위한 기초연구로서 포도 송이가지의 건조방법에 따른 생리활성을 측정함으로써 기능성 소재으로서의 개발 가능성을 검토하고자 하였다.
재료 및 방법
재 료
본 실험에서 사용된 포도 송이가지는 경북 영천에서 수확한 Muscat Bailey A 품종을 사용하였으며, 항산화 효과를 측정하기 위해 사용한 시약으로 Folin-Ciocalteu reagent, gallic acid, rutin hydrate, (+)-catechin, vanillin, 1,1-diphenyl-2-picryl-hydrazyl, 2,2'-azino-bis(3-ethylbenzothiazoline-6-sulfonic acid) diammonium salt, rabbit lung acetone powder, Hippuryl-histidyl-leucine, mushroom tyrosinase, arbutin, dibutyl hydroxy anisole 및 dibutyl hydroxy toluene은 Sigma-Aldrich Chemical Co.(St. Louis, MO, USA)에서 구입을 하였으며, sodium carbonate, ascorbic acid, sodium carbonate, sodium nitrite, aluminium chloride, potassium ferricyanide, trichloroacetic acid, potassium persulfate 및 ethyl acetate는 Junsei Co.(Tokyo, Japan)의 1급 및 특급시약을 사용하였다.
포도 송이가지 건조
동결건조는 freeze dryer(FD SFDSM12, Samwon, Korea)로 건조하였으며, 적외선건조는 infrared dryer(IRD-250, Woori Sci, Seoul, Korea)를, 열풍건조는 hot air dryer (OF-22GW, Jeiotec., Daejeon, Korea)를 각각 이용하여 60℃에서 일정수분함량까지 건조하였다. 천일건조는 통풍이 잘되는 곳에서 일광에 노출시켜 8-10일간 건조하였으며, 각각의 건조물은 균질기(Nihonseili, Kaisha Ltd., Japan)를 사용하여 40 mesh로 분쇄한 후 분말을 제조하여 실험에 사용하였다.
시료의 추출 및 수율 측정
건조 방법에 따른 포도 송이가지의 에탄올 추출물을 얻기 위하여 각각 건조된 분말 시료를 70% 에탄올 용매에 1:8의 비율로 넣고 60℃의 맨틀 상에서 3시간씩 3회 반복 추출한 후 Whatman No.1여과지로 여과하였다. 다음 rotary vacuum evaporator(rotary vacuum evaporator N-N series, Eyela, Tokyo, Japan)로 감압농축한 후에 동결건조하여 분말 시료를 제조하였으며 -70℃에 보관하면서 실험에 사용하였다. 각 추출물들의 수율(%)은 추출액을 동결 건조시켜 건물 중량을 구한 다음 추출액 조제에 사용한 원료 건물량에 대한 백분율로 계산하였다.
색 도
색도는 색차계(Chromameter CR-200 Minolta, Tokyo, Japan)로 측정하였으며, 밝기를 나타내는 L*(lightness), 적색도를 나타내는 a*(redness), 황색도를 나타내는 b*(yellowness) 및 H°(hue angle value)를 측정하였다.
폴리페놀 함량 측정
Dewanto 등(10)의 방법에 따라 시료 100 μL에 2% sodium carbonate 2 mL과 50% Folin-Ciacalteu reagent 100 μL을 가한 후 720 nm에서 흡광도를 측정하였으며 gallic acid (Sigma-Aldrich Co.)의 검량선에 의하여 함량을 산출하였다.
플라보노이드 함량 측정
Saleh와 Hameed(11)의 방법에 따라 시료 100 mL에 5% sodium nitrite 0.15 mL을 가한 후 25℃에서 6분간 방치한 다음 10% aluminium chloride 0.3 mL를 가하여 25℃에서 5분간 방치하였다. 다음 1 N NaOH 1 mL를 가하고 vortex상에서 가한 후 510 nm에서 흡광도를 측정하였으며 rutin hydrate(Sigma-Aldrich Co.)의 검량선에 의하여 함량을 산출하였다.
프로안토시아니딘 함량 측정
Vanillin-sulfuric acid법(12)에 따라 시료 200 μL에 1.2% vanillin 용액 500 μL와 20% sulfuric acid 500 μL를 혼합하여 20분간 방치한 후 500 nm에서 흡광도를 측정하였으며 (+)-catechin(Sigma-Aldrich Co.)의 검량선에 의하여 함량을 산출하였다.
TLC에 의한 카테킨 정성 분석
Thin layer chromatography(TLC)의 조건은 Andriambeloson 등(13)의 방법을 변용하였으며, 분리한 획분을 silica plate (Merck, Darmstadt, Germany)에 spotting한 후 toluene/acetone/formic acid(6:6:1, v/v/v)의 혼합용매로 전개하였다. 발색제로 70% hydrochloric acid에 녹인 1% vanillin 용액을 사용하였으며 (+)-catechin(Sigma-Aldrich Co.)을 표준품으로 하여 추출물 중의 catechin을 정성 분석하였다.
전자공여능
Blois(14)의 방법에 따라 시료 0.2 mL에 0.4 mM 1,1diphenyl-2-picryl-hydrazyl(DPPH)용액 0.8 mL를 가하여 10분간 방치 한 다음 525 nm에서 흡광도를 측정하였으며 계산식, electron donating ability(%)=100-[(OD of sample/OD of control)×100]에 의하여 활성도를 산출하였다.
환원력 측정
Saeedeh와 Asna(15)의 방법에 따라 시료 1 mL에 0.2 M phosphate buffer(pH 6.6) 2.5 mL와 1% potassium ferricyanide 용액 2.5 mL를 가한 후 50℃에서 30분간 반응시켰다. 다음에 10% trichloroacetic acid(TCA) 용액 2.5 mL를 가한 후 1,650 ×g에서 10분간 원심분리 하였으며, 상등액 2.5 mL에 증류수 2.5 mL와 0.1% FeCl3 용액 0.5 mL를 가한 후 700 nm에서 흡광도를 측정하였다.
ABTS radical 소거활성 측정
Re 등(16)의 방법에 따라 7.4 mM 2,2'-azino-bis(3-ethylbenzothiazoline-6-sulfonic acid) diammonium salt(ABTS)와 2.6 mM potassium persulfate를 혼합하여 실온의 암소에서 24시간 동안 방치하여 radical을 형성시킨 다음 실험 직전에 ABTS 용액을 732 nm에서 흡광도가 0.700±0.030이 되도록 phosphate buffer saline(PBS, pH 7.4)로 희석하여 사용하였다. 희석된 용액 950 μL에 추출물 50 μL를 가하여 암소에서 10분간 반응시킨 후 732 nm에서 흡광도를 측정하였으며 계산식, ABTS radical scavenging ability(%)=100-[(OD of sample/OD of control)×100]에 의하여 활성을 산출하였다.
Angiotensin I-converting enzyme(ACE) 저해활성
ACE 저해활성은 Cushman과 Chung의 방법(17)을 변형하여 측정하였으며, 조효소액은 rabbit lung acetone powder (Sigma-Aldrich Co.)를 0.2 g/10 mL(w/v)의 농도로 4℃에서 24시간 추출한 후, 원심분리(4℃, 4,000 rpm, 40 min)하여 상등액을 조효소액으로 사용하였다. 기질은 0.3 M NaCl이 함유된 0.1 M sodium borate buffer(pH 8.3)에 hippuryl-histidyl-leucine(HLL, Sigma-Aldrich Co.)을 5 mg/mL(w/v)의 농도로 녹인 후 기질로 사용하였다. ACE 저해활성은 시료 50 μL에 ACE 조효소액 50 μL을 가한 다음 37℃에서 5분간 예비 반응을 시킨 후, 기질 50 μL을 가하고 다시 37℃에서 1시간 반응시켰다. 다음 1 N HCl 150 μL을 가하여 반응을 정지시키고 750 μL의 ethyl acetate를 가한 후, 1분간 교반하고 원심분리(4℃, 5,000 rpm, 10 min)한 다음 500 μL의 상등액을 얻었다. 이 상등액을 120℃에서 30분간 완전히 건조시켜 2 mL의 methanol을 넣은 후 228 nm에서 흡광도를 측정하였다. 대조구로서는 추출물 대신 추출용매 50 μL을 가하여 측정하였으며, 저해활성은 계산식, ACE inhibition (%)=[1-(CAbs-SAbs)/(CAbs-BAbs)]×100: “CAbs; 대조구 흡광도, SAbs; 시료 흡광도, BAbs; 시료 무첨가구의 흡광도”에 의하여 산출하였다.
통계처리
모든 실험은 3회 반복으로 행하여 평균치와 표준편차로 나타내었고, 유의성 검증은 version 12의 SPSS(Statistical Package for Social Sciences, SPSS Inc., Chicago, IL, USA) software package program을 이용하여 각 측정 평균값의 유의성(p<0.05)은 Duncan’s multiple range test로 검정하였다.
결과 및 고찰
수율 및 색도
건조방법에 따른 포도 송이가지 70% 에탄올 추출 수율 및 색도는 Table 1과 같다. 수율은 ethanol extract of grape fruit stem with freeze drying(GFSF), ethanol extract of grape fruit stem with infrared drying(GFSI), ethanol extract of grape fruit stem with heat air drying(GFSH) 및 ethanol extract of grape fruit stem with sun drying(GFSS)가 각각 59.17%, 57.13%, 58.57%, 58.87%로 높은 수율을 보였으나 건조방법에 따른 유의적인 차이는 없었다. Jeong과 Youn(18)의 건조방법에 따른 포도씨 연구에서는 적외선건조에 의한 수율이 가장 높게 측정되었으며, 그 다음으로 열풍건조, 천일건조 및 동결건조로 나타나 본 연구결과와 상이하였다. 이는 포도씨와 포도가지의 차이로 생각되며, 식용식물 중의 플라보노이드와 같은 페놀성 화합물은 수용성 또는 지용성으로 구분되어 있어 추출되는 용매에 따라 그 성분들이 달라지기 때문에 추출 수율에 있어서 차이를 나타내는 것으로 판단된다(19). 포도 송이가지의 경우 비극성 용매에서도 가용성 고형분이 잘 용출된 결과로 사료된다. 색도에서는 적외선건조, 열풍건조 및 천일건조에서 밝기를 나타내는 L* 값은 감소하고 적색도를 나타내는 a* 및 황색도를 나타내는 b* 값은 증가하는 경향을 보였는데 이는 건조하는 과정 중에 온도의 영향에 따른 갈변현상에 기인하는 것으로 판단된다.
Table 1.
Yields, moisture content, and Hunter’s color value of 70% ethanol extracts of grape fruit stem with different drying methods
| Samples1) |
Yields
(%, dry basis) |
Hunter’s color value |
L*
(lightness) |
a*
(redness) |
b*
(yellowness) |
Ho
(hue angle) |
| GFSF |
59.17±1.252)NS3) |
53.37±0.98a4) |
5.77±0.14c |
8.60±0.17c |
68.31±0.63a |
| GFSI |
57.93±1.53 |
49.25±0.99c |
7.02±0.22a |
10.61±0.33b |
62.77±0.25c |
| GFSH |
58.57±1.19 |
51.00±0.94bc |
6.50±0.27b |
11.42±0.19a |
66.37±0.76b |
| GFSS |
58.87±1.81 |
50.70±0.44b |
6.73±0.09ab |
11.55±0.11a |
63.37±0.06c |
Download Excel Table
폴리페놀, 플라보노이드 및 프로안토시아니딘 함량
포도에는 polyhydroxyflavan-3-ol units의 oligomer과 polymer인 프로안토시아니딘으로 정의되는 폴리페놀 화합물이 각종 기능성을 나타내는 유용물질로 보고되고 있다(20). GFSF, GFSI, GFSH, 및 GFSS의 총 폴리페놀, 플라보노이드 및 프로안토시아니딘의 함량을 측정한 결과는 Table 2와 같다. GFSF, GFSI, GFSH 및 GFSS의 폴리페놀 함량은 g당 각각 270.09 mg, 268.44 mg, 252.49 mg, 및 253.03 mg이 검출되었으며 동결건조 및 적외선 건조의 경우 대등한 함량을 나타내었으나 열풍 및 천일건조에서는 감소하는 결과를 나타내었다. Kim 등(21)의 건조 조건별에 따른 홍삼의 연구 결과에서도 동결건조 및 적외선 시료에서 총 페놀 함량이 타 건조방법에 비해 높게 측정되어 본 연구 결과와 일치하였다. 반면 GFSF, GFSI, GFSH, 및 GFSS의 플라보노이드 함량은 각각 58.35 mg, 64.57 mg, 61.65 mg, 및 59.46 mg으로 적외선건조, 열풍건조, 천일건조 및 동결건조 순으로 증가하였으며, 이는 Kim 등(21)의 건조 방법에 따른 홍삼의 연구에서의 연구결과와 일치하였으나 건조에 따른 직접적인 영향은 받지 않는 것으로 나타났다. 또한 Kim 등(22)은 적정 열처리는 식품성분 내 환원당과 질소화합물의 갈색화 반응을 일으키며, 생성된 산물은 항산화 효과를 가진다고 보고하여 본 연구에서 적외선건조, 열풍건조, 천일건조에서 플라보노이드 함량이 증가하는 현상과 관련이 있는 것으로 여겨진다. 프로안토시아니딘 함량에서는 GFSF, GFSI, GFSH, 및 GFSS가 g당 각각 193.47 mg, 181.30 mg, 159.60 mg 및 157.13 mg이 검출되었으며, 적외선건조, 열풍건조 및 천일건조가 동결건조에 비하여 각각 6.29%, 17.51% 및 18.78%가 감소하였는데 이는 열처리 시 페놀성 화합물이 변형되어 그 함량이 감소한 것으로 판단된다(23). 한편 Xu 등(24)의 보고에 따르면 포도씨와 과피의 프로안토시아니딘 함량을 vanillin-H2SO4법으로 측정한 결과 g당 각각 61.30 mg 및 7.40 mg에 이르는 것으로 보고하였으며, 또 Cosme 등(25)은 포도씨는 34.80-91.90 mg, 과피는 1.10-5.90 mg의 함량으로 보고하여 포도 송이가지의 프로안토시아니딘의 함량이 포도씨, 과피 등의 함량보다 월등히 높은 것으로 나타났다.
Table 2.
Total polyphenol, flavonoid, and proanthocyanidin contents of 70% ethanol extracts of grape fruit stem with different drying methods
(mg/g, dry basis)
| Mesurement |
GFSF1) |
GFSI2) |
GFSH3) |
GFSS4) |
| Polyphenols (mg GAE5)/g) |
270.09±5.718)a9) |
268.44±3.75a |
252.49±2.45b |
253.03±3.13b |
| Flavonoids (mg RHE6)/g) |
58.35±1.20c |
64.57±0.76a |
61.65±2.24b |
59.46±1.41bc |
| Proanthocyanidins (mg CE7)/g) |
193.47±2.62a |
181.30±2.54b |
159.60±1.61c |
157.13±1.71c |
Download Excel Table
TLC에 의한 카테킨 정성분석
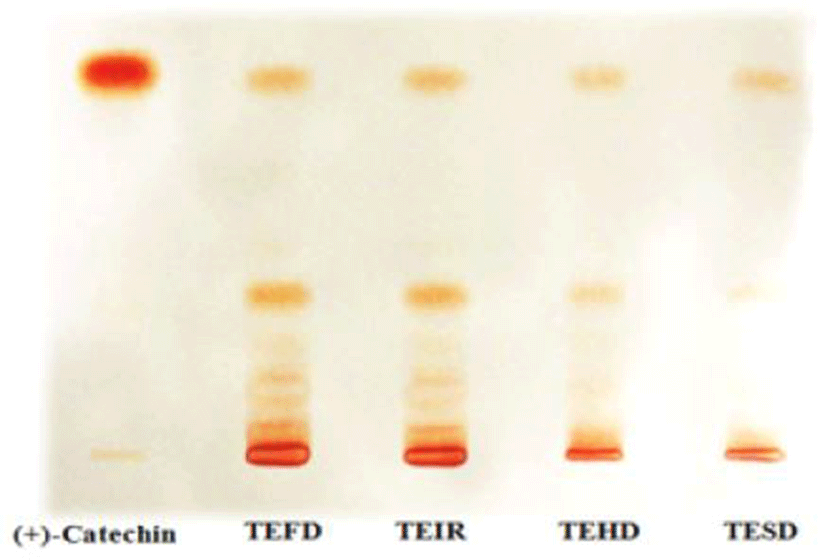
Vanillin-H2SO4법은 프로안토시아니딘을 빠르게 정량하기 위하여 일반적으로 사용되는 방법(12)으로 catechin monomers 뿐만 아니라 그의 polymer인 여러 프로안토시아니딘 성분들을 특이적으로 발색시키기 때문에 catechin류의 정성 및 정량분석법으로 널리 사용되고 있다. GFSF, GFSI, GFSH, 및 GFSS 각각을 TLC에 10 μL씩 spotting하여 catechin을 정성 분석한 결과는 Fig. 1과 같다. 모든 건조구에서 catechin과 동일한 위치에서 band가 확인되었으며 동결건조, 적외선건조, 열풍건조, 천일건조 순으로 선명한 적색을 나타내어 프로안토시아니딘의 함량(Table 2)과 일치함을 알 수 있었다. 한편 GFSF 및 GFSI에서 수종의 미세한 spot이 확인되었으나 GFSH 및 GFSS에서 발색정도가 감소하는 것을 통해 열에 의한 성분의 손실이 있는 것으로 추정되며, 적외선건조에서는 큰 영향을 미치지 않는 것으로 나타났다.
Fig. 1.
TLC chromatogram of 70% ethanol extracts of grape fruit stem with different drying methods.
The spots were visualized by spraying with a 1% vanillin solution in 70% hydrochloric acid. The concentrations of test solutions were measured at 1,000 ppm.
Download Original Figure
전자공여능
GFSF, GFSI, GFSH, 및 GFSS의 전자공여활성을 천연 및 인공 항산화제로 알려진 L-ascorbic acid(AA), butylated hydroxyanisole(BHA), butylated hydroxytolune(BHT)와 비교한 결과는 Table 3과 같다. 50 μg/mL의 낮은 농도에서는 건조 방법별 유의적인 차이는 없었으나 농도가 증가함에 따라 활성은 비례적으로 증가하였다. 500 μg/mL의 농도에서 GFSF, GFSI, GFSH, 및 GFSS의 전자공여 활성은 각각 93.14%, 93.07%, 92.64% 및 86.95%로 동결건조, 적외선건조 및 열풍건조가 천일건조에 비하여 유의적으로 높은 활성을 나타내었다. Jeong 등(26)의 건조방법에 따른 가시오갈피생약제의 연구에서는 열풍건조보다는 동결건조에 따른 항산화 활성이 높아 본 연구와 일치하였으며, Kim 등(27)의 건조방법을 달리한 감말랭이의 연구에서는 감압건조, 적외선건조, 냉풍건조, 열풍건조 순으로 85.11-90.41%의 범위의 활성으로 높게 측정되어 타 건조방법에 비해 적외선건조 제품에서 높은 항산화성을 나타내 본 연구 결과와 유사하였다. 50 μg/mL의 농도에서 대조군인 AA 및 BHA는 각각 97.82% 및 82.61%로 동일농도의 실험군에 비하여 높은 활성을 나타내었지만 포도 송이가지 추출물의 농도가 증가함에 따라 그 활성 역시 증가하기 때문에 기능성 소재로서의 활용도는 높을 것으로 사료된다.
Table 3.
Electron donating ability of 70% ethanol extracts of grape fruit stem with different drying methods
| Samples1) |
Concentration (μg/mL) |
Positive control2) (50 μg/mL) |
| 50 |
100 |
500 |
AA |
BHA |
BHT |
| GFSF |
24.37±0.853)a4) |
46.83±1.53a |
94.14±0.64a |
97.82±0.15A |
82.61±1.05B |
20.96±1.45C |
| GFSI |
23.26±0.48a |
46.44±1.20a |
93.07±0.57a |
| GFSH |
23.06±1.73a |
46.21±1.11a |
92.64±0.29a |
| GFSS |
23.09±0.72a |
39.21±0.74b |
86.95±0.32b |
Download Excel Table
환원력
GFSF, GFSI, GFSH, 및 GFSS의 환원력을 측정한 결과는 Table 4와 같다. 농도가 증가할수록 환원력도 유의적으로 증가하는 경향을 보였으며 동결건조, 적외선건조, 열풍건조, 천일건조 순으로 나타나 Nam 등(28)의 건조방법에 따른 산사과 추출물 연구에서는 동결건조 시료에서 환원력이 높게 측정되어 본 연구 결과와 일치하였다. 반면 대조군 AA, BHA, 및 BHT에 비해 낮은 흡광도를 나타내었다. Osawa(29)는 phenol성 물질은 항산화능을 포함한 다양한 생리적 효능을 나타내며 이는 주로 환원력에 의한 효과라고 보고한 바 있으며, 항산화 활성과 프로안토시아니딘 함량 사이에 상관성이 높다는 보고(30)로 비추어 볼 때 포도 송이가지의 항산화 활성을 나타내는 주요 성분은 프로안토시아니딘 성분일 것으로 추정되며 이들의 항산화력에 의한 결과라 사료된다. 따라서 동결건조에서 환원력이 높은 현상은 이에 함유된 총 폴리페놀 및 프로안토시아니딘 함량에 기인된 것으로 판단된다.
Table 4.
Reducing power of 70% ethanol extracts of grape fruit stem with different drying methods
| Samples1) |
Concentration (μg/mL) |
Positive control2) (50 μg/mL) |
| 50 |
100 |
500 |
AA |
BHA |
BHT |
| GFSF |
0.316±0.0083)a4) |
0.636±0.008a |
1.933±0.023a |
2.547±0.017A |
2.578±0.019A |
0.514±0.02B |
| GFSI |
0.312±0.012a |
0.629±0.014a |
1.765±0.010b |
| GFSH |
0.248±0.005b |
0.621±0.008a |
1.455±0.026c |
| GFSS |
0.215±0.005c |
0.587±0.004b |
1.200±0.016d |
Download Excel Table
ABTS 라디칼 소거활성
GFSF, GFSI, GFSH, 및 GFSS의 ABTS 라디칼 소거활성을 비교한 결과는 Table 5와 같다. 농도가 증가함에 따라 그 활성도 비례적으로 증가하였으나 대조군 AA, BHA, 및 BHT보다는 낮은 활성을 나타내었다. 50-100 μg/mL의 농도에서는 동결건조가 44.95%로 유의적으로 높게 측정되었으며, 그 다음으로 적외선건조 및 열풍건조가 천일건조 순으로 나타났다. 이는 Nam 등(28)의 건조방법에 따른 산사과 추출물 연구에서의 ABTS 라디칼 소거활성이 동결건조에서 가장 높게 측정된 것과 일치하였다. 500 μg/mL의 농도에서는 다소 차이는 있으나 모든 건조구에서 비슷한 활성을 보였다. 한편 동일 농도(50-100 μg/mL)의 모든 처리구에서 ABTS 라디칼 소거능이 전자공여능에 비하여 월등히 높은 활성을 나타내는 것은 radical을 제거하는 기작이 다르고, 기질이 결합하는 정도가 다르다는 점에서 낮은 농도에서도 높은 활성을 나타내는 것으로 판단된다.
Table 5.
ABTS radical scavenging ability of 70% ethanol extracts of grape fruit stem with different drying methods
| Samples1) |
Concentration (μg/mL) |
Positive control2) (50 μg/mL) |
| 50 |
100 |
500 |
AA |
BHA |
BHT |
| GFSF |
44.95±1.093)a4) |
83.84±2.46a |
93.67±0.19a |
98.61±0.13A |
97.96±0.16B |
90.96±0.61C |
| GFSI |
42.41±2.63ab |
82.02±0.95ab |
93.20±0.12a |
| GFSH |
40.86±2.06b |
80.07±2.12b |
91.60±0.81b |
| GFSS |
29.68±1.04c |
56.11±1.53c |
91.49±0.69b |
Download Excel Table
ACE 저해활성 측정
건조방법에 따른 포도 송이가지의 ACE 저해활성을 rutin 및 catechin과 비교한 결과는 Table 6과 같다. 500 μg/mL 농도에서의 GFSF, GFSI, GFSH, 및 GFSS의 ACE 저해활성은 각각 61.13%, 66.79%, 55.58%, 53.54%로 적외선건조에서 가장 높았고 다음으로 동결건조, 열풍건조, 천일건조 순의 활성을 나타내었다. 건조방법에 따른 항고혈압활성의 차이는 식물자원에 함유된 다양한 페놀화합물의 작용에 의한 가능성이 높다는 보고(31)와, 감나무 잎에서 분리한 페놀성 물질 중 플라보노이드성분이 ACE 저해활성을 높인다는 보고(32)로 볼 때 포도 송이가지에 함유되어 있는 페놀화합물에 기인한 것으로 추측된다. 한편 포도 송이가지 추출물의 경우 대표 저해인자로 알려진 활성물질인 rutin (92.49%)과 catechin(87.72%)의 수준에는 미치지 못하나 높은 활성을 나타내어 천연 항고혈압 소재로서의 이용가능성을 예견케 하였으며 특히, 적외선건조 시 우수한 활성을 나타내어 산업적 활용에 기여할 수 있으리라 사료된다.
Table 6.
Angiotensin converting enzyme(ACE) inhibitory activity of 70% ethanol extracts of grape fruit stem with different drying methods
| Measurement |
GFSF1) |
GFSI2) |
GFSH3) |
GFSS4) |
Positive control
(500 μg/mL) |
| Rutin |
Cathechin |
ACE inhibitory activity
(%, 500 μg/mL) |
61.13±2.105)b6) |
66.79±2.10a |
55.58±1.07c |
53.54±1.66c |
92.49±1.37A |
87.72±2.11B |
Download Excel Table
요 약
포도 부산물의 활용 및 생리활성 소재 개발 가능성을 알아보고자 건조 방법에 따른 포도 송이가지 70% ethanol 추출물에 대한 생리활성을 측정하였다. 실험군은 포도 송이가지 동결건조분말 70% ethanol 추출물(GFSF), 적외선건조분말 70% ethanol 추출물(GFSI), 열풍건조분말 70% ethanol 추출물(GFSH), 천일건조분말 70% ethanol 추출물(GFSS)을 각각 동결건조하여 실험에 사용하였다. 수율은 GFSF, GFSI, GFSH, 및 GFSS가 각각 59.17%, 57.13%, 58.57%, 58.87%로 높은 수율을 보였으나 건조방법에 따른 유의적인 차이는 없었다. 색도는 적외선건조, 열풍건조 및 천일건조에서 L* 값은 감소하고 a* 값 및 b* 값은 증가하는 경향을 나타내었다. 폴리페놀 함량은 GFSF, GFSI, GFSH, 및 GFSS가 g당 각각 270.09 mg, 268.44 mg, 252.49 mg 및 253.03 mg이였으며 플라보노이드 함량은 각각 58.35 mg, 64.57 mg, 61.65 mg 및 59.46 mg이 검출되었다. 프로안토시아니딘 함량에서는 g당 각각 193.47 mg, 181.30 mg, 159.60 mg 및 157.13 mg이 검출되었다. TLC 분석 결과 모든 건조구에서 catechin과 동일한 위치에서 band가 확인되었으며 동결건조, 적외선건조, 열풍건조, 천일건조 순으로 선명한 적색을 나타내었다. 500 μg/mL의 농도에서 GFSF, GFSI, GFSH, 및 GFSS의 전자공여 활성은 각각 93.14%, 93.07%, 92.64% 및 86.95%로 동결건조, 적외선건조 및 열풍건조가 천일건조에 비하여 유의적으로 높은 활성을 나타내었고 환원력은 농도가 증가할수록 유의적으로 증가하는 경향을 보였다. 50-100 μg/mL의 농도에서의 ABTS 라디칼 소거활성에서는 동결건조, 적외선건조 및 열풍건조가 천일건조에 비하여 월등히 높은 활성을 나타내었다. 500 μg/mL 농도에서의 ACE 저해활성은 GFSF, GFSI, GFSH, 및 GFSS가 각각 61.13%, 66.79%, 55.58%, 53.54%의 활성을 나타내었으며 적외선건조에서 가장 높은 저해활성을 나타내었다. 이러한 결과를 종합해 볼 때 동결건조 및 적외선건조 포도 송이가지 추출물이 열풍건조 및 천일건조에 비해 소재 활용가치가 높을 것으로 사료되며 천연항산화제 및 기능성 증진을 위한 소재로 이용 가능할 것으로 판단된다.
Acknowledgements
본 논문은 2017년도 대구가톨릭대학교 교내연구비 지원에 의한 것으로 감사드립니다.
References
HalliwellB. 2006; Reactive oxygen species and the central nervous system. J Neurochem. 59:1609-1623.

HwangIT, HwangJS, LimHK, ParkNJ. 2010; Biorefinery based on weeds and agricultural residues. Korean J Weed Sci. 30:340-360


ChoiSW, ChungUS, LeeKT. 2005; Preparation of high quality grape seed oil by solvent extraction and chemical refining process. Korean J Food Preserv. 12:600-607.

YooMA, ChungHK, KangMH. 2004; Evaluation of physicochemical properties in different cultivar grape seed waste. Food Sci Biotechnol. 13:26-29.

JoeAK, LiuH, SuzuiM, VuralME, XiaoD, WeinsteinIB. 2002; Resveratrol induces growth inhibition. S-phase arrest, apophysis and changes in biomarker expression in several human cancer cell line. Clin Cancer Res. 8:893-903.

Gao X, Xu YX, Divine G, Janakiraman N, Chapman RA, Gautam SC (2002) Disparate in vitro and in vivo antileukemic effects of resveratrol, a natural polyphenolic compound found in grapes. J Nutr, 132, 2076-2081
GaoX, XuYX, DivineG, JanakiramanN, ChapmanRA, GautamSC. 2002; Disparate
in vitro and
in vivo antileukemic effects of resveratrol, a natural polyphenolic compound found in grapes. J Nutr. 132:2076-2081


ChoYJ, KimJE, ChunHS, KimCT, KimSS, KimCJ. 2003; Contents of resveratrol in different parts of grapes. Korean J Food Sci Technol. 35:306-308.

JoJE, YookHS, KimKH, BaekJY, MoonYJ, ParkSJ, JangSA. 2010; Effect of drying methods and gamma irradiation on the color changes and antioxidant activity of grape by-products. J Korean Soc Food Sci Nutr. 39:1826-1831


YookHS, KimKH, JangSA. 2010; Quality characteristics of grape pomace with different drying methods. J Korean Soc Food Sci Nutr. 39:1353-1358


DewantoV, WuX, AdomKK, LiuRH. 2002; Thermal processing enhances the nutritional value of tomatoes by increasing total antioxidant activity. J Agric Food Chem. 50:3010-3014


SalehES, HameedA. 2008; Total phenolic contents and free radical scavenging activity of certain Egyptian Ficus species leaf samples. Food Chem. 114:1271-1277.

SunB, Ricardo-da-silvaJM, SparangeerI. 1998; Critical factors of vanillin assay for catechins and proanthocyanidins. J Agric Food Chem. 46:4267-4274


AndriambelosonE, MagnierC, Haan-ArchipoffG, LobsteinA, AntonR, BeretzA, StocletJC, AndriantsitohainaR. 1998; Natural dietary polyphenolic compounds cause endothelium-dependent vasorelaxation in rat thoracic aorta. J Nutr. 128:2324-2333


BloisMS. 1958; Antioxidant determinations by the use of a stable free radical. Nature. 181:1199-1200


Arabshahi-Delouee S, Urooj A (2007) Antioxidant properties of various solvent extracts of mulberry (Morus indica L.) leaves. Food Chem, 102, 1233-1240
Arabshahi-DeloueeS, UroojA. 2007; Antioxidant properties of various solvent extracts of mulberry (
Morus indica L.) leaves. Food Chem. 102:1233-1240


ReR, PellegriniN, ProteggenteA, PannalaA, YangM, Rice-EvansC. 1999; Antioxidant activity applying an improved ABTS radial cation decolorization assay. Free Radical Biol Med. 26:1231-1237


CushmanDW, CheungHS. 1971; Spectrophotometric assay and properties of the angiotensin-converting enzyme of rabbit lung. Biochem Pharmacol. 20:1637-1648


JeongDS, YounKS. 2016; Comparison of the antioxidant and physiological activities of grape seed extracts prepared with different drying methods. Korean J Food Preserv. 23:1-6


Cha JY, Jeong JJ, Kim YT, Seo WS, Yang HJ, Kim JS, Lee YS (2006) Detection of chemical characteristics in Hamcho (Salicornia herbacea) according to harvest periods. J Life Sci, 16, 683-690
ChaJY, JeongJJ, KimYT, SeoWS, YangHJ, KimJS, LeeYS. 2006; Detection of chemical characteristics in
Hamcho (
Salicornia herbacea) according to harvest periods. J Life Sci. 16:683-690.

da SilvaJMR, RigandJ, CheynierV, CheminatA, MoutounetM. 1991; Procyanidin dimers and trimers from grape seeds. Phytochemistry. 30:1259-1264.

KimKY, ShinJK, LeeSW, YoonSR, ChungHS, JeongYJ, ChoiMS, LeeCM, MoonKD, KwonJH. 2007; Quality and functional properties of red ginseng prepared with different steaming time and drying methods. Korean J Food Sci Technol. 39:494-499.

Kim JH, Kwak DY, Choi MS, Moon KD (1999) Comparison of the chemial compositions of Korean and Chinese safflower (Carthamus tinctororius L.) seed. Korean J Food Sci Technol, 31, 912-918
KimJH, KwakDY, ChoiMS, MoonKD. 1999; Comparison of the chemial compositions of Korean and Chinese safflower (
Carthamus tinctororius L.) seed. Korean J Food Sci Technol. 31:912-918.

KangHK, YooYK, LeeSK. 2003; Effets of prestorage heat treatment on changes of phenolic compound contents and incidence of skin blackening in 'Niitaka' pear fruits during cold storage. J Korean Soc Hortic Sci. 44:197-200.

XuC, ZhangY, CaoL, LuJ. 2010; Phenolic compounds and antioxidant properties of different grape cultivars grown in China. Food Chem. 119:1557-1565


CosmeF, Ricardo-da-SilvaJM, LaureanoO. 2009; Effect of various proteins on different molecular weight proanthocyanidin fractions of red wine during wine fining. Am J Enol Vitic. 60:74-81.

Jeong HN, Lim SH, Kim HY, Kim KD, Park YH, Ham HJ, Lee KJ, Kim KH, Ahn YS (2010) Quality changes in Eleutherococcus senticosus Cortex processed by different pretreatment and drying method. Korean J Med Crop Sci, 18, 98-104
JeongHN, LimSH, KimHY, KimKD, ParkYH, HamHJ, LeeKJ, KimKH, AhnYS. 2010; Quality changes in
Eleutherococcus senticosus Cortex processed by different pretreatment and drying method. Korean J Med Crop Sci. 18:98-104.

KimYS, LeeSJ, KimMY, KimGR, ChungHS, PaekHJ, KimMO, KwonJH. 2009; Physicochemical and organoleptic qualities of sliced-dried persimmons as affected by drying methods. Korean J Food Sci Technol. 41:64-68.

NamS, KwonYR, ChungHS, YounKS. 2016; Antioxidant abilities and physiological properties of dried Haw extracts prepared using different drying methods. Korean J Food Preserv. 23:246-251


OsawaT. 1994; Novel natural antioxidant for utilization in food and biological systems: In Postharvest Biochemistry of Plant Food Material in the Tropics. Japan Scientific Societies Press. Tokyo, Japan: p. 241-251.

Luximon-Ramma A, Bahorun T, Soobrattee MA, Aruoma OI (2002) Antioxidant activities of phenolic, proanthocyanidin, and flavonoid components in extracts of Cassia fistula. J Agric Food Chem, 50, 5042-5047
Luximon-RammaA, BahorunT, SoobratteeMA, AruomaOI. 2002; Antioxidant activities of phenolic, proanthocyanidin, and flavonoid components in extracts of
Cassia fistula. J Agric Food Chem. 50:5042-5047


KimKM, SuhHJ, hungSH, ChoWD, MaSJ. 1999; Chemical structure of angiotensin converting enzyme inhibitor isolated from onion flesh. Food Sci Biotechnol. 8:329-332.

KamedaK, TakakuT, OkudaH, KimuraH. 1987; Inhibitory effects of various flavonoids isolated from leaves of persimmon on angiotensin-converting enzyme activity. J Nat Prod. 50:680-683