Article
고수 종자 추출물의 산화방지 및 유지 산화안정성 효과
김민아,
한창희,
김미자*

In vitro antioxidant activity and oxidative stability in bulk oil of coriander seeds ethanol extract
Min-Ah Kim,
Chang Hee Han,
Mi-Ja Kim*

Author Information & Copyright ▼
Department of Food and Nutrition, College of Health Science, Kangwon National University, Samcheok 25949Korea
Copyright ⓒ The Korean Society of Food Preservation. This is an Open-Access article distributed under the terms of the Creative Commons Attribution Non-Commercial License (http://creativecommons.org/licenses/by-nc/3.0/) which permits unrestricted non-commercial use, distribution, and reproduction in any medium, provided the original work is properly cited.
Received: May 14, 2018; Revised: Jun 16, 2018; Accepted: Jun 21, 2018
Abstract
The aim of the study was to confirm whether the coriander seeds ethanol extract (CSEE) exhibited effective antioxidant activity and oxidative stability in corn oil. The results showed that the 2,2-diphenyl-1-picrylhydrazyl (DPPH) and 2,2'-azino-bis(3-ethylbenzothiazoline-6-sulphonic acid) (ABTS) cation radical scavenging activity were 24.4, 55.0, and 81.0, and 8.9, 16.8, and 34.3% at the concentrations of 0.25, 0.5, and 1.0 mg/mL, respectively. The ferric reducing antioxidant power (FRAP) reduction power was 284.1 μM ascorbic acid equivalent/g extract, and the total phenol content (TPC) was 31.9 μM tannic acid equivalent/g extract. Furthermore, the TPC showed positive correlations with the DPPH radical scavenging activity, ABTS cation radical scavenging, and FRAP value (p<0.01). oxygen radical absorbance by fluorescein (ORAC) analysis showed that the antioxidant activities of trolox 50 μM and CSEE 100 μg/mL were 3.1 and 4.4 times higher than those of blank AUC, respectively. In addition, CSEE reduced the amounts of conjugated diene and ρ-anisidine by 8.3 and 40.8%, respectively, in the oxidized corn oil. Thus, the coriander seeds ethanol extract is confirmed to have effective antioxidant activity and oxidative stability in corn oil, and it can be used as a natural antioxidant for preservation in food processing.
Keywords: coriander seeds; ethanol extract; antioxidant; oxidative stability; corn oil
서 론
식생활의 서구화 및 간편 조리식품 수요 증가로 인해 가공식품 생산 증가 및 인스턴트 식품의 수요가 꾸준히 증가하고 있다(1). 이러한 식품을 가공하는 과정이나 저장, 유통과정에서 품질을 저하시키는 원인 중 하나는 지질의 산화이다. 이러한 요인을 방지하기 위해 식품첨가물을 사용하는데 대표적으로 butylated hydroxyanisol(BHA), buthylated hydroxytoluene(BHT)가 있지만 이는 저렴하다는 장점이 있으나 Chen 등(2)은 돌연변이를 유발한다는 보고도 있어 안전성에 우려가 있다. 우리나라 역시 독성으로 인해 일일섭취허용량을 각각 0.5 및 0.3 mg/kg bw/day로 사용량을 제한하고 있다. 이러한 실정으로 식물 등의 천연 소재로 부터의 항산화 물질을 얻기 위해 다양한 연구가 진행되고 있다(3). 본 연구에서는 산화방지 효과가 우수한 천연소재를 발굴하여 합성 항산화제를 대체할 수 있는지를 확인하고자 하였으며, 특히 산화방지 효과가 알려진 향신료를 대상으로 실제적 이용가능성을 검토하였다(4).
고수는 지중해 및 서아시아 지역에서 서식하는 일년생 허브로, 터키, 인도, 불가리아, 모로코 등에서 생산되며 수천 년 동안 중국에서 음식과 의학에서 사용되어왔다(5). 이는 잎과 종자 모두 사용되는데 잎은 허브류, 종자는 향신료로 분류된다. 잎은 생채, 볶음 또는 향미를 주기위해 향료 또는 차로 이용되고 있으며, 종자는 잘 건조하여 분말로 만들어 카레에 사용되거나 조미료, 소시지 등에 첨가하는 향신료로 사용된다(6). 또한 종자 속 오일은 1% 정도이며, 이 정유 성분은 linalool, monoterpenoid가 주요성분으로 알려져 있다(7). Delaquis 등(8)에 의하면 linalool에 의한 항균효과가 효과적이었다고 보고하였으며, Silva 등(9)은 고수 오일을 그람 양성균과 음성균에 대한 항균효과를 연구한 결과 병원성 박테리아를 효과적으로 사멸시키는 효과가 있다고 보고하였다. Farah 등(10)은 고수의 잎과 종자의 메탄올 추출물의 총 페놀함량을 비교한 결과 잎보다 종자에서 더 많은 함량을 보였다고 보고하였으며, 또한 이를 Salmonella typhi, Staphylococcus aureus, Candida tropicals, Aspergillus flavus, Mucor sp. and Emericella nidulans를 이용한 미생물 생육억제 효과를 살펴본 결과 이들에 대한 항균작용이 있음을 보고하였다. 이러한 고수 종자 오일은 식품산업에서 향 성분으로 사용되고 있으며, 비누, 로션, 향수 등의 화장품 등에도 사용되고 있는데 오랜 시간동안 사용되면서 보고된 부작용은 없으며 제한적인 동물연구에서도 주요 성분인 linalool의 독성이 없음을 보고하였다(11). 이에 부작용이 없는 소재로 가공식품 등의 산화방지 작용뿐만 아니라 항균작용의 역할도 기대할 것으로 사료되어 본 연구의 소재로 선정하여 연구를 진행하였다.
따라서 본 연구에서는 잎보다 종자의 총 페놀함량 및 항균효과가 우수하다고 연구되어지는 고수 종자를 이용하여 식품 산업에서 유지 산패를 지연해줄 수 있는 산화방지제로의 사용가능 여부를 판별해 보기위해 본 연구를 실시하였다.
재료 및 방법
고수 종자 에탄올 추출물 제조
모르코산의 고수 종자를 분쇄기를 이용하여 곱게 분쇄하여 시료의 10배에 해당하는 양의 80% 에탄올을 용매로 사용하였다. 그 후 shaker(RS-1, JEIO TECH, Daejeon, Korea)를 사용하여 280 rpm의 속도로 50 분간 실시 후 교반기를 이용하여 4시간 진탕하여 추출하였다. 이 후 여과지(Whatman No.2, Buckinghamshire, England)로 여과하여 40℃ water bath에서 rotary vacuum evaporator(BŰCHI, Zollikofen, Switzerland)를 이용하여 감압농축을 실시하고 동결건조(BFD85-F8, IlshinBiobase, Seoul, Korea)하여 용매를 제거하였다. 고수 종자 에탄올 추출물의 수율은 10.1%였으며, 얻어진 추출물은 -20℃에서 냉동 보관하여 사용하였다.
2,2-Diphenyl-1-picrylhydrazyl(DPPH) 라디칼 소거능 측정
고수 종자 에탄올 추출물의 DPPH 라디칼 소거능은 다음과 같이 측정하였다. 0.1 mM DPPH(Sigma Aldrich Co., St. Louis, MO, USA) 용액이 되도록 메탄올(Daejung, Siheung, Korea)로 제조하여 사용하였다. 제조된 용액 0.75 mL를 각 농도별로 희석한 시료 용액 0.25 mL를 넣어 30분간 암소에서 반응시켜 DPPH 라디칼이 감소하는 정도를 517nm에서 UV-VIS spectrophotometer(Mega-U600, Scinco, Seoul, Korea)를 이용하여 측정하였다(12). 대조군은 메탄올을 이용하여 추출시료용액과 동량 처리하여 같은 과정으로 실시하였다.
Ac : 대조군의 흡광도
As : 시료의 흡광도
2,2’-Azino-bis(3-ethylbenzothiazoline-6-sulphonic acid)(ABTS) 양이온 라디칼 소거능 측정
ABTS 양이온 라디칼 소거능은 7 mM ABTS(Sigma Aldrich Co.)와 2.45 mM potassium persulfate(Sigma Aldrich Co.)를 증류수에 용해하여 1:1(v/v)로 혼합한 용액을 12시간 방치하여 ABTS 양이온 라디칼을 형성하였다. 그 후 734 nm 파장에서 UV-VIS spectrophotometer(Mega-U600, Scinco)을 이용하여 흡광도가 0.700±0.050이 되도록 에탄올을 이용하여 적정농도로 희석하였다. 이를 0.95 mL와 각 농도별로 희석한 시료 0.05 mL를 넣어 암실에서 6분간 반응 시켰다(13). 대조군은 시료용액과 동량의 에탄올을 이용하여 같은 과정을 실시하여 734 nm에서 흡광도를 측정하였다.
Ac : 대조군의 흡광도
As : 시료의 흡광도
Ferric reducing antioxidant power(FRAP) 환원력
300 mM sodium acetate(Sigma Aldrich Co.)을 증류수에 용해시켜 acetic acid(Daejung)로 pH 3.6으로 조정하였다. 10 mM 2,4,6-tripyridyl-S-triazine(Sigma Aldrich Co.)은 40 mM HCl(Daejung)로 용해하였다. 또한 20 mM FeCl3(Sigma Aldrich Co.)은 증류수에 용해하여 사용하였으며, 제조한 각각의 용액을 10:1:1(v/v/v)의 비율로 혼합한 후 37℃에서 15분간 평형시켜 FRAP reagent를 제조하였다. 제조한 용액 0.9 mL와 각 농도별로 희석한 시료 0.03 mL를 넣어 준 후 암실에서 30분간 반응시켰다(14). 그 후 593 nm 파장에서 UV-VIS spectrophotometer(Mega-U600, Scinco)로 흡광도를 측정하였다. FRAP 환원력은 표준물질로 ascorbic acid(Sigma Aldrich Co.)를 이용하여 농도별로 증류수에 녹인 후 검량곡선을 작성하여 정량하였다.
총 페놀함량(total phenolic contents)
Folin-Denis법을 이용하여 고수 종자 에탄올 추출물의 총 페놀함량을 측정하였다. 적정 농도로 희석한 시료 용액 0.05 mL와 증류수 0.8 mL를 섞은 후 Folin-Denis' reagent(Sigma Aldrich Co.) 0.05 mL 를 첨가하여 혼합한 후 5분간 반응 시켜 포화된 sodium carbonate(Sigma Aldrich Co.) 0.1 mL를 첨가하여 30분간 정치하였다(15). 그 후 725 nm 파장에서 UV-VIS spectrophotometer(Mega-U600, Scinco)로 흡광도를 측정하였다. 표준물질로 tannic acid(Sigma Aldrich Co.)를 증류수에 용해하여 각 농도별로 희석하였으며, 이를 가지고 검량곡선을 작성한 후 정량하였다.
oxygen radical absorbance by fluorescein(ORAC) assay
고수 종자 에탄올 추출물을 75 mM 인산완충용액에 일정 농도로 용해하여 시료로 사용하였다. 100 nM fluorescein salt를 시료와 동일한 buffer에 녹여 37℃ 항온수조에서 평형시켜 사용하였으며, peroxy radical을 생성시키는 2,2'-azobis(2-methylpropionamidine) dihychloride(AAPH)는 300 mM이 되도록 동일한 완충용액을 이용하였다. 시료는 50 μL, fluorescein salt는 150 μL, AAPH는 50 μL를 넣은 후 형광물질의 발광정도를 37℃ 온도를 유지하여 493 nm에서 전자가 여기되며, 515 nm 파장에서 방출되게 측정하였다(16). 표준물질로 trolox(Sigma Aldrich Co.)를 75 mM phosphate buffer에 녹여 fluorescence microplate reader (Gemini XPS, Molecular devices, San Jose, CA, USA)에서 측정하였다.
고수 종자 에탄올 추출물 첨가 유지 제조
고수 종자 에탄올 추출물을 소량의 dimethyl sulfoxide (Daejung)에 완전히 녹인 후 옥수수유에 100 ppm이 되도록 첨가하였다. 대조군으로는 동량의 dimethyl sulfoxide가 처리된 옥수수유를 사용하였다. 이를 dry oven(GISICO, Seoul, Korea)에서 3, 6, 9시간 동안 100±5℃의 열로 산화시켰다. 잔열로 산화되는 것을 방지하기 위해 산화된 후에 -20℃에서 보관하며 실험하였다.
Conjugated dienoic acid(CDA)가
산화된 시료 100 mg을 isooctane(Daejung) 25 mL에 분산시켜 흡광도 값이 적정범위로 들어오도록 isooctane을 이용하여 희석하였다(17). 그 후 UV/VIS-spectrometer(Mega-U600, Scinco)로 233 nm파장에서 석영셀을 이용하여 흡광도를 측정하였다.
ρ-Anisidine value(ρ-AV) 법
ρ-AV는 산화된 시료 100 mg을 25 mL의 isooctane (Daejung)에 분산시켜 준비한다. 0.25% ρ-anisidine(Kanto chemical, Tokyo, Japan)이 되도록 acetic acid에 제조하여 시료 1 mL와 제조된 용액 0.2 mL를 넣어 암실에서 15분간 반응시켜(18) UV-VIS spectrophotometer(Mega-U600, Scinco)로 350 nm 파장에서 석영셀을 이용하여 흡광도를 측정하였다.
통계처리
모든 실험은 3반복 실시하여 결과를 얻었으며, 이는 SPSS program(SPSS Inc., Chicago, IL, USA)을 이용하여 평균±표준편차로 나타내었다. 또한, 유의성 검정은 p<0.05 수준에서 t-test 및 one-way ANOVA로 분석하였고, 사후검정은 Duncan’s multiple range test를 이용하였다. 상관관계지수는 피어슨 상관계수(Pearson correlation coefficient)를 이용하여 p<0.05 수준에서 유의성 검정을 실시하였다.
결과 및 고찰
고수 종자 에탄올 추출물의 라디칼 소거능
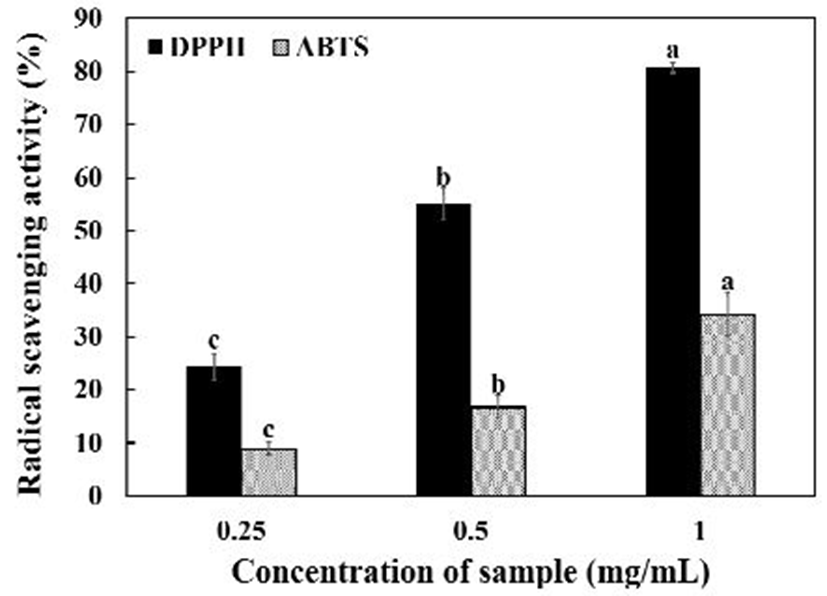
고수 종자 에탄올 추출물을 0.25, 0.5, 1.0 mg/mL의 농도로 제조하여 측정하였다. 그 결과는 Fig. 1과 같다. DPPH 라디칼 소거능은 각각 24.40, 54.97, 80.66%로, ABTS 양이온 라디칼 소거능은 각각 8.89, 16.8, 34.25% 농도 의존적으로 소거능이 증가하였다. Wangensteen 등(19)의 연구에 의하면 고수 잎과 종자의 에탄올 추출물의 DPPH 소거활성을 IC50으로 나타내었을 경우 각각 389, 510 μg/mL로 나타났다고 보고하였다. 이와 비교하여 본 연구를 IC50으로 나타내었을 경우 536.62 μg/mL로 나타나 유사한 결과를 보였다(data not shown). Shahwar 등(20)은 고수 잎과 종자의 메탄올 추출물의 DPPH 소거활성을 살펴본 결과 500 μg/mL 농도에서 각각 72.19, 64.4%의 활성을 보였다고 보고하였다. 이러한 차이는 추출 용매의 차이로 사료된다. Wang 등(21)은 고수 종자 오일을 에탄올에 1 mg/mL 농도로 녹인 시료는 19.7% ABTS 양이온 라디칼소거활성을 보였다고 보고하였다. 이는 오일을 추출한 후 사용하여 에탄올 추출물을 사용한 본 연구와의 차이가 발생한 것으로 사료된다.
Fig. 1.
Radical scavenging activities of coriander seeds ethanol extract.
Different letters are significantly different at p<0.05 among different treatment concentration of each group.
Download Original Figure
고수 종자 에탄올 추출물의 FRAP 환원력 및 총 페놀함량
고수 종자 에탄올 추출물의 FRAP 환원력과 총 페놀함량은 Table 1과 같다. FRAP 환원력의 결과 284.1 μM ascorbic acid equivalent/g extract로 나타났으며, 총 페놀함량은 31.9 μM tannic acid equivalent/g extract로 나타났다.
Table 1.
Contents of total phenolics and FRAP value in coriander seeds ethanol extract
| |
TPC1)
(μM tannic acid equivalent/g extract) |
FRAP2)
(μM ascorbic acid equivalent/g extract) |
| Coriander seeds extract |
31.9±0.2 |
284.1±16.1 |
Download Excel Table
Wangensteen 등(19)의 연구에 의하면 총 페놀함량을 gallic acid equivalents(GAE)로 나타내었을 경우 잎과 종자의 에탄올 추출물은 각각 0.15, 0.36 GAE/100 g extract로 나타났다고 보고하였으며 Farah 등(7) 역시 고수 잎, 종자의 에탄올 추출물을 연구한 결과 각각 0.83, 0.72 g gallic acid equivalent/100 g extract로 나타났다고 보고하였다. 추출용매를 메탄올로 사용한 연구를 비교하여 보면 Shahwar 등(20)의 연구는 표준물질로 ascorbic acid를 이용하여 총 페놀함량을 비교 시 고수 잎과 종자 추출물의 경우 각각 30.25, 29.21 mg/mL로 보고하였으며, 또 다른 연구인 Deepa 등(22)은 고수 종자 추출물의 총 페놀함량은 gallic acid equivalent(mg/g)로 환산하였을 때 1.36 mg/g 로 나타났으며, FRAP 환원력은 ascorbic acid equivalent(mg/g)로 나타내었을 때 7.53 mg/g로 보고하였다. 고수의 잎과 종자에 대한 추출물의 총 페놀함량에 대한 연구는 많이 보고되어 있으며 추출 용매와 동일 용매를 사용하여도 추출된 시간 등의 조건 차이로 결과의 차이가 발생한 것으로 보인다.
고수 종자 에탄올 추출물의 ORAC assay
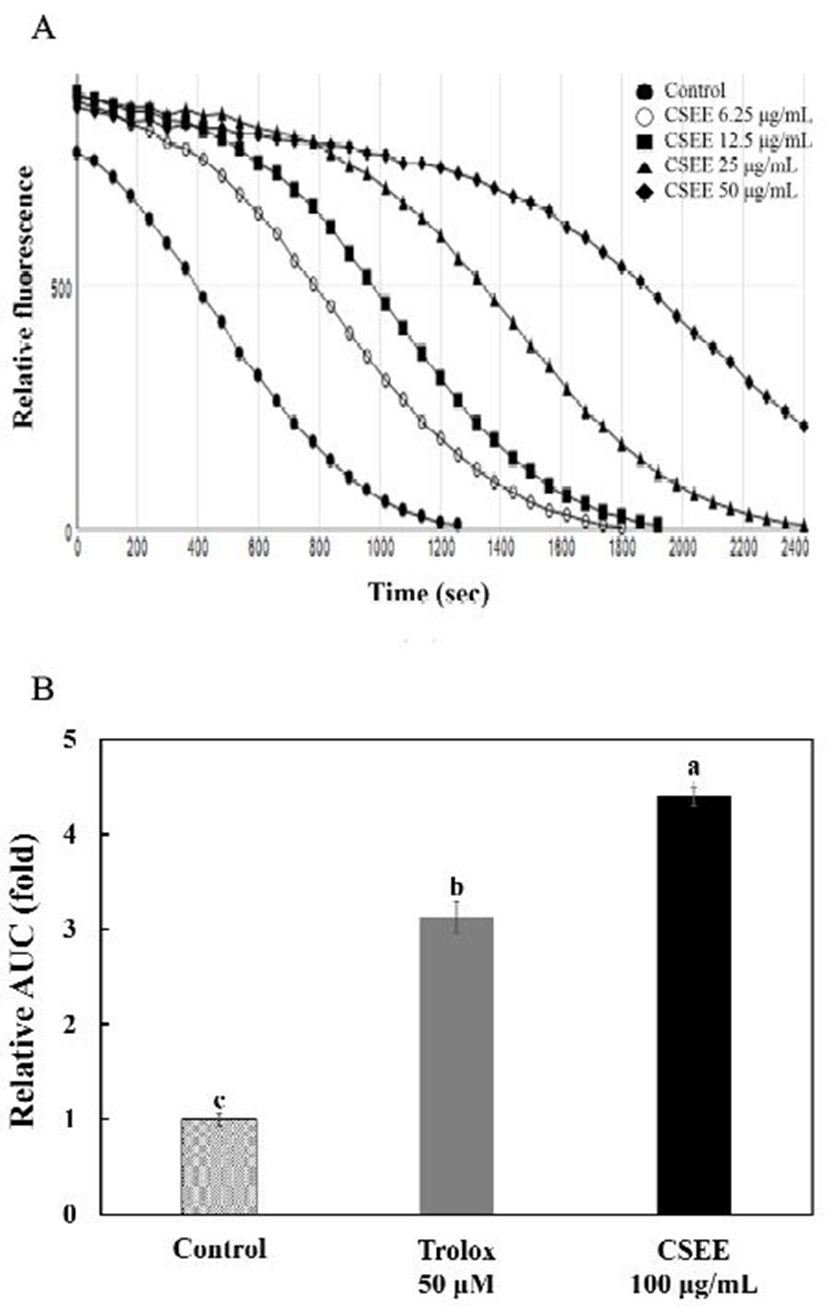
Fig. 2A는 시간에 다른 fluorescein의 감소된 양을 고수 종자 에탄올 추출물 6.25, 12.5, 25, 50 μg/mL의 농도로 희석하여 나타낸 것으로 농도의존적인 경향을 보였다. Fig. 2B는 blank area under the curve(AUC)에 대한 고수 종자 에탄올 추출물의 AUC를 나타낸 것으로 대조군에 비해 trolox 50 μM은 3.12배, 고수 종자 에탄올 추출물은 4.40배 항산화력을 보였다. 또한 trolox를 이용하여 표준곡선을 작성하여 1,135.1±28.5 μM trolox equivalent/g extract으로 나타났다(data not shown). Zheng과 Wang(23)은 베트남 고수를 인산완충용액을 이용하여 추출한 후 ORAC 분석한 결과 22.3 μmol of trolox equivalents/g으로 보고하였다. Karthiga와 Jaganathan는(24) 건조되지 않은 curry leaves에서 ORAC assay 분석 결과 52.5 μmol trolox equivalents/g으로 나타났다고 보고하였다. 본 연구 결과와 비교하면 추출물의 형태로 측정되어 차이가 발생한 것으로 사료된다.
Fig. 2.
Effect of coriander seeds ethanol extract on fluorescein elimination induced by AAPH.
A, Time course of the reaction of fluorescein with AAPH in coriander seeds ethanol extract at different concentration. B, relative area under the curve of control, trolox 50 μM, and coriander seeds ethanol extract 100 μg/mL in ORAC assay.
Values represent the mean±SD (n=3). Mean with different letters above a bar are significantly different at p<0.05.
Download Original Figure
고수 종자 에탄올 추출물의 산화방지법과 총 페놀 함량의 상관관계
고수 종자 에탄올 추출물의 산화방지 측정 및 총 페놀 함량(TPC)의 상관관계를 분석한 결과는 Table 2와 같다. TPC와 DPPH 라디칼 소거능은 r=0.797(p<0.05), ABTS 양이온 라디칼 소거능은 r=0.919(p<0.01), FRAP 환원력은r=0.894(p<0.01)로 모두 유의적인 상관관계를 나타내었다. 본 연구 결과에서 TPC가 증가할수록 산화방지에 효과가 있는 것으로 나타났다. Ramkissoon 등(23)은 TPC와 DPPH의 상관관계를 coriander, turmeric scallion, pepper mint, onion, pasley, ginger, curry leaves를 비교하였을 때 r=0.8로 양의 상관관계를 보였다고 보고하였으며, TPC와 FRAP 환원력을 비교하였을 때는 낮은 상관성을 보였다고 보고하였다. Sreeramulu 등(26)의 연구를 살펴보면 고수 잎 등 일반적으로 소비되는 식물성 식품의 항산화 효과에 대한 연구로 가열 처리하지 않은 시료의 TPC와 DPPH의 상관관계는 r=0.935(p<0.001), TPC와 FRAP 환원력은 r=0.955(p<0.001)로 분석되었다.
Table 2.
Pearson’s correlation coefficient between total flavonoid content and antioxidant assays in coriander seeds ethanol extract
| |
DPPH radical scavenging |
ABTS cation radical scavenging |
FRAP assay |
Total phenolic contents |
| DPPH radical scavenging |
1 |
|
|
|
| ABTS cation radical scavenging |
0.867**1) |
1 |
|
|
| FRAP assay |
0.950** |
0.963** |
1 |
|
| Total phenolic contents |
0.797* |
0.919** |
0.894** |
1 |
Download Excel Table
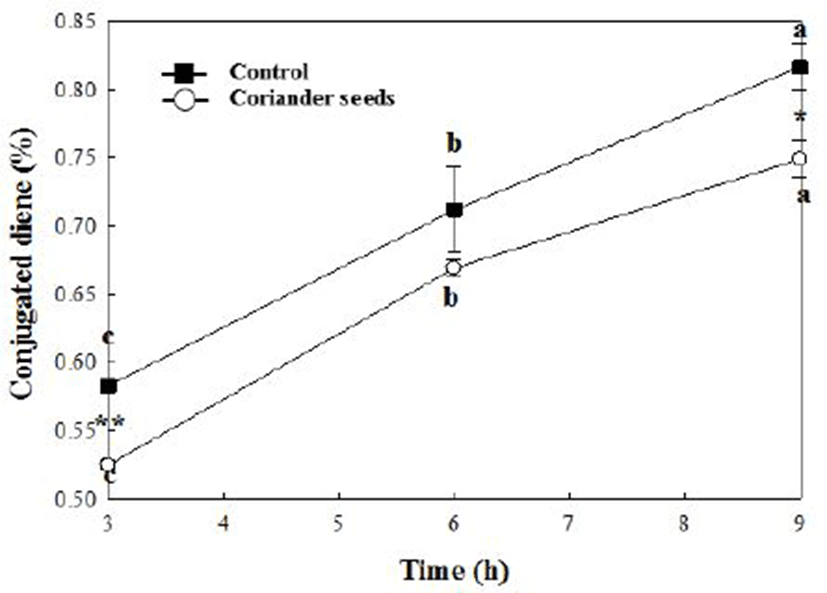
Fig. 3.
Change in conjugated dienoic acid in bulk oil with 100 ppm coriander seeds ethanol extract at 100℃.
Different letters are significantly different among different treatment time of each group at p<0.05 . * and ** are significantly different between control and coriander seeds ethanol extract at p<0.05 and p<0.01, respectively.
Download Original Figure
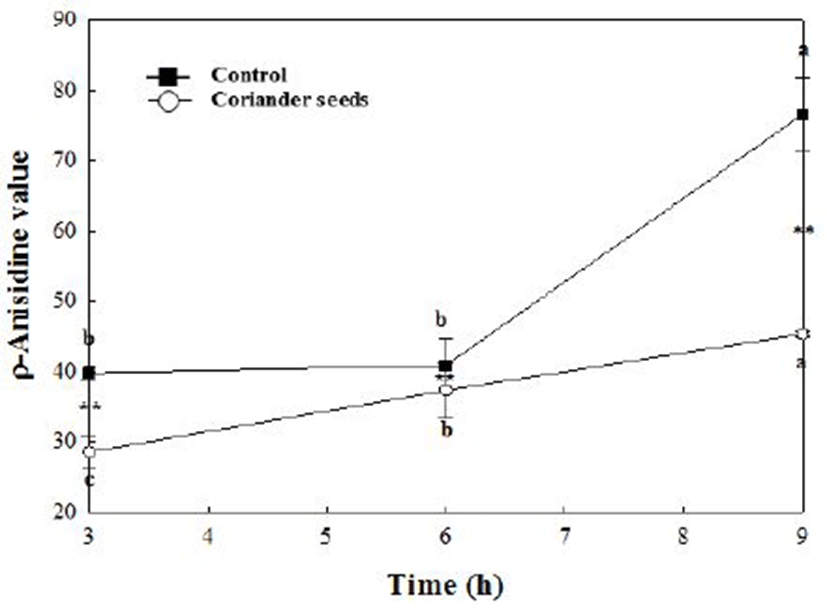
Fig. 4.
Change in ρ-anisidine value in bulk oil with 100 ppm coriander seeds ethanol extract at 100℃.
Different letters are significantly different among different treatment time of each group at p<0.05. * and ** are significantly different between control and coriander seeds ethanol extract at p<0.05 and p<0.01, respectively
Download Original Figure
고수 종자 에탄올 추출물의 CDA 가
100℃에서 3, 6, 9시간 산화시킨 결과 대조군의 경우 각각 0.58, 0.71, 0.82%로 나타났으며, 고수 종자 에탄올 추출물이 100 ppm 농도로 첨가된 시료군의 경우 각각 0.53, 0.67, 0.75%로 나타났다. 9시간 CDA의 양은 대조군에 비해 시료군은 8.27% 감소하여 생성되었다. Mohamed 등(27)은 고수 종자 오일을 추출하여 옥수수유와 1:9, 2:8(w/w)로 혼합 후 60℃에서 0, 5, 10, 15일간 산화시킨 결과 대조군에 비해 유의적으로 고수 종자 오일의 양이 많을수록 산화생성물의 양이 적었다. 고수 종자에서 오일을 추출하여 포함한 경우 더 우수한 산화안정성을 갖는 것으로 보인다.
고수 종자 에탄올 추출물의 ρ-AV 가
100℃에서 3, 6, 9시간 산화시킨 결과 대조군의 경우 각각 39.78, 40.85, 76.55로 나타났으며, 100 ppm 농도로 첨가된 시료군의 경우 각각 28.52, 37.0, 45.30으로 나타났다. 9시간 산화된 생성물의 양은 대조군에 비해 시료군은 40.82% 감소하여 생성되었다. Farah 등(10)은 고수 종자 메탄올 추출물을 100 ppm 농도로 첨가한 유지를 60℃에서 7일간 산화시킨 결과, 대조군은 41.09, BHT를 첨가시킨 군은 25.08, 고수 추출물을 첨가한 군은 33.06으로 나타났다고 보고하였다. 대조군에 비해 고수 추출물 첨가군이 19.54% 생성을 감소시켜 본 연구와의 차이가 나지만 온도와 시간 등의 조건차이로 사료된다. 하지만 대조군에 비해 산화생성물의 양은 감소시켜 산화안정성에 긍정적인 영향을 주는 것으로 판단된다.
요 약
본 연구는 고수 종자 에탄올 추출물이 산화방지 및 bulk oil에서 산화안정성에 효과가 있는지 확인하고자 하였다. 산화방지 효과를 확인하기 위해 DPPH 라디칼 소거능, ABTS 양이온 라디칼 소거능, FRAP 환원력, 총 페놀함량을 확인하였다. DPPH 라디칼 소거능의 결과 0.25, 0.5, 1.0 mg/mL의 농도에서 24.4, 55.0, 80.7%, ABTS 양이온 라디칼 소거능은 8.9, 16.8, 34.3%로 농도 의존적으로 유의적이게 증가하였다. FRAP 환원력과 총 페놀함량은 각각 표준물질을 사용하여 검량곡선으로 정량한 결과 각각 284.1 μM ascorbic acid equivalent/g extract, 31.9 μM tannic acid equivalent/g extract로 나타났다. 또한, ORAC assay의 결과 대조군과 비교하였을 때 표준물질 trolox 50 μM 농도는 3.12배, 고수 종자 에탄올 추출물은 4.40배 항산화력을 보였으며, 이는 고수 종자 에탄올 추출물이 농도 의존적으로 우수한 항산화 효과를 나타내는 결과를 보였다. 유지 산화안정성을 살펴보기 위해 고수 종자 에탄올 추출물을 100 ppm 첨가한 시료를 100℃에서 3, 6, 9시간 산화시킨 결과, CDA는 대조군의 경우 각각 0.58, 0.71, 0.82%, 시료군은 0.53, 0.67, 0.75%로 나타났다. ρ-AV는 대조군의 경우 각각 39.78, 40.85, 76.55로 나타났으며, 시료군은 28.52, 37.0, 45.30로 나타났다. 9시간 산화시킨 결과에서 CDA와 ρ-AV는 유의적으로 각각 8.27, 40.82% 생성물이 감소하였다. 따라서 고수 종자 에탄올 추출물은 산화방지 및 bulk oil에서 산화안정성에 효과를 확인함으로써 식품 산업에서 식품 저장기간을 향상시킬 수 있는 천연 소재의 산화방지제로서 사용가능할 것으로 사료된다.
Acknowledgements
본 연구는 2015년도 강원대학교 대학회계 학술연구조성비로 수행되었다.
References
SeogHM, SeoMS, KimHM, AhnMS, LeeYT. 2002; Antioxidative activity of barley polyphenol extract (BPE) separated from pearling by-products. Korean J Food Sci Technol. 34:889-892.

ChenC, PearsonAM, GrayJI. 1992; Effects of synthetic antioxidants (BHA, BHT and PG) on the mutagenicity of IQ-like compounds. Food Chem. 43:177-183


Kang WS, Kim JH, Park EJ, Yoon KR (1998) Antioxidative property of turmeric (Curcumae Rhizoma) ethanol extract. Korean J Food Sci Technol, 30, 266-271
KangWS, KimJH, ParkEJ, YoonKR. 1998; Antioxidative property of turmeric (
Curcumae Rhizoma) ethanol extract. Korean J Food Sci Technol. 30:266-271.

ChoiYM, KimMH, ShinJM, ParkJM, LeeJS. 2003; The antioxidant activities of the some commercial teas. J Korean Soc Food Sci Nutr. 32:723-727.

Maroufi K, Farahani HA, Darvishi HH (2010) Importance of coriander (Coriandrum sativum L.) between the medicinal and aromatic plants. Adv Environ Biol, 4, 433-436
MaroufiK, FarahaniHA, DarvishiHH. 2010; Importance of coriander (
Coriandrum sativum L.) between the medicinal and aromatic plants. Adv Environ Biol. 4:433-436.

Kim KJ, Choi OJ, Kim YD, Kang SK, Hwang GH (2001) A Study on the flavor constituents of the coriander (Coriandrum sativum L). Koean J Soc Food Sci, 17, 80-90
KimKJ, ChoiOJ, KimYD, KangSK, HwangGH. 2001; A Study on the flavor constituents of the coriander (
Coriandrum sativum L). Koean J Soc Food Sci. 17:80-90.

WojdyloA, OszmianskiJ, CzemerysR. 2007; Antioxidant activity and phenolic compounds in 32 selected herbs. Food Chem. 105:940-949


DelaquisPJ, StanichK, GirardB, MazzaG. 2002; Antimicrobial activity of individual and mixed fractions of dill, cilantro, coriander and eucalyptus essential oils. Int J Food Microbiol. 74:101-109


Silva F, Ferreira S, Queiroz JA, Domingues FC (2011) Coriander (Coriandrum sativum L.) essential oil: its antibacterial activity and mode of action evaluated by flow cytometry. J Med Microbiol, 60, 1479-1486
SilvaF, FerreiraS, QueirozJA, DominguesFC. 2011; Coriander (
Coriandrum sativum L.) essential oil: its antibacterial activity and mode of action evaluated by flow cytometry. J Med Microbiol. 60:1479-1486


Farah H, Elbadrawy E, Al-Atoom AA (2015) Evaluation of antioxidant and antimicrobial activities of ethanolic extracts of parsley (Petroselinum erispum) and coriander (Coriandrum sativum) plants grown in saudi arabia. Int J Adv Res, 3, 1244-1255
FarahH, ElbadrawyE, Al-AtoomAA. 2015; Evaluation of antioxidant and antimicrobial activities of ethanolic extracts of parsley (Petroselinum erispum) and coriander (
Coriandrum sativum) plants grown in saudi arabia. Int J Adv Res. 3:1244-1255.

Burdock GA, Carabin IG (2009) Safety assessment of coriander (Coriandrum sativum L.) essential oil as a food ingredient. Food Chem Toxicol, 47, 22-34
BurdockGA, CarabinIG. 2009; Safety assessment of coriander (
Coriandrum sativum L.) essential oil as a food ingredient. Food Chem Toxicol. 47:22-34


BloisMS. 1958; Antioxidant determinations by the use of a stable free radical. Nature. 181:1199-1200


FellegriniN, KeR, YangM, Rice-EvansC. 1999; Screening of dietary carotenoids and carotenoid-rich fruit extracts for antioxidant activities applying 2, 2’-azinobis (3-ethylenebenzothiazoline-6-sulfonic acid radical cation decolorization assay. Methods Enzymol. 299:379-389.

BenzieIFF, StrainJJ. 1996; The ferric reducing ability of plasma (FRAP) as a measure of “antioxidant power”: The FRAP assay. Anal Biochem. 239:70-76


FolinO, DenisW. 1912; On phosphotungstic-phosphomolybdic compounds as color reagents. J Biol Chem. 12:239-243.

OuB, Hampsch-WoodillM, PriorRL. 2001; Development and validation of an improved oxygen radical absorbance capacity assay using fluorescein as the fluorescent probe. J Agric Food Chem. 49:4619-4626


AOCS (1980) Official and Tentative Methods of the AOCS. 3rd ed, American Oil Chemists’ Society press, Champaign, IL, USA, Method Cd 18-90
AOCS 1980 Official and Tentative Methods of the AOCS. 3rd edAmerican Oil Chemists’ Society press. Champaign, IL, USA: Method Cd 18-90.

AOCS (1990) Official and tentative Methods of the AOCS. 4th ed, American Oil Chemists’ Society press, Champaign, IL, USA, Method Ti la-64
AOCS 1990 Official and tentative Methods of the AOCS. 4th edAmerican Oil Chemists’ Society press. Champaign, IL, USA: Method Ti la-64.

WangensteenH, SamuelsenAB, MalterudKE. 2004; Antioxidant activity in extracts from coriander. Food Chem. 88:293-297


Shahwar MK, El-Ghorab AH, Anjum FM, Butt MS, Hussain S, Nadeem M (2012) Characterization of coriander (Coriandrum sativum L.) seeds and leaves: volatile and non volatile extracts. Int J Food Prop, 15, 736-747
ShahwarMK, El-GhorabAH, AnjumFM, ButtMS, HussainS, NadeemM. 2012; Characterization of coriander (
Coriandrum sativum L.) seeds and leaves: volatile and non volatile extracts. Int J Food Prop. 15:736-747


WangHF, YihKH, HuangKF. 2010; Comparative study of the antioxidant activity of forty-five commonly used essential oils and their potential active components. J Food Drug Anal. 18:24-33.

DeepaG, AyeshaS, NishthaK, ThankamaniM. 2013; Comparative evaluation of various total antioxidant capacity assays applied to phytochemical compounds of Indian culinary spices. Int Food Res J. 20:1711-1716.

ZhengW, WangSY. 2001; Antioxidant activity and phenolic compounds in selected herbs. J Agric Food Chem. 49:5165-5170


KarthigaS, JaganathanD. 2018; Effect of processing on the total antioxidant capacity and total phenol content of Indian green leafy vegetables. Asian J Multidimens Res. 7:150-155.

RamkissoonJS, MahomoodallyMF, AhmedN, SubrattyAH. 2013; Antioxidant and anti-glycation activities correlates with phenolic composition of tropical medicinal herbs. Asian Pac J Trop Med. 6:561-569


SreeramuluD, ReddyCVK, ChauhanA, BalakrishnaN, RaghunathM. 2013; Natural antioxidant activity of commonly consumed plant foods in India: effect of domestic processing. Oxid Med and Cell Longevity. 2013:1-12


MohamedKM, ElsanhotyRM, HassanienMF. 2014; Improving thermal stability of high linoleic corn oil by blending with black cumin and coriander oils. Int J Food Prop. 17:500-510