서론
시리얼 곡물은 상업적으로 식품에 사용하는 중요한 곡물중 하나로서, 수많은 식품에서 영양뿐만 아니라 기능적 역할을 한다(1). 시리얼 곡물의 주요 단백질인 글루텐은 전체 종자단백질의 75-85%를 차지하고, prolamins과 glutelins의 단백질 복합체이다. 글루텐은 밀, 호밀, 보리, 귀리, 옥수수와 같은 일부 곡물의 내피 속 전분과 결합 된 것들이 존재하는데, 물에 녹지 않기 때문에 밀 씨앗의 전분을 씻어 내면 정제할 수 있고, 반죽형성에서 유변학적 성질을 부여하는 역할을 한다(2).
글루텐 함유 식품 섭취 후 celiac diease(CD)에 걸리기 쉬운 사람에 경우 소장 점막에 면역 독성을 띠는 펩타이드가 될수 있는데, 밀, 보리 및 호밀의 prolamins과 glutelins 분획은 강력한 체액성 및 세포성 면역 반응을 일으킬 수 있는 풍부한 아미노산 결정기를 가지고 있다(3). 특히, 이들 펩타이드 모티프 및 탈아미노화된 유사체는 HLA markers에 선택적으로 유전적인 감수성이 높은 사람들에게서 CD 의 특징을 나타내는 T 세포 반응을 유도한다. CD는 전 세계 인구의 약 1%에 영향을 미치고 있으며, 최근 몇 년 동안 뚜렷하고 지속적인 발병율을 보인다(4-6).
글리아딘은 α/β-, γ-, ω2- 및 ω5- 아형으로 분류되는 단량체 단백질이며, 글루텐은 저분자 및 고분자량 글루테닌 subunits(LMW-GS 및 HMW-GS)으로 분류되는 고분자 단백질이다(7). 알파 글리아딘(α-gliadin)의 일부분은 장세포(enterocytes)를 자극하여 더 큰 분자가 세포 사이의 실란트 주변을 통과하도록 한다. 이러한 tight junctions의 붕괴는 세 개로 구성된 아미노산보다 큰 펩타이드가 혈액으로 유입 및 순환 가능하게 한다. 글리아딘 중에서 길이가 33개 아미노산인 α2-gliadin 단편들이 흡수되는데, 일단 장벽이 33-mer 펩타이드를 흡수하면, 복강 내 스프루 환자의 항원 제시 세포가 다른 백혈구에 신호를 보내 공격하고, 그 결과 장벽에 흡수된 세포와 융모가 파괴되어 CD를 일으키게 된다. 이로 인한 심한 체강 질병은 창백하고, 느슨하고 기름기가 많은 대변(steatorrhoea), 어린 아이들에게서 나타나는 체중 감소 또는 체중 증가 어려움 등의 특징적인 증상을 유발하며, 소장에서의 염증, 전반적인 흡수불량을 증상으로 한다(8,9).
CD가 글루텐을 섭취한 결과 나타나는 것처럼, 이 질병 관리는 엄격한 식이를 회피에 초점을 맞춰져 있다(10). 글루텐 프리 제품은 가공 중에 미량성분이나 교차 오염을 통한 글루텐 오염 가능성 때문에 실제로 글루텐 없는 식품(gluten-free foods)은 엄격하게 확인하고 찾기가 쉽지 않다. 이러한 우려를 해결하기 위해 규제 당국은 “글루텐 프리(gluten-free)”라고 표시된 식품의 글루텐 함량에 대해 허용 가능한 임계치 수준을 제시하였다. Codex alimentarius는 CD 환자에게 안전한 음식으로 글루텐 20 mg/kg의 기준치를 정하고 있다(11). 이 기준치를 “gluten-free”라고 인정한다. 최근 VITAL Scientific Expert Panel은 밀 단백질에 1 mg의 용량으로 밀 알레르기 환자의 95%에서 증상이 나타나지 않는다는 사실을 입증하여 20 mg/kg 기준치가 밀 알레르기 환자에게도 적합하다는 것을 시사하고 있다(12).
현재 국내에서 식품공전상에 gluten을 측정하는 방법은 등록되어 있지 않다. 아직까지 국내에서 gluten을 측정하여 사회적으로 문제가 되지 않기 때문이지만 향후 국외로 gluten-free 식품을 수출하기 위해서는 측정법과 교차오염에서 오는 미세한 함량까지 측정이 되어야 할 것으로 본다. gluten을 측정하는 방법으로는 크게 2가지의 방법으로 나누어 지는데 강력, 중력, 박력과 같이 gluten의 함량이 많은 경우 사용되는 방법(13)과 CD에 기준이 되는 20 mg/kg를 측정할 수 있는 방법으로 나누어진다. 미량 측정법으로는 글루텐에 존재하는 펩타이드 서열에 특이적인 면역적 진단법의 사용을 통해 이루어진다. 글루텐 검출의 현재 표준은 밀, 보리, 호밀에 함유하고 있는 프롤린 분획에 존재하는 에피토프 QQPFP, QQQFP, LQPFP 및 QLPFP를 인식하는 R5 monoclonal antibody(mAb)의 사용에 기초한다(14,15). 이들 결합 부위에서 글루타민(Q) 잔기의 존재는 항원 결정기가 탈아미드화에 어렵게 만든다. 사실, 글루타민이 그 유도체인 글루탐산으로 전환되면 항체-항원 상호 작용에 관련된 정전기적 및 공간적 보완이 영향을 받으며 글루텐의 물리 화학적 성질이 크게 달라진다. 이들 항원결정기에서 탈 아미드화의 효과는 매우 중요한데, R5 mAb는 산업용 글루텐에 대한 친화도 및 상업용 R5 기반 competitive ELISAs(16,17)를 이용한 분석에 근거한 키트 표준을 기준으로 산업 및 실험실에서 만들어진 탈 아미드 글루텐에 대한 친화도가 ≥125배 감소한 것으로 나타났다. 이러한 시그니처 R5 에피토프의 항원성을 결정하는데 있어서 글루타민의 중요성을 강조했다.
본 연구에 목적은 국내에는 아직 규정이 없는 gluten-free 시험법에 대하여 고함유 glutens 함량에서는 wet-gluten 측정법을 사용하였고, 미량측정 시 AOAC 및 또는 해외의 규제 당국에서 인정되고 있는 방법 중에 gluten allergen ELISA 방법 중 선택, 그 유효성 확인하고자 한다. 향후 gluten-free식품이나 소재의 국제적인 유통에 대비, 수출의 경우 발생가능한 gluten-free 식품의 인증요구에 효과적인 대응방법이 될 자료로 제공하고자 한다.
재료 및 방법
Gluten-free 측정을 위하여 밀가루 반죽을 제조하였는데 밀가루는 강력분(큐원 고급면용 밀가루, Samyang Co., Seoul, Korea)을 사용하여 밀가루 반죽을 제조하였고 여기에 상용화된 효소 Protamex®(EC 3.4.24.28)를 첨가, 분해반응을 실시 이를 분해도의 정확성을 검정하는데 사용하였다. Gluten형성을 위한 기본조성은 밀가루 600 g에 물 390 g을 넣고 여기에 효소를 넣어 섞어준 다음 믹싱기(KM-800, Kenwood, UK)를 이용하여 10분간 믹싱하여 이를 기본시료로 사용하였다.
gluten 분해물을 얻기 위해서 상용화된 효소를 이용하여 분해하였다. 사용한 효소로는 Protamex®(EC 3.4.24.28, from Bacillus subtilis)(Novozymes, Copenhagen, Denmark)를 사용하여 gluten 분해를 실시하였고, 효소의 특징을 보면 Protamex®는 pH 5-11에서 활성이 있고, pH 8에서 최적의 활성을 보였으나, 단백질 안정화를 위하여 최적 pH는 7.0으로 선정하였다. pH 5.5-7.5에서 잘 작동하며, 35-60℃에서 95%의 활성을 유지하며, 85℃, 10분처리에 불활성화된다. Protamex®는 효소 제제의 단백질 분해 활성은 Anson(18)에 따라 결정되었다. Protamex®를 이용하여 gluten 분해실험은 밀가루 600 g에 설탕 30 g, 물(tap water) 390 mL를 넣고서 여기에 위의 효소를 0, 0.1, 0.2, 0.3%를 넣고서 중간 중간 저어 주면서 pH 7, 40℃ 반응시켰고, 반응시간은 0, 1, 2, 3, 4시간으로 반응시켰으며 반응 후 90℃에서 15분간의 열처리를 통해 효소의 반응을 중지시켰고, 반응된 시료를 건조시켜 시료로 사용하였다. 분해된 시료의 점도측정은 Brookfield-viscometer(DV2T, Brookfield Engineering, USA)를 사용하여 spindle No.4, speed 12 rpm 조건으로 3분간씩 3반복 측정하였다.
Gluten 고함량에 대한 gluten degradation측정에서 Glutomatic을 이용한 wet-gluten 측정과 수작업을 통한 dry-gluten 측정법을 수행하였다. 두 가지의 gluten 측정방법은 AACC Method 38-10 방법에 기초하고 있는데 glutomatic방법은 wet-gluten을 측정하는 방법이고 이를 항량이 되도록 건조하여 건조무게를 비교하는 것은 dry-gluten측정방법이다.(13)
AgraQuant® 글루텐 G12 분석법은 샌드위치 효소 결합 면역 흡착 분석법(ELISA)이다. 이 단일 클론 항체는 33개 아미노산으로 구성되어 있는 글루텐 면역 독성의 주요 유발하는 α-2-gliadin fraction으로부터 생성된다. 33-mer는 효소 분해에 매우 저항성이 강하며 분석 마커로 적합하다. G12 항체는 복강 내 환자에서 자가면역반응을 유발하는 글루텐의 독성 펩타이드를 표적으로 하므로 식품 안전성에 보다 적합하다(19). 글루텐의 독성 분획물에 대한 단일클론 G12 항체는 마이크로 웰(micro well) 표면에 미리 코팅되어 있는데, 추출된 샘플을 웰에 넣어 글루텐은 항체에 결합하게 한다. 세척 단계 후, 글루텐 G12 단백질에 특이적인 효소 결합 모노클로날 항체를 웰에 가하고 반응시킨다.
시험방법은 최소 sample 5 g을 균질화시키고, 0.25 g sample/2.5 mL extraction solution을 넣어 다시 균질화시켰다. 그리고 50℃에서 40분간 자주 섞어주어 추출한다. 그리고, 80% ethanol 7.5 mL을 넣고 혼합, 상온에서 60분간 교반시킨 후, 2,000 ×g에서 10분간 원심분리하여 상등액만을 얻는다. 얻은 상등액은 dilution buffer에 1/10 비율로 희석하여 분석에 사용한다. 분석방법으로는 microwell 준비하고 각 well에 standard와 sample을 100 μL씩 첨가하여 상온에서 20분간 반응시킨다. 그리고 세척용액을 이용하여 이를 5-6회 반복 세척한 후 종이 towel을 이용, 바닥의 물이 완전히 제거한 후, 각 well에 conjugate solution 100 μL씩 첨가하여 상온에서 20분간 반응시킨 다음, 5-6회정도 세척한다. 그리고 평면에 종이 towel을 깐 후, 바닥의 물이 완전히 제거 한 다음, 각 well에 substrate solution 100 μL씩 첨가, 암실에서 상온, 20분간 반응시키고, 각 well에 stop solution 100 μL씩 첨가 시켜 색이 blue에서 yellow로 전환되어지는데 이를 450 nm 흡광도 측정한다.
음식 재료, 식품 등의 낮은 수준의 gluten의 정량 분석에 적합한 방법으로 Skerrit과 Hill은 The Association of Analytical Communities(AOAC)의 공식 방법으로 승인된 샌드위치 형식을 개발했으며 이 방법은 열 안정성이 있는 wheat-gliadin 분획을 인식하는 항체를 기반으로 한다(20,21). 이것은 식품 열처리 과정에 영향을 받지 않기 때문에 이점이 있다. 그러나 이 방법의 단점은 gluten이 들어 있는 다른 곡류 중에 wheat-분획의 함량 값이 달라질 수 있는 곡물의 단백질 조성에 따라 영향을 받고 있어 단백질 구성의 변화가 분석 결과에 영향을 준다. 또 다른 단점으로는 보리 호르딘에 대한 반응이 약한 점도 가지고 있다. 이 방법은 일반적으로 사용되지 않으나 여전히 쉽게 사용되어지는 방법이다(21). 시료의 준비는 sample을 균일하게 분쇄한 다음에 희석액은 1/10 희석 한 다음, 완전히 섞일 때까지 충분히 섞어주면서 추출한다. 2,000 ×g에서 10분이나 또는 30분 침전으로 분리로 상등액을 얻는다. 이 액을 1/20 비율로 희석시켜 시료를 만든다. ELISA 측정방법은 각 well에 diluted sample/control extracts & standards 100 μL 넣은 다음, 20분간 상온에서 반응을 시키고, 3회 wash solution으로 세척한다. 여기에 각 well에 anti-gliadin HRP 100 μL 넣고, 다시 20분간 상온에서 반응시킨 다음, 4회정도 wash solution으로 세척한다. 그리고 각 well에 3,3’,5,5’- tetramethylbenzidine (TMB) substrate 100 μL 넣고 20분간 상온반응 후 각 well에 acid stop solution 100 μL 넣어 반응을 종료시키고 450 nm에서 측정한다.
Gluten 결과(mg/kg(PPM))=controls/samples
Enzyme-linked Immunoassay R5 Mendez Method(22)를 대표적인 방법으로 ELISA방법이 사용되고 있는데 현재 gluten 함량 20 mg/kg을 확인하기 위하여 사용하고 있으며 on-off방식과 함량을 정량으로 측정하는 방법이 사용되고 있다. 이 Wheat ELISA kit의 특징은 gliadin을 antigen으로 하며 wheat gluten을 검출하는데 사용하고 있다. 측정방법에는 시료 1 g에 시료추출용액 19 mL를 넣고 30초간 혼합한 다음, 100℃에서 10분간 정치 후 강하게 혼합한 다음, NaOH로 pH 6-8로 조정한다. 조정한 반응액을 3,000 ×g에서 20-30℃를 유지하면서 10분간 원심분리를 실시하여 분석할 상등액을 얻는다. 얻어진 상등액을 표준 gluten 용액과 함께 ELISA kit에 나눈 다음, 20-25℃에서 1시간 동안 반응을 시키고, buffer로 충분히(6회) 세척한다. 물기가 제거된 kit에 antibody가 결합된 효소를 각 well에 분주하여 20-25℃에서 30분 동안 2차 반응을 시킨 후 반응된 효소액을 6회 buffer로 세척 후 물기를 충분히 제거한다. 효소기질을 각기의 well에 분주하여 항체와 결합된 부착되어 있는 효소와 반응하게 하는 20-25℃에서 30분 정도 반응을 이뤄지도록 하고 이때 암실에서 반응이 실행되어진다. 그리고 반응 후 stop 용액을 첨가하여 반응을 종료하고 반응의 확인은 400 nm에서 실시되었다. ELISA 시험 manual에 따라 실시하였으며, 본 방법은 정성적인 sandwich ELISA 측정방법이며 표준 측정범위로는 0.26-17 ppm Gluten, 0.31-20 ppm Wheat이고, 고범위 측정으로는 1.25-80 ppm Gluten, 1.05-68 ppm Wheat이다(23).
Gluten의 가열/비가열시 gluten함량측정에 차이 유무를 확인하기 위하여 GLUTEN-CHECKTM ELISA kit을 이용하였고, 상용밀가루를 이용하여 앞서의 시험방법에 따라 gluten이 형성되는 밀가루 반죽을 제조하였고 여기에 단백질 분해효소 Protamex® 0.3%를 처리, 시간에 따라 gluten이 분해되도록 처리한 다음 반죽을 비이커에 넣고 호일로 충분히 덥고 이를 autoclave(121℃, 25분)처리하여 가열처리하여 가열처리된 gluten을 얻어 시료로 사용하였다.
결과 및 고찰
강력분 밀가루를 실측용 시료로 하여 gluten을 산업용 효소 Protamex®를 처리, 이를 gluten 분해도 측정용 시료로 사용하였는데 사용하기에 앞서 강력분 밀가루의 gluten함량은 AACC Method 38-10 방법에 기초한 wet-gluten측정법을 측정하였다. 이 방법은 밀가루에서 수분을 사용, gluten을 형성시키고 내부에 존재하는 탄수화물을 충분히 제거하여 항량이 되도록 건조시켜 측정하는 방법으로 gluten이 형성되어 물성변화를 일으키는 많은 gluten이 함유하고 있는 곡물에서 측정에 적합하고 본 연구의 기초 시료가 되는 강력분의 gluten의 함량이 13.2 g/100 g으로 나타났다.
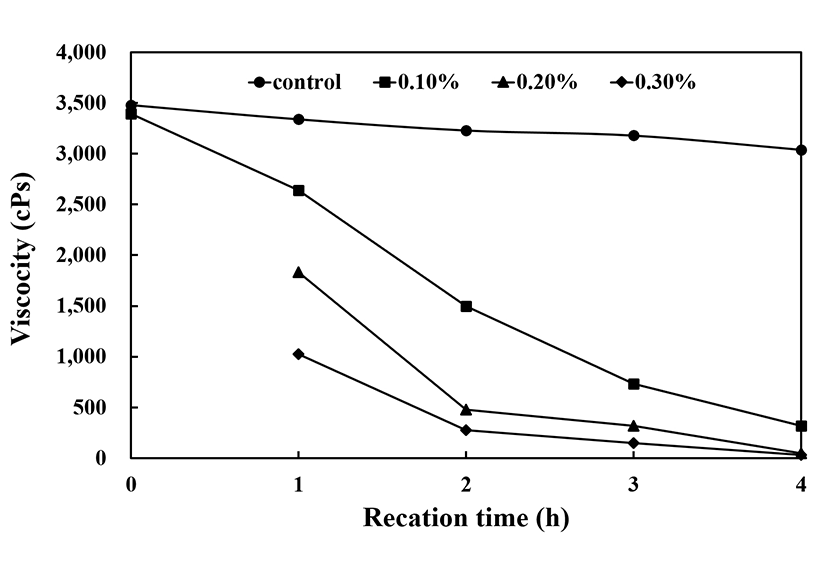
Gluten분해를 실시하기 위하여 상용화된 효소 Protamex®를 첨가 밀가루 반죽으로부터 분해를 실시하였다. Gluten분해물에 대한 측정은 gluten 함량이 소재에 많이 함유하고 있을 때 측정하는 방법인 wet-gluten측정법을 이용하여 측정하고자 하였으나 분해가 이뤄지면서 gluten의 형성력이 급격히 떨어져 glten을 형성하지 못하였다. 이에 gluten분해를 간접 측정할 수 있는 점도변화로서 분해되어감을 확인할 수 있는 측정법을 선택하였다. 분해된 시료의 점도 측정은 점도계를 이용하여 spindle No.4, speed 12 rpm 조건으로 3분간씩 3반복 측정하였다. 또한 초기값은 측정하기에 부적합한 점도를 보여 1/20 배수의 희석을 통한 점도로서 보정하여 측정하였고 분해반응 1시간 이후부터 측정하였다. Fig. 1에서 보는 바와 같이 gluten에 Protamex®처리농도와 시간에 따라 점도가 변화하는 것을 확인하였다. 효소처리가 이뤄지지 않은 control group은 시작점에서 3,456 cps에서 효소처리군과 함께 4시간 처리에서도 3,140.1 cps로 크게 변화가 없었던 반면 0.1% Protamex®를 처리군에서는 처리 1시간 후 2,623.9 cps에서 4시간 처리에서는 240.3 cps로 급격하게 떨어졌고, 0.3% Protamex® 처리군에서는 더 급격히 떨어져 4시간 효소처리에서는 32.2 cps까지 떨어졌다. 이후의 시험에서는 시간과 관계없어 큰 변화가 있지는 않았는데 이는 분해된 탄수화물소재와 미분해물질들의 영향으로 점도에 변화가 없을 것으로 판단된다. 본 점도로 gluten의 분해도를 알아보는 과정에 팔서 wet-gluten측정을 시도하였다. 그러나 효소처리농도와 반응시간에 크게 영향이 없이 gluten 형성능에 이상현상을 보였다. gluten 형성능이 급격히 떨어지는 것은 작용하는 효소보다는 gluten을 형성하는 단백질의 구성이 변함에 따라 물성의 변화가 크게 나타나는 것으로 보여 점도를 이용한 gluten의 분해가 간접적으로 확인하였고 이에 따라 1차로 분해된 gluten의 시료를 얻었다.
gluten-free를 이루기 위하여 다양한 방법의 처리법들을 활용하였는데 크게 효소와 유산균, 그리고 이를 혼합하여 이용하는 방법을 사용하였다. Dariusz Stepniak 등은 Aspergillus niger prolyl endoprotease(AN-PEP)가 4-5 pH 최적활성이고 위에서 작용에 필요한 pH 2에서도 안정적이며, 최종 펩신으로 완전히 소화되며, 또한, Aspergillus niger 유래 효소는 완전한 글루텐 분자뿐만 아니라 시험한 모든 T 세포 자극 펩티드를 효과적으로 분해하며, 평균적으로 A. niger endoprotease는 prolyl oligopeptidase보다 60배 빠른 글루텐 펩타이드를 분해한다고 발표하였다(24). AN-PEP는 어떤 글루텐도 십이지장 부분에 거의 도달하지 못하게 위장 내 글루텐의 분해를 촉진시켰다. AN-PEP를 이용하여 장관모델에서 효율성을 시험하였는데 이 효소는 생체 내 소화와 유사하게 위장 시스템에서 글루텐의 분해를 촉진하였고, 글루텐 식사와 AN-PEP의 동시 투여가 글루텐을 분해 독성을 제거하여 celiac 환자에게 gluten-free 식이를 하지 않아도 될 가능성이 있다고 발표하였다(25). 유산균과 곰팡이 프로테아제와 함께 사용하여 gluten을 20 ppm 이하로 감소시켰는데, 면역원성 에피토프의 생성없이 α-2 glidin 단백질의 33-mer 펩타이드를 분해하기 위한 14시간 반응 후, 완전히 가수 분해하여 유리 아미노산화하였다고 보고하였다(26).
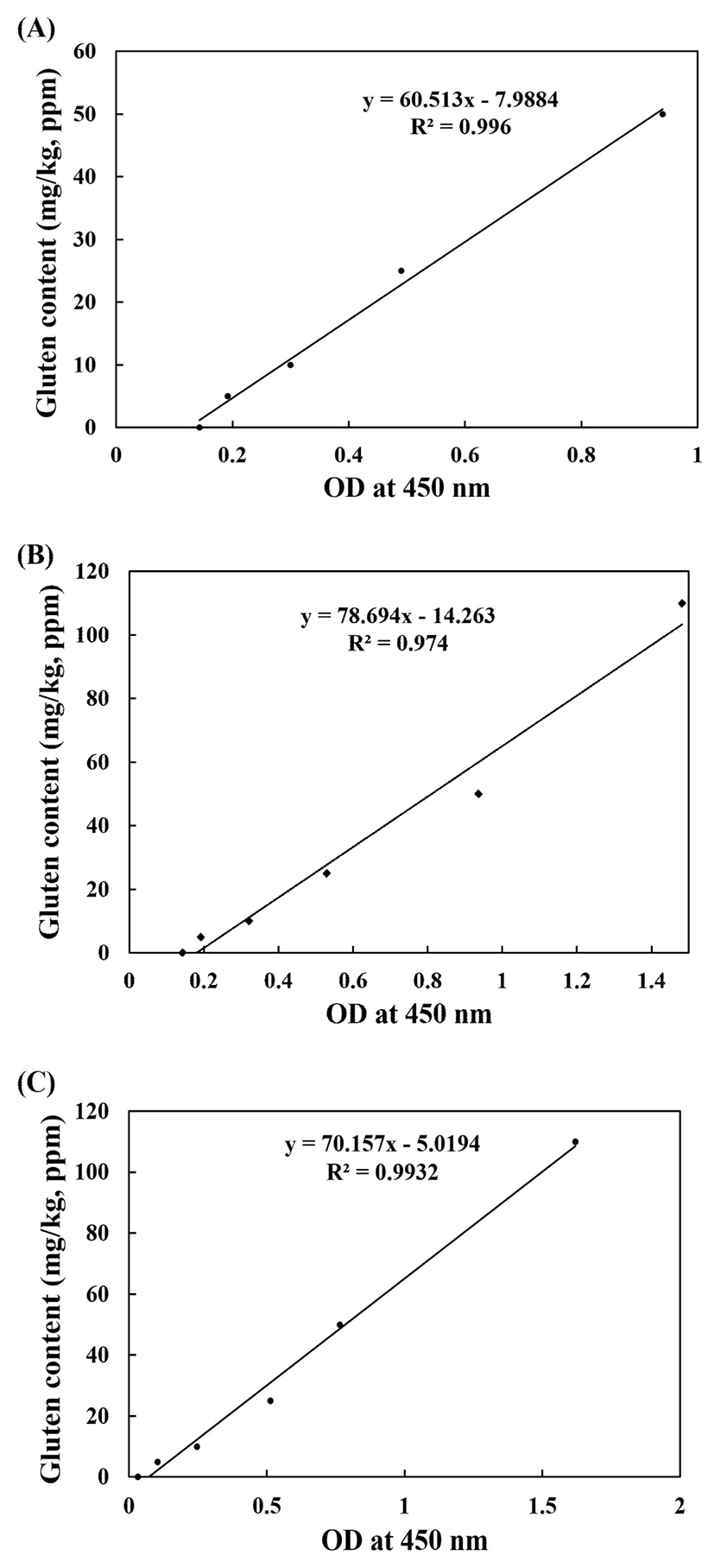
Gluten의 분해물에 대한 미량측정방법의 적합성을 검정 위하여 소개한 3가지 kit로 위의 상용효소 Protamex®를 처리한 시료에 대하여 gluten함량을 분석하였다. 분석한 시료에 앞서 각기 kit에 대한 calibration curve를 작성하였다. Fig. 2에서 보는 바와 같이 A, B, C가 내부 수장한 표준용액을 이용하여 calibration curve는 최대 농도 110 ppm 까지 포함하여 작성하였다. 모두 R2 값이 0.99 이상으로 직선성을 만족하였다. 모두 celiac diease(CD)의 한계치인 20 ppm을 측정하는데 정확도가 맞춰져 있어서 정합한 것이라 판단된다.
글루텐은 glutelin과 gliadin으로 구성되는 단백질특성 말고도 글루텐 단백질은 구조적 특성에 따라 나눌수도 있는데 Table 1에서 보는 바와 같이 밀 글루텐의 고 분자량의 prolamins과 sulfur(S)가 풍부한 prolamins을 함유하고 있는데 prolamins은 점탄성과 반죽 구조를 형성하는데 중요한 역할을 한다. 이들의 물리적 성질 때문에 밀 글루텐은 종종 제품 품질을 향상시키기 위한 증점제, 유화제 또는 유동제로서 다른 식품에 넣어 사용하기도 한다(1).
CD 발병의 주요 유전적 위험인자는 대부분의 환자가 DQ2 heterodimer를 함유한 HLA 클래스 II 분자인 HLA-DQ2와 HLA-DQ8을 코딩하는 유전형이다. 그러나 유럽의 인구 중 약 1/3이 DQ2 heterodimer를 보유하고 있으나 실제 약 1%의 유럽인구가 CD를 앓고 있어 질병 발달에 기여하는 다른 요소가 있음을 의미하고, CD를 발병 위험을 증가시키는 또 다른 요인으로는 다양한 유형의 감염과 글루텐을 섭취하는 연령이 있는데(27-30), CD는 모든 연령대에서 진단할 수 있지만 글루텐을 섭취한 후 어린아이에서 가장 흔하게 발견되며 여성과 남성의 경우 각각 40세에서 50세 사이에 확인된다(31,32).
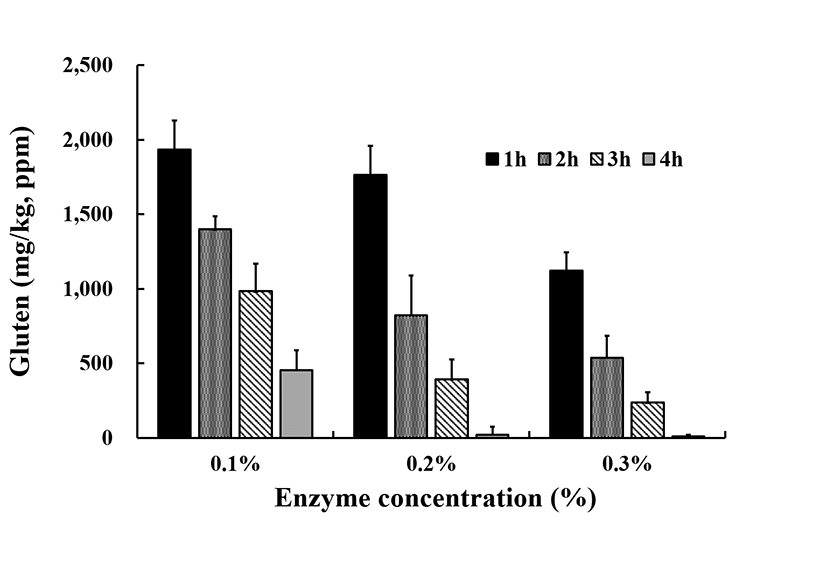
AgraQuant® Gluten G12 Assay을 이용하여 상용화 효소처리 농도를 달리하여 시간에 따른 분해과정을 kit로 확인하였다. Fig. 3에 따르면 gluten 추출 kit을 이용하여 1/80 배율로 희석 추출하였는데 Protamex®를 0.1%에서 1시간 처리시 1,802.6 mg/kg 에서 4시간 처리에서는 453.2 mg/kg으로 단백질이 분해되는 것을 31.6 mg/kg까지 떨어져 CD의 안전농도까지 도달하였음을 알수 있었고, 효소 0.3% 처리구에는 1시간 처리에서 1,123.4 mg/kg에서 4시간 처리시 8.6 mg/kg까지 gluten 단백질이 분해되어 충분하게 단백질 분해된 것을 확인할 수가 있었다. 본 시험방법은 G12 항체를 사용하는 AgraQuant® Gluten G12 kit 는 α-2 glidin 단백질에서 발견되는 33mer 펩타이드(LQLQPFPQPQLPYPQ PQLPYPQPQLPYPQPQPF 라는 펩타이드 구조)에서 자가면역 반응을 유발하는 독성 fracion을 목표로 하기 때문에 G12 항체를 통하여 보다 신뢰성있는 테스트가 가능하다고 소개하고 있으며 G12 항체를 사용하는 AgraQuant® Gluten G12 kit는 귀리의 잠재적인 면역 독성 변종을 검출 할 수 있다고 소개하고 있다. AgraQuant® G12 검사 키트는 정량적인 방식으로 정확하고 신뢰할 수 있는 enzyme-linked immunosorbent assays(ELISA)이다.
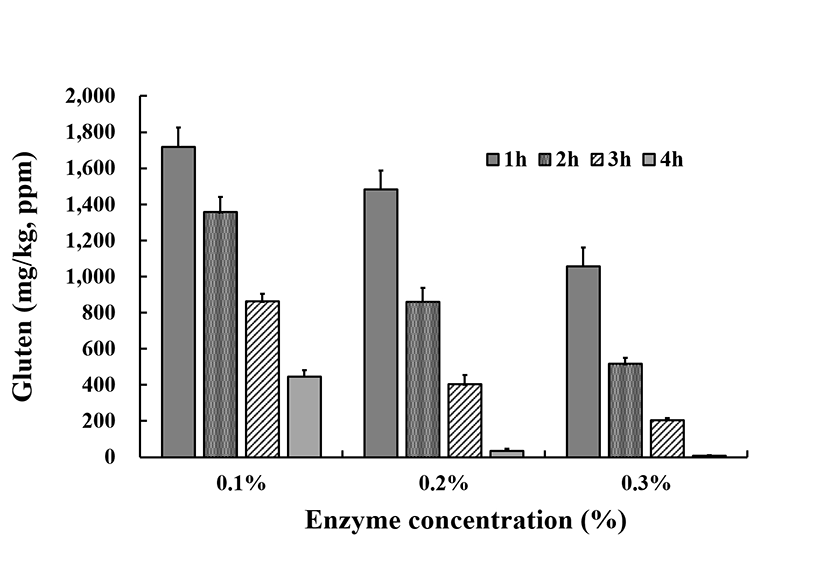
GLUTEN-CHECKTM를 이용한 gluten분해도를 측정하였다. Fig. 4에서 제시하였듯이 Protamex® 0.1%를 처리한 동일시료에 대하여 1시간 후 1,718.6 mg/kg에서 2시간에 1,356.7 mg/kg, 3시간에 862.1 mg/kg, 4시간에 446.7 mg/kg으로 측정되었고, 효소 0.2% 처리구에 경우 각각 시간대별로 1,483.6, 861.3, 403.2, 34.8 mg/kg으로 떨어져다. 효소 0.3% 처리구의 경우 1시간 처리구에 1,057.4 mg/kg에서 최종 4시간 처리구에서는 8.9 mg/kg으로 gluten의 함량이 떨어지는 것으로 나타났다. AgraQuant® Gluten G12 Assay kit의 0.3%, 4시간 처리구에서 8.6 mg/kg보다는 높았으나 gluten-free수준을 벗어나지 않았다. 0.1% 효소처리구나, 0.2% 효소처리구에서 초기 시간대에 높은 분해율로 측정된 것이 차이점으로 평가되고 또한 분해시간에 따라 gluten의 함량이 감소함과 함께 표준편차도 함께 크게 줄어드는 것을 확인하였다.
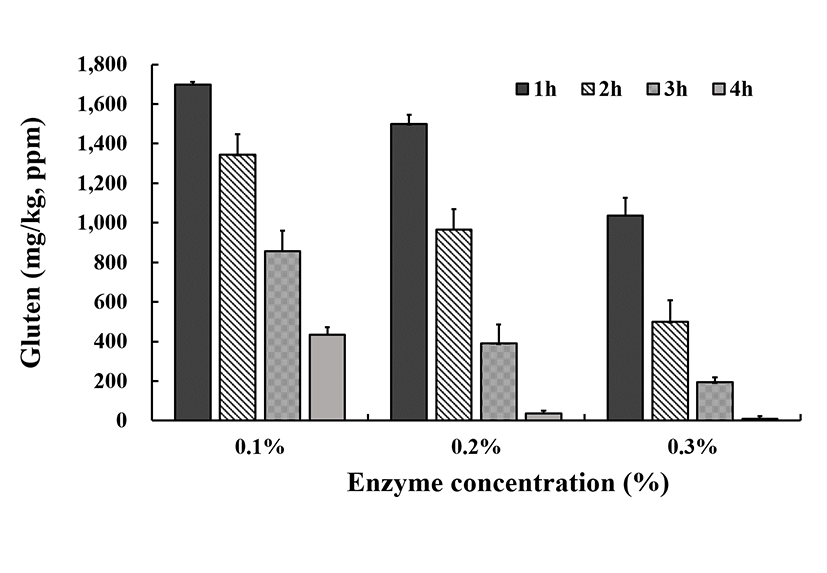
Wheat/gluten(Gliadin) ELISA kit Ⅱ(Wheat ELISA kit)를 이용하여 위와 동일하게 Protamex® 0.1-0.3%를 처리 분해된 gluten분해 시료를 분석하였다. Fig. 5에서 보는 바와 같이, 단백질 분해효소 0.1%를 처리하여 1시간 분해에서 gluten함량이 1,698.7 mg/kg, 1시간 처리에 1,343.2 ×g, 3시간 처리에 856.2 mg/kg, 4시간 처리에 435.6 mg/kg을 나타내었고, Protamex®효소 0.3% 처리구에서는 1-4시간의 처리에서 각각 1,036.8, 498.6, 193.4, 8.4 mg/kg을 나타내었다.
높은 gluten함량을 보인 Protamex® 0.1% 처리, 1시간 처리에서는 GLUTEN-CHECKTM ELISA kit가 1,718.6 mg/kg이었고, 다음으로 AgraQuant® Gluten G12 Assay kit가 1,802.6 mg/kg이였고 Wheat ELISA kit이 1,698.7 mg/kg을 나타내어 저농도과 고농도간의 차이가 측정된 시료의 6.1%에 달하는 차이를 보여 매우 작은 편차로 보였다. 한편 효소 처리군 0.3%에서 4시간 처리에서는 3가지의 kit가 매우 유사한 값들을 나타내었고 gluten-free 인정기준에 매우 부합하여 gluten kit의 측정 적합성을 만족한다고 평가한다.
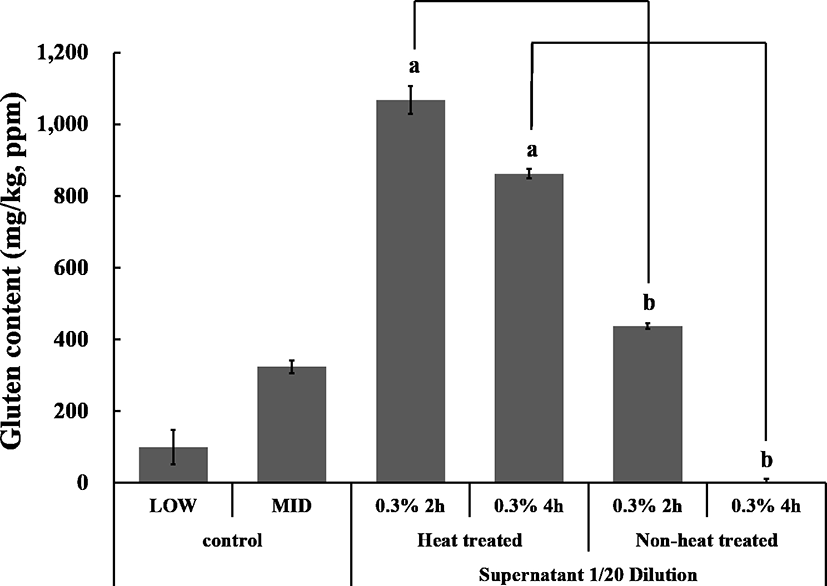
Gutenfree를 표시하기 위한 기초시험법의 정확성을 확인하기 위하여 미량시험법들의 적합성을 시험하였다. 그러나 gluten 섭취는 생식보다는 식이 과정 중에 혼입될 경우를 산정하여 동일시료에 대하여 가열, 비가열처리 시 gluten함량이 정확성의 차이를 확인하고자 하였다. Fig. 6에서 보는바와 같이 밀가루의 gluten을 가열, 비가열처리 시 현격한 차이를 보이는 것을 확인하였는데 단백질 분해효소 Protamex® 0.3% 처리구를 2시간 반응하였을 때 가열처리한 시료에서 gluten함량이 1,067.7 mg/kg을 나타내었는데 반하여 비가열처리구에서는 437.1 mg/kg으로 나타나 가열, 비가열 처리사이에 특이적인 측정변화가 있음을 확인할 수 있다. 또한 Protamex® 0.3%에 4시간 처리구에서는 가열처리 시 861.9 mg/kg이였는데 반하여 비가열 처리구에서는 2.0 mg/kg으로 나타나 효소처리과정에 대한 확인이 필요할 것으로 보인다. 예상되는 시험과정의 혼선은 비처리구에서 잔존하는 효소들이 ELISA에 결합시킨 항체 단백질들을 일부 공격을 하거나 또는 γ-glidin처럼 heat에 저항성이 있는 경우 가열, 비가열처리에서 차이가 발생할 수 있을 것으로 보인다.
식품에서 CD와 관련한 글루텐 분석에 가장 많이 사용되는 방법은 면역 분석방법이다. 면역학적 측정방법은 글루텐 단백질에서 발견되는 다른 프로타민 분획 또는 특정 서열에 대해 생성된 항체를 기반으로 한다. 분석에 필요한 것은 어떤 식품 또는 어떤 제조 공정의 유형에 관계없이 gluten 단백질과 펩타이드를 측정가능 해야 할 것이다(35). 면역분석방법을 이용하는 3가지 kit에 대한 gluten 함량의 정확성은 glutenfree제품에 적합한 표시가 가능하도록 측정법이 적합하다는 것을 확인하였다. 후일 glutenfree식품의 해외 수출과 관련 시 제품의 validation 측정에 충분한 시험법으로 사용가능하다는 것을 평가된다. 그러나 가열식품에 대하여서는 시료에 대한 처리방법을 재정립하거나 비가열 gluten과의 차이점에 대한 규명이 있어야 할 것으로 판단된다.