ARTICLE
쇠비름 물, 에탄올 추출물의 항산화 및 항염증 활성
김동규, 신정혜, 강민정*
Antioxidant and anti-inflammatory activities of water extracts and ethanol extracts from Portulaca oleracea L.
Dong-Gyu Kim, Jung-Hye Shin, Min-Jung Kang*
Author Information & Copyright ▼
Namhae Garlic Research Institute, Namhae 52430, Korea
© The Korean Society of Food Preservation. This is an Open-Access article distributed under the terms of the Creative Commons Attribution Non-Commercial License (http://creativecommons.org/licenses/by-nc/3.0/) which permits unrestricted non-commercial use, distribution, and reproduction in any medium, provided the original work is properly cited.
Received: Dec 6, 2017; Revised: Jan 22, 2018; Accepted: Feb 20, 2018
Abstract
Portulaca oleracea L., a species of Portulacaceae, is ubiquitous. It is a well-known traditional Chinese medicine for removing heat, counteracting toxicity, cooling blood, and maintaining hemostasia; it is also used as antidysentery agent. This study investigated the anti-oxidative and anti-inflammatory activities of water and ethanol extracts from P. oleracea. The total polyphenol content (21.08±0.03 mg GAE/g) and total flavonoid content (5.45±0.76 mg QE/g) of the ethanolic extracts were higher than those of the water extracts. The antioxidative activities were determined by evaluating the 1,1-diphenyl-2-picrylhydrazyl (DPPH) and the 2,2’-azinobis(3-ethylbenzothiazoline-6-sulphonic acid) (ABTS) radical scavenging activity and by the ferric reducing antioxidant potential (FRAP) assay. The ABTS radical scavenging activity of the water extract (75.53%) was higher in those of the water extract (67.03%) at concentration of 1,000 μg/mL. The DPPH radical scavenging activity and FRAP of the ethanol extract were higher than those of the water extract. We also investigated the anti-inflammatory activity of the P. oleracea extracts in LPS-stimulated Raw 264.7 cells. The production levels of nitric oxide (NO) and reactive oxygen species (ROS) significantly decreased with an increasing concentration of the extract. The expression levels of pro-inflammatory cytokines (tumor necrosis faction (TNF)-α, interleukin (IL)-1β, and IL-6) were significantly lower in the ethanol extract than in the LPS alone treatment group. Based on these results, ethanolic extract from P. oleracea could be an effective antioxidant and anti-inflammatory agent.
Keywords: Portulaca oleracea; antioxidant effect; anti-inflammatory effect; pro-inflammatory cytokine
서 론
쇠비름은 쇠비름과의 한해살이 식물로서 오행초(五行 草), 장명채(長命采), 마치채(馬齒采)등으로 불리기도 하며, 전 세계적으로 분포하며 주로 길가, 텃밭 등에서 자생한다 (1). 또한 고대의학 서적에 의하면 해독, 지혈, 부기완화, 지사 등의 다양한 효능이 있고 임상적으로는 장염, 혈변, 설사, 피부궤양, 벌레물린 상처, 피부염 등의 상처나 질병치 료에 사용하였다(2).
쇠비름의 알려진 성분으로는 L-noradrenaline, dopamine, dihydroxyphenylalanin 등이 있으며, 그 외 다량의 organic acid, glutamic acid, aspartic acid, alanine 등이 있다(3). 또한 약리학적 효과를 가지는 물질인 terpene, phenolic acid(4), coumarin(5), flavonoid(6) 및 oleracein A-G(7) 등을 포함하 고 있어 항균, 항바이러스 활성(8), 신경보호 효과(9) 및 항암제(10)로서의 효능이 있다고 보고되어 있다.
염증은 복잡한 자기 방어 기작에 대한 반응으로, 외부자 극이나 조직 손상에 의해 유발되는 면역계의 활성화에 영향 을 미친다(11,12). 과도한 염증은 생체 기관의 기능 장애를 일으킬 수 있기 때문에 정확하게 제어되어야 한다(13). 비정 상적인 염증반응이 일어나면 염증 관련 세포에서 염증 매개 물질이 과도하게 생성되고, 그 결과 다양한 질환들이 나타 나게 되는데, 이러한 질환들은 만성 염증성질환이라 불리 며 동맥경화증, 류마티스 관절염, 천식, 기관지염, 다발성 경화증 등이 이에 속한다(14).
항상성 유지, 감염 및 염증 반응에 필수적인 역할을 하는 대식세포는 성장인자에 영향을 주어 세포증식에 관여할 뿐만 아니라 염증 매개체 생성에도 관여하는 것으로 알려져 있다(15). 최근 lipopolysaccharide(LPS)에 의해 활성화된 RAW 264.7 세포는 다양한 천연물이나 화합물의 항염증 효과를 평가하고 이러한 면역 반응과 관련된 기전을 연구하 기 위한 모델로 널리 사용되고 있다(16). LPS에 의해 활성화 된 RAW 264.7 세포는 tumour necrosis factor-α(TNF-α), interleukin-1β(IL-1β), interleukin-6(IL-6)을 포함하는 proinflammatory cytokine의 발현을 유발하는 것으로 보고되어 있다(17).
모든 생물체들은 산소를 이용하여 생명유지에 필요한 에너지를 생성하는데 이러한 과정에서 발생하는 활성산소 종(reactive oxygen species)은 정상세포 내에서 항산화인자 와 균형을 이루면서 존재하고 있다(18). 활성산소종의 과다 또는 항산화인자의 결핍은 산화적 스트레스를 유발하고, 이는 세포구성 성분들(지질, 단백질, 당, DNA)에 대한 비선 택적, 비가역적인 파괴 작용을 나타낸다(18,19). 산화적 스 트레스에 의해 조직손상이 초래되면 동맥경화, 만성염증, 당뇨병, 심장의 허혈 재관류 손상 및 악성 종양에 이르는 다양한 질환이 발생한다(20). 인체는 이러한 활성산소로부 터 세포손상을 방지하고 항상성을 유지하기 위하여 superoxide dismutase, glutathione peroxidase, catalase 등과 같은 항산화 효소를 생산한다(21). 잘 알려진 비효소적 항산 화 물질로는 아스코르브산, 토코페롤, 카로티노이드, 플라 보노이드, 글루타티온과 같은 천연 항산화제와 butylated hydroxyanisole, butylated hydroxytoluene와 같은 합성 항산화 제가 있다(22). 합성 항산화제의 경우 효율성과 경제성은 높으나 인체 독성으로 인한 안전성의 우려가 있어 생약제나 과일, 채소 등과 같이 저독성 천연물에서 유래된 항산화제, 염증질환 치료제 연구가 널리 진행되고 있다(23).
본 연구에서는 천연물 유래 항산화 및 항염증 소재 탐색 을 위한 기초 연구의 일환으로 국내산 쇠비름 물 추출물과 에탄올 추출물을 제조하여 그 활성을 비교 분석 하였다.
재료 및 방법
실험 재료 및 추출
본 실험에 사용된 쇠비름(Portulaca oleracea L.)은 경남 산청군 인근 농가에서 재배, 세척 후 자연 건조된 것을 산청 기능성콩영농조합법인으로 부터 제공받아 사용하였다. 쇠 비름 추출물 제조를 위하여 건조 시료 200 g에 물 및 발효주 정을 각각 4 L씩 가한 후 충분히 교반하였다. 물 추출물은 70℃에서 5시간 추출 후 여과한 여액을 모아 동결건조하였 고, 에탄올 추출물은 상온에서 24시간 정치, 추출한 다음 여과한 여액을 모아 회전식진공농축기(N-1200AVW, EYELA, Tokyo, Japan)로 완전 건조한 것을 일정농도로 만 들어 실험에 사용하였다.
총 페놀 화합물 함량 측정
총 페놀 화합물의 함량은 Foiln-Denis 방법(24)을 이용하 여 정량하였다. 1,000 μg/mL농도의 쇠비름 물과 에탄올 추 출액 1 mL에 Foline-Ciocalteau 시약(Sigma-Aldrich Co., St. Louis, MO, USA) 및 10% NaCO3 용액(Daejung, Siheung, Korea)을 각 1 mL씩 차례로 가한 다음 실온에서 1시간 정치 한 후 분광광도계(Libra S 35, Biochrom, Cambridge, England)로 760 nm에서 흡광도를 측정하였다. 표준물질로 gallic acid(Sigma-Aldrich Co.)를 사용하여 시료와 동일한 방법으로 분석하여 얻은 검량선으로 부터 총 페놀 화합물의 함량을 계산한 후 gallic acid equivalent (mg/g)로 표현하 였다.
총 플라보노이드 함량 측정
총 플라보노이드 함량은 Moreno 등(25)의 방법을 이용하 여 측정하였다. 각각의 농도의 물과 에탄올 추출물에 10% aluminium nitrate 0.1 mL과 1 M potassium acetate 0.1 mL 및 80% 에탄올 4.3 mL를 차례로 가하여 혼합하여 실온에서 40분간 방치한 후 microplate reader(Perkin-Elmer Inc., Waltham, MA, USA)를 이용하여 415 nm에서 흡광도를 측 정하였다. Quercetin(Sigma-Aldrich Co.)을 표준물질로 사용 하여 얻은 표준검량 선으로부터 플라보노이드 함량을 산출 하여 quercetin equivalent(mg/g)로 표기하였다.
항산화 활성 측정
1,1-Diphenyl-2-picrylhydrazyl(DPPH) 라디칼 소거활성 은 DPPH에 대한 전자공여 활성을 나타낸 것으로 농도별 시료액과 DPPH 용액(5 mg/100 mL methanol)을 동량으로 혼합한 다음 실온에서 20분간 반응시킨 후 분광광도계를 이용하여 525 nm에서 흡광도를 측정하였다(26).
2,2-Azinobis-3-ethylbenzo-thiazoline-6-sulphonate(ABTS) 라디칼 소거활성은 7 mM의 ABTS 용액에 potassium persulfate(Sigma-Aldrich Co.)를 2.4 mM이 되도록 용해시킨 다음 암실에서 12-16시간 동안 반응시킨 후 415 nm에서 흡광도가 1.5가 되도록 증류수로 조정한 ABTS 용액을 사용 하였다. ABTS 용액 150 μL에 시료액 50 μL를 혼합하고 실온에서 반응시킨 다음 분광광도계를 이용하여 415 nm에 서 흡광도를 측정하였다(27). DPPH 및 ABTS 라디칼 소거 활성은 시료 무첨가구에 대한 시료 첨가구의 흡광도비로 계산하여 %로 나타내었다.
Ferric reducing antioxidant power(FRAP) 측정은 Kim 등 (28)의 방법을 사용하였다. 300 mM acetate buffer(pH 3.6), 40 mM HCl에 용해한 10 mM 2,4,6-tripyridyl-s-triazine 및 20 mM FeCl3․6H2O를 각각 10:1:1(v/v/v)의 비율로 혼합하 여 FRAP 시약을 제조하였다. 이어서 농도별 시료액 0.15 mL과 3.0 mL의 FRAP 시약을 혼합하고 37℃에서 5분간 반응시킨 후 593 nm에서 흡광도를 측정하였다. 결과는 표 준물질인 FeSO4․7H2O에 대한 당량(mM)으로 나타내었다.
RAW 264.7 대식세포 증식에 대한 세포독성
실험에 사용된 RAW 264.7 세포는 한국세포주은행 (KCLB, Korea)에서 분양받았으며, 세포 배양을 위해 10% fetal bovine serum(FBS, Hyclone, Loran, UT, USA)과 1% penicillin-streptomycin을 포함하는 Dulbecco's Modified Eagle's Medium(DMEM) 배지를 사용하였다. 세포는 CO2 incubator(37℃, 5% CO2)에서 배양하였으며 추출물의 세포 에 대한 독성 측정은 3-(4,5-dimethylthiazole-2-yl)-2,5- diphenyltetrazolium bromide(MTT, Gibco, Waltham, MA, USA) 환원방법을 이용하여 측정하였다. 세포를 96-well plate에 well당 5×104개가 되도록 분주하고 24시간 부착시 킨 후, 추출물들을 각기 일정한 농도로 희석하여 세포에 처리한 다음 30분 후 1 μg/mL 농도의 lipopolysaccharide (LPS, Sigma-Aldrich Co.)를 처리하여 24시간 동안 배양하 였다. 이후 시료를 포함하는 배지를 제거한 후 serum-free 배지와 5 mg/mL 농도의 MTT 용액을 첨가하여 37℃에서 2시간 더 배양한 다음 DMSO를 분주하여 sonication하고 10분간 교반한 뒤 570 nm에서 흡광도를 측정해 세포생존율 을 구하였다. 세포생존율은 무처리군에 대한 백분율로 나 타내었다.
RAW 264.7 대식세포의 nitric oxide(NO) 생성율 측정
마우스 대식세포주인 RAW 264.7세포를 5×105 cell/well 의 농도로 24-well plate에 분주하여 24시간 배양한 후 각각 의 추출물을 농도별로 처리하였다. 이것을 30분 배양한 후 에 LPS(1 μg/mL)를 처리하여 20시간 또는 24시간 배양한 후 세포 상등액을 회수하였다. 회수한 세포 배양 상등액을 원심분리(1,000 rpm, 10 min, 4℃) 한 다음, 50 μL를 취해 sulfanilamide solution 50 μL와 혼합하여 5분간 빛을 차단하 고 반응시킨 후 NED solution 50 μL와 혼합하여 상온에서 10분간 반응시켜, ELISA reader(Epoch, Bioteck, Winooski, VT, Germany)를 이용하여 540 nm에서 흡광도를 측정하였 고, LPS 단독처리세포군에 대한 상대적인 생성율로 나타내 었다.
DCFH-DA에 의한 intracellular reactive oxygen species(ROS) 측정
추출물의 intracellular ROS 측정은 intracellular ROS assay kit(Cell Biolabs, INC, San Diego, CA, USA)를 이용하 여 측정하였다. 96-well black plate에 5×104 cell/well의 RAW 264.7 cell을 분주하여 배양 한 후 serum free DMEM 배지로 교환하였다. 다시 세포를 24시간 배양한 후 시료를 농도별로 처리하여 37℃, 5% CO2 조건에서 24시간 배양하 였다. PBS(pH 7.4)로 3회 세척한 후 1X dichloro-dihydrofluorescein diacetate(DCFH-DA)를 배지에 100 μL 첨가하여 37℃, 5% CO2에서 1시간 배양한 후 또 다시 PBS로 3회 씻어냈다. Lysis buffer 100 μL를 첨가하여 혼합한 후 fluorescence microplate reader를 이용하여 excitation 485 nm, emission 535 nm에서 형광을 측정하여 LPS 단독 처리 군에 대한 상대적인 ROS 생성 억제율을 비교하여 나타내었 다.
염증성 cytokine 측정
12-well plate에 1×105 cells/well의 농도로 RAW 264.7 세포를 분주한 후 12시간 동안 배양하고 농도별 쇠비름 추출물을 처리하였다. 한 시간 후 LPS(1 μg/mL)를 처리하고 20시간 배양하였다. 이 후 세포 상등액을 회수하여 TNF-α, IL-1β 및 IL-6의 사이토카인 측정에 사용하였으며 측정방 법은 다음과 같다. 각 사이토카인에 반응하는 항체가 코팅 된 96-well plate에 각 standard와 샘플들을 각각 50 μL씩 분주하여 overnight하였다. 3회 세척한 후 Streptavidin-HRP solution(Invitrogen Corp., Carlsbad, CA, USA)을 well당 100 μL씩 분주하여 30분간 반응시키고, 3회 세척 후 마지막으로 TMB substrate solution을 각 well당 100 μL씩 분주하여 실온 암소에서 반응시켰다. Stop solution을 각 well에 100 μL씩 첨가하여 반응을 중지시킨 후 microplate reader로 450 nm에 서 흡광도를 측정하여 LPS 단독처리세포군에 대한 상대적 인 생성 억제율로 나타내었다.
통계처리
모든 실험은 3회 이상 반복 실시하였으며 실험으로부터 얻은 결과는 IBM SPSS Statistics 18(IBM, Armonk, NY, USA)을 사용하여 분석하였다. 결과는 실험군당 평균±표준 편차로 표시하였고, 통계적 유의성 검정은 일원배치 분산 분석(one-way analysis of variance)을 한 후 p<0.05 수준에서 Student's t-test 및 Duncan's multiple range test를 시행하였다.
결과 및 고찰
총 페놀 화합물과 총 플라보노이드 함량 측정
식물성 페놀 화합물은 식물계에 널리 분포되어 있는 2차 대사산물로서 광합성에 의해 생성된 식물의 색소와 쓴맛을 내는 성분이며 식물세포의 생성 및 활성화에 영향을 주는 것으로 알려져 있다(29). 또한, 식물이 자외선 또는 병원균 등과 같은 외부의 침입으로부터 자신을 보호하기 위해서 방출하는 물질로 페닐알라닌(phenylalanine)과 타이로신 (tyrosine)으로부터 합성되며(30), 대표적인 생리활성 기능 은 항산화, 항암 및 발암의 과정에 관여하는 변이원성 억제 작용, 항염증작용, 항균작용 등을 들 수 있다(31-34).
쇠비름 물과 에탄올 추출물 중의 총 페놀 화합물 함량과 총 플라보노이드 함량을 측정하여 Table 1에 나타내었다. 총 페놀 함량은 에탄올 추출물에서 21.08 mg GAE/g으로 물 추출물의 15.03 mg GAE/g보다 유의적으로 높았다. 쇠비 름을 각종 유기용매로 추출하여 총 페놀 화합물 함량을 측정한 Park 등(35)은 ethyl acetate 추출물 52.45 mg%, methanol 추출물 47.17 mg%, 증류수 추출물 25.93 mg% 순으로 비극성 용매에서 총 페놀의 용출이 더 용이하다고 보고하였다. 이러한 보고는 물보다 상대적으로 극성이 낮 은 에탄올 추출물에서 총 페놀 함량이 높았던 본 실험결과 와 일치하는 경향이었다.
Table 1.
Total polyphenol and flavonoid contents of Portulaca oleracea L. extracts with different extraction solvent (mg/g)
| Extraction solvent |
Total polyphenol (mg GAE/g)1) |
Total flavonoid (mg QE/g)1) |
| Water |
15.03±0.032) |
2.18±0.21 |
| Ethanol |
21.08±0.03*3) |
5.45±0.76* |
Download Excel Table
총 플라보노이드 함량의 경우도 에탄올 추출물이 5.45 mg QE/g으로 물 추출물의 2.18 mg QE/g 보다 유의적으로 높았다. 항산화 활성이 뛰어난 것으로 알려진 한방 식물류 인 Salvia officinalis, Matricaria recutita 및 Potentilla fruticosa의 폴리페놀 함량은 각각 22.6 μg/mg, 7.5 μg/mg 및 37.9 μg/mg이며 플라보노이드 함량은 각각 3.5, 7.1 및 6.1 μg/mg으로 보고된바 있는데(36), 쇠비름의 총 페놀 및 플라보이드 함량도 이들 식물류와 유사한 수준이므로 항산 화 활성이 뛰어날 것으로 추정된다.
항산화 활성
항산화와 산화시스템의 불균형은 많은 질병을 유발하며, 라디칼 소거 활성은 항산화 시스템의 중요한 요소로 많은 질병 예방에 효과적이라고 보고되어 있다(37). 본 실험에서 DPPH와 ABTS 라디칼 소거활성을 통해 항산화 활성을 평 가한 결과는 Table 2와 같다.
Table 2.
DPPH, ABTS radical scavenging activity and FRAP of Portulaca oleracea L. extracts with different extraction solvent (%)
| Item |
Extraction solvent |
Concentration (μg/mL) |
| 250 |
500 |
1,000 |
| DPPH radical scavenging activity |
Water |
6.86±1.501)a2) |
12.27±0.59b |
24.63±2.25c |
| Ethanol |
18.83±0.90a*3) |
23.97±2.49b* |
27.85±2.33b* |
| ABTS radical scavenging activity |
Water |
21.07±0.74a |
41.63±0.89b |
75.53±1.27c* |
| Ethanol |
23.11±0.26a* |
41.42±0.71b |
67.03±0.18c |
| FRAP |
Water |
26.67±0.23a |
44.86±0.19b |
85.64±0.54c |
| Ethanol |
28.27±0.41a* |
57.72±0.55b* |
115.67±2.07c* |
Download Excel Table
DPPH를 이용한 소거활성은 시료의 항산화 활성 측정에 많이 활용되는 방법 중 하나로 DPPH가 항산화 물질과 반응 하여 음이온 라디칼이 소거되면서 보라색에서 노란색으로 탈색되는 원리로 항산화 활성을 측정하는데 사용된다(26). DPPH 라디칼 소거활성을 250-1,000 μg/mL의 농도 범위에 서 측정한 결과, 에탄올 추출물은 18.83-27.85%, 물 추출물 은 6.86-24.63%의 범위였는데, 250과 500 μg/mL 농도에서 는 에탄올 추출물의 활성이 물 추출물에 비해 유의적으로 더 높았으나 1,000 μg/mL 농도에서는 추출용매에 따른 활 성의 유의차는 없었다.
ABTS 라디칼 소거활성도 DPPH을 이용한 방법과 함께 항산화 활성을 측정하는데 많이 이용되는 방법으로 ABTS 가 항산화물질과 반응하여 양이온 라디칼이 소거되면서 청록색에서 무색으로 탈색되는 원리로 항산화 활성을 측정 하는데 사용된다(27). ABTS 라디칼 소거활성 측정 결과, 250-1,000 μg/mL의 농도 범위에서 물 추출물은 21.07-75.53%, 에탄올 추출물은 23.11-67.03%의 범위였는 데, 250 μg/mL 농도에서는 에탄올 추출물이 물 추출물에 비해 유의적으로 활성이 높았으나 1,000 μg/mL 농도에서는 물 추출물의 활성이 유의적으로 더 높았다.
산화반응 촉매제로 작용하는 금속이온을 환원시키는 효 력을 측정하는 방법 중 하나인 FRAP 법을 이용하여 쇠비름 추출물들의 환원력을 측정하였다. 쇠비름 물 추출물의 경 우, 26.67-85.64 mM이었고, 에탄올 추출물은 28.29-115.67 mM로 에탄올 추출물의 환원력이 더 높았으며, 또한 농도가 증가할수록 환원 활성이 증가하였다.
기존의 보고에 따르면 DPPH와 ABTS 라디칼 소거활성 은 총 폴리페놀 화합물의 함량과 양의 상관관계를 나타낸다 고 하며(38), Kang 등(39)의 쑥 추출물 항산화 활성 연구에 서도 총 페놀과 총 플라보노이드 함량이 가장 높게 측정된 추출물에서 DPPH와 ABTS 라디칼 소거 활성 역시 가장 높은 것으로 보고되어 있다. 본 연구 결과도 상대적으로 총 페놀 화합물과 플라보노이드 함량이 높았던 쇠비름 에탄 올 추출물에서 DPPH와 ABTS 라디칼 소거 활성이 높았다. 예외적으로 1,000 μg/mL 농도의 물 추출물에서만 ABTS 라디칼 소거능이 에탄올 추출물보다 더 높았다. 이는 두 방법에 대한 기질과 반응하는 물질과의 결합정도가 달라 측정값에서 차이가 나타날 수 있다는 Lee 등(40)의 보고와 유사한 경향이며 DPPH 라디칼 소거능은 자유라디칼을 소 거하며, ABTS는 양이온 라디칼을 소거하는 차이를 가지므 로, 쇠비름 추출물에 의한 페놀 및 플라보노이드류의 추출 정도와 각 기질에 결합하는 정도가 다르기 때문에 이와 같은 결과가 나타난 것으로 보인다.
세포독성 및 NO 생성 억제 활성
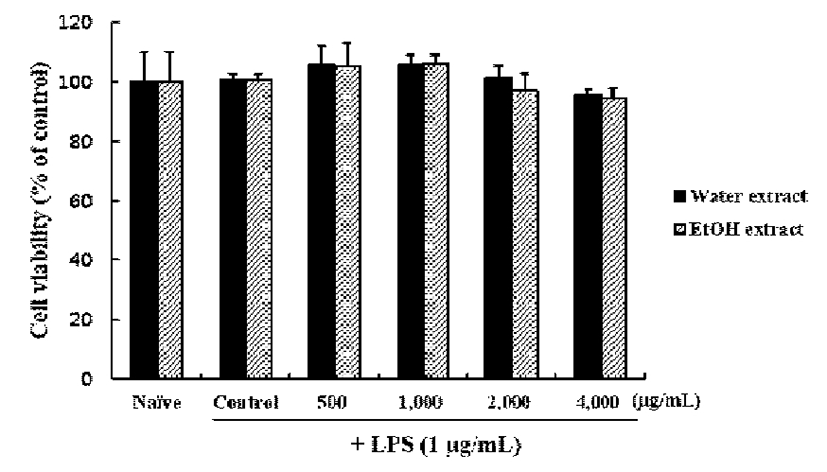
RAW 264.7 세포에 쇠비름의 물 및 에탄올 추출물을 농도 별(0, 500, 1,000, 2,000, 및 4,000 μg/mL)로 24시간 동안 처리한 결과(Fig. 1), 4,000 μg/mL 농도 범위까지 모든 시료 가 대조군 대비 세포 독성이 없는 것으로 확인되었다.
Fig. 1.
Effects of Portulaca oleracea L. extracts with different extraction solvent on the cell viability in RAW 264.7 cells.
After Raw 264.7 cells were pre-treated with LPS for 30 min, it were treated with the indicated concentrations (0, 500, 1,000, 2,000, and 4,000 μg/mL) of extracts for 24 h. Cell viability was evaluated using a colorimetric assay based on MTT assay.
Data represent the mean±SD of three independent experiments.
Download Original Figure
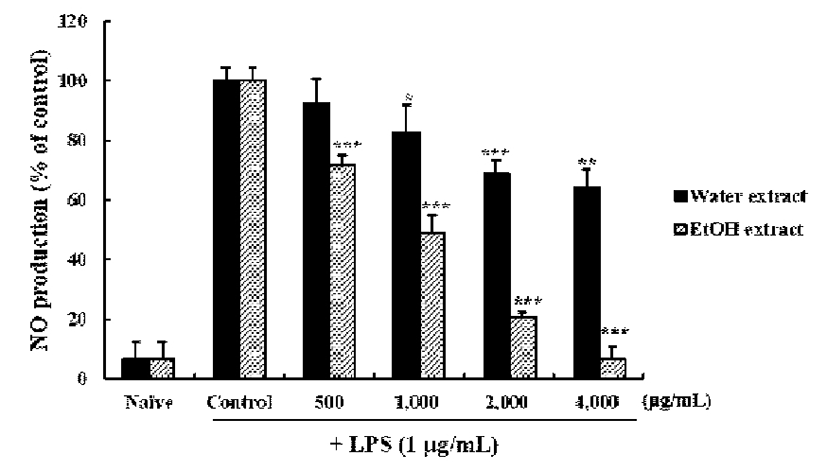
LPS를 처리한 RAW 264.7 세포를 대상으로 쇠비름 물 및 에탄올 추출물의 nitric oxide(NO) 생성 억제활성을 측정 한 결과는 Fig. 2와 같다. LPS를 처리한 RAW 264.7 세포는 대조군보다 NO의 생성이 증가하였으나, 쇠비름 물 및 에탄 올 추출물을 동시에 처리하였을 때 1,000-4,000 μg/mL 농도 에서 NO 생성량이 유의적으로 감소하였다(p<0.05). 추출물 별에 따른 NO 생성 억제효과를 비교해 보면, 500-4,000 μg/mL 농도에서 에탄올 추출물이 물 추출물에 비하여 NO 생성 억제 효과가 높게 나타났다. 앞선 세포독성 실험결과 물과 에탄올 추출물 모두 500-4,000 μg/mL 농도에서 독성이 관찰되지 않았는데 이는 쇠비름 물과 에탄올 추출물의 NO 생성억제 효과가 독성으로 인한 cell population의 저하에서 기인하지 않는다는 것을 확인하는 결과라고 사료된다.
Fig. 2.
Effects of Portulaca oleracea L. extracts with different extraction solvent on the production of NO on RAW 264.7 cells.
The results are mean±SD of triplicates from a representative experiment. Statistically significant value was calculated by compared with control group (LPS alone) by Student's t-test (*, p<0.05; **, p<0.01; ***, p<0.001).
Download Original Figure
추출 방법에 따른 비파엽 추출물의 항염 활성 연구에서 에탄올 추출물이 물 추출물에 비해 NO 생성 억제 활성이 높게 나타났다는 보고가 있으며(41), 사백산 물 추출물과 에탄올 추출물의 항염증 효과 비교 연구에서도 물 추출물은 농도의 증가에 따른 NO 생성 억제 활성이 미미한 반면 에탄올 추출물은 농도 증가에 따른 NO 생성 억제 활성이 현저히 높게 나타났다고 한다(42). 본 연구 결과에서 물 추출물보다 에탄올 추출물이 높은 NO 생성억제 활성을 보였는데 이는 기존 연구들과 일치하는 결과로써 천연물들 은 추출 용매에 따라 NO 생성 억제 활성이 영향을 받을 것으로 사료된다.
체내 세포 조직에 어떠한 기질적인 변화를 가져오는 침 습이 일어날 때, 다양한 염증 유도인자 중 NO는 대식세포, 간세포, 근육세포 등에서 생성되어 박테리아를 죽이거나 종양을 제거시키는 등 생리학적 순기능을 하는 것으로 알려 져 있으며, inducible nitirc oxide synthase(iNOS)에 의해 생 성된다(43). 반면 염증상태에서 iNOS에 의해 생성된 NO는 점막손상을 촉진시킬 뿐만 아니라 염증매개체의 생합성을 촉진하여 염증을 심화시키는 것으로도 알려져 있다(44).
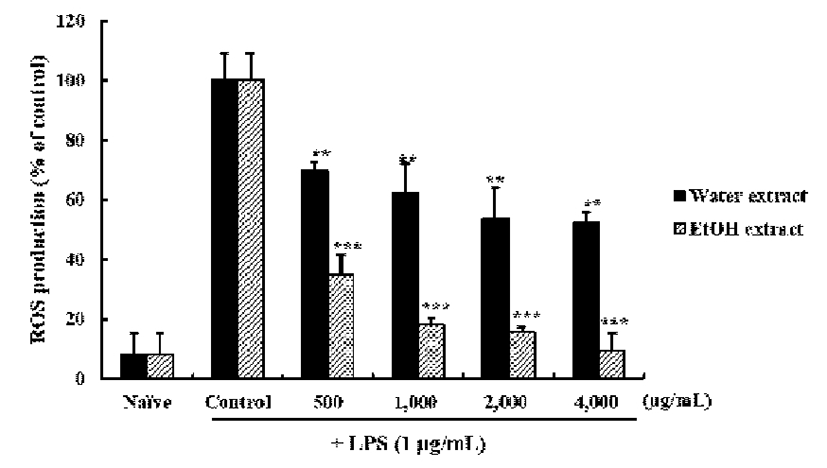
Reactive oxygen species(ROS) 생성 억제 효과
RAW 264.7 세포에 LPS를 처리하여 산화적 스트레스를 유발시킨 후 쇠비름 추출물들에 의한 ROS 생성 억제를 확인하였다. 쇠비름 추출물들에 의한 ROS 억제 활성은 세 포 내에서 증가된 ROS가 DCF-DA와 반응하면 녹색형광으 로 관찰되는 원리를 이용하였다(26). Fluorescence microplate reader를 이용하여 DCF-DA로 염색한 세포를 분석한 결과 (Fig. 3), 쇠비름 물과 에탄올 추출물 모두가 500-4,000 μ g/mL 농도에서 ROS의 생성을 유의적으로 감소시켰다 (p<0.05). 특히 4,000 μg/mL의 에탄올 추출물의 ROS 생성량 은 LPS만 처리한 세포보다 유의적으로 낮았고, 염증을 유 발하지 않은 세포의 ROS 생성 수준과 비슷한 정도였다. 이러한 결과는 쇠비름 추출물의 항산화 활성이 염증을 유발 한 세포 내에서도 유효하며, 염증반응으로 발생하는 ROS 생성을 감소시켜 과도한 염증반응을 감소시킬 수 있음을 나타낸다.
Fig. 3.
Effects of Portulaca oleracea L. extracts with different extraction solvent on the production of ROS on RAW 264.7 cells.
The results are mean±SD. of triplicates from a representative experiment. Statistically significant value was calculated by compared with control group by Student's t-test (**,p<0.01; ***, p<0.001 ).
Download Original Figure
플라보노이드와 폴리페놀을 함유하고 있는 천연 추출물 이 LPS로 자극한 RAW 264.7 세포의 ROS를 제거할 뿐만 아니라 전사인자의 발현을 조절하여 ROS 발생을 미연에 방지할 수 있었다는 Kim 등(45)의 보고는 본 연구 결과와도 일치하는 경향이었다.
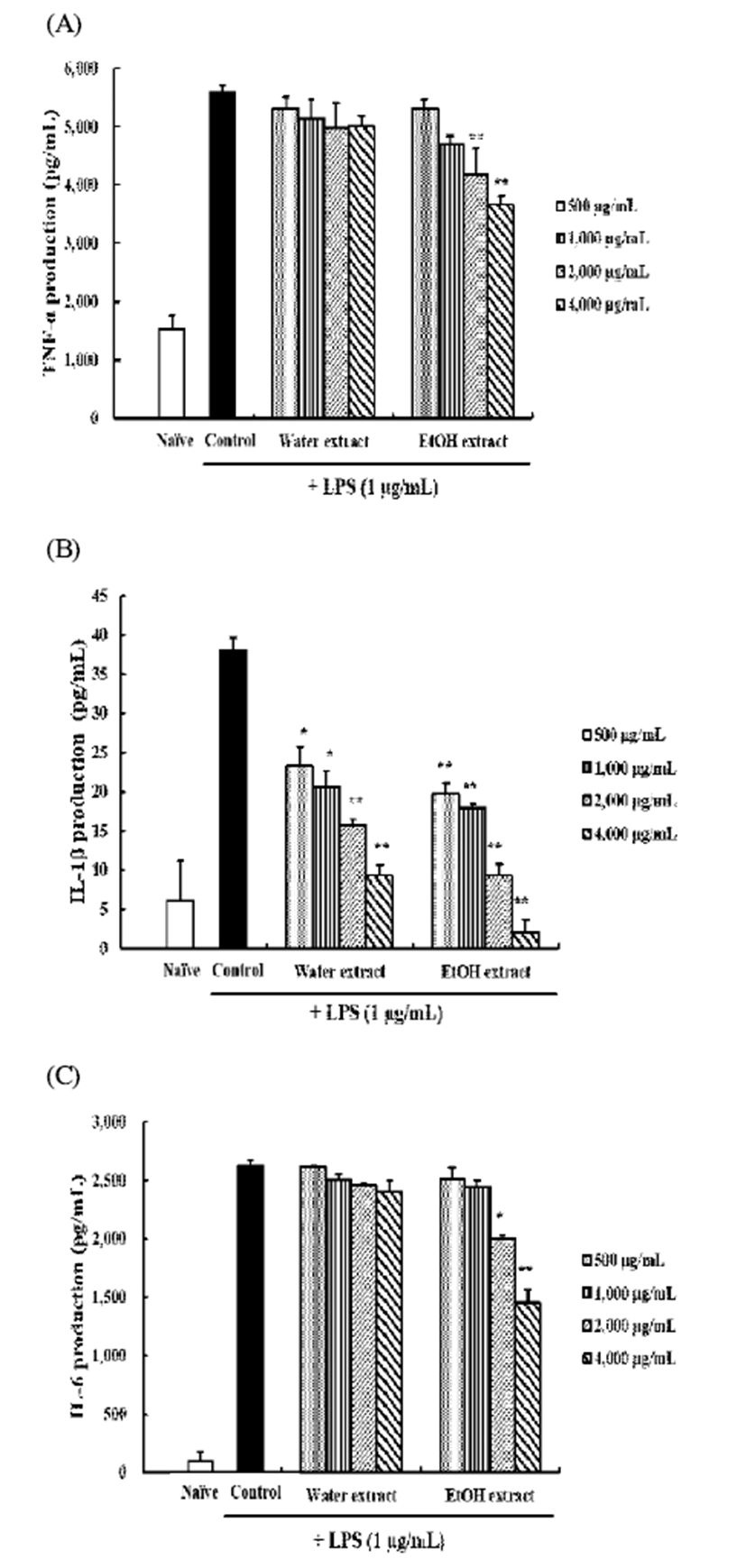
염증성 cytokines
염증 반응에 관여하는 주요 세포는 macrophage로 알려져 있으며, 여러 자극이나 면역세포들이 분비하는 사이토카인 등에 의해 활성화 되어 염증 반응을 유발하고, 염증 부위로 면역 세포의 이동을 촉진시킨다(46). 대식세포는 염증 유발 물질 LPS에 의해 cyclooxygenase-2(COX-2), prostaglandin E2(PGE2), iNOS 및 NO의 생성이 증가되고 염증성 cytokine 인 TNF-α, IL-1, IL-6 분비가 증가된다고 알려져 있다(47).
쇠비름 물과 에탄올 추출물의 염증성 cytokines 억제 효 과 또한 에탄올 추출물이 더 높은지 실험을 통해 확인하였 다(Fig. 4). RAW 264.7 세포에 LPS를 처리한 후, 쇠비름의 물과 에탄올 추출물을 500, 1,000, 2,000과 4,000 μg/mL 농도 로 처리하고 mouse ELISA kit를 이용하여 염증성 cytokines 의 생성량을 정량하였다. 그 결과 TNF-α의 경우, 에탄올 추출물이 2,000과 4,000 μg/mL 농도에서 유의성 있는 감소 를 보였고 반면 물 추출물은 유의성 있는 변화가 없었다. IL-1β는, 물과 에탄올 추출물 모두에서 농도 의존적으로 유의적인 감소가 확인되었다. 마지막으로 IL-6의 경우에도 TNF-α결과와 동일하게 에탄올 추출물의 2,000과 4,000 μ g/mL 농도에서만 유의성 있는 감소가 확인되었다.
Fig. 4.
Inhibitory effects of Portulaca oleracea L. extracts on the LPS-induced TNF-α (A), IL-1β (B) and IL-6 (C) expression in RAW 264.7 cells.
RAW 264.7 cells pretreated with various concentration of Portulaca oleracea L. extracts were stimulated with or without LPS (1 μg/mL) for 24 h. TNF-α, IL-1β, and IL-6 protein levels in the cell culture media were measured by ELISA (A, B and C, respectively).
Data are represented as means±SD. Statistically significant value was calculated by compared with control group by Student's t-test (*, p<0.05; **, p<0.01).
Download Original Figure
염증 전구물질인 TNF-α, IL-1β 그리고 IL-6은 in vivo 및 in vitro 상에서 서로 상호작용이 있는 것으로 알려져 있으며, 염증 반응을 일으키는 동안 발현 정도가 증가된다 (48). 쇠비름 추출물 중 에탄올 추출물만이 TNF-α, IL-1β, 그리고 IL-6의 발현을 모두 유의적으로 억제하였으므로 이 는 쇠비름 에탄올 추출물이 RAW 264.7 세포에서 염증성 cytokine을 효과적으로 억제하여 항염증 효과에 기여하는 것으로 판단된다.
요 약
본 연구에서는 쇠비름의 활용가치를 높이고 기능성 소재 로서의 이용 가능성을 타진하기 위해 쇠비름 물 및 에탄올 추출물의 항산화와 항염증 활성을 탐색하였다. DPPH 라디 칼 소거능과 FRAP을 이용한 총 항산화 효능 평가 결과 에탄올 추출물이 물 추출물보다 항산화 활성이 우수한 것을 확인하였고, ABTS 라디칼 소거능은 1,000 μg/mL의 농도에 서만 쇠비름 물 추출물의 활성이 더 높았다. 한편, 세포 독성을 살펴보기 위하여 쇠비름 물 및 에탄올 추출물을 이용해 대식세포에 MTT assay를 수행한 결과, 4,000 μg/mL 의 이하 농도까지는 세포의 생존율에 영향을 미치지 않는 것을 확인하였다. 1.0 μg/mL LPS로 염증반응을 유도시킨 세포에 대해 쇠비름 물 추출물에 비해 에탄올 추출물이 더 효과적으로 농도의존적인 NO와 ROS 생성 억제 효과가 있었다. 추가적으로 세포의 항염증 효능의 지표 단백질로 알려진 TNF-α, IL-1β, IL-6의 발현을 확인하였을 때 LPS 단독 처리군 대비 쇠비름 에탄올 추출물에서 3가지 단백질 모두의 발현양이 감소하는 것을 확인하였다.
이상의 결과를 종합하여 볼 때 쇠비름 에탄올 추출물은 물 추출물에 비해 높은 항산화와 항염증 활성을 가지는 것으로 확인되었으며, 추후 쇠비름의 유효성분 추출을 통 한 항염증 물질의 연구와 염증 억제 성분의 분리 및 그 작용기전 연구에 기초 자료가 될 것으로 사료된다.
Acknowledgements
본 연구는 2017년도 경상남도의 항노화산업육성지원사업(천연물소재응용지원사업) 수행에 따른 연구 성과의 일부이며 이에 감사드립니다.
References
Lee S.J., Lee B.D., Jeon M.R., Kim Y.J., Kim M.R. Storage characteristics and retrogradation properties of Sulgidduk sdded with Portulaca oleracea L. J KoreanSoc. Food Sci. Nutr. 2015; 44:1517-1524.

Zhang R., Lee H.J., Yoon Y.M., Kim S.M., Kim H.S., Li S.H., An S.K. The melanin inhibition, anti-aging and anti-inflammation effects of Portulaca oleraceaextracts on cells. KSBB Joural. 2009; 24:397-402.

Feng P.C., Haynes L.J., Magnus K.E. High concentration of(-)-Noraderenaline in Portulaca Oleracea L. Nature. 1961; 191:1108-1110


Xin H.L., Xu Y.F., Hou Y.H., Zhang Y.N., Yue X.Q., Lu J.C., Ling C.Q. Two novel triterpenoids from Portulaca oleracea L. Helv. Chim. Acta. 2008; 11:2075-2080


Lei X., Li J., Liu B., Zhang N., Liu H. Separation and identification of four new compounds with antibacterial activity from Portulaca oleracea L. Molecules. 2015; 20:16375-16387.

Xu X., Chen G. Determination of flavonoids in Portulaca oleracea L. by capillary electrophoresis withelectrochemical detection. J. Pharm. Biomed. Anal. 2006; 41:493-499.

Liu D., Shen T., Xiang L. Two antioxidant alkaloids from Portulaca oleracea L. Helv. Chim. Acta. 2011; 3:497-501


Oh K.B., Chang I.M., Hwang K.J., Mar W. Detection of antifungal activity in Portulaca oleracea by a single-cell bioassay system. Phytother. Res. 2000; 5:329-332


Abdel Moneim A.E. The neuroprotective effects of purslane (Portulaca oleracea) on rotenone-induced biochemical changes and apoptosis in brain of rat. CNS Neurol. Disord. Drug Targets. 2013; 12:830-841.

Zhao R., Gao X., Cai Y., Shao X., Jia G., Huang Y., Qin X., Wang J., Zheng X. Antitumor activity of Portulaca oleracea L. polysaccharides against cervical carcinoma in vitro and in vivo. Carbohydr. Polym. 2013; 2:376-383


Pyee Y., Chung H.J., Choi T.J., Park H.J., Hong J.Y., Kim J.S., Kang S.S., Lee S.K. Suppression of inflammatory responses by handelin, a guaianolide dimer fromChrysanthemum boreale, via downregulation of NF-I B signaling and pro-inflammatory cytokine production. J. Nat. Prod. 2014; 4:917-924


Kvietys P.R., Granger D.N. Role of reactive oxygen and nitrogen species in the vascular responses toinflammation. Free Radic. Biol. Med. 2012; 3:556-592.

Fujihara M., Muroi M., Tanamoto K., Suzuki T., Azuma H., Ikeda H. Molecular mechanisms of macrophage activation and deactivation by lipopolysaccharide : roles of the receptor complex. Pharmacol. Ther. 2003; 100:171-194.

Tak P.P., Firestein G.S. NF-kappa B: a key role in inflammatory diseases. J. Clin. Invest. 2001; 107:7-11.

Kang S.W. Role of reactive oxygen species in cell death pathways. Hanyang Med. Rev. 2013; 33:77-82


Kim D.G., Kang M.J., Hong S.S., Choi Y.H., Shin J.H. Antiinflammatory effects of functionally active compounds isolated from aged black garlic. Phytother. Res. 2017; 31:53-61.

Comalada M., Lloberas J., Celada A. MKP-1: a critical phosphatase in the biology of macrophages controlling the switch between proliferation and activation. Eur. J. Immunol. 2012; 8:1938-1948.

Camello-Almaraz C., Gomerz-Pinilla P.J., Pozo M.J., Camello P.J. Mitochondrial reactive oxygen species and Ca2+ signaling. Am. J. Physiol. Cell Physiol. 2006; 291:1082-1088.

Waris G., Ahsan H. Reactive oxygen species: role in the development of cancer and various chronic conditions. J. Carcinog. 2006; 5:1477-1493.

Ozer A., Ergul B.K., Sezai S. Oxidative stress in patients with acne vulgaris. Mediators Inflamm. 2005; 6:380-384.

Cha E.J., Pyo M.Y., Yang K.S., Kim A.K. Effect of Phellinus Linteus extract on the activity of antioxidant enzyme. Cancer Prev. Res. (Phila.). 2008; 13:311-315.

Park J.H., Kweon G.R. Clinical applications of antioxidants. Hanyang Med. Rev. 2013; 33:130-136.

Hwang J.H., Park K.Y., Oh Y.S., Lim S.B. Phenolic compound content and antioxidant activity of citrus peels. J Korean Soc Food Sci Nutr. 2013; 42:153-160


Folin O., Denis W. A colorimetric method for determination of phenols (and phenol derivatives) in urine. J. Biol. Chem. 1915; 22:305-308.

Moreno M.I., Isla M.I., Sampietro A.R., Vattuone M.A. Comparison of the free radical scavenging activity of propolis from several regions of Argentina. J Enthrophamacol. 2000; 71:109-114


Blois M.S. Antioxidant determinations by the use of a stable free radical. Nature. 1958; 181:1199-1200


Re R., Pellegrini N., Proteggente A., Pannala A., Yang M., Rice-Evans C. Antioxidant activity applying an improved ABTs radical cation decolorization assay. Free Radic. Biol. Med. 1999; 26:1231-1237.

Shahidi F., Naczk M. Phenolic in food and nutraceuticals: sources, applications and health effects. Boca Raton, FL, England: CRC Press. 2003; p. 235-289.

Cha J.Y., Kim H.J., Chung C.H., Cho Y.S. Antioxidative activities and contents of polyphenolic compounds of Cudrania tricuspidata. J Korean Soc FoodSci Nutr. 1999; 28:1310-1315.

Carlo G.D., Mascolo N., Izzo A.A., Capasso F. Flavonoids: Old and new aspects of a class of natural therapeutic drugs. Life Sci. 1999; 65:337-353.

Ren W., Qiao Z., Wang H., Zhu L., Zhang L. Flavonoids: Promising anticancer agents. Med. Res. Rev. 2003; 23:519-534.

Cowan M.M. Plant products as antimicrobial agents. Clin. Microbiol. Rev. 1999; 12:564-582.

Hemaiswarya S., Kruthiventi A.K., Doble M. Synergism between natural products and antibiotics against infectious diseases. Phytomedicine. 2008; 15:639-652.

Kim D.H., Jeong G.T. Antimicrobial and antioxidant activities of extracts of marine greenalgae Enteromorpha intestinalis. KSBB J. 2014; 29:92-97


Park S.H., Kim D.K., Bae J.H. The antioxidant effect of Portulaca oleracea extracts and its antimicrobial activity on Helicobacter pylori. Korean J Food & Nutr. 2011; 24:306-311


Miliauskas G., Venskutonis P.R., Van Beek T.A. Screening of radical scavenging activity of some medicinal and aromatic plant extracts. Food Chem. 2004; 85:231-237


Reis F.S., Martins A., Barros L., Ferreira I.C. Antioxidant properties and phenolic profile of the most widely appreciated cultivated mushrooms: a comparative study between in vivo and in vitro samples. Food Chem. Toxicol. 2012; 50:1201-1207.

In J.P., Shin J.M., Hur S.J., Lee S.K. Antioxidative, antimicrobial and anticytotoxic activities of seungmagalgeuntang and fermented seungmagalgeuntang. J Korean Soc Food Sci Nutr. 2014; 43:980-988


Kang K.M., Lee S.H. Effects of extraction methods on the antioxidative activity of Artemisia sp. J Korean Soc Food Sci Nutr. 2013; 42:1249-1254


Lee S.M., You Y.H., Kim K.M., Park J.J., Jeong C.S., Jhon D.Y., Jun W.J. Antioxidant activities of native Gwangyang Rubus coreanus Miq. J Korean Soc Food Sci Nutr. 2012; 41:327-332


Oztuurk A., Ozbek H. The anti-inflammatory activity of eugenia caryophyllata essential oil: an animal model of anti-inflammatory activity. Eur. J. Gen. Med. 2005; 2:159-163.

Lee D.S., Choi H.G., Kim K.S., Kim D.C., Min H.K., Li B., Kim J.S., Park J.H., Oh H.C., Kim Y.C. The comparison between Sabaek-san water and 30% EtOH extracts for anti-inflammatory effects. Yakhak Hoeji. 2012; 56:240-247.

Aktan F. iNOS-mediated nitric oxide production and its regulation. Life Sci. 2004; 75:639-653.

Park E.Y., Yang K.S. Inhibition of nitric oxide production by the extracts of Hibiscus manihot. Yakhak Hoeji. 2008; 52:259-263.

Kim Y.H., Lee M.J., Lee H.S., Kim J.G., Park W.H. Suppressive effect of Euryale ferox salisbury extracts on inflammatory response in LPS-stimulated RAW 264.7 cells through the antioxidative mechanism. Dongui Saengli Byeongli Haghoeji. 2011; 25:202-211.

Lee E.S., Ku H.K., Moon T.C., Lee E., Jahng Y., Lee S.H., Son J.K., Baek S.H., Chang H.W. Inhibition of nitric oxide and tumor necrosis factor-alpha (TNF-alpha) production by propenone compound through block ade of nuclear factor(NF)-kappa B activation in cultured murine macrophages. Biol. Pharm. Bull. 2004; 27:617-620.

Hinz B., Brune K. Cyclooxygenase-2 10 years later. J. Pharmacol. Exp. Ther. 2002; 300:367-375.

Feldmann M., Brennan F.M., Maini R.N. Role of cytokine in rheumatoid arthritis. Annu. Rev. Immunol. 1996; 14:397-440.