서 론
장류는 한국인의 식문화에서 가장 많은 비중을 차지하는 발효식품 중 하나로 현재 꾸준한 연구를 통해 기름지고 불균형한 영양의 서구화된 식습관으로 초래된 당뇨, 비만, 성인병 등 현대인의 질병을 개선하는 효과가 있는 유익한 생리활성 물질을 다량 함유하고 있으며, 특히 항산화(1), 항당뇨(2,3), 혈전용해(4) 등의 기능성을 갖고 있는 것으로 보고되고 있다. 특히, 콩을 이용하여 단기간 발효를 통해 섭취하게 되는 청국장은 나트륨의 과잉 섭취를 줄일 수 있으며, 발효 과정을 통해 콩이 가지고 있는 이소플라본과 같은 성분의 배당체가 아글리콘(aglycone)으로 전환되고 항산화 물질이 생성(5)될 뿐 아니라 필수 아미노산, 불포화 지방산, 유리아미노산, 비타민 등이 풍부하여(6) 체내 영양 의 균형을 맞추는데 도움이 된다. 또한 혈전용해 활성, 혈압 강하 등의 효과도 있는 것으로 보고되면서 많은 주목을 받고 있는 건강식품 중 하나이다(7,8). 하지만 최근에는 국 내 일부 발효식품에서 유해 물질이 검출되는 등 안전상의 문제점이 부각되고 있는 실정이다.
전통 발효식품에서 가장 문제시 되는 요소로는 곰팡이 독소(aflatoxin), biogenic amine, Bacillus cereus 독소로, 특 히 biogenic amine은 아미노산을 전구체로Bacillus를 포함 한 발효에 관여하는 대부분의 미생물이 갖는 amino acid decarboxylase에 의해 탈카르복실화되어 생성된다. 체내 섭 취 시 가장 크게 문제시 되는 biogenic amine 중 특히 tyramine과 histamine은 과량 섭취 시 설사, 구토, 두통 등을 유발하며, 최근 연구에서는 전통 장류, 김치, 젓갈 등 국내 전통발효식품에서 높은 함량이 검출되고 있는 것으로 밝혀 지고 있다(9,10). 또한 Bacillus sub-group 1에 속하는 구토 및 설사 유발 독소를 생성하는 B. cereus는 토양 및 공기 중에 부유하는 미생물로 전통 장류의 발효 과정에서 쉽게 오염되고 있어 한국식품의약품안전처(KFDA)는 2007년부 터시판 장류제품에서B. cereus의함량을 1.0×104 CFU/g 이하 로 규제하고 있고(11), 최근에는 미생물을 활용하여 발효를 통한 식중독 유발 유해 미생물의 제어와 관련하여 다양한 연구가 진행되고 있는 추세이다(12,13).
프로바이오틱스는 숙주와 상호작용을 통해 숙주의 건강 증진에 영향을 주는 미생물을 총징하며, 2001년 세계보건 기구 WHO에서 “살아있는 미생물로 적정량 섭취 시 숙주에 게 유익한 영향을 미치는 물질”로 정의한 이후 최근까지 다양한 소재로 활용되고 있다(14). 특히, 최근 서구화된 식 습관으로 인해 현대인의 비만, 당뇨, 고혈압, 아토피 등과 같은 질병에 효과가 있다고 알려지면서 소비자의 관심이 급증하는 추세로 국내 프로바이오틱스 시장 또한 크게 증가 하고 있는 실정이다(15,16). 일반적으로 프로바이오틱 균주 는 Bifidobacterium, Lactobacillus, Enterococcus, Bacillus 속 균주로 알려져 있으며, 특히 Bacillus 속 균주의 경우 활성 아포를 형성하여 생균 대부분이 장에 도달되어 장질환에 대한 치료효과를 보이는 등 프로바이오틱 균주에 대한 연구 는 다양한 분야에 걸쳐 지속적으로 진행되고 있다(17). 현재 시판되고 있는 프로바이오틱스 제품은 대부분 정장제나 유산균 제제, 사료 첨가제로서의 생균제 등으로 동물성 유 산균에 집중되어 있는 실정이나 최근 연구에 따르면 식물성 Bacillus 속 또한 프로바이오틱 특성을 가지고 있는 것으로 확인되고 있어 기존의 동물성 유산균을 대체할 수 있는 소재로 보고되고 있다(18).
따라서 본 연구에서는 전통발효 식품에서 프로바이오틱 후보균을 분리하고, 분리주를 대상으로 상업적 이용이 가 능하며 우수한 발효 특성 및 잠재적 프로바이오틱스 소재로 서의 특성을 갖는 식물성 Bacillus 속 균주를 선발하고자 하였다. 특히 전통 발효식품에서 문제시 되는B. cereus 독 소와 biogenic amine 생성, 식품 유해 미생물에 대한 항균활 성 등을 목표로 선별을 진행하였고, 최종 선발한 균주의 프로바이오틱스 균주로서의 특성을 확인하기 위해 세포표 면 소수성, 내산성, 내담즙성 등을 분석하였고, 상업적 활용 을 위해 청국장 발효를 통한 발효 특성 분석을 실시하였다.
재료 및 방법
프로바이오틱스로 활용할 수 있는 고초균을 분리하기 위해 전국에서 전통적인 방법으로 제조된 장류 100종을 수집하여 균원 시료로 사용하였다. 각각의 시료 1 g을 멸균 수 9 mL에 혼합한 후 단계 희석하여 Luria-Bertani agar(LB agar, Difco, Sparks, MD, USA)에 도말하여 30℃, 18시간 배양하여 형성된 집락의 형태학적 차이를 이용하여 1차 선별하였다. 1차 선별 분리주 중에서 설사 및 구토를 유발하 는 B. cereus 균주를 제거하기 위해 Bacillus cereus agar (BCA, Oxoid, Hampshire, UK) 배지에 도말하여 30℃에서 18시간 진탕배양 한 뒤 배양액을 14,000 rpm에서 10분간 원심분리한 후 균체를 10% skim milk(Difco, Sparks, MD, USA) 용액에 현탁하여 -80℃에 보관하였다.
선별한 분리주의 세포외 효소 활성 측정은 단백질(19), 섬유소, 전분에 대하여 조사하였고, 2% skim milk(Difco), 1% carboxylmethyl cellulose(CMC), 1% soluble starch를 각 각의 기질로 하여 well diffusion 방법을 이용하여 측정하였 다. 또한 혈전분해효소 활성 측정은 식품의약품안전처 독 성연구소의 fibrin 배지 방법(20)을 일부 변형하여 측정하였 으며, 100 unit/mL thrombin(Sigma-Aldrich, St. Louis, MO, USA) 용액 200 μL를 10 mL의 0.5% fibrinogen 용액(in phosphate buffered saline(PBS) buffer, pH 7.4)와 10 mL의 1% agarose(Bio-rad, Hercules, CA, USA)와 혼합하여 fibrin plate를 제조하였다. 선별 분리주는 LB 액체 배지에 30℃에 서 24시간 배양하였고, 제조한 청국장 시료의 효소활성은 청국장 분말 1 g에 9 mL의 멸균수를 첨가하여 혼합한 후 각각 14,000 rpm에서 10분간 원심분리 하여 균체를 제거한 배양 상등액을 시료로 사용하여 측정하였다.
1차 선별 균주의 항균활성 측정을 위해 식품내 부패 원인 균으로 알려진Bacillus cereus KCTC 3624, KCCM 40935와 방광염 등 화농성 질환을 일으키는 원인균으로 국내에서는 식중독을 일으키는 세균 중 하나인 Staphylococcus aureus KCCM 11593, KCCM 41331을 지시균주로 사용하여 0.8% soft LB agar를 제조하여 well diffusion 방법으로 측정하였 다. 또한 분리 균주의 독소 유전자 보유 여부와 병원성 세균 을 억제하는 것으로 알려진 지질 펩타이드 항생물질에 대한 분석은 hemolytic enterotoxin 유전자 3종(hblA, hblD, hblC) 와 non-hemolytic enterotoxin 3종(nheA, nheB, nheC), emetic toxin 유전자 2종(cer, ces), enterotoxin T 유전자(bceT), enterotoxin FM 유전자(entFM)를 Bacillus cereus Toxin 6-plex Detection kit(KogenBIOtech, Seoul, Korea) 및 primer 를 제작하여 유전자를 증폭하여 분석하였다. 항생물질 보 유 여부에 대한 유전자 분석은 bacilomycin D synthetase A(bmyA), iturin A(ituA), surfactin(sufA) 생합성 유전자의 primer를 제작하여 PCR을 통한 분석으로 추가 측정하였다. 각각의 제작 primer 및 PCR 조건은 Table 1의 조건에 따라 진행하였다.
Biogenic amine의 생성 유전자 보유 여부를 조사하기 위 해 histidine과 tyrosine의 생성과 관련된 유전자인 histidine decarboxylase(hdc)와 tyrosine decarboxylase(tdc) 유전자의 primer를 제작하여 Table 1의 조건하에 유전자를 증폭하여 보유 여부를 조사하였으며, 발효를 통한 biogenic amine의 실제 생성여부는 Yang 등(21)의 방법에 따라 측정하였고, 각각의 시료를 High performance liquid chromatography (HPLC, Agilent1200, Agilent Technologies Inc., Santa Clara, CA, USA)를 이용하여 Kim 등(11)의 분석 조건에 따라 조사 하였다.
선별 균주의 용혈성 확인을 위해 5% sheep blood(MBcell, Seoul, Korea)를 첨가하여 blood agar 배지를 제조하였으며, 각각의 선별 균주를 획선 도말 후 37℃에서 24시간 배양하 여 콜로니 주위에 생기는 환의 형태로 용혈성을 확인하였 다. Indole 생성 여부는 TSB(Difco) 배지에 접종한 후 37℃에 서 24시간 진탕배양한 후 indole reagent dropper(Difco)를 첨가하여 배지 표면의 색 변화로 생성여부를 조사하였으 며, phenylalanine agar(Fluka, Buchs, Switzerland) 배지에 획 선 도말 후 37℃에서 24시간, 48시간 배양하고 10% ferric-chloride(MBcell)를 3-4 방울 첨가한 후 콜로니 주위의 색 변화로 phenyl-pyruvic acid의 생성 여부를 확인하였다. Urease의 생성 여부는 urea rapid test kit(MBcell)에 각각의 선별 균주를 접종하고 vaseline oil(MBcell)을 첨가하여 산 소가 차단된 상태로 37℃에서 24시간 배양 후 색의 변화로 확인하였으며, β-glucuronidase는 tryptone bile X-glucuronide (TBX, Oxoid) 배지에 각각의 선별 균주를 획선 도말 후 37℃에서 24시간 배양하여 색의 변화를 통해 측정하였다.
선별 분리주를 대상으로 프로바이오틱스 소재로서 활용 하기 위한 잠재적 특성을 분석하기 위해 내산성 및 내담즙 성과 세포 표면 소수성 분석을 실시하였다. 내산성 및 내담 즙성 측정은 LB 액체 배지(Difco)에 각각의 선별 균주를 접종하고 30℃에서 18시간 배양한 후 14,000 rpm에서 10분 간 원심분리 하여 균체를 회수하여 각각의 내성 배지에 접종후 37℃에서 3시간 진탕 배양한 후 각각의 배양액 1 mL을 취하여 LB 고체 배지(Difco)에 도말하여 생균수를 측정하였다. 내산성은 pH 2.0과 pH 7.0으로 조절한 PBS에 내담즙성의 측정은 앞서 회수한 균체를 0.3%, 0.6% oxgall(Neogen, Lansing, MI, USA)이 첨가된 PBS(pH 7.0)에 재부유하여 측정하였으며, 각각의 대조구는 첨가 전 생균 수를 측정하여 사용하였다. 또한 선별 균주를 대상으로 용 매에 대한 미생물의 부착능(microbial adhesion to solvent, MATS) 실험을 진행하였으며, Doyle과 Rosenberg(22)의 방 법을 일부 변형하여 측정하였다. LB 액체배지(Difco)에 접 종한 균주를 30℃에서 18시간 배양한 후 600 nm에서 흡광 도가 0.4가 되도록 조절한 후 540 nm에서 흡광도를 측정하 였다(A1). 다음으로 현탁액에 5%의 n-hexadecane(Sigma- Aldrich)을 첨가한 후 충분히 혼합한 후 실온에서 1시간 정치하여 상층의 hydrocarbon phase로 이동된 세포의 양을 유기용매를 제거한 뒤 흡광도를 540 nm에서 측정하였다 (A2). 각각의 흡광도 결과 값을 아래의 식에 대입하여 세포 표면의 소수성을 산출하였다.
16S rRNA 유전자 염기서열 분석을 통해 최종 선별 균주 의 동정을 실시하였다. 균체를 LB 액체 배지(Difco)에 접종 하여 30℃에서 18시간 배양한 후 14,000 rpm에서 10분간 원심분리하여 균체를 회수하고 QIAamp DNA mini QIAcube kit(Qiagen)를 이용하여 genomic DNA를 추출하였 다. 추출한 DNA를 universal primer인 27F와 1492R을 이용 하여 증폭하였고 증폭 유전자 산물은 (주)마크로젠에 의뢰 하여 염기서열을 해독하였다. 계통도 분석은 Tamura-Nei model에 기초한 Maximum Likelihood 방법(23)을 사용하여 작성하였으며, 산출한 각각의 계통수에서 각 분지에 대한 통계학적 신뢰도를 산출하기 위해 bootstrap 분석을 1,000회 실시하였다.
청국장의 제조는 순창산 백태를 사용하였으며, 형태가 고른 백태를 선별하여 3회 수세하고 25℃에서 16시간 동안 물에 침지한 뒤 약 30분간 체로 걸러 물기를 제거하고, 멸균 한 유리병에 500 g씩 담아 121℃에서 30분간 멸균 후 상온에 서 40-45℃가 되도록 냉각하였다. 최종 선별한 균주의 배양 액을 멸균 생리식염수로 3회 세척 후 백태의 1%(v/w, 105 CFU/g)가 되도록 접종하였다. 대조구는 동량의 멸균 생리 식염수를 첨가하고 각각의 시료는 37℃, 80%의 습도로 36 시간 발효시켜 청국장을 제조하여 특성 분석을 위한 시료로 사용하였다.
최종 선별한 균주를 사용하여 제조한 청국장의 발효 특 성 분석은 γ-PGA(γ-poly-glutamin acid)와B. cereus의 함량, 아미노태 질소 함량 및 유리아미노산 함량을 측정하여 분석 하였다. 먼저 γ-PGA 함량의 측정은 청국장 발효가 종료된 후 표면에 생긴 점질물의 점도를 Mann 등(24)의 방법에 따라 늘어나는 길이와 굵기, 점지물의 양을 비교하여 측정 하였으며, B. cereus의 함량은 22.5 mL의 멸균 식염수에 2.5 g의 청국장을 첨가하여 혼합한 뒤 단계 희석하여 BCA(Oxoid) 고체 배지에 도말하여 실제 시료에 존재하는 B. cereus의 생균수를 계수하여 확인하였다. 제조한 청국장 의 아미노태 질소 함량은 Formol 적정법(25)에 의해 측정하 였으며, 10 mL 멸균 증류수와 1 g의 열풍 건조한 청국장 시료를 혼합한 후 4,000 rpm에서 20분간 원심분리한 뒤 0.45 μm syringe filter(Sartorius)로 여과하였다. 여과 시료 10 mL에 0.1 N NaOH(Sigma-Aldrich) 용액을 사용하여 pH 8.4로 적정한 후 본 실험에서 소비된 0.1 N NaOH 용액의 양을 아래 식에 대입하여 아미노태 질소 함량을 산출하였 다.
-
A : titration value of blank treat(mL)
-
B : titration value of sample(mL)
-
C : factor of 0.1 N NaOH
-
D : nitrogen weight in 1 mL of 1 N NaOH(g)
-
E : dilution ration
-
F : mass of sample(g)
유리아미노산 함량은 2 g의 열풍 건조한 청국장 시료에 20 mL 멸균 증류수를 혼합한 후 3,000 rpm에서 10분간 원심 분리 후 상등액을 취하여 시험 용액으로 사용하였다. 2 mL의 시험 용액에 동량의 5% (v/w) trichloroacetic acid solution(TCA, Sigma-Aldrich) 용액을 첨가하여 혼합한 후 4℃에서 1시간 반응시킨 후 15,000 rpm에서 10분간 원심 분리하여 상등액을 취하였다. 상등액 500 μL에 동량의 0.02 N HCl(Sigma-Aldrich)를 첨가한 후 0.22 μm membrane filter(Sartorius)로 여과하고 아미노산 분석기(L-8900, Hitachi Co., Tokyo, Japan)을 이용하여 분석하였다.
결과 및 고찰
프로바이오틱스 특성을 갖는 고초균을 선별하기 위해 전통적인 방법으로 제조된 장류 100여 종을 수집하였으며, 확보된 시료를 단계 희석을 통해 형태학적 특징에 따라 약 400 종의 분리주를 1차 확보하였다. 선별한 분리주를 대상으로B. cereus를 선택적으로 분리할 수 있는 선별 배지 를 사용하여 100여 주의 분리주를 확보하였으며, 이를 대상 으로 효소, 항균활성 및 프로바이오틱스로서의 잠재적 특 성 분석을 위한 균주로 -80℃에 보관하여 사용하였다.
일반적으로 콩을 사용한 국내 전통 발효식품과 같은 식 품은 발효 과정 중 미생물이 생성하는 다양한 효소에 의해 콩이 갖는 단백질, 올리고다당류, 이소플라본, 지질 등이 소화되기 쉬운 아미노산, 유리당, 이소플라본, aglycone, 지 방산 등으로 분해되어 발효 식품의 풍미 향상과 기능성을 갖는 다양한 2차 대사산물을 생성한다고 알려져 있다(26). 따라서 분리주의 1차 선별을 위해 protease, amylase, cellulase와 혈전분해 효소 활성에 대한 정성 실험을 실시하 였다. 측정 결과 protease의 경우 1.5 cm 이상의 활성을 대부 분 지니고 있는 것으로 나타났으며, amylase와 cellulase의 활성은 없거나 낮은 수준을 유지하는 것으로 나타났다. 또 한 혈전분해 효소 측정 결과에서는 분리주의 약 50%가 활성을 갖지 않았으며, 20종의 분리주가 약 1.5 이상의 활성 을 나타내고 있는 것으로 측정되었다. 발효식품에서 특히 protease는 대두 단백질을 가수분해하여 구수한 맛 성분인 아미노산, polypeptide 함량에 영향을 준다고 알려지고 있으 며(27), cellulase는 식물 세포벽의 주 구성 성분인 cellulose 를 분해하여 장내 이용성을 향상시키고, amylase는 대표적 인 세포외 분비효소로 당분의 감미성분 등에 관여한다고 보고되고 있어(26) 선별 분리주 중 protease, cellulase, amylase에 대한 효소활성과 국내 중장년층에 많이 발생하 는 혈관 장애에 도움을 주는 혈전용해 활성도 동시에 갖는 분리주 50 주를 선별하였다(Table 2).
전통 발효식품의 경우 대부분 개방형 제조 방식으로 인 해 외부 오염원으로 인한 식품 유해 미생물의 오염이 빈번 하게 발생하게 된다. 특히, 식품의 부패와 오염으로부터 식중독을 유발하는B. cereus, S. aureus로 인한 식중독 발생 이 가장 많이 발생하게 되며, 이를 해결하기 위해 발효 과정 중 항균 활성 및 독소 유전자를 갖지 않는 발효 균주를 사용하는 등 다양한 연구가 최근 진행되고 있는 추세이다 (3,11). 따라서 앞선 효소활성 분석을 통해 선별한 50종의 분리주를 대상으로 정성적인 방법을 통해 1차로 항균 활성 을 측정하였고(Table 2), 약 30종의 분리주가 식중독 관련 미생물에 대한 항균활성을 보유하고 있는 것으로 나타났 다. 하지만 B. cereus는 Bacillus 속 균주와 계통학적으로 유연관계가 높고 급성 식중독, 구토 설사를 유발하는 독소 유전자를 갖고 있다고 알려지고 있어(28), 이와 관련된 유전 자 분석을 통해 선발 균주의 안전성을 추가로 확보하기 위한 유전자 분석을 실시하였다. 일반적으로 단백질 독소 로는 non-hemolytic enterotoxin(nhe), hemolytic enterotoxin (hbl), cytotoxin K(cytK)가 알려져 있고, 구토를 유발하는 펩타이드 독소로는 cereulide가 보고되고 있어(29,30), B. cereus가 생성하는 것으로 알려진 관련 유전자 10종에 대해 PCR을 통하여 선별 균주의 독소 유전자 보유 여부를 조사 하였다. 확인 결과 선발된 균주들 중 일부 분리주를 제외하 고는 대부분 한 개 이상의 독소 유전자를 보유하고 있는 것으로 나타나B. cereus 독소 관련 유전자를 모두 보유하지 않는 10종의 균주를B. cereus 독소 비생성 균주로 선별하였 다(Table 2). 또한, Bacillus 속 균주들이 병원성 세균을 억제 하는 지질 펩타이드 항생물질을 합성하는데 관련된 유전자 인 bacillomycin A(bmyA), iturin A(itudA), surfactin(surfA)의 유전자(29) 보유 여부를 추가로 조사하여 독소 생성 유전자 뿐만 아니라 외부 요인으로 인한 식중독 예방이 가능한 균주를 선발하기 위한 PCR을 실시하였다. SRCM 100730의 경우 항생 물질 합성 유전자를 모두 보유하고 있는 것으로 나타났으며, SCGB 55, SCGB 74, SCGB 149, SRCM 100169 는 itudA, surfA 유전자를 보유하고 있는 것으로 확인되어 (Table 2), 항균활성 관련 정성 및 유전자 분석을 통해 선발 한 10종의 균주 모두 식품 유해 미생물에 대한 유용한 항균 활성 균주로 활용 가능함을 확인하였다.
Biogenic amine은 단백질을 함유하고 있는 식품의 부패 또는 발효되는 과정에서 탈탈산 효소활성을 갖는 미생물에 의해 유리아미노산이 탈탄산 작용으로 생성되는 질소화합 물로, 히스타민과 티라민이 널리 알려져 있다. 세포의 성장 과 증식에 관여하기도 하지만 과량을 섭취하게 되면 고혈 압, 알레르기, 복통, 두통 등을 유발한다고 보고되고 있다 (9,10). 식품의 안전성 측면에서 최근 biogenic amine의 부작 용이 알려지면서 미생물 자체의 biogenic amine 생성에 대 한 연구도 매우 중요한 부분으로 자리 잡고 있다. 따라서 선별 균주를 이용하여 biogenic amine의 생성 여부에 대한 조사가 매우 중요하다. 선별된 균주를 이용하여 biogenic amine 비생성 균주의 선별을 위해 전구체인 히스타민과 티라민을 첨가한 액체배지에 배양 후 HPLC 분석을 통해 biogenic amine 생성 여부를 조사한 결과 선별 5종 모두 2종의 biogenic amine을 생성하지 않는 것으로 분석되었다 (Table 2). 또한 biogenic amine 합성 유전자로 알려진 histidine decarboxylase(hdc), tyrosine decarboxylase(tdc) 유 전자 보유 여부를 확인한 결과 선별 균주에서 HPLC 결과와 동일하게 모두 유전자를 보유하고 있지 않은 것으로 확인되 었으며(Table 2), 이로 인해 선별 균주 모두 식품내 안전성 부분에서도 biogenic amine을 생성하지 않음으로 최근 전통 식품에서 문제가 되는 biogenic amine의 유해성에 대하여 안전한 분리주임을 확인하였다.
선별 균주를 대상으로 hemolysin을 유리하여 적혈구를 용해하거나 혈액을 변색시키는 용혈성을 보유하고 있는지 확인한 결과 선별 균주 모두 용혈연쇄상구균이나 폐렴연 쇄상구균에 의한 용혈에 대한 α-hemolysis를 나타내는 것으 로 확인되었다(Table 3). 또한 프로바이오틱스 균주로 활용 하기 위해서는 면역시스템에 내성과 병원성, 알레르기성, 돌연변이 유발 발암성이 없어야 하며, 인체에 먹어도 안전 한 상태이어야 한다(31). 따라서 선별 균주가 tryptophanase 에 의해 tryptophane을 분해하여 생성되는 발암 관련 물질인 indole과 phenyl-pyruvic acid, 발암에 관련된 효소인 urease 와 β-glucuronidase를 생성하는지를 확인하는 실험을 진행 한 결과 Table 3과 같이 선별 균주 모두 발암 관련 물질을 생성하지 않는 것으로 확인되어, 타 분리주 대비 약한 용혈 성을 갖는 균주를 제외하고는 안전성이 우수함을 확인하였 다.
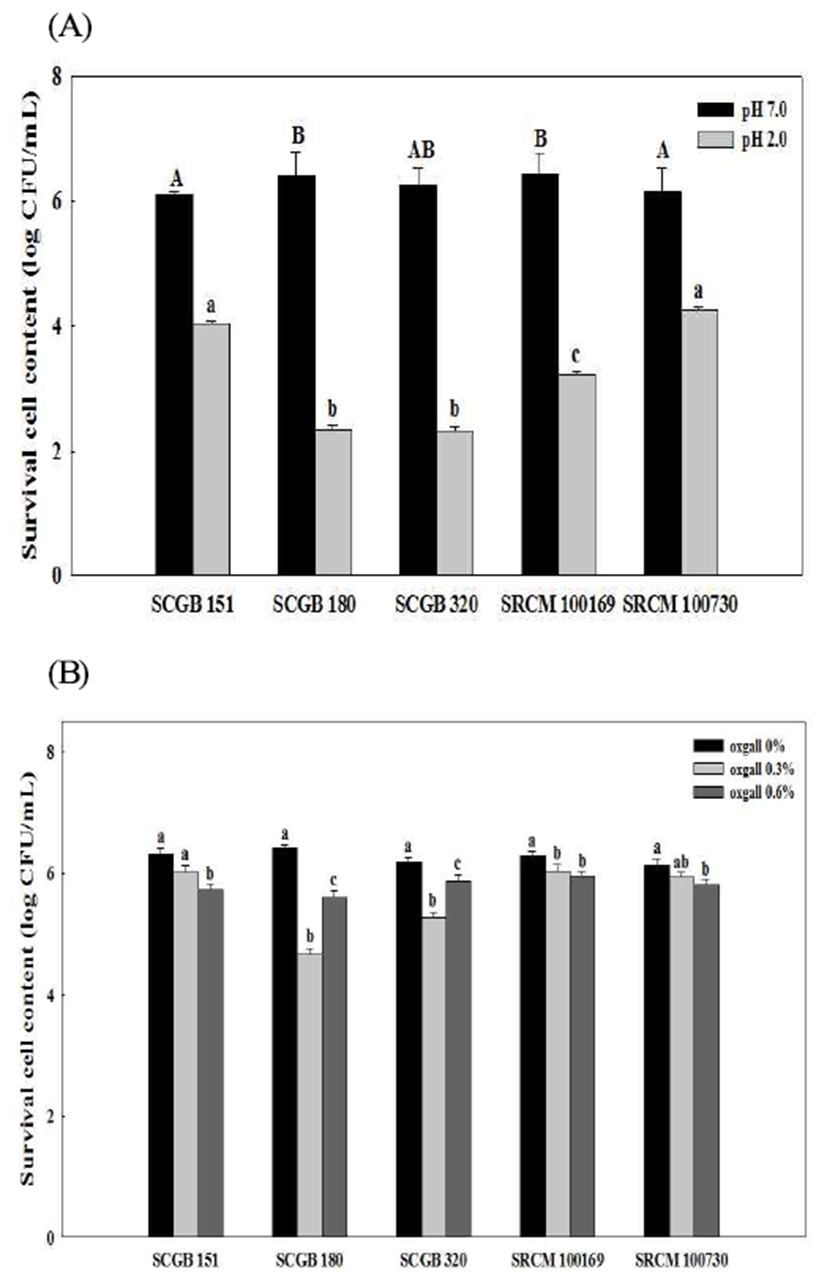
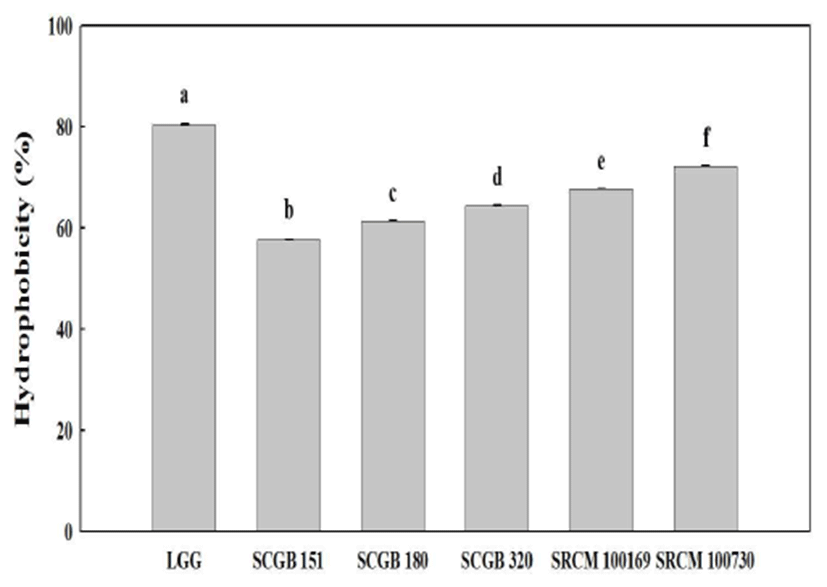
프로바이오틱스 균주로 활용하기 위해서는 무엇보다도 활성부위에서 생존하는 여부가 가장 중요하며, 최대 활성 을 위해서는 균주가 특수부위에 서식과 증식할 수 있는 특성을 가져야 하고, 낮은 pH와 고농도의 담즙산염에 대한 내성도 지녀야 한다(31). 특히 활성부위에 생존하기 위해서 는 미생물세포의 장내 부착성이 중요하며, 이는 세포 표면 의 소수성이 주요한 요인으로 알려져 있다(22). 따라서 선별 균주의 내산성을 확인하기 위해 pH 2.0 조건 하에 3시간 처리한 결과 일반 조건(pH 7.0, 6.0 log CFU/mL)과 비교해 5종의 선별 균주가 2.27 log CFU/mL에서 4.32 log CFU/mL 로 감소하는 경향을 보였으나, SCGB 151과 SRCM 100730 균주는 4.0 log CFU/mL 이상의 수치를 나타내고 있어 처리 전 대비 65% 이상의 생존율을 나타내었다(Fig. 1A). 또한 인공 담즙산에 대한 내성을 확인한 결과 장내 군총으로 견뎌야 하는 기준 농도인 0.3%에서 내성을 가졌으며, 특히 일반 대조구(6.26 log CFU/mL)와 비교해 선별 5종 모두 4.66 log CFU/mL 이상의 생균수로 최소 85% 이상의 생존율 을 나타내었고 0.6%의 조건하에서도 소폭 상승하거나 감소 할 뿐 크게 변동을 보이지는 않았다(Fig. 1B). El-Naggar 등(32)이 보고한 B. subtilis, L. brevis, L. plantarum 균주가 pH 3.0의 조건에서 2시간째 생존율이 각각 45%, 57%, 12% 인 것과 비교하면 최종 선별 균주 5종 모두 높은 내산성을 지니면서 동시에 담즙에 대한 높은 저항성을 나타내어 프로 바이오틱스로 적합한 안정성을 지닌 것으로 확인되었다. 프로바이오틱스 선발 기준 중에서 안정성과 더불어 장관세 포에 대한 부착성은 매우 중요한 요소로 Todorov와 Dicks(33)은 9개의 유산 균주의 소수성과 Caco-2 세포에 대한 부착능이 상관관계가 있음을 보고한 바 있다. 따라서 상업적으로 프로바이오틱스로 사용되는 고초균을 확보하 는데 어려움이 있어, 프로바이오틱스 특성이 우수하다고 알려진 대표 유산균 L. rhamnosus GG(LGG)를 대조구로 사용하였으며, n-hexadecane에 대한 부착능은 대조구가 80.41%로 높게 나타났고, 선별 균주는 약 57-72%의 부착능 을 지니고 있는 것으로 측정되었다(Fig. 2). Ananthaya Sansawat와 Thirabunyanon(34)이 보고한 n-hexadecane에 대 한 소수성이 25.6%를 갖는B. subtilis P33의 세포 부착능이 Caco-2 세포에서 4.2 log CFU/mL 부착한 점과 대조구를 유산균으로 비교한 점을 감안할 때 5종의 선별 균주 모두 부착능이 높을 것으로 기대되며 특히 SRCM 100730은 72.2%로 LGG와 유사한 높은 소수성을 나타내 프로바이오 틱스의 섭취 시 유해균의 증식 또는 부착을 다소 저해 할 수 있을 것으로 판단되며, 앞선 기능성 및 특성 분석 결과에 서도 우수하여 프로바이오틱스로 활용하기 위한 최종 균주 로 선별하였다.
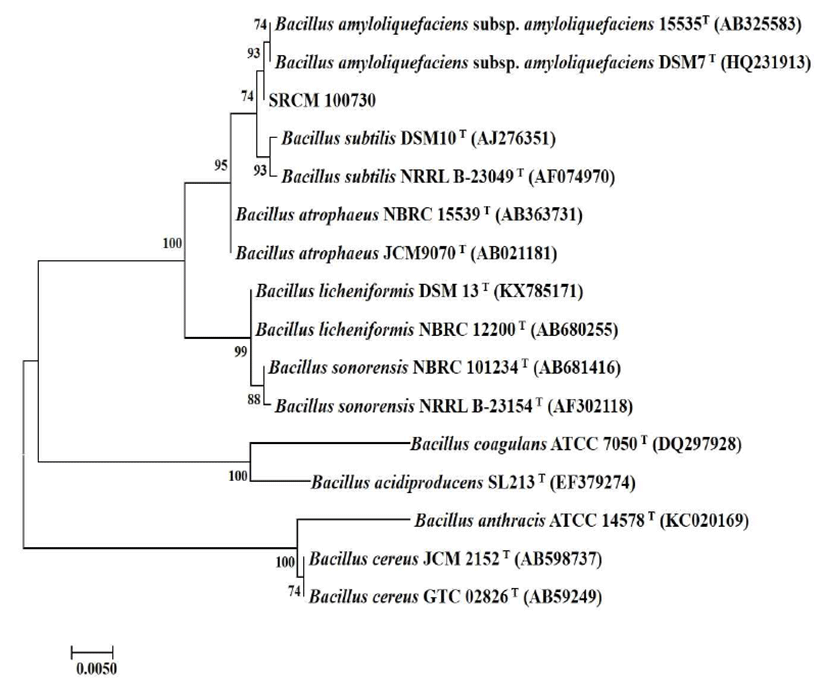
최종 선별한 SRCM 100730의 16S rRNA 유전자 염기서 열 분석 결과를 이용하여 BLAST search 결과 Bacillus amyloliquefaciens와 99%의 상동성을 보이며 B. amyloliquefaciens로 판명되었고, Eztaxon serve에서 표준 균 주와 상동성을 비교 분석하였다. Sequence alignment 분석 결과 SRCM 100730은 B. amyloliquefaciens DSM7(HQ 231913)과 95.8%의 상동성을 나타내었다. 분석한 염기서열 을 토대로 phylogenetic tree를 작성하기 위해 evolutionary distance의 추론은 maximum composite Likehood 방법을 모 델로 사용하였다(Fig. 3). 최종적으로 B. amyloliquefaciens SRCM 100730로 명명하였으며 한국미생물보존센터 (KCCM, Korean Culture Center of Microorganisms)에 B. amyloliquefaciens KCCM 11966P로 기탁하였다.
우리나라 전통 대두 발효식품인 청국장은 단백질과 불포 화 지방산의 함량이 많고 소화율이 높은 고단백 식품으로 다른 전통장에 비해 담그는 기간이 짧고 방법이 간단하다 (5). 청국장은 발효가 진행됨에 따라 숙성 과정 중 균으로부 터 각종 효소가 생성되며, 효소들이 청국장에 작용하면서 대두 성분을 분해해 소화율을 향상시키고 발효 과정 중 특이한 향미와 구수한 맛을 형성하는 동시에 끈끈한 점질물 을 생성하게 된다(24). 따라서 발효 기간이 짧고 장내 환경 을 개선할 수 있는 청국장을 제조하기 위해 최종 선별 균주 인 SRCM 100730 균주를 사용하여 청국장을 제조하여 γ -PGA, 효소활성, B. cereus 함량, 아미노태 질소 함량, 유리 아미노산 함량을 조사하여 청국장의 발효 특성을 분석하였 다.
고초균의 발효대사산물인 점질물은 glutamic acid가 중합 된 γ-PGA와 과당의 중합체인 fructan 형태의 레반으로 구성 되어 있으며, 이러한 점질물은 발효 제품 특히 청국장에서 품질 특성에 중요한 영향을 미치며, 면역증진 효과, 항암효 과 등의 생리활성 기능을 지녀 각광 받는 기능성 소재의 하나이다(35). 따라서 청국장의 정성적 평가를 통해 늘어나 는 신장력으로 γ-PGA를 측정한 결과 27.00 cm으로 시판 청국장 8.0 cm과 비교해 높은 함량의 γ-PGA를 지닌 것으로 확인되었다(Table 4). 또한 청국장, 낫또 등 대두를 이용한 발효물들은 효소의 작용에 의해 혈전용해 활성을 갖는 것으 로 알려져 있어, 최종 선별 균주와 일반 시판 청국장의 혈전 용해 활성을 측정한 결과 혈전용해 물질인 plasmin 500 μ g/mL(1.0 Unit)이 2.2 cm으로 나타났으며, 시판 청국장의 경우 3.78 cm, 선별 균주를 사용한 청국장 제조시 3.85 cm으로 큰 차이를 보이지 않았으나 균주 자체의 혈전용해 활성 1.79 cm와 비교해 크게 증가하여 대두가 선별 균주의 효소 작용에 의해 혈전 용해 활성도 동반 상승한 것을 확인 할 수 있었다(Table 4). Hwang(36)은 청국장 제조시 약 2.0 cm의 혈전 용해 활성을 나타내는 결과보다도 높은 수치를 보임을 확인하였고, 혈전 용해 활성이 우수한 균주를 활용 하여 청국장 제조시 균주 자체의 혈전용해 활성이 동일하거 나 증가하여 발현된다는 보고와는 일치하는 결과를 얻었 다. 이외 세포외 효소 활성은 protease 경우 1.94 cm으로 균주 자체의 활성과 비슷한 수치를 나타냈으나 당분의 감미 성분에 관여하는 amylase의 경우 2.29 cm으로 균주 자체의 활성보다 약 2배 이상 증가하였으며, cellulose를 분해하여 장내 이용성을 향상 시키는 cellulase 또한 1.5 cm으로 크게 증가하여 전반적으로 청국장 발효 후 효소 활성의 증가로 인해 풍미 및 장내 이용성이 향상된 것을 확인하였다(Table 4). 또한, 선별 균주를 이용하여 제조한 청국장의 경우 B. cereus가 검출되지 않아 초기 청국장 발효에서 생육하여 청국장뿐만 아니라 국내 발효식품에서 문제시 되는 B. cereus에 대한 SRCM 100730 균주의 길항 작용으로 인해 유해미생물의 제어가 이루어져 안전한 청국장이 제조된 것을 확인하였다.
아미노태 질소 함량은 대두 발효 식품의 맛의 척도로 미생물의 protease 효소에 의해 단백질이 peptide를 거쳐 아미노태 질소 형태로 가수분해 하며 청국장에서 구수한 맛이 형성되게 된다. 현재 식품 공전에 따르면 청국장의 아미노태 질소 함량은 280 mg%으로 규정되어 있으며, SRCM 100730을 이용하여 제조한 청국장에서는 544.02 mg%로 대조구인 시판 청국장 584.73 mg%와 비슷한 함량 으로 Mann 등(24)의 청국장 발효시 72시간까지 아미노태 질소 함량이 지속적으로 증가하여 425-450 mg%에 도달한 다는 보고보다 높은 함량을 나타내었고, Zheng 등(26)의 균주에 따라 일반적으로 112-224 mg% 함량을 기록한 보고 보다도 높은 함량을 기록하였다(Table 4). 또한 제조 청국장 과 일반 시판 청국장의 아미노산 함량을 측정하여 Table 5에 나타내었다. 청국장에서 유리아미노산은 단맛(alanine, lysine, glycine, serine, threonine), 쓴맛(leucine, isoleucine, valine, methionine, phenylalanine), 감칠맛(aspartate, glutamate, glycine, lysine, betaine)을 내는 역할을 한다고 알려져 있으며, 이들이 어우러져 청국장 특유의 향과 맛을 갖게 해준다고 보고되고 있다(37). 본 연구에서는 29종의 유리 아미노산을 분석하였으며, urea 232.94 mg/L로 가장 높았고, phosphoserine 128.44 mg/L, α-aminoadipic acid 78.83 mg/L의 순으로 나타났다. 특히 쓴맛을 내는 leucine, isoleucine, valine, methionine, phenylalanine이 시판 제품보 다 낮게 검출되었으며, SRCM 100730을 접종한 청국장에 서 γ-amino-butyric acid(GABA)의 함량이 28.72 mg/L로 시 판 청국장보다 3배 이상 높게 나왔다. GABA는 포유류의 중추신경계에 작용하는 억제계의 신경전달 물질로 비만 방지, 혈압강화, 간기능 개선 등의 효과가 있는 것으로 알려 져 SRCM 100730을 사용하여 제조한 청국장의 경우 쓴맛도 감소되고 성인병 예방에도 효과가 있는 청국장의 제조가 가능한 프로바이오틱스 균주로 활용 가능성이 높을 것으로 판단된다.
요 약
본 연구에서는 전통발효 식품에서 균주를 분리하고 상업 적으로 이용 가능하며 프로바이오틱스 특성, 우수한 발효 특성 및 전통발효식품에서 문제시 되고 있는 부분을 통제하 여 안전성을 갖는 Bacillus 속 균주를 선발하고자 하였다. 전통발효식품 100종에서 400종의 균주를 분리 후 선택배지 를 이용하여 Bacillus 속 균주 100 종을 1차 선별하였다. 분리주를 대상으로 세포외 효소, 항균활성 등 기본 균주 특성 분석을 수행하였고, biogenic amine 생성능, 용혈성 및 유해 대사산물과 효소 생성능을 조사하여 안전성을 확인 하였다. 또한 독소유전자, biogenic amine 생성 관련 유전자, 항균 펩타이드 유전자에 대한 보유 여부 조사를 통해 가장 우수한 5종의 균주를 2차 선별하였다. 5종의 선별 분리주를 대상으로 프로바이오틱스 활용 가능성을 확인하기 위해 내산성 및 내담즙성, 세포표면 소수성 분석을 실시하였다. 5종의 선별 균주 중 SRCM 100730은 pH 2.0 조건에서 4.24 log CFU/mL, 0.6% oxgall 조건에서 5.81 log CFU/mL로 높 은 생존율을 나타내었고, 세포 표면 소수성 분석 결과 72.2%로 가장 높은 소수성을 지니고 있어, 잠재적 프로바이 오틱스 특성이 우수한 SRCM 100730을 최종 균주로 선정하 였다. 최종 선발 균주는 16S rRNA 염기서열 분석을 통해 B. amyloliquefaciens로 확인되어 B. amyloliquefaciens SRCM 100730(KCCM 11966P)로 명명하였으며, 이를 이용 한 청국장을 제조하여 대두를 이용한 발효 특성을 확인하였 다. 제조 청국장은 B. cereus가 검출되지 않았으며, γ-PGA 와 세포외 효소 활성이 시판 청국장과 비교해 우수함을 확인하였다. 또한 아미노태 질소 함량은 544.02 mg%, 유리 아미노산은 26종이 검출되었고, 쓴맛을 내는 leucine, isoleucine, valine, methionine, phenylalanine이 시판 제품보 다 낮으며, 중추신경계에 작용하는 억제 신경전달물질인 GABA는 시판 청국장에 비해 약 3배 높은 것을 확인하였다. 연구 결과를 토대로 SRCM 100730은 세포외 효소 및 항균 활성이 우수하고, 내산성 및 내담즙성 등의 프로바이오틱 스 특성이 우수하며, 청국장 발효와 같은 발효식품 산업에 활용 가능성이 높은 프로바이오틱스 소재로 기대된다.










