서 론
염증이란 조직손상이나 세균 감염 등과 같은 자극에 대 한 손상부위를 최소화 하거나 복구하려는 방어적 기능으 로, 손상된 조직을 재생하기 위해 일어나는 신체적 반응이 다(1). 이러한 염증반응은 발열, 부종, 통증을 발생시킬 뿐만 아니라 점막손상을 유발하여 염증성 질환 및 암의 발병을 초래하게 된다(2). 대식세포(macrophages)는 식균 작용을 통해 항상성 유지에 관여하며, lipopolysaccharide(LPS)와 같은 자극에 의해 tumor necrosis factor(TNF-α), interleukine (IL)-6, IL-1β 등의 pro-inflammatory cytokine을 비롯하여 inducible nitric oxide synthase(iNOS) 및 cyclooxygenase-2 (COX-2)와 같은 효소의 발현을 통해 nitric oxide(NO), prostaglandin E2(PGE2)를 생성하여 염증반응을 유도하고 염증이 발생된 부위로 면역세포의 이동이 촉진 된다(3,4). NO는 활성화된 iNOS로부터 생성된 L-arginine으로부터 생 성되며(5), NO의 발현과 pro-inflammatory cytokine의 생산 은 주로 nuclear factor kappa B(NF-κB)와 mitogen-activated protein kinases(MAPKs)를 통해 일어난다(6). NF-κB는 보통 세포질에 존재하게 되지만, 염증이 발생하면 핵 안으로 들 어가 염증 매개 효소(iNOS, COX-2) 및 염증 매개성 cytokine을 합성하며, 주로 세포질에서 IκB와 결합하여 NF- κB의 활성이 억제된다(7,8). 또한, MAPKs의 활성은 대식세 포에서 NO의 생성과 pro-inflammatory cytokine의 발현을 초래한다(9). 따라서 NF-κB 및 MAPKs의 활성을 억제하여 염증성 매개인자들 감소에 영향을 주는 것은 염증반응을 조절하기 위한 신호전달 요소로서 이와 같은 활성을 가지는 천연물을 찾기 위한 연구가 활발히 진행되고 있다.
해조류는 현재 많은 연구들로부터 다양한 생리활성이 물질이 풍부한 것으로 보고되고 있으며, 그중 갈조류는 항 암, 고지혈증 개선, 항균 등의 주요 생리 활성이 알려져 있다. 특히 갈조류의 cellulose, alginic acid, fucoidan과 같은 다당류에 관한 생리활성 연구가 활발히 진행 중 이며, fucoidan의 경우 항암, 항응고제 등의 다양한 생리활성물질 을 포함하고 있는 것으로 알려져 있다(10-12). 이처럼 다양 한 해조류 중 넓패(Ishige sinicola)는 갈조식물문 (phaeophyte), 민가지말목(Chordariales), 패과(Ishgeacease)에 속하는 갈조류로서 남부 해안 각지, 제주도, 일본 및 중국에 분포하고, 파도가 조용한 남부 해안과 제주도 등 주로 조간 대에서 서식하고 있다(13). 또한 넓패에 대한 연구는 활발히 진행 중이지만 항염증에 대한 실험은 미비한 실정이다.
이에 본 연구에서는 넓패의 다양한 활용을 위해 LPS로 유도한 RAW 264.7 세포의 염증 반응에 대한 넓패 에탄올 추출물의 효과를 알아보기 위해 NO 및 전염증성 cytokine (IL-6, TNF-α, IL-1β)의 발현정도, 세포 독성에 대해 조사하 였으며, 이를 통해 항염증 활성을 갖는 소재로서의 넓패의 기능성을 밝히고자 하였다.
재료 및 방법
본 실험에서 사용한 넓패는 2014년도 부산 연화리에서 채취하였으며 이를 담수로 깨끗이 수세하고 동결 건조 한 후 분말화 하고 진공 포장하여 -20℃에서 보관하며 사용하 였다.
넓패 건조 분말에 10배의 95% 에탄올을 첨가 하고, 교반 기(H-0820, Dongwon Science Co., Busan, Korea)를 이용하 여 24시간 동안 상온에서 교반기를 돌린 후 추출하였다. 원심분리기를 이용하여 3,000 rpm에서 10분간 원심분리한 후 상층액만 취하였고, 이후 남은 잔사를 이와 동일한 방법 으로 2회간 반복 추출하였다. 추출한 상층액은 37℃에서 감압농축기(RE200, Yamoto Co., Tokyo, Japan)로 농축하였 으며, 농축 후 건조된 시료는 -20℃에서 보관하며 실험에 이용하였다.
ICR 마우스(생후 8주령, 수컷)을 오리엔트 바이오로부터 구입하여 귀 부종 및 귀 조직실험에 사용하였으며, 마우스 는 온도 20℃, 습도 50%, 12시간 명암주기가 유지되는 동물 실에서 1주일간 예비 사육한 후 실험에 사용하였다. 본 실험 은 부경대학교 동물실험 윤리위원회로부터 동물실험 승인 을 받아 수행하였다(승인번호 2015-04).
대식세포인 RAW 264.7 세포(KCLB 40071)를 한국 세포 주 은행으로부터 분양 받아 사용하였으며, DMEM(GIBCO, Grand Island, NY, USA)에 10% inactivated fetal bovine serum(HyClone Laboratories, Inc, Logan, Utah, USA)과 1% penicillin-streptomycin(HyClone Laboratories, Inc.)을 첨가 한 배지를 배양액으로 37℃, 5% CO2 incubator(MCO-15AC, Sanyo, Osaka, Japan)에서 배양하였다. 실험과정의 모든 세 포는 80-90% 정도의 밀도로 자랐을 시 계대배양을 실시하 였고, 20 passages를 넘기지 않은 세포만 사용하였다.
추출물의 세포독성을 평가하기 위해 Kim 등(14)의 방법 을 인용하여 MTT assay를 실시하였다. RAW 264.7 세포 (1×106 cells/mL)를 well plate에 분주하고 20시간 전 배양 후, 추출물을 농도 별(0.1, 1, 10, 50, 100 μg/mL)로 첨가하여 24시간 배양하였으며, 배양 후, 5 mg/mL 농도의 MTT시약 을 첨가하여 2시간 재 배양하고 이를 4℃, 2,000 rpm에서 10분간 원심분리(UNION 32R, Hanil Co., Incheon, Korea)하 여 상층액을 제거하였다. 그 후, 각 well에 dimethyl sulfoxide (Sigma-Aldrich Co., St. Louis, MO, USA)를 첨가하고 이를 microplate reader(Model 550, Bio-rad, Richmond, CA, USA) 를 이용하여 540 nm에서 흡광도를 측정하였으며, 세포 생 존율을 다음 식에 의해 계산하였다.
세포로부터 생성된 NO에 대한 넓패 추출물의 영향을 알아보기 위해 Kim 등(14)의 방법을 약간 변형하여 griess 시약(1% sulfanilamide+0.1% naphthylendiamine dihydrochloride, 1:1) 반응을 이용하여 배양액 중에 존재하는 NO2-의 형태로 측정하였다. RAW 264.7 세포를 2.5×105 cells/mL의 농도로 48-well plate에 접종하고, 5% CO2 incubator(MCO-15AC, Sanyo)에서 20시간 전 배양하였다. 세포에 1 μg/mL의 LPS 와 추출물을 농도별(0.1, 1, 10, 50, 100 μg/mL)로 처리하여 24시간 재 배양하였다. 배양액의 상층액을 얻은 후, 상층액 과 griess 시약을 1:1의 비율로 실온에서 10분간 반응시키고, microplate reader(Model 550, Bio-rad)를 이용하여 540 nm에 서 흡광도를 측정하였다. 세포배양액 내 NO의 농도는 sodium nitrite(NaNO2)의 농도 별 표준곡선과 비교하여 산출 하였다.
세포배양액 중 IL-6, TNF-α 및 IL-1β cytokine의 분비량을 Kim 등(15)의 방법을 인용하여 ELISA kit(Mouse ELISA set, BD Bioscience, San Diego, CA, USA)를 이용하여 측정 하였다. 이를 위해 ELISA microplate에 capture antibody anti mouse IL-6, TNF-α 및 IL-1β를 분주하여 4℃에서 하룻밤 동안 coating 하였다. 이를 0.05% Tween 20이 포함된 PBST 로 세척 후 10% FBS 용액으로 blocking 하였다. 그리고 PBST로 세척한 뒤 microplate에 각 배양 상층액을 분주하고 실온에서 2시간 반응시켰다. 다시 PBST로 세척한 뒤, 희석 한 biotinylated anti-mouse IL-6, TNF-α detection antibody와 streptavidin-horseradish peroxidase conjugate를 첨가하여 실 온에서 1시간 반응시켰다. IL-1β의 경우, biotinylated anti-mouse IL-1β detection antibody를 첨가하고 1시간 반응 후, streptavidin-horseradish peroxidase conjugate를 첨가하 여 30분 반응시켰다. 그 후, 다시 PBST로 세척한 다음, OPD 용액을 첨가하여 실온에서 30분간 암 반응시켰다. 2 N H2SO4로 반응을 종료 시킨 후, microplate reader(Model 550) 를 이용하여 490 nm에서 흡광도를 측정하였다.
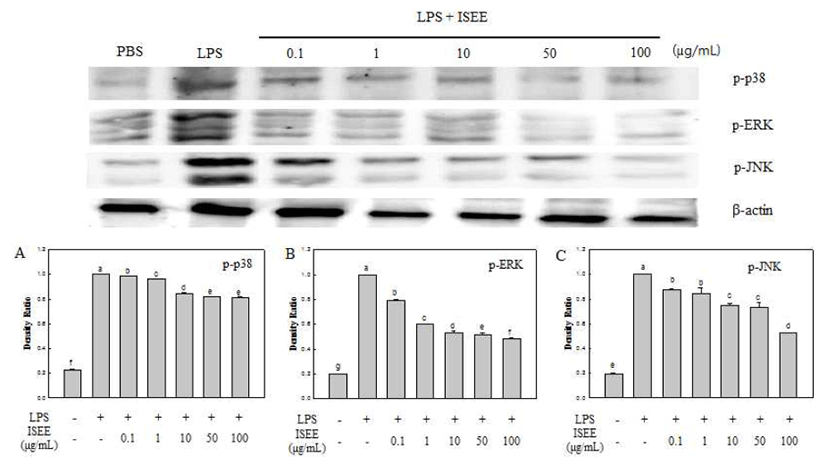
배양이 끝난 세포를 수집하여 3회 PBS(phosphate buffered saline)로 세척한 후, lysis buffer[50 mM HEPES(pH 7.4), 150 mM NaCl, 5 mM EDTA, 1% deoxycholate, 5 mM phenylmethylsulfonyl fluoride(PMSF), 1 μg/mL aprotinin, 1% triton X-100, 0.1% NP-40]를 첨가하여 30분간 4℃에서 lysis시킨 후, 12,000 rpm에서 10분간 원심분리 하여 세포막 성분 등을 제거하였다. 단백질 농도는 BCA protein assay kit(Pierce, Rockford, IL, USA)를 사용하여 정량하였으며, 30 μL의 lysate를 10% sodium dodecyl sulfate-polyacrylamide gel electrophoresis(SDS-PAGE)로 분리하였다. 분리된 단백 질은 polyvinylidene difluoride membrane(PVDF, Bio-rad)에 70 mA에서 1시간 30분 동안 전사시킨 후, Kim 등(16)의 방법에 따라 5% skim milk가 포함된 TBST(tris buffered saline; pH 7.5) 용액으로 상온에서 2시간동안 blocking 하였 다. iNOS, COX-2 및 NF-κB의 발현 양을 검토하기 위한 항체로는 anti-mouse iNOS, COX-2 및 NF-kB(Santa Cruz Biotechnology, Inc., Dallas, TX, USA)를 사용하였으며, MAPKs의 발현양을 알아보기 위해 anti-mouse JNK, ERK 및 p38(Cell Signaling Technology, Inc., Denvers, MA, USA) 항체를 사용하여 1:500으로 희석해서 사용하였다. 각각 상 온에서 2시간 반응시킨 후 TBST로 3회 세정하였다. 2차 항체로는 horseradish peroxidase가 결합된 anti-mouse IgG 및 anti-rabbit IgG(Santa Cruz Biotechnology, Inc.)를 1:2,000 으로 희석하여 상온에서 1시간 반응시킨 후, TBST로 3회 세척하여 ECL(Thermo Scientific, Rockford, IL, USA) 기질 과 1-3분간 반응한 후 각각의 단백질 밴드는 Gene tool(Syngene software, Synopics Ltd., Cambridge, UK)를 이 용하여 가시화 및 정량하였다.
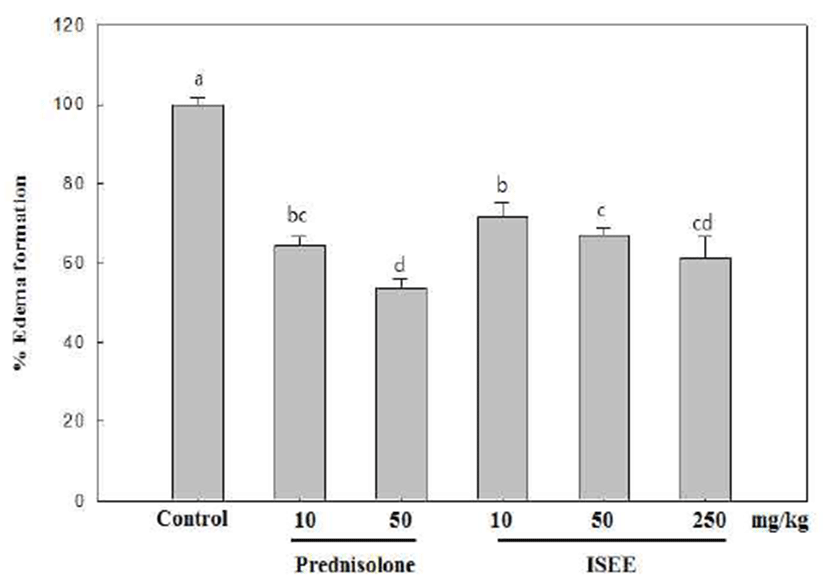
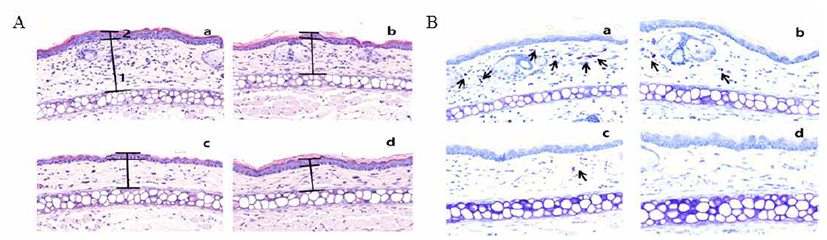
귀 부종 측정을 위해 ICR mouse에 추출물을 10, 50 및 250 mg/kg·body weight 농도가 되도록 200 μL씩 단 회 경구 투여 하고 한 시간 후, 오른쪽 귀에 2.5% croton oil(Tokyo Chemical Industry Co., Ltd., Tokyo, Japan)을 20 μL/ear씩 도포하였다. 귀 두께는 croton oil을 처리하고 5시간 후에 측정하였으며 croton oil 처리한 후 두께의 증가를 부종의 형성으로 간주하였다. 귀 조직 관찰은 ICR mouse의 오른쪽 귀에 추출물을 100 mg/mL 농도로 20 μL씩 도포하고 15분 뒤, 5% croton oil을 20 μL씩 도포하였다. 6시간 후, diethylether로 마취시키고, 귀 조직을 절제하여 10% formaldehyde에 72시간 고정하였다. 고정 후 파라핀 블록을 만들러 박편을 제조하고 hematoxylin-eosin 및 toluidine-blue 염색을 하여 조직을 관찰하였다.
결과 및 고찰
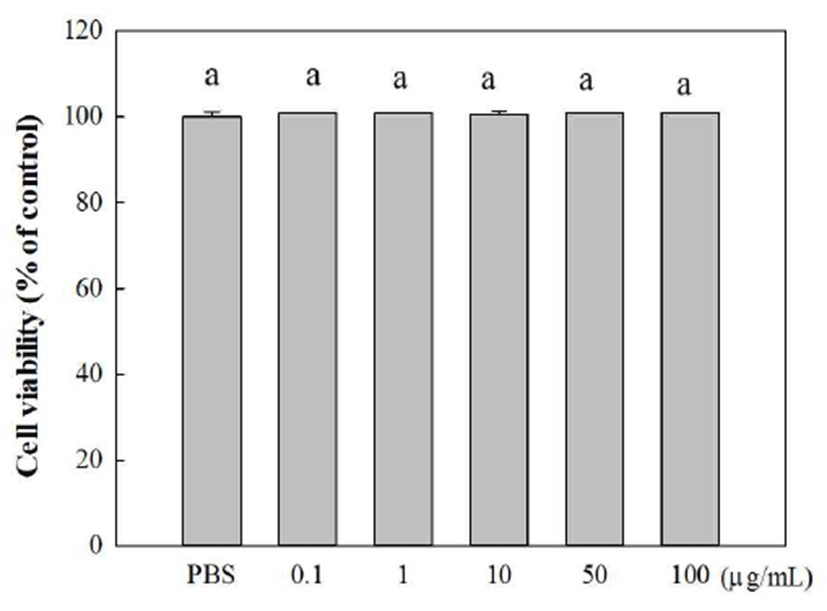
넓패 추출물이 대식세포에 미치는 영향을 확인하기 위해 추출물을 0.1, 1, 10, 50, 및 100 μg/mL의 농도로 첨가하여 MTT assay를 수행하였다. 그 결과, PBS 처리구와 비교하였 을 시 세포의 생존율이 추출물의 모든 처리에서 농도 의존 적인 차이를 보이지 않음을 관찰하였다(Fig. 1). 따라서, 넓 패 추출물이 RAW 264.7 세포에 대해 독성이 나타나지 않음 을 확인 한 후 실험을 진행하였다.
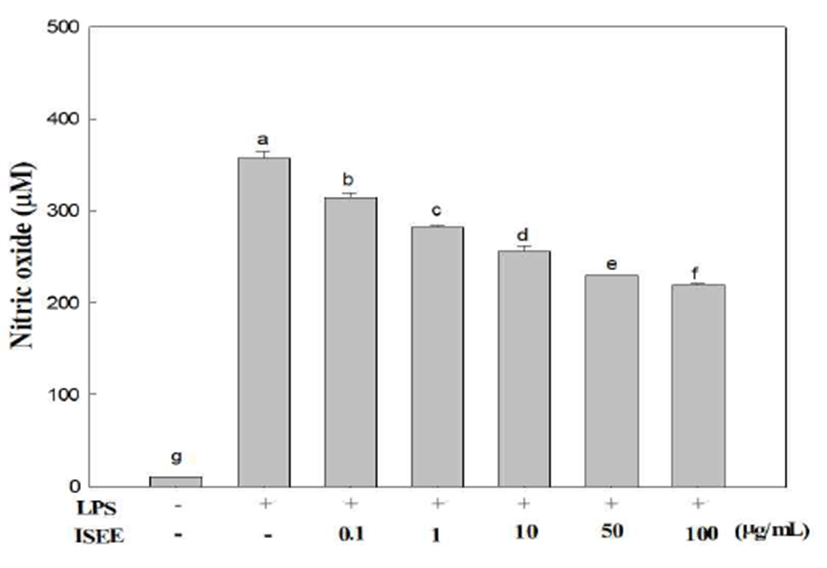
NO는 L-arginine에서 산화질소 합성효소에 의하여 생성 되는 산화물질로서 암 생성, 피부손상 및 노화의 주요 원인 이 되며 매우 불안정한 화합물로서 LPS와 같은 염증유발물 질에 의한 과도한 증가는 염증을 유발하고 조직의 손상을 초래한다(17,18). 따라서 RAW 264.7 세포에서 LPS로 유도 된 NO에 대해 넓패 에탄올 추출물의 억제효과를 확인하였 다(Fig. 2). RAW 264.7 세포를 LPS로 활성 시킨 후, LPS 처리군은 LPS를 처리 하지 않은 처리 군에 비하여 10배 이상 NO의 농도가 높아졌음을 확인할 수 있었다. 추출물을 처리하였을 경우, 전반적으로 시료의 농도가 증가할수록 NO 생성 억제능이 증가하였으며, 특히 100 μg/mL에서 38% 이상 감소를 보임을 확인하였다.
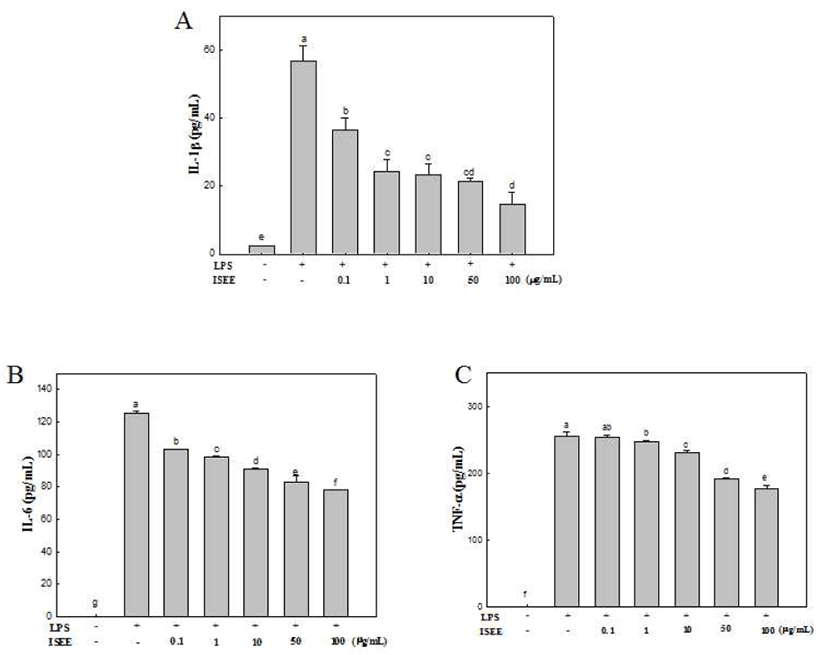
사이토카인은 다양한 세포들에서 분비되어 손상이나 감 염에 대한 면역반응 조절과 세포간 신호전달을 담당하는 물질이다(19). 그중, pro-inflammatory cytokine은 염증 면역 반응에서 자연히 동반되는 매개물로서 정상조직에서 발현 될 뿐만 아니라 병리적인 조건 하에서 그 발현정도가 증가 되며 중추신경계의 염증반응 확장(20)과 피부염증 및 암 발생등에서중요한역할을한다(21). 대표적인pro-inflammatory cytokine은 IL-6, TNF-α 및 IL-1β cytokine가 있다(22). LPS 로 염증이 유발된 RAW 264.7 세포는 종양 괴사 인자인 TNF-α를 생성하는데 이는 전사인자를 활성화시키며 분비 된 TNF-α 및 LPS는 IL-6 및 IL-1β의 생성을 유도하여 NO 생성과 국소적 염증을 발생시켜 염증반응을 지속시키게 된다(23,24). 따라서 초기 면역 반응과 염증단계에서 중요 한 역할을 하는 pro-inflammatory cytokine의 생성을 저해 시, 염증반응이 조절될 가능성이 높다고 보고하였다(25). 본 연구에서는 넓패 추출물이 pro-inflammatory cytokine의 생성에 미치는 영향을 알아보기 위해 RAW 264.7 세포에 LPS 처리 후 추출물을 농도별로 처리하여 ELISA 방법을 통해 측정하였다. 그 결과(Fig. 3), IL-1β의 분비량이 넓패 추출물의 50 μg/mL의 농도로 처리하였을 때 LPS 처리구보 다 62% 감소하였다(Fig. 3A). 또한 LPS 자극에 의해 유도되 는 IL-6, TNF-α cytokine의 생성이 각각 33.87%, 25.23% 감소를 보였다(Fig. 3B-C). 이는 넓패 에탄올 추출물이 RAW 264.7 세포에서 염증성 cytokine이 억제되어 항염증 효과에 관여하는 것을 의미한다.
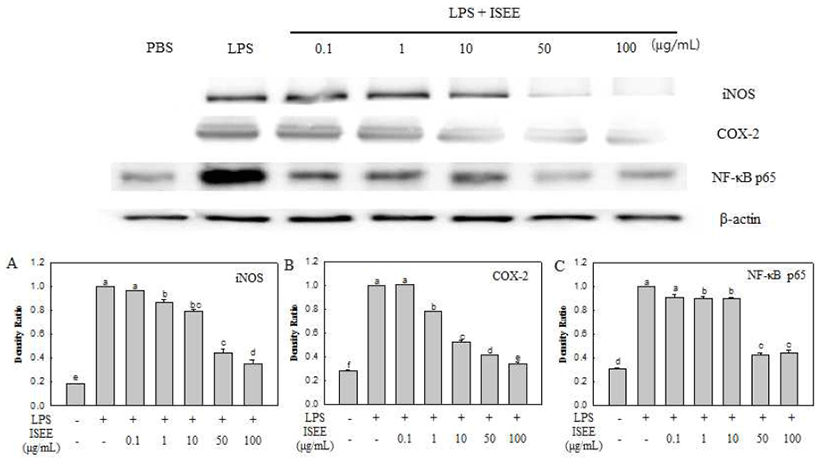
iNOS는 보통 세포 내 존재하지 않으나 체내에 염증반응 이 일어나면 세포에서 iNOS의 발현이 증가 되어 다량의 NO가 생성되며 이는 신경손상, 조직 손상 등과 함께 혈관 투과성이 증가되어 부종 및 발열 등의 염증반응을 촉진시킨 다(26,27). 또한, COX-2는 염증 매개 물질인 PGE2의 형성 에 관여하며, NF-κB는 염증반응과 관련된 promoter에 결합 되어 LPS 등에 의해 활성화된 이후 핵으로 이동하여 iNOS, COX-2 등의 염증반응을 유도하는 유전자 발현을 촉진시키 는 것으로 알려져 있다(28,29). 따라서 이들 매개인자(iNOS, COX-2 및 NF-κB)의 발현 양에 미치는 추출물의 항염증 효과를 확인 하였다. RAW 264.7 세포에 추출물을 0.1, 1, 10, 50, 및 100 μg/mL 농도로 처리하고 각 단백질의 발현 양을 측정한 결과(Fig. 4), LPS 단독 처리구에는 각 단백질 의 발현양이 눈에 띄게 증가하였으나 추출물을 처리하였을 때, 그 발현양이 농도 의존적으로 감소하는 것을 확인할 수가 있었다. 특히, 50 및 100 μg/mL 농도에서 PBS 처리구 와 유사한 발현 양을 보여 탁월한 항염증 효과를 확인하였 다. 또한, iNOS의 단백질 발현 감소 결과는 iNOS의 활성화 로부터 생성되는 NO의 분비량 감소 결과와도 관련이 있음 을 알 수 있다. 넓패 추출물은 최종 농도인 100 μg/mL과 비교 하였을 때, 각각 iNOS는 65%, COX-2는 67%, NF-κB는 56%의 발현양 감소를 확인하였다(Fig. 4A-C). 이러한 결과 를 바탕으로 NF-κB의 활성억제를 통해 COX-2 및 iNOS 발현을 억제하며 PGE2와 NO의 생성을 저해하여 항염증 효과를 나타낸다고 사료된다.
MAPKs는 pro-inflammatory cytokine에 중요한 조절인자 로서 ERK, JNK, p38 등의 신호전달경로를 가지고 있다. 이러한 활성은 인산화에 의해 나타나며, 신호전달은 주로 LPS와 같은 염증자극에 반응하며 세포내에서 활성화되어 사이토카인 전사를 유도한다(30). 따라서 인산화된 MAPKs 의 발현양을 western blot을 통해 알아본 결과(Fig. 5), LPS로 유도된 RAW 264.7 세포에서 p-ERK, p-p38의 발현이 넓패 에탄올 추출물 처리에 의해 농도 의존적으로 감소함을 확인 하였다, 특히 p-ERK, p-p38, p-JNK의 발현은 추출물 100 μg/mL에서 LPS 단독 처리구의 발현양에 비하여 인산화 된 p38, ERK 및 JNK의 발현양이 각각 19%, 52% 및 48% 감소하였다(Fig. 5A-C). LPS는 MAPKs와 NF-κB를 활성화 를 통해 NO 및 pro-inflammatory cytokine을 발생시킨다. 이러한 과정을 통해 염증반응에 관여한다. 따라서 본 연구 의 결과를 종합해 볼 때 넓패 추출물의 염증 매개성 물질 감소 효과는 NF-κB의 활성화 및 MAPKs 인산화 억제로 인한 항 염증효과로 사료된다.
Mast cell은 모든 피부조직이나 점막조직에서 관찰 할 수 있다. 주로 염증, 알레르기에 중요한 역할을 하는 세포이 다(31). 염증반응이 발생하면 활성화된 mast cell은 염증 매개체들을 방출한다. 그 중 protease나 histamine과 같은 혈관확장 물질들을 분비하며 혈관확장, 부종, 발열, 호중구 의 활성화, 비만세포 조직의 침윤 등이 있으며, 이는 외부 환경에 의해 손상된 부위를 복구 시키려는 일련의 생체과정 이다(32,33). 이에 본 연구는 염증 반응 중 하나인 부종에 대한 넓패 에탄올 추출물의 부종 억제 효과 및 조직 내의 mast cell 억제 효과를 알아보기 위해in vivo 실험을 진행하 였다. Positive control으로 사용된 합성 스테로이드인 prednisolone은 10 및 50 mg/kg·body weight의 농도로 진행 하였으며, 넓패 에탄올 추출물은 10, 50, 250 mg/ kg·body weight 농도가 되도록 200 μL씩 경구 투여 한 후 croton oil로 염증을 유발하여 급성부종을 일으킨 다음 귀 두께를 측정하였다. 그 결과(Fig. 6), control과 비교했을 때 모든 추출물의 농도에서 유의적으로 귀 두께가 감소한 것을 확인 할 수 있다. 특히 넓패 추출물의 250 mg/ kg·body weight 처리구가 positive control인 prednisolone 10 mg/ kg·body weight 처리구와 유사하게 감소한 것을 확인하였다. 또한 이는 조직 관찰 결과에서도 확인 할 수 있으며, croton oil만 을 처리한 경우에 비해 넓패 추출물 처리구의 경피 및 진피 두께가 얇아진 것을 알 수 있었다(Fig. 7A). 또한 조직내 mast cell의 조직의 수를 관찰 한 결과(Fig. 7B) 넓패 에탄올 추출물의 처리구가 염증반응에서 mast cell의 침윤을 억제 한 것을 확인하였다.
요 약
본 연구에서는 넓패 에탄올 추출물의 항염증 효과를 알 아보기 위해 RAW 264.7 세포에 LPS로 유도된 염증 반응 in vitro 및 in vivo 실험을 실시하였다. RAW 264.7 세포에 LPS와 함께 세포를 배양하였다. 먼저 MTT assay 실험을 통해 넓패 에탄올 추출물이 모든 농도(0.1, 1, 10, 50, 100 μg/mL)에서 세포독성을 나타내지 않는 것을 학인 하였다. 또한 모든 농도에서 염증억제 효과를 살펴 본 결과, LPS 처리구는 iNOS, COX-2, NF-κB 그리고 MAPKs의 발현양을 증가 시켰으나, 넓패 에탄올 추출물의 경우 염증 반응에 관여하는 전사인자인 NF-κB와 MAPKs의 활성을 억제함으 로써 항염증 효과를 나타내었다. 마지막으로 넓패 에탄올 추출물의 mast cell의 피부 조직학적 변화를 알아본 결과, control의 경우 진피와 경피의 면적이 확장 되어있고, mast cell의 침윤이 정상 군에 비하여 현저하게 증가함을 알 수 있었다. 반면에 넓패 에탄올 추출물의 경우 대조군에 비해 진피와 경피의 두께가 줄었으며 mast cell의 침윤감소에 효과가 있는 것을 확인하였다. 따라서 모든 결과를 종합하 였을 때 넓패 에탄올 추출물이 항염증 치료제 뿐만 아니라 더 나아가 항염증에 유용한 기능성 식품소재로써 가치가 높다고 사료된다.










