서 론
인간을 포함한 생물체는 에너지 생성과정에서 산소가 필요하며 이들 산소 중 일부는 자유라디칼 반응에 의해 노화 및 질병의 원인이 되는 활성산소가 생성된다(1). 인간 은 활성산소의 유리기를 제거하는 다양한 항산화 물질을 생성하며, 항산화 방어시스템을 지니고 있다. 그러나 항산 화 시스템은 과잉 생성된 다량의 산화물을 모두 방어할 수 없으므로 산화적 스트레스를 감소시킬 수 있는 항산화제 를 추가 섭취하여 활성산소를 제거하는 것이 질병예방에 매우 중요하다(2). 이에 새로운 항산화 물질을 찾고자 한약 자원을 포함한 민간약초로부터 생리활성 물질의 동정 및 그 작용기전에 관해 활발한 연구가 진행되고 있으며, 특히 폴리페놀 화합물 유래 항산화제가 질병예방 및 치료제로서 의약품 및 기능성 식품 산업화에 집중되고 있는 추세이다 (3,4)
이팝나무(Chionanthus retusus)는 물푸레나무과(Oleaceae) 에 속하는 다년생 낙엽교목으로 이팝나무 꽃이 쌀밥과 같다 하여 이팝나무라고 명명하게 되었다고 하며, 육도목(六道 木), 다엽수(茶葉樹)라고도 한다. 예로부터 민간에서는 성숙 된 이팝나무 열매는 설사를 멈추고 위장을 튼튼하게 하는 건위작용이 있어 지사제, 건위제, 해열제 및 중풍 등의 질환 치료제로도 사용하였으며, 이팝나무 잎은 나물로 먹거나 차로 마시기도 하였다(5,6). 최근에는 관상용으로 가로수 및 조경용으로도 활용도가 높아지고 있다. 이팝나무 잎과 줄기는 다양한 플라보노이드를 포함한 폴리페놀 화합물과 lignan, coumarin 화합물 등 다양한 유용성분을 함유하며 (7-9), 항산화 활성(10) 및 항암 효과(11)가 있다고 보고된 바 있다.
생리활성이 우수한 한약자원을 포함한 천연유래 생물자 원을 활용하기 위해서는 그 특징을 고려한 추출공정에 대한 검토가 필요하다(12). 저렴한 비용과 짧은 시간에 동일한 양의 생물자원으로부터 다량의 기능성 성분을 생산할 수 있어야 한다(13). 일반적으로 열수 추출은 식품의 추출방법 으로 많이 이용되고 있으나 가용성분 위주의 추출로 인해 낮은 추출수율, 고온으로 인한 에너지 소비 및 열에 의한 유용성분 파괴 등의 단점이 있다. 그러나 물을 용매로 사용 하므로 인체에 가장 안전하며, 가압되는 경우 다양한 화학 적 변화에 의해 생리활성 물질이 증가된다는 연구가 보고 된 바 있다(14). 그러나 민간에서는 약용으로 사용되고 있는 이팝나무는 주로 관상용으로만 식재되고 있을 뿐 이팝나무 에 대한 영양학적 가치와 생리활성에 대한 관심과 연구는 미흡한 실정이다. 이에 활용도가 낮은 이팝나무 성숙 열매 의 과육에 대한 폴리페놀과 플라보노이드 화합물, 그리고 수용성 단백질과 환원당의 함량을 측정하고, DPPH와 ABTS radical 소거율 및 아질산염 소거율 등을 측정하여 식품소재로서의 활용 가능성과 미백 및 항주름 활성 등의 비교 분석함으로써 화장품 소재로서의 산업적 활용 가능성 을 증대시키기 위한 자료를 제공하고자 한다.
재료 및 방법
이팝나무 과육은 2011년 10-11월에 경북 경산시 일대에 서 성숙된 이팝나무 열매를 채집하여 과병은 제거한 후 이물질과 먼지 제거를 위하여 흐르는 물에 수회 수세하고 물기제거를 위하여 약 12시간 정도 음건하였다. 건조된 이 팝나무 열매는 과육만을 분리하여 열풍건조기(DR-0160, Hankwang, Siheung, Korea)를 이용하여 55℃의 조건으로 수분함량 12±1% 내외로 건조하여 blender(Waring, HGB2WTS3, Torrington, CT, USA)를 이용하여 아주 작게 마쇄하여 본 실험을 위한 추출시료로 사용하였다.
건조하여 잘게 마쇄된 이팝나무 과육은 시료 무게당 10 배에 해당되는 증류수를 첨가하여 25℃의 실온조건과, 환 류 냉각관을 부착시킨 환류추출기(Changshin, Pocheon, Gyeonggi, Korea)를 이용하여 80℃의 조건에서 각각 3시간 동안 추출하고 빼내는 과정을 3회 반복하였으며, 이팝나무 과육의 30배에 해당하는 증류수를 넣고 압력추출기 (DM-701, Seoul, Korea)를 이용하여 110℃, 1.5기압 하에서 3시간 동안 추출하였다. 각각의 추출물은 filter paper (Whatman No.2, Little Chalfont, England)로 여과한 다음 rotatory vacuum evaporator(400 series, Eyela, Tokyo, Japan) 로 감압농축한 후에 동결건조(Ilsin, Korea)하여 분말 제조 하여 상온추출물(25W; water extract at room temperature), 80℃추출물(80W; water extract by reflux extraction at 80℃), 그리고 110℃추출물(110W; water extract by pressure heating extraction at 110℃)로 하였다. 각 추출물의 수율은 건조중량 을 기준으로 환산하여 계산하였다.
추출온도가 상이한 이팝나무 과육 물 추출물에 함유된 총 폴리페놀 화합물은 Folin-Denis법(15)으로 추출된 시료 0.2 mL에 증류수 1.8 mL를 혼합하고, Folin-Ciocalteu's phenol reagent 0.2 mL를 첨가하여 5분간 실온에서 반응시 켰다. 이 용액에 2 M Na2CO3 0.4 mL를 가하여 혼합하고 증류수를 1.4 mL 첨가하고 실온암소에서 1시간 동안 반응 시킨 후 spectrophotometer(Mecasys Optizen POP, Daejeon, Korea)를 사용하여 725 nm에서 흡광도를 측정하였고, tannic acid (Sigma-Aldrich Co., St. Louis, MO, USA)을 이용 한 검량선과 비교하여 이팝나무 과육 추출물의 폴리페놀 화합물 함량을 구하였다.
총 플라보노이드 화합물 정량은 Nieva Moreno 등(16)의 방법을 변형하여 이팝나무 과육 추출액 0.1 mL에 80% ethanol 0.4 mL, 10% aluminum nitrate 0.1 mL와 1 M potassium acetate 0.1 mL 그리고 80% ethanol 4.3 mL를 가하여 25℃에서 40분간 반응시킨 후 415 nm에서 흡광도를 측정하였다. 표준물질로는 quercetin(Sigma-Aldrich Co.)을 위와 동일한 방법으로 측정한 검량선으로부터 총 플라보노 이드 화합물을 정량하였다.
이팝나무 과육 물 추출물에 함유된 수용성 단백질 함량 은 Lowry 등(17)의 방법에 따라 추출물 0.2 mL에 혼합시약 을 1 mL 첨가하여 30℃에서 10분간 반응시키고 여기에 0.1 mL Folin-Ciocalteu's phenol reagent를 첨가하여 실온에 서 30분간 반응시킨 후, 750 nm에서 흡광도를 측정하였다. 표준물질로 bovine serum albumin(Sigma-Aldrich Co.)으로 검량선을 작성하여 수용성 단백질의 함량을 산출하였다.
환원당은 Somogyi-Nelson법(18)으로 추출물 1 mL에 혼 합시약 1 mL 첨가하여 20분간 가열한 후 냉각하여 C액 1 mL 첨가하고 실온에서 반응시킨 다음, 증류수 5 mL를 혼합하여 520 nm에서 흡광도를 측정하였다. 환원당 함량은 glucose(Sigma-Aldrich Co.)로 검량선을 작성하여 이팝나무 과육 추출물의 환원당 함량을 산출하였다.
2,2-diphenyl-1-picryl hydrazyl(DPPH) radical에 대한 소 거능력은 Blois의 방법(19)에 준하여 측정하였다. 일정농도 로 희석된 각 추출물 2 mL에 2×10-4 M DPPH용액(dissolved in 99% ethanol) 1 mL룰 첨가하여 37℃에서 30분간 반응 후 517 nm에서 흡광도를 측정하였다. DPPH radical에 대한 소거활성(%)은 시료 무첨가구에 대한 시료 첨가구의 흡광 도비로 산출하였다.
2,2-azino-bis(3-ethylbenzothiazoline-6-sulphonic acid)(ABTS) radical에 대한 소거능력은 Re 등(20)의 방법을 변형하여 측정하였다. 7 mM ABTS와 2.45 mM potassium persulfate를 첨가하여 상온에서 12-16시간 반응시켜 ABTS 양이온을 생성시킨 후, 734 nm에서 흡광도 값이 0.70±0.02 가 되도록 99.9% 에탄올을 이용하여 제조하였다. 그다음 ABTS 용액 100 μL에 시료 100 μL를 가하여 7분간 실온에서 반응하여 734 nm에서 흡광도를 측정하였으며, 시료 무첨가 구에 대한 시료 첨가구의 흡광도비로 ABTS radical 소거활 성(%)을 산출하였다.
Kato 등의 방법(21)에 따라 1mM의 NaNO2 용액 1 mL에 이팝나무 과육 물 추출물 1 mL를 혼합하고, 0.2M citrate buffer와 0.1 N HCI를 완충용액으로 하여 반응용액의 pH를 각각 1.2, 3.0, 6.0으로 보정하여 총 10 mL로 조정하였다. 이 용액을 37℃에서 1시간 동안 반응시킨 후, 1 mL씩 취하 여 2% acetic acid 5 mL와 30% acetic acid에 용해한 Griess reagent 시약(1% sulfanilic acid:1% naphthylamin=1:1)을 0.4 mL 가하여 혼합한 후 실온에서 15분간 반응하여 520 nm에 서 흡광도를 측정하였다. 아질산염 소거 활성(%)은 시료 무첨가구에 대한 시료 첨가구의 흡광도비로 산출하였다.
SOD 유사활성은 Marklund와 Marklund의 방법(22)에 시 료 0.2 mL에 tris-HCl buffer(pH 8.5) 2.6 mL와 7.2 mM pyrogallol 0.2 mL를 첨가하여 25℃에서 10분간 반응 후, 1 N HCl 0.1 mL를 가하여 반응을 정지시켰다. 반응액 중 산화된 pyrogallol의 양은 420 nm에서 흡광도를 측정하여 시료 첨가구와 무첨가구 사이의 흡광도 차이를 SOD 유사 활성(%)으로 나타내었다.
Stirpe와 Corte 방법(23)에 이팝나무 과육 물 추출물 0.1 mL와 0.1 M potassium phosphate buffer(pH 7.5) 0.6 mL에 2 mM xanthine(Sigma-Aldrich Co.) 기질액을 첨가하고, xanthine oxidase(0.2 U/mL, Sigma-Aldrich Co.) 0.1 mL를 가하였다. 이를 37℃에서 5분간 반응 후 1 N HCl 1 mL를 가하여 반응을 정지시키고 반응액 중에 생성된 uric acid를 흡광도 292 nm에서 측정하였다. Xanthine oxidase 저해활성 (%)은 시료 첨가구와 무첨가구의 흡광도 감소율비로 나타 내었다.
이팝나무 과육 물 추출물의 tyrosinase 저해 활성은 Yagi 등의 방법(24)에 따라 0.175 M sodium phosphate buffer(pH 6.8) 0.5 mL에10 mM L-DOPA(L-3,4-dihydroxy-phenylalanine, Sigma-Aldrich Co.)를 녹인 기질액 0.2 mL, 그리고 시료 0.1 mL를 혼합하고, mushroom tyrosinase(110 U/mL, Sigma-Aldrich Co.) 0.2 mL 첨가하여 25℃에서 2분간 반응 후, 생성된 DOPA chrome을 흡광도 475 nm에서 측정하였 으며, 시료 첨가구와 무첨가구의 흡광도 감소율비로 tyrosinase 저해활성(%)을 나타내었다.
Collagenase 저해효과는 Wünsch와 Heindrich의 방법(25) 을 변형하여 시료 0.1 mL에 4 mM의 CaCl2를 가한 0.1 M의 Tris-HCl buffer(pH 7.5)에 4-phenylazobenzyloxycarbonyl- Pro-Leu-Gly-Pro-D-Arg(0.3 mg/mL, Sigma-Aldrich Co.)를 녹인 기질액 0.25 mL과 혼합하여 collagenase(0.2 mg/mL, Sigma-Aldrich Co.) 0.15 mL를 가한 후 실온에서 20분간 반응하였다. 여기에 반응을 정지시키기 위하여 6%의 citric acid 0.5 mL를 가하고 ethyl acetate 1.5 mL를 혼합한 후 상등액만을 320 nm에서 흡광도를 측정하였다. Collagenase 저해율(%)은 시료 첨가구와 무첨가구의 흡광도 감소로 나 타내었다.
이팝나무 과육 물 추출물의 elastase 저해활성은 Cannell 등의 방법(26)에 따라 시료 0.5 mL에 50 mM의 tris-HCl buffer(pH 8.6)에 녹인 porcine pancrease elastase(2.5 U/mL) 0.5 mL와 50 mM의 tris-HCl buffer에 N-succinyl-Ala Ala-Ala-p-nitroanilide(0.5 mg/mL, Sigma-Aldrich Co.)를 녹 인 기질액 1 mL를 첨가하여 25℃에서 20분간 반응시켰다. 이때 기질로부터 생성되는 p-nitroanilide의 생성량을 405 nm에서 측정하였으며, elastase 저해율(%)은 시료 첨가구와 무첨가구의 흡광도 감소로 나타내었다.
결과 및 고찰
건조된 이팝나무 과육을 물을 용매로 상이한 온도에서 추출하여 각 추출물의 고형분 수율을 측정한 결과, 실온에 서 추출된 25W가 21.78%였으며, 80℃에서 환류추출기를 이용하여 추출된 80W는 51.17%, 그리고 가압열수 추출기 를 이용한 110W는 67.94%로 가장 많은 고형분이 추출되었 다(Table 1). 총 폴리페놀 화합물 함량을 측정한 결과에서는 80W 72.71 mg/g > 110W 66.88 mg/g > 25W 8.71 mg/g의 순으로 함유하였으며, 플라보노이드 화합물은 110W가 7.60 mg/g으로 가장 많이 함유하였으며, 80W 5.58 mg/g, 그리고 25 W는 3.64 mg/g을 함유하였다. 본 결과에서는 80℃에서 추출된 이팝나무 과육 물 추출물이 가장 많은 폴리페놀을 함유하였으며, 플라보노이드 함량도 높았다. 가압열수 추출물 또한 실온 추출물보다 폴리페놀과 플라보 노이드 화합물이 많이 함유된 것으로 분석되었다. 이러한 결과는 Park 등(27)과 Kwon과 Youn(28)의 보고와도 일치하 였으며, Yoon과 Cho(29)는 시료량과 추출온도 및 추출시간 이 증가할수록 추출되는 polyphenol의 함량이 높아진다고 보고하였다. 이는 추출 열처리 과정 중 식물체의 세포벽 파괴로 인하여 탄수화물 및 용출되는 여러 불용성 성분의 용출이 용이하여 수율 및 유용 성분인 폴리페놀 화합물이 많이 추출된 것으로 사료된다.
추출온도가 다른 이팝나무 과육 추출물의 수용성 단백질 과 환원당 함량을 측정한 결과, Table 1에 나타낸 바와 같이 수용성 단백질은 2.10-4.93 mg/g 이었으며, 환원당은 32.47-46.77 mg/g으로 110℃의 고온에서 추출한 가압열수 추출물이 가장 많은 수용성 단백질과 환원당을 함유하였 다. Seo 등(30)은 감에는 0.98 mg/g, 대추에는 1.17 mg/g의 수용성 단백질이 함유되었다는 보고와 본 실험결과와 비교 하면 이팝나무 과육의 수용성 단백질 함량이 2-4배 이상 많았다. 또한 우산나물 잎과 뿌리가 각각 8.48 mg/g과 14.21 mg/g의 환원당을 함유한다는 Lee 등(31)의 결과와 비교하 면 식용 및 약용으로 사용되고 있는 감과 대추, 그리고 우산 나물보다 이팝나무 과육의 수용성 단백질과 환원당의 함유 량이 높아서 기능성 식품소재로의 활용 가능성이 높은 것으 로 판단된다.
DPPH radical 소거활성은 hydrazyl의 불안정한 질소원자 가 쉽게 항산화 물질과 반응, 수소 원자를 받아 환원되는 성질을 이용하여 자체의 짙은 보라색이 탈색되는 정도를 측정하여 항산화 물질의 음이온 radical 소거활성을 흡광도 로 측정하는 방법이다(19,32). ABTS radical 소거활성은 potassium persulfate와의 반응에 의해 생성되는 양이온 ABTS radical이 추출물에 함유된 항산화성 물질에 의해 제거되고, radical 특유의 청록색이 항산화 물질의 radical 저해작용으로 인해 연한 녹색으로 탈색되는 것을 이용한 방법으로 극성, 비극성 시료의 구분 없이 항산화 활성을 측정할 수 있다(33).
이팝나무 과육을 25℃, 80℃ 그리고 110℃의 조건에서 추출한 3가지 추출물의 DPPH 및 ABTS radical 소거활성을 측정한 결과는 Fig. 1과 같다. DPPH radical 소거율은 0.1-1.0 mg/mL의 농도에서 25.79-92.89%로 시료의 농도가 높을수 록 소거활성이 증가하였다. 0.1 mg/mL의 농도에서는 환류 추출기를 이용한 80W의 소거능이 가장 높았으며, 110W에 서도 약 75%의 DPPH radical 소거율을 나타내어 실온에서 추출된 25W보다 약 3배 이상 우수한 소거활성을 나타내었 다. 또한 80W와 110W는 0.3 mg/mL에서 90%이상의 소거율 을 보였으며, 1.0 mg/mL에서는 이팝나무 과육의 3가지 추 출물 모두 90% 이상의 높은 DPPH radical 소거활성을 나타 내었다. 식용으로 많이 활용되고 있는 갈근, 당귀, 감초, 인삼, 사상자 및 둥굴레 등에서 2.5-16.8%의 전자공여 효과 를 나타내었다는 Kim 등(34)의 결과와 비교하면 이팝나무 과육의 전자공여효과가 매우 우수한 것으로 나타났다.
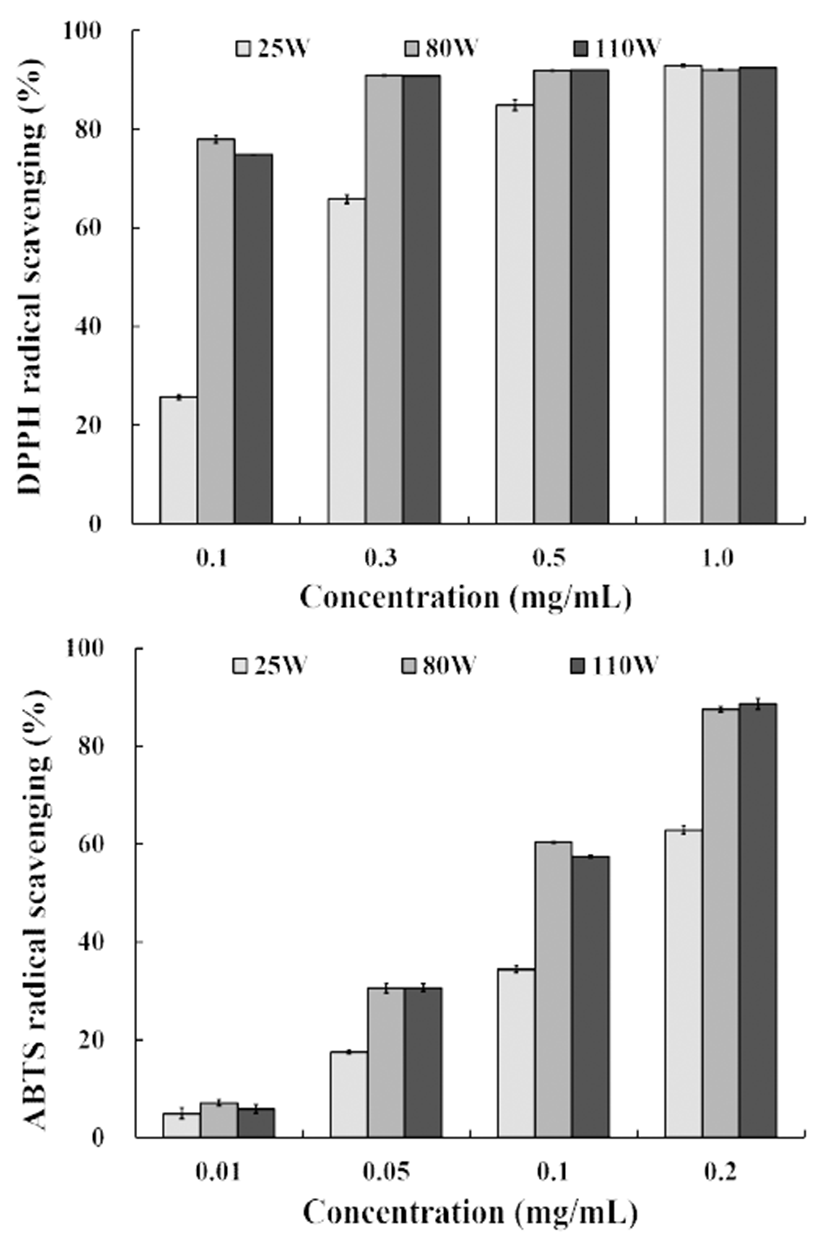
ABTS radical 소거활성은 0.2 mg/mL에서 25W는 62.88% 였으며, 80W 87.49%, 110W 88.62%으로써 80W와 110W의 두 추출물간의 유의적 차이는 없었다. Kim 등(10)은 이팝나 무 꽃과 열매 그리고 잎의 물 추출물에서 100 μg/mL 처리시 80% 이상의 ABTS radical 소거율을 나타낸다고 하여 본 실험 결과보다 높은 소거효과를 보이는 것으로 나타났다. DPPH 및 ABTS radical 소거활성 모두 80℃의 조건에서 추출된 이팝나무 과육 추출물이 가장 높은 radical 소거율을 나타내어 기존의 여러 연구와도 동일한 결과를 보였다 (28,35). 식물을 열처리할 경우 결합형 페놀 화합물이 유리 형으로 되어 항산화 활성이 증가한다는 보고(36)로 미루어 이팝나무 과육은 유리된 상태로 존재하거나 또는 약간의 가열로도 유리될 수 있는 결합형 페놀성 화합물이 유리형으 로 전환됨으로써 항산화 활성이 증가되기 때문인 것으로 생각된다.
물을 용매로 25℃, 80℃, 110℃의 조건에서 이팝나무 과육 추출물에 대한 아질산염 소거활성을 측정한 결과, Table 2와 같이 1.0 mg/mL의 농도에서 pH 1.2는 59.32-66.16%로 110W에서 가장 높은 아질산염 소거활성을 보였으며, pH 3.0에서는 16.42-37.86%로 80W가 25W와 110W보다 약 2배 높은 소거활성을 나타내었다. pH 6.0은 4.84-8.06%로 모든 추출물은 농도가 증가함에 따라 아질산염 소거율이 높았으 며, pH가 낮을수록 아질산염 소거효과가 우수하여 Lee 등 (2)의 기존의 연구결과와 일치하였다. Yoon 등(29)이 보고 한 pH 1.2의 1.0 mg/mL 농도에서 미숙, 완숙 및 과숙 뜰보리 수 추출물이 각각 63.8%, 67.2% 그리고 66.0%의 아질산염 소거활성을 나타내었다는 결과와 유사한 소거효과를 나타 내었다. Polyphenol과 flavonoid 화합물은 종류에 따라 차이는 있으나 nitrosamine의 생성을 효과적으로 억제한다 는 Yamada 등(37)의 보고와도 유사한 결과를 나타내었으 며, phenol compound가 다량으로 함유된 시료일수록 산성 조건에서 nitrite 소거효과가 우수하며, 반응용액의 pH가 높을수록 효과가 감소된다는 Mirvish(38)의 결과와도 일치 하여 이팝나무 과육은 아질산염 소거를 위한 천연소재로 사용될 수 있을 것으로 판단된다.
이팝나무 과육 물 추출물의 superoxide dismutase(SOD) 저해활성을 농도에 따라 측정한 결과, 110℃의 조건에서 추출한 가압열수 추출물이 1.0 mg/mL에서 14.95%의 SOD 유사활성을 나타내었으며, 80W는 10% 미만의 활성을 보였 다. 실온에서 추출한 25W는 4.21%였으며, 낮은 농도에서는 SOD 유사활성 효과가 없었다(Table 3). SOD는 생체에 유해 한 superoxide anion radical과 반응하여 과산화수소를 생성 하는 효소로서 가장 독성이 강한 hydroxy radical의 생성 억제 활성을 나타내는 대표적 항산화 효소이다(39). Nice 등(40)은 polyphenol류와 결합된 SOD가 열에 대한 안정성 이 높다고 하였으며, 본 실험에서도 추출온도가 가장 높은 110W의 SOD 유사활성이 25W보다 3배 이상 높았다. An과 Lee(41)의 보고에서 산사자 물 추출물이 12% 미만의 활성 을 나타낸다는 결과와 비교하면 이팝나무 과육의 110W 추출물이 약간 더 높은 활성을 나타내었다.
Xanthine oxidase는 주로 purine 대사에 관여하는 효소로 서 산소를 전자수용체로 이용하여 xanthine 또는 hypoxanthine으로부터 uric acid를 생성한다(42). 혈장내에 uric acid가 증가되면 낮은 용해성으로 인하여 침상모양의 결정을 형성하며 이로 인해 심한 통증을 유발하는 통풍과 신장질환을 일으키는 효소이다(43). 그러므로 xanthine oxidase(XOase) 활성을 저해하는 것은 free radical의 생성을 억제하게 되므로 항산화, 항노화 및 질병치료 및 예방에 생리학적으로 중요하다. 이에 이팝나무 과육 물 추출물의 XOase 저해활성을 측정한 결과, 1.0 mg/mL에서 110W (59.45%) > 80W(54.80%) > 25W(33.33%)의 저해율을 보였 으며, 추출온도가 높을수록 XO 저해효과가 증가하였다 (Table 3). 이러한 결과는 선복화, 홍화, 감국의 고온추출물 에서 XOase 저해활성이 가장 높게 나타났다는 보고와 동일 한 결과를 나타내었다(44). An 등(41)은 1.0 mg/mL 농도의 산사자 물 추출물은 9.6%, 5.0 mg/mL에서는 16%의 XOase 저해효과를 나타내었다고 보고하여, 실온과 80℃에서 추출 된 국화과 3종의 물 추출물에서도 27% 이하의 저해율이 나타냈다는 Kong 등(44)의 결과와 비교하여도 이팝나무 과육의 XOase 저해효과가 매우 우수한 것으로 분석되었다. 이상의 결과 이팝나무 과육의 유용성분 추출에는 가열 추출 방법이 좋은 것으로 판단되며, 이러한 과육 추출물은 XOase 저해를 위한 항산화 기능성 소재로서의 활용 가능성 이 높을 것으로 사료된다. 하였다. 이상의 결과 유용성분 추출을 위하여 열을 가하여 추출하는 것이 좋으며, 이팝나 무 과육을 XOase 저해를 위한 기능성 소재로서 활용 가능 할것으로 사료된다.
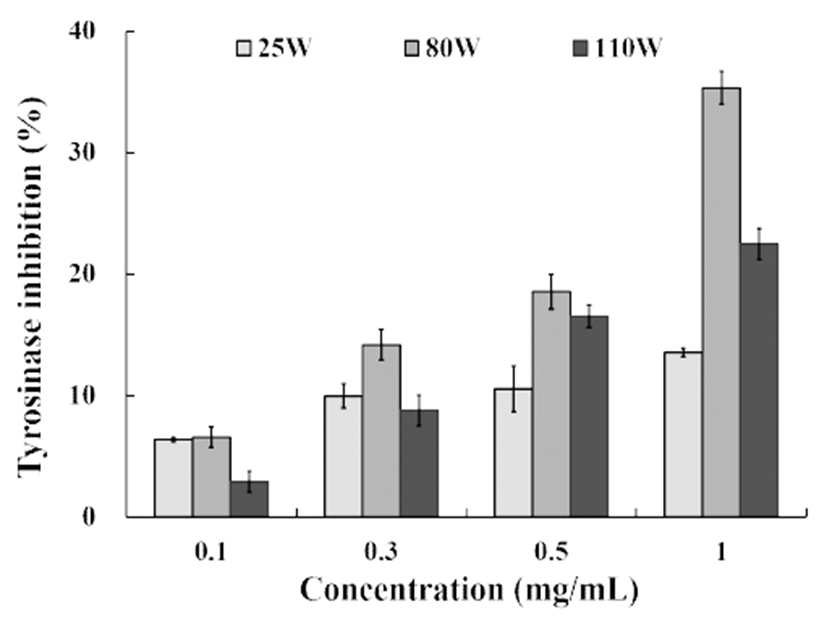
사람의 피부색을 결정하는 melanin은 피부 기저층에 존 재하는 melanocyte에서 melanosome를 통하여 합성되며 외 부 자극물질이나 자외선 등으로부터 피부를 보호하는 역할 을 한다. 그러나 melanin이 과다생성되면 기미, 주근깨, 검 버섯 등의 피부색소 침착과 흑색종 등의 질병이 유발될 수 있다(45). 또한 식물의 경우 야채나 과실류에서는 갈변화 를 일으키는 원인이 되기도 한다. Tyrosinase는 tyrosine을 산화시켜 DOPA(3,4-dihydroxyphenylalanine)로의 전환에 관여할 뿐만 아니라 DOPA-quinone으로 전환한다. 이 과정 에서 tyrosinase는 melanine 생성 초기에 중요한 역할을 하는 효소이므로 미백과 노화방지 및 식품 갈변화 방지제 개발에 중요한 평가방법으로 활용되고 있다(46,47). 상이한 온도에 서 추출한 이팝나무 과육 추출물에 대한 tyrosinase 저해활 성을 측정한 결과 1.0 mg/mL에서 25W 13.54%, 110W 22.46%, 그리고 80W는 35.31%로 실온 추출물보다 2.5배 이상의 높은 tyrosinase 저해율을 나타내었다(Fig. 2). 일부 한약재 열수 추출물의 tyrosinase 저해를 측정한 Hwang 등(48)의 박하 7.92%, 진피 12.85%, 영지 21.18%를 나타낸 다는 결과와 비교하면 이팝나무 과육이 박하와 진피보다 높은 저해활성을 나타내었다.
피부 진피층에 존재하는 collagen은 피부의 견고성과 결 합조직의 저항력, 조직력, 그리고 세포분화를 유도하며, 힘 줄, 뼈, 치아의 유기질 대부분을 형성한다. 또한 진피내 피부 탄력을 유지하는 기질 단백질인 elastine은 collagen과 같이 그물망 구조를 형성하면서 피부의 탄력성을 유지한다. 자 연노화에 따른 세포 활성의 감소와 같은 내적요인과, 여러 유해 환경에 의한 스트레스 증가, 자외선 조사에 의한 광노 화와 같은 외적 요인에 의해 collagen과 elastine이 분해되며, 이 과정에서 collagenase과 elastase가 관여하여 피부의 주름 및 탄력성 소실 등을 유발한다(49,50). 또한 elastase는 피부 탄력섬유의 3차원적 뒤틀림에 중요한 역할을 하며, 조직파 괴의 직접적 원인이 되기도 한다(51). 이에 이팝나무 과육의 3가지 추출물에 대한 collagenase와 elastase 저해효과를 측 정하였으며, 그 결과는 Table 4와 같다. 1.0 mg/mL의 농도에 서 collagenase 저해활성은 110W에서 37.78%였으며, 80W 27.71%, 그리고 25W에서는 20.38% 저해하였다. Elastase에 대한 저해율은 1.0 mg/mL 농도에서 110W 20.33% > 80W 20.39% > 25W 15.58%의 순으로 110W와 80W의 두 추출물 간에 유의적 차이가 없었으나, 저농도에서는 80W(10.22%) 가 110W(1.24%)보다 8배 이상 높은 저해활성을 나타내었 다. 이러한 결과는 모든 추출물은 농도가 증가함에 따라 collagenase와 elastase 저해효과도 증가하였으며, 추출온도 가 높을수록 저해활성도가 높다는 Kong 등(44)와 결과와도 동일하였다. 선복화 감국, 홍화의 collagenase 저해율이 13.38-23.94%이며, elastase 저해율은 10.30-24.00%을 나타 낸다는 결과(44)과 비교하면 이팝나무 과육의 collagenase 와 elastase 저해활성이 더 우수한 것으로 나타났다. 이상의 결과에서 이팝나무 과육에는 주름 및 피부탄력성 소실을 저해하는 효과가 있을 것으로 판단되며, 기능성 항노화 제 품 및 식품의 갈변화를 억제시킬 수 있는 소재로 활용 가능 할 것으로 판단된다.
요 약
민간에서 식용 및 약용으로 사용되고 있으나 최근에는 활용도가 낮은 이팝나무 성숙열매 과육의 산업적 활용 증진 을 위하여 상이한 추출조건(실온 25℃, 80℃, 110℃)에서 물을 용매로 추출된 이팝나무 과육 3가지 추출물에 대한 항산화 및 항노화 활성을 측정하였다. 총 폴리페놀 화합물 은 환류추출기를 이용한 80W에서 72.71 mg/g으로 가장 많이 함유하였으며, 플라보노이드 화합물은 가압열수 추출 기를 이용 110W 추출물에서 7.608 mg/g을 함유하였다.
수용성 단백질과 환원당의 함량도 110W에서 각각 4.93 mg/g과 46.77 mg/g으로 가장 많이 함유하였다. DPPH radical 소거율은 1.0 mg/mL에서 모든 추출물이 92% 이상의 소거율을 보였으며, ABTS radical 소거활성은 110W가 88.67%였으며, 80W(87.49%)와 유의적 차이는 없었다. 아 질산염 소거능은 pH 1.2의 조건에서 110W가 66.16%였으 며, pH 3.0에서는 80W에서 37.86%를 나타내었다. SOD 유 사활성 및 xanthine oxidase 저해활성에서도 추출온도가 가 장 높은 110W에서 각각 14.95%와 59.45%의 활성을 나타내 었다. 추출온도에 따른 이팝나무 과육의 미백효과를 알아 보고자 tyrosinase 저해율을 측정한 결과, 환류추출기를 이 용한 80W 추출물이 35.31%로 비교적 높은 저해율을 나타 내었다. Collagenase에 대한 저해효과는 1.0 mg/mL에서 110W가 37.78%로 가장 우수하였으며, elastase 저해활성은 80W 20.39%, 110W 20.33%로 유사한 저해효과를 나타내었 다. 모든 실험에서 농도 의존적으로 항산화 및 항노화 활성 이 증가하는 경향을 보였으며, 실온보다는 높은 온도에서 추출한 이팝나무 과육 추출물에서 유용성분의 함량과 생리 활성이 높게 나타났다. 이는 추출온도가 높을수록 유용성 분의 추출이 용이해져 다양한 항산화 및 항노화 활성을 나타내는 것으로 사료되며, 이팝나무 과육은 기능성 식품 및 제품을 위한 천연소재로 활용 가능할 것으로 판단된다.










