ARTICLE
백산차 추출물의 항산화 및 항염증 활성
김세기*
Antioxidant and anti-inflammatory activities of extracts from Ledum palustre L.
Se Gie Kim*
Author Information & Copyright ▼
Department of Pharmaceutical Science and Technology, Daegu Catholic University, Gyeongsan 38430, Korea
© The Korean Society of Food Preservation. This is an Open-Access article distributed under the terms of the Creative Commons Attribution Non-Commercial License (http://creativecommons.org/licenses/by-nc/3.0/) which permits unrestricted non-commercial use, distribution, and reproduction in any medium, provided the original work is properly cited.
Received: Nov 10, 2017; Revised: Nov 19, 2017; Accepted: Nov 20, 2017
Abstract
In this study, Ledum palustre L. was extracted by 4 different methods (LPW, hot water extraction; LPA, autoclave extraction; LPU, ultrasonification extraction; LPE, 70% ethanol extraction) and LPE was fractionated by using polarity difference of each solvent and used as 4 samples (LPE/H, the n-hexane layer; LPE/E, the EtOAc layer; LPE/B, the n-BuOH layer; LPE/W, the H2O layer). Antioxidant activities of Ledum palustre L. extracts were measured by DPPH and ABTS. As a result, the DPPH and ABTS radical scavenging showed high activities with LPE (82.3%, 99.8%) and LPE/E (91.8%, 99.6%) at the concentration of 1,000 μg/mL. The anti-inflammatory activities of LPE and LPE/E were measured by the inhibitory activity against NO, PGE2, TNF-α, IL-1β and IL-6 production on LPS-stimulated Raw 264.7 macrophages. As a result of MTT assay, cell viabilities of LPE and LPE/E were more than 90% at 25 μg/mL. NO and PGE2 productions were inhibited by LPE (NO: 50%, PGE2: 70%) and LPE/E (NO: 57%, PGE2: 73%) at the concentration of 25 μg/mL. The inhibition activities against TNF-α, IL-1β, IL-6 production were 24%, 47% and 40% at the concentration of 25 μg/mL of LPE. In particular, LPE/E showed 51%, 57% and 62% inhibition activities at the same concentration, respectively. From the above results, it can be concluded that 1,000 μg/mL of LPE and LPE/E have the high antioxidant activities similar with Vitamin C, and 25 μg/mL, the low concetration of LPE and LPE/E have excellent anti-inflammatory activities. Therefore, if more research about anti-aging, whitening and antimicrobial activity of Ledum palustre L. extracts is carried out in the future, it will be possible to use them as effective materials for the prevention and treatment of inflammatory diseases and in the areas of functional foods and cosmetics.
Keywords: Ledum palustre L.; DPPH; ABTS; nitric oxide; Raw264.7; PGE2
서 론
산업사회의 발달과 고령화 인구의 증가에 따라 건강한 삶을 영위하고자하는 욕구가 증가하고 있고, 전 세계적으 로 기능성 식품 및 화장품에 대한 소비자의 관심이 커지고 있다(1). 따라서 이에 대한 연구 개발이 활발해졌으며, 항산 화와 항염효과 등의 활성성분 발견을 위한 근거 중심적 연구가 활발하게 진행되고 있다(2-4). 활성산소는 대부분 불안정하여 전자를 잃거나 얻어서 보다 안정된 상태로 가려 는 성질이 있으며 이들의 높은 반응성은 생체내에서 산화적 손상을 일으킨다(5). 생체의 산화반응 과정 중에 생성되는 활성산소들은 체내의 superoxide dismutase, catalase, glutathione peroxidase와 같은 항산화효소에 의해 제거되지 만, reactive oxygen species(ROS)는 지질과산화, 단백질산 화, 단백질 분해효소의 활성화, DNA산화와 같은 손상을 야기한다(6). 이러한 손상의 결과로 고혈압, 당뇨병, 아토피 성 피부염, 류마티스 관절염과 같은 염증성 질환이 발생하 게 된다(7-9). 이와 같은 과량의 ROS로 인한 산화적 스트레 스가 항산화물질에 의해 감소되는 것이 알려지면서 항산화 물질을 개발하기 위한 연구들이 지속적으로 이루어지고 있으며, 합성 항산화제의 부작용이 증가함에 따라 천연물 유래의 항산화제에 관한 연구가 더욱 활발히 진행되고 있다 (10). 식물 유래의 2차 대사산물들은 자유유리기와 활성산 소의 생성을 억제하거나 제거시켜서 산화에 의한 세포손상 을 방지하는 것으로 알려져 있으며(11,12), 천연물로부터의 radical 소거능을 확인하는 방법으로 1,1-diphenyl-2- picrylhydrazyl(DPPH)와 2,2-azinobis(3-ethyl-benzothiazoline- 6-sulfonic acid)(ABTS) assay가 널리 연구되어 지고 있다 (13). 염증반응은 인체에 외부 병원체 등의 각종 외부 물질 의 침입을 식별하고 이를 제거하여 항상성을 유지하는 자기 방어체계인 1차적 면역반응이며(14), 대식세포는 대표적인 염증 매개물질인 nitric oxide(NO)생성에 관여한다(15). 활 성산소의 하나인 NO는 염증 반응 시에 inducible NO synthase(iNOS)에 의해 과도하게 생성되어 염증을 심화시 키게 된다(16). 또한 대식세포에 그람 음성세균의 세포외막 에 존재하는 내독소 lipopolysaccharide(LPS)에 의해 tumor necrosis factor-α(TNF-α), interleukin-1β(IL-1β) 및 interleukin- 6(IL-6) 등과 같은 cytokine의 분비를 증가시킨다(17). 또한 iNOS에 의해 생성되는 NO와 cyclooxygenase-2 (COX-2)에 의 해 생성되는 prostaglandin E2(PGE2)등의 염증유발인자들도 생성된다(18,19). 이러한 염증유발인자들은 NO와 ROS의 생성을 더 자극하게 되어 염증 반응이 과도해지며 이러한 현상은 만성 염증 질환의 원인이 된다. 따라서 다양한 만성 염증 질환의 예방 및 치료를 위하여 항산화 및 항염증 효과 가 있는 기능성 소재의 개발이 중요시 되고 있다.
백산차(Ledum palustre L.)는 백두산 지역에 자생하는 진 달래과의 상록 소교목으로 높은 산의 숲 밑에서 자라며 뿌리에서 어린 싹이 돋고 다갈색의 털이 빽빽이 나는 형태 를 가진다(20,21). 시베리아, 북유럽에서는 동종요법에서 자주 사용하였으며, 우리나라에서는 차로 마시면서 식후의 청량감 준다. 백산차는 방부제로도 사용하였다고 알려져 있으며 잎부위를 약용으로 사용한다. 백산차 잎과 뿌리 속 에는 tannin, terpene이 함유되어 있으며, 만성기관지염, 월 경불순, 불임, 위궤양, 류마티스성 관절염에 효능이 있다 (22-24). 그러나 아직까지 백산차에 대한 연구는 많이 부족 한 실정이며 백산차의 항산화 및 항염증 활성 역시 보고된 바가 없다.
이에 본 연구에서 아직까지 명확하게 연구되지 않은 백 산차 추출물 및 용매 분획물에 대해 DPPH와 ABTS 측정을 통해 항산화 활성을 검증하고, LPS로 유도된 대식세포에서 생성되는 NO, PGE2 및 pro-inflammatory cytokine에 대한 저해 활성 측정을 통해 항염증 활성을 검증하여 예로부터 전통차로서 우리 민족이 즐겨 마셔 오던 백두산 백산차의 항산화 및 항염증 기능성 소재로서의 활용 가능성을 평가하 였다.
재료 및 방법
실험재료 및 추출물의 제조
백산차는 ㈜파이로젠(대구 달성군 소재)으로부터 5월에 건조된 것을 구입하여 본 실험에 사용하였으며 분쇄기(IKA Ⓡ Werke GmbH & Co., KG, Staufen, Germany)를 이용 40 mesh 이하로 분쇄한 후 -20℃에서 보관하면서 실험에 사용하였다. 추출방법은 백산차의 열수추출은 분쇄된 시료 100 g에 9배의 증류수를 끊인 후 시료를 가하고 3시간 2회 반복 추출하였고(LPW), 초음파추출(ultrasonification extraction) 은 시료 100 g에 9배의 증류수를 넣은 유리병을 초음파 수조(NXPC-4020P, KODO, Hwaseong, Korea) 바닥에 닿지 않도록 하여 40 kHz로 3시간 2회 반복 추출하였다(LPU). 고온가압추출(autoclave extraction)은 autoclave(JSAC-100, JS Research Inc., Gongju, Korea)에 분쇄된 시료 100 g에 9배의 증류수를 넣은 후 121℃에서 3시간 동안 2회 반복 추출하였으며(LPA), 70% 에탄올추출(70% ethanol extraction) 은 시료 100 g에 20배의 70% 에탄올 2 L을 넣고 24시간 동안 2회 침지 추출하였다(LPE). 각각의 추출물은 여과지 (Whatman No.2, Maidstone, England)로 여과한 후 회전진공 농축기(WB2000, Heidolph, Schwabach, Germany)로 농축하 였다. 농축액은 동결건조(FD SFESM12, Samwon, Busan, Korea)하여 분말을 제조하였으며, 제조한 추출분말은 -7 0℃에 저장하여 실험에 사용하였다. 이후 얻어진 추출물 중 실험을 통하여 가장 효능이 우수한 70% 에탄올 추출물 을 이용하여 용매 분획을 하였다. 70% 에탄올 추출물 8 g을 100 mL의 증류수로 현탁시킨 후에 n-hexane 1 L씩 3회(LPE/H), ethyl acetate 1 L씩 3회(LPE/E), 그리고 n-butanol 1 L씩 3회(LPE/B)로 순차적으로 분획하였으며, LPE/H, LPE/E, LPE/E와 물 층(LPE/W)은 모두 농축하여 각각의 분획물을 확보 한 후 동결 건조하고 -70℃에서 냉동 보관하면서 실험에 사용하였다.
DPPH 라디칼 소거 활성
1,1-diphenyl-2-picrylhydrazyl(DPPH) 라디칼 소거 활성 은 Blois(25)의 방법을 응용하여 DPPH에 대한 전자공여 효과로 측정하였다. 0.2 mM DPPH 용액 50 μL와 시료 100 μL를 혼합한 다음 상온에서 10분간 반응 시킨 후 microplate reader(SunriseTM, Tecan Group Ltd., Männedorf, Switzerland) 를 이용하여 517 nm에서 흡광도를 측정하였다. DPPH 라디 칼 소거 활성률은 시료 무첨가구에 대한 시료 첨가구의 흡광도비로 산출하였다.
ABTS 라디칼 소거 활성
2,2-azinobis-(3-ethylbenzo-thiazoline-6-sulphonate)(ABT S) 라디칼 소거활성은 Re 등(26)의 방법을 응용하여 측정하 였다. 7 mM의 ABTS 용액에 potassium persulfate를 2.45 mM이 되도록 용해시켜 빛을 차단시켜 12-16시간 동안 반 응 시킨 후 사용하였다. ABTS 용액을 흡광도가 0.6-0.8이 되도록 에탄올로 조정한 다음, 용액 100 μL와 시료 50 μL를 혼합하고 실온에서 15분간 반응 시킨 다음 microplate reader 기를 이용하여 734 nm에서 흡광도를 측정하였다. ABTS 라디칼 소거 활성률은 시료 무첨가구에 대한 시료 첨가구의 흡광도비로 산출하였다.
세포 배양
마우스 대식세포주인 Raw264.7 세포는 american type culture collection(ATCC, Rockville, MD, USA)에서 구입하 였으며, 세포배양을 위해 10% fetal bovine serum(FBS)와 1% penicillin-streptomycin을 포함하는 dulbecco’s modified eagle medium(DMEM)(Invitrogen Carlsbad, CA, USA)배지 를 사용하였다. Raw264.7 세포는 75 T-flask에서 37℃, 5%, CO2 인큐베이터 조건에서 배양하였다.
MTT assay
본 실험에서 Raw264.7 세포에 대한 백산차 추출물 및 용매분획물의 유효농도를 결정하기 위한 세포생존율 측정 은 MTT assay로 진행하였다. 배양된 Raw264.7 세포를 48 well plate에 각각 5×104cells/well로 접종하고 24시간 배양 하였다. 동일 배지로 교체한 후 백산차 추출물 및 분획물을 농도별 로 희석하여 처리한 후 24 시간 CO2 incubator에서 배양하였다. 5 mg/mL 3-(4,5-Dimethyl-2-thiazolyl)-2,5- diphenyl-2H-tetrazolium bromide(MTT, Sigma, St. Louis, MO, USA) 용액을 배양된 세포에 20 μL씩 처리한 후 4시간 반응시켰다. 그 후 demethyl sulfoxide(DMSO, Duksan Co., Ltd., Ulsan, Korea) 100 μL 넣은 후, 10분간 교반 한 후 microplate reader로 540 nm에서 흡광도를 측정하였다.
Nitric oxide(NO) 생성량 측정
NO 발현을 측정하기 위하여 Raw264.7 세포를 48-well plate에 5×104 cells/well로 접종하고 24시간 CO2 incubator에 서 배양하였다. 24시간 뒤 serum free DMEM으로 교체 한 후 LPS(1 μg/mL)를 처리하였다. 1시간 후 serum free DMEM 로 희석된 백산차 추출물 및 분획물을 농도별로 처리한 후 18시간 CO2 incubator에서 배양하였다. 배양이 끝난 세포 의 상등액과 griess reagent(Sigma)를 1:1 비율로 혼합 한 뒤 10분간 반응 시켰다. 그 후 microplate reader기를 이용하 여 540 nm에서 흡광도를 측정하였다.
PGE2 생성량 측정
Raw264.7 세포를 2×105 cells/mL 되도록 24-well plate에 접종하고 24시간동안 5% CO2 incubator 배양하였다. 24시 간 후 serum free DMEM 배지로 교환한 후 LPS 1 μg/mL로 처리 한 뒤 1시간 동안 전처리를 하고 난 다음 백산차 추출 물 및 분획물을 농도별로 처리하여 24시간동안 배양하였 다. 배양이 끝 난 세포의 상층액을 취하여 PGE2 생성량을 측정하였다. PGE2 측정은 mouse enzyme-linked immnunosorbent assay(ELISA) kit(R&D system Inc., Minneapolis, MN, USA) 를 이용하여 정량하였으며, standard에 대한 표준곡선 R2 값은 0.99 이상이었다.
염증성 cytokine 생성량 측정
세포배양액 내의 TNF-α, IL-1β, IL-6 생성량은 mouse enzyme-linked immnunosorbent assay(ELISA) kit를 이용하 여 측정하였다. Raw 264.7 cell은 DMEM 배지를 이용하여 5×105 cells/ml로 조절한 후 6-well plate에 접종하고, 5% CO2 incubator에서 24시간 배양하였다. 세포에 1 μg/mL 의 LPS를 처리 한 뒤 1시간 후에 백산차 추출물 및 분획물을 농도별로 처리하여 24시간 배양하였다. 배양 후 얻어진 상 층액의 pro-inflammatory cytokine 함량을 측정하였으며, 정 량은 ELISA kit를 이용하여 정량하였으며, standard에 대한 표준곡선 R2 값은 0.99 이상이었다.
통계처리
모든 실험은 3회 이상 반복하여 실시하였으며 평균치와 표준편차로 나타내었으며, 유의성 검증은 SPSS statistics 20(IBM, Armonk, NY, USA) software package program을 이용하여 Duncan‘s multiple range test와 t-test를 실시하 였다.
결과 및 고찰
추출방법에 따른 수율
백산차를 건조하고 분쇄한 시료 각각 100 g에 대하여 추출물 제조 방법에 따라 추출하여 동결 건조한 뒤 측정한 시료의 무게는 LPA > LPW > LPE > LPU 순으로 11.62 g, 10.38 g, 8.65 g, 5.82 g 이 얻어졌으며 수율은 11.62%, 10.38%, 8.65%, 5.82%이었다. 위와 같이 얻어진 4가지 시료 에 대하여 DPPH 및 ABTS 라디칼 소거 활성을 측정하고 비교한 결과 LPE(70% 에탄올 추출물을 동결 건조한 시료) 가 DPPH 라디칼에 대하여 RC50=197.2 μg/mL와 1,000 μ g/mL 농도에서 82.3% 소거 활성을 나타내었고 ABTS 라디 칼에 대하여 RC50=143.5 μg/mL와 1,000 μg/mL 농도에서 99.8% 소거 활성을 나타내어 두 가지 라디칼 소거 활성 모두에서 가장 뛰어난 결과를 나타내었다(Table 1, Table 3). 이에 따라, 용매분획은 LPE 8 g을 취하여 분획물 제조 방법에 따라 분획하고 동결 건조하였으며 얻어진 각각의 분획물 시료의 무게는 LPE/W > LPE/B > LPE/E > LPE/H 순으로 2.62 g, 1.86 g, 1.23 g, 0.06 g이었고 회수율은 32.75%, 23.25%, 15.37%, 0,75%이었다.
Table 1.
DPPH radical scavenging activity of extracts from Ledum palustre L. (%)
| Samples |
Concentration (μg/mL) |
RC50 |
| 10 |
100 |
1,000 |
| Water extraction |
13.7±2.31)a2) |
41.0±3.2b |
75.2±2.2d |
272.1±1.9 |
| Autoclave extraction |
19.5±1.9a |
41.4±0.5b |
79.2±0.8d |
242.1±1.1 |
| Ultrasonic wave extraction |
29.9±1.1a |
38.1±1.4b |
81.0±1.0de |
281.5±0.8 |
| 70% Ethanol extraction |
19.2±0.7a |
43.4±0.5b |
82.3±1.3e |
197.2±2.4 |
| Ascorbic acid |
24.5±0.5a |
47.5±0.9d |
90.2±0.8e |
135.3±1.1 |
Download Excel Table
DPPH 라디칼 소거 활성
DPPH는 화학적으로 안정화된 free radical을 가지고 있는 수용성 물질로 ascorbic acid, tocopherol, polyhydroxy 방향 족 화합물 등에 의해 환원되어 짙은 자색이 탈색되는데, 이것은 다양한 천연 소재로부터 항산화 물질을 검색하는데 많이 이용되고 있다(27). reactive oxygen species(ROS)는 체내 방어기전에 의해 대부분 제거되지만 제거되지 못할 경우 생체분자들과 신속하게 반응하여 단백질의 변성이나 생체막의 지질 과산화, DNA 손상 등을 일으키며, 세포 내로 확산되거나 혈류를 통해 이동된 지질 과산화물은 새로운 radical 반응을 촉진시켜 각종 질환의 원인으로 작용 하였다 (28). 본 연구에서는 추출방법을 달리한 4가지 추출물과 가장 효과가 우수한 70% 에탄올 추출물에 대한 4가지 용매 분획물의 DPPH 라디칼 소거 활성을 측정하였다. 추출방법 에 따른 4가지 추출물의 DPPH radical 소거 활성은 Table 1과 같이 나타났다. DPPH 라디칼 소거 활성은 1,000 μg/mL 농도에서 LPE > LPU > LPA > LPW 순으로 측정 되었으며, 가장 우수한 활성을 나타낸 LPE로부터 용매 분획물의 DPPH 라디칼 소거 활성을 측정한 결과 1,000 μg/mL의 농도 에서 LPE/E이 91.8%의 활성을 나타내었고 RC50값은 43.5 μg/mL으로 측정되어, vitamin C의 라디칼 소거 활성과 유사 한 활성을 나타냄을 확인 할 수 있었다(Table 2). 이러한 결과는 인진호 추출물의 1,000 μg/mL 농도에서 65.6%의 DPPH 라디칼 소거 활성을 나타내는 결과(29)보다 우수한 활성을 나타내었으며, 높은 활성을 보인 제주 당근 꽃 추출 물의 에틸아세테이트 분획물의 51.97 μg/mL의 RC50값과 비슷함을 확인 할 수 있었다.
Table 2.
DPPH radical scavenging activity of solvent fractions from Ledum palustre L. (%)
| Samples |
Concentration (μg/mL) |
RC50 |
| 10 |
100 |
1,000 |
| Hexane fraction |
22.7±1.71)a2) |
37.6±2.1b |
83.2±1.3e |
364.2±1.3 |
| Ethyl acetate fraction |
48.0±0.9c |
62.7±1.1d |
91.8±1.5e |
43.5±0.9 |
| Butanol fraction |
36.2±1.0b |
52.8±1.7c |
80.6±1.6e |
92.7±0.9 |
| Water fraction |
20.2±1.6a |
28.3±2.3a |
68.7±2.2d |
542.7±1.4 |
| Ascorbic acid |
24.5±0.5a |
47.5±0.9c |
90.2±0.8e |
135.3±1.1 |
Download Excel Table
ABTS 라디칼 소거 활성
유기용매에 용해되는 DPPH는 친수성 화합물의 항산화 력을 측정함에 어려움이 있으나, 2,2-azino-bis(3-ethylbenthiazoline- 6-sulfonic acid) diammonium salt(ABTS)는 645, 734, 815 nm의 파장에서 최대의 흡광도를 가지므로 추출물 고유의 색소에 의한 영향이 최소화되어 DPPH에서 보다 정확한 항산화력을 측정할 수 있다고 보고되었다(31). ABTS+ radical cation 소거 활성은 ABTS와 potassium persulfate와의 반응으로 ABTS+․radical이 생성되면 특유 의 색인 청록색을 띄게 되며 hydrogen donating antioxidant 와 chain breaking antioxidant 모두를 측정할 수 있다. ABTS 라디칼 소거 활성에서도 백산차의 추출방법을 달리한 4가 지 추출물에 대한 활성을 먼저 측정하였으며, 그 결과는 Table 3에서 나타낸 것처럼 1,000 μg/mL 농도에서 LPE > LPU > LPW > LPA순으로 측정되었으며, LPE의 경우 가장 높은 농도인 1,000 μg/mL의 농도에서 99.8%의 높은 ABTS 라디칼 소거 활성을 나타내었다. 이는 톳의 고온가압 추출 물의 5 mg/mL의 농도에서 90% 이상의 활성을 나타낸 것 (31)보다 더 우수한 활성임을 확인 할 수 있었다. 추출물 중 가장 높은 활성을 나타낸 LPE의 용매 분획물에 대하여 ABTS 라디칼 소거 활성을 측정한 결과, 1,000 μg/mL 농도 에서 LPE/E > LPE/B > LPE/H > LPE/W 순서로 측정되었으 며 LPE/E 역시 1,000 μg/mL의 농도에서 99.6%의 높은 소거 활성이 확인되어 초석잠 부탄올 분획물의 1,000 μg/mL의 농도에서 98%의 높은 소거 활성(32)과 비교 시 유사한 활성 을 확인할 수 있었다(Table 4). 이러한 결과를 토대로 가장 우수한 라디칼 소거 활성을 지닌 백산차 추출물은 LPE와 LPE의 분획물인 LPE/E임을 알 수 있었으며 이들의 활성은 10-100 μg/mL 농도 사이에서도 vitamin C의 활성과 유사할 만큼 우수한 결과이다.
Table 3.
ABTS radical scavenging activity of extracts from Ledum palustre L. (%)
| Samples |
Concentration (μg/mL) |
RC50 |
| 10 |
100 |
1,000 |
| Water extraction |
12.4±1.61)b2) |
40.6±4.1c |
92.1±2.7d |
251.5±0.8 |
| Autoclave extraction |
11.8±2.7a |
39.2±3.6c |
86.3±1.3d |
273.9±2.5 |
| Ultrasonic wave extraction |
12.0±0.9a |
45.7±1.9c |
98.7±2.4e |
158.5±2.4 |
| 70% Ethanol extraction |
9.4±0.5a |
50.5±2.5c |
99.8±2.7 |
143.5±1.7 |
| Ascorbic acid |
18.2±0.9b |
49.7±2.2c |
99.3±1.7e |
156.5±1.5 |
Download Excel Table
Table 4.
ABTS radical scavenging activity of solvent fractions from Ledum palustre L. (%)
| Samples |
Concentration (μg/mL) |
RC50 |
| 10 |
100 |
1,000 |
| Hexane fraction |
10.2±0.91)a2) |
47.9±4.1c |
97.5±5.1e |
178.2±4.2 |
| Ethyl acetate fraction |
26.1±1.1b |
64.9±3.2d |
99.6±4.7e |
25.0±2.2 |
| Butanol fraction |
16.8±2.0b |
50.3±1.9c |
98.3±2.5e |
168.5±2.9 |
| Water fraction |
7.8±0.8a |
64.7±1.2d |
80.7±2.4d |
367.0±1.5 |
| Ascorbic acid |
18.2±0.9b |
49.7±2.2c |
99.3±1.7e |
156.5±1.5 |
Download Excel Table
세포 독성 측정
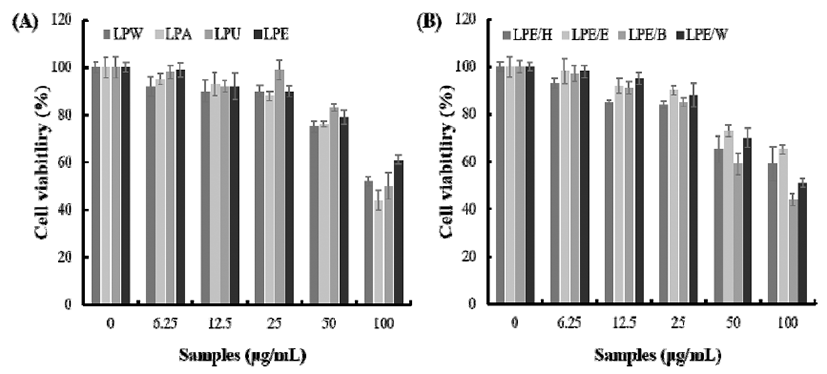
백산차 추출물 및 분획물에 의한 macrophage세포에서의 독성을 MTT assay에 의해 확인한 결과를 Fig. 1에 나타내었 다. 백산차 추출물 및 분획물의 항염효과가 LPS로 유도된 염증관련 물질의 생성을 감소시킨 것에서 기인하는지, 추 출물의 세포 독성으로 인한 cell population의 저하에서 기인 하는지를 고려하기 위한 실험한 결과, 백산차 4가지 추출물 및 4가지 분획물 모두 25 μg/mL의 농도 이하에서 90% 이상 의 높은 생존율을 나타내었다. 따라서 NO, PGE2, TNF-α, IL-1β와 IL-6 생성 저해 활성은 25 μg/mL이하의 농도에서 진행하였다.
Fig. 1.
Cell viability of the extracts and its fractions of Ledum palustre L. (LP) in Raw264.7 cells.
A, cell viability extracts of LP; B, cell viability fraction LPE.
LPW, Ledum palustre L. extracted with water; LPA, Ledum palustre L. extracted with autoclave; LPU, Ledum palustre L. extracted ultrasonic wave; LPE, Ledum palustre L. extracted with 70% EtOH; LPE/H, Hexane fraction of LPE; LPE/E, Ethyl acetate fraction of LPE; LPE/B, BuOH fraction of LPE; LPE/W, water fraction of LPE.
The values shown represent mean±SD of three different assays. *p<0.05, **p<0.01 compared with absence of samples.
Download Original Figure
nitric oxide(NO) 생성 저해 활성
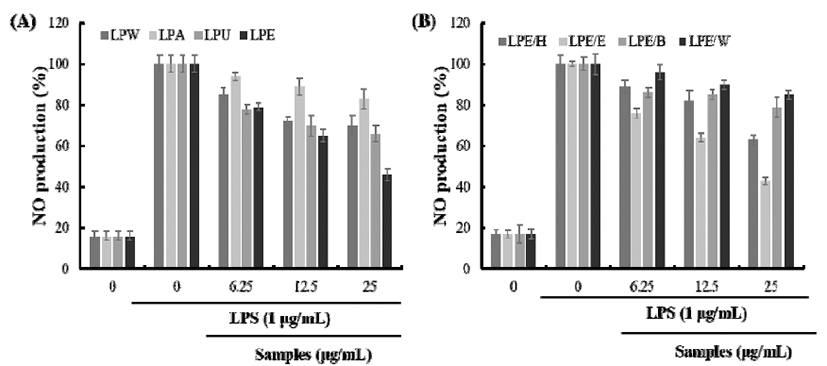
체내 염증과정에서는 과량의 NO 및 prostaglandin E2(PGE2)등의 염증인자가 유도형 NO synthase(iNOS) 및 cycloxygenase(COX)-2에 의해 형성된다(17). 일반적으로 NO의 형성은 박테리아를 죽이거나 종양을 제거시키는 중 요한 역할을 하지만 병리학적인 원인에 의한 과도한 NO의 형성은 염증을 유발시키게 되며, 조직의 손상, 유전자 변이 및 신경 손상 등을 유발한다(29). 백산차 추출물이 이러한 NO의 생성 저해 활성이 있는 지를 알아보기 위해 본 연구에 서는 우선 백산차 4가지 추출방법에 따른 추출물에 대하여 Raw264.7 세포에서 LPS 자극에 의해 생성되는 NO 생성량 에 대한 영향을 측정하였다. 4가지 추출물이 모두 농도 의존 적으로 세포 내에서의 NO 생성량을 감소 시켰지만 그 중 LPE은 25 μg/mL의 농도에서 50% 의 저해 활성을 나타내어, 잣 에탄올 추출물이 동일한 농도에서 46% 의 저해 활성을 나타낸 것(33)보다 우수한 활성을 나타내었다. LPE의 용매 분획물에 대한 활성을 측정한 결과, LPE/E에서 가장 높은 생성 저해 활성이 확인 되었으며(Fig. 2) 25 μg/mL의 농도에 서 57%의 저해 활성을 나타내어 풀솜대 에틸아세테이트 분획물의 100 μg/mL 농도에서 50% 이하의 저해 활성(34)을 나타낸 것보다 우수한 활성을 보였다.
Fig. 2.
Effects of the extracts and its fractions of Ledum palustre L. (LP) on NO production in LPS-stimulated Raw264.7 cells.
A, NO production of LP extracts; B, NO production of LP fractions.
LPW, Ledum palustre L. extracted with water; LPA, Ledum palustre L. extracted with autoclave; LPU, Ledum palustre L. extracted ultrasonic wave; LPE, Ledum palustre L. extracted with 70% EtOH; LPE/H, Hexane fraction of LPE; LPE/E, Ethyl acetate fraction of LPE; LPE/B, BuOH fraction of LPE; LPE/W, water fraction of LPE.
The values shown represent mean±SD of three different assays. *p<0.05, **p<0.01 compared with absence of samples.
Download Original Figure
prostaglandin E2(PGE2) 생성 저해 활성
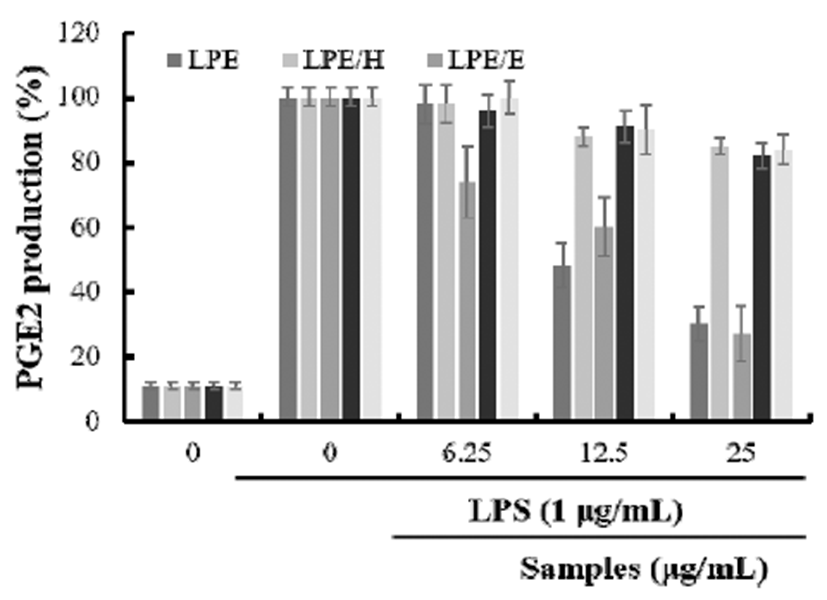
Prostaglandin은 국소적으로 활성화되는 물질로서 염증 반응을 유도하는 중요한 인자로 arachidonic acid로부터 cyclooxygenase(COX)의 작용에 의해 합성되어 진다(18). 그 중 체내에서 염증의 발생과정에서 과량의 PGE2는 cycloxygenase-2(COX-2) 등의 작용에 의해 발현되게 되며, PGE2는 잘 알려진 염증 유발 인자로서 면역세포를 염증 부위로의 이동에 관여하는 것으로 알려져 있다(19,33). 본 실험에서 PGE2의 생성 저해 활성은 NO 생성 저해 활성 실험에서 가장 우수한 결과를 나타낸 LPE와 LPE 용매 분획 물에 대해서만 측정하였다. Raw264.7 세포에서의 과량의 염증 유발 인자인 PGE2의 생성량 저해에 LPE와 그 용매 분획물들이 미치는 효과를 측정한 결과 LPE의 경우 25 μg/mL에서 70%의 저해 활성을 나타내었으며, LPE/E의 경 우도 농도 의존적으로 높은 저해 활성을 나타내었다. 특히 12.5, 25 μg/mL의 농도에서 각각 40%, 73%의 높은 저해 효과를 나타내었다(Fig. 3). 이러한 결과는 개소시랑개비 에틸아세테이트 분획물의 PGE2에 대한 IC50이 50.75 μg/mL 의 농도에서 측정되었으며, 10, 50, 100 μg/mL의 농도에서 농도 의존적으로 생성량을 저해하는 것(35)보다 더 우수한 활성임을 보여주고 있다. 따라서 백산차 에탄올 추출물과 백산차 에틸아세테이트 분획물이 PGE2의 생성을 강하게 저해함으로써 유의성 있는 항염증 효과를 보이는 것을 확인 할 수 있었다.
Fig. 3.
Inhibition of LPS-induced PGE2 production by Ledum palustre L. (LP) extracts and fractions.
LPE, Ledum palustre L. extracted with 70% EtOH; LPE/H, Hexane fraction of LPE; LPE/E, Ethyl acetate fraction of LPE; LPE/B, BuOH fraction of LPE; LPE/W, water fraction of LPE.
The values shown represent mean±SD of three different assays. *p<0.05, **p<0.01 compared with absence of samples.
Download Original Figure
염증성 cytokine 생성 저해 활성
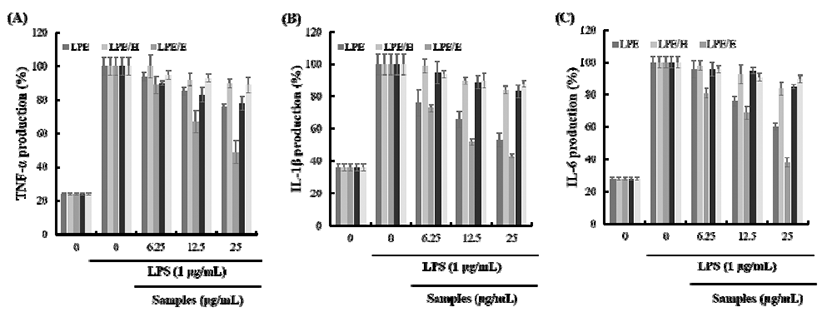
염증반응에는 다양한 염증조절인자인 TNF-α, IL-1β, IL-6등과 같은 pro-inflammatory cytokines, prostagrandin, free radicals 등 다양한 매개물질이 관여한다(36). 특히, IL-6 와 IL-1β는 발열작용을 일으키며, 면역계를 자극하는 pro-inflammatory cytokine으로서 TNF-α와 더불어 종양형 성에 관여한다고 알려져 있는 염증 매개물질이다(37-40). 이러한 염증성 cytokine들의 과량 발현을 억제하는 소재는 염증반응으로 유도되어지는 여러 염증 질환을 예방 혹은 조절할 수 있는 가능성이 있음을 나타낸다. 본 연구에서는 Raw264.7 세포에서의 LPS 자극에 의한 염증 조절 인자인 TNF-α, IL-1β, IL-6 과발현에 LPE와 그 용매 분획물이 미치 는 영향을 측정하였다. 측정 결과, LPE과 LPE/E는 TNF-α, IL-1β, IL-6 사이토카인을 농도 의존적으로 저해하였다. LPE의 경우 25 μg/mL의 농도에서 TNF-α, IL-1β, IL-6를 각각 24%, 47%, 40%로 저해하여 TNF-α, IL-6보다 IL-1β에 서 우수한 저해 활성을 보였다. 특히 LPE/E는 25 μg/mL의 농도에서 TNF-α와 IL-1β 생성량을 각각 51%, 57% 저해시 켰으며, IL-6의 경우 같은 농도에서 62%의 저해 활성을 나타내었다(Fig. 4). 상황버섯 에틸아세테이트 용매 분획물 이 100 μg/mL 농도에서 IL-6 생성량을 75% 저해 시킨 결과 (41)와 비교 시 LPE/E의 우수한 염증성 cytokine의 생성 저해 활성을 확인 할 수 있었다. 이러한 결과로부터 본 연구 에서의 백산차 추출물 및 그 용매 분획물에 대한 항산화 및 항염증 연구결과는 항염증관련 기능성 소재 개발에 중요 한 기초 자료가 될 수 있으며 향후 염증관련 질환이나 증상 의 연구에서도 유의미한 결과를 나타낼 수 있을 것으로 기대된다. 또한 항노화, 항균, 미백 활성 등에 대한 추가적인 연구 진행이 이루어진다면 백산차추출물은 기능성 식품, 화장품 분야 등에서도 효과적인 소재로 활용될 수 있을 것으로 사료된다.
Fig. 4.
Inhibition of LPS-induced pro-inflammatory cytokines production by Ledum palustre L.(LP) extracts and fractions.
Effect of LP extact and fractions A, TNF-α; B, IL-1β; C, IL-6 productions induced by LPS.
LPE, Ledum palustre L. extracted with 70% EtOH; LPE/H, Hexane fraction of LPE; LPE/E, Ethyl acetate fraction of LPE; LPE/B, BuOH fraction of LPE; LPE/W, water fraction of LPE.
The values shown represent mean±SD of three different assays. *p<0.05, **p<0.01 compared with absence of samples.
Download Original Figure
요 약
본 연구에서는 백산차추출물의 항산화 활성을 알아보기 위해 추출방법을 달리한 4가지 추출물인 열수추출물 (LPW), 고온가압추출물(LPA), 초음파추출물(LPU), 70% 에탄올 추출물추출(LPE)과 LPE에 대한 4가지 용매 층 분획 물인 n-hexane 층(LPE/H), ethyl acetate 층(LPE/E), n-butanol 층(LPE/B), water 층(LPE/W) 분획물의 DPPH와 ABTS 라디 칼 소거 활성을 측정하였다. 또한 백산차 추출물의 항염 활성을 알아보기 위해 LPS로 자극된 Raw 264.7 대식세포에 서 LPE와 LPE/H, LPE/E, LPE/B, LPE/W의 NO, PGE2, TNF- α, IL-1β, IL-6의 생성 저해 활성을 측정하였다. 그 결과, DPPH와 ABTS 라디칼 소거 활성에서 LPE가 1,000 μg/mL 의 농도에서 각각 82.3%와 99.8%의 소거 활성을 나타내었 으며, LPE/E의 경우 1,000 μg/mL의 농도에서 각각 91.8%와 99.6%의 높은 소거 활성을 나타내었다. 항염 활성 확인을 위하여 먼저 MTT assay를 수행하였으며 25 μg/mL 농도에 서 LPE와 LPE/E 모두 90% 이상의 세포 생존율이 확인 되었다. NO와 PGE2의 생성 저해 활성을 분석한 결과, LPE 와 LPE/E에서 높은 NO와 PGE2 저해 활성을 확인 하였다. LPE는 25 μg/mL의 농도에서 각각 50%와 70%의 저해 활성 을 나타내었고 LPE/E는 같은 농도에서 각각 57%와 73%의 저해 활성을 나타내었다. 마지막으로 TNF-α, IL-1β, IL-6의 생성 저해 활성을 측정한 결과 LPE 및 LPE/E의 농도의존적 인 저해 활성을 확인 하였으며 LPE가 25 μg/mL의 농도에서 각각 24%, 47%, 40%의 저해 활성을 나타내었다. 특히 LPE/E는 같은 농도에서 각각 51%, 57%, 62%의 높은 저해 활성을 보였다. 이러한 결과들로부터 1,000 μg/mL 농도의 LPE 및 LPE/E는 비타민C와 유사한 DPPH 및 ABTS 라디칼 소거능을 가지며 비교적 낮은 농도인, 25 μg/mL 농도에서 도 높은 항염증 활성을 가지고 있는 것으로 결론을 내릴 수 있다. 따라서 추후 항노화, 항균, 미백 활성 등에 대한 더 많은 연구 진행이 이루어진다면 백산차추출물은 염증성 질환의 예방 및 치료와 기능성 식품, 화장품 분야 등에서 효과적인 소재로 활용될 수 있을 것으로 사료된다.
감사의 글
본 논문은 2014년도 대구가톨릭대학교 교내연구비 지원 에 의해 수행된 연구 결과로 이에 감사드립니다.
References
Azuma K., Nakayama M., Koshioka M., Ippoushi K., Yamaguchi Y., Kohata K., Yamauchi Y., Ito H., Higashio H. Phenolic antioxidants from the leaves of
Corchorus olitorius L.. J. Agric. Food Chem. 1999; 47:3963-3966.

Kawashima S. The possible role of lipoperoxide in aging.. Nagoya J. Med. Sci. 1969; 32:303-326.

Decker E.A., Crum A.D., Calvert J.T. Differences in the antioxidant mechanism of carnosine in the presence of copper and iron.. J. Agric. Food Chem. 1992; 40:756-759


Jeong S.I., Kim H.S., Jeon I.H., Kang H.J., Mok J.Y., Cheon C.J., Yu H.H., Jang S.I. Antioxidant and anti-inflammatory effects of ethanol extracts from
Perilla frutescens.. Korean J. Food Sci. Technol. 2014; 46:87-93


Aniya Y., Naito A. Oxidative stress-induced activation of microsomal glutathione S-transferase in isolated rat liver.. Biochem. Pharmacol. 1993; 45:37-42.

Halliwell B., Gutteridge J.M. Role of free radicals and catalytic metal ions in human disease: an overview.. Methods Enzymol. 1990; 186:1-85.

Khalid O.A. Oxidant/Antioxidant status in obese adolescent females with
Acne Vulgaris.. Indian J. Dermatol. 2009; 54:36-40.

Kwon M.J., Kim B.H., Lee Y.S., Kim T.Y. Role of superoxide dismutase 3 in skin inflammation.. J. Dermatol. Sci. 2012; 67:81-87


Ozer A., Ergul B.K., Sezai S. Oxidative Stress in Patients With
Acne Vulgaris.. Mediators Inflamm. 2005; 14:380-384.

Kim S.G., Byun H.D., Kim S.C., Yang K.W., Kim J.H., Han J.H. Antioxidative and Anti-inflammatory Activities of Carrot flower.. Korean Soc Biotechnol Bioeng J. 2015; 30:77-81


Jeong S.J., Lee J.H., Song H.N., Seong N.S., Lee S.E., Baeg N.I. Screening for antioxidant activity of plant medicinal extracts.. J Korean Soc Appl Biol Chem. 2004; 47:135-140.

Kang I.H., Cha J.H., Han J.H., Lee S.W., Kim H.J., Kwon S.H., Han I.H., Hwang B.S., Whang W.K. Isolation of anti-oxidant from domestic
crataegus pinnatifida bunge leaves.. Korean J. Pharmacogn. 2005; 36:121-128.

Huang M.T., Ho C.T., Lee C.Y. Phenolic compounds in food and their effects on health II: Antioxidants and cancer prevention. American Chemical Society. Washington, DC, USA: ACS. 1992; p. 54-71.

Hogquist K.A., Baldwin T.A., Jameson S.C. Central tolence: learning self-control in the thymus.. Nat. Rev. Immunol. 2005; 5:772-782


Baek S., Choi J.H., Ko S.H., Lee Y.J., Cha D.S., Park E.Y., Kang Y.G., Jeon H. Antioxidant and anti-inflammatory effect of
Nardostachys Chinensis in IFN-I3 /LPS-stimulated peritoneal macrophage.. Kor J Ori Med Physiol Pathol. 2009; 23:853-859.

Ryu J.H., Ahn H.N., Kim J.Y., Kim Y.K. Inhibitory activity of plant extracts on nitric oxide synthesis in LPS-activated macrophage.. Phytother. Res. 2003; 17:485-489


Yayeh T., Jung K.H., Jeong H.Y., Park J.H., Song Y.B., Kwak Y.S., Kang H.S., Cho J.Y., Oh J.W., Kim S.K., Rhee M.H. Korean red ginseng saponin fraction down regulates pro-inflammatory mediators in LPS stimulated RAW264.7 cells and protects mice against endotoxic shock.. J. Ginseng Res. 2012; 36:263-269


Oh S.H., Choi S.Y., Lee N.R., Lee J.N., Kim D.S., Lee S.H., Park S.M. Cell migration and anti-inflammatory effect of red ginseng extracts fermented with
laetiporus sulphureus.. J Soc Cosmet Sci Korea. 2014; 40:297-305


Willeaume V., Kryus V., Mijatovic T., Huez G. Turmor necrosis factor-alpha production induced by viruses and by lipopolysaccharides in macrophages : similarities and differences.. J. Inflamm. 1996; 46:1-12.

Narimanov A.A. The reproductive capacity of male mice protected against the superlethal action of gamma radiation by the administration of a mixture of
Archangelica officinalis and
Ledum palustre extracts.. Radiobiologiia. 1992; 32:271-275.

Narimanov AA, Miakisheva SN, Kuznetsova SM. The radioprotective effect of extracts of Archangelica officinalis Hoffm. and Ledum palustre L. on mice.. Radiobiologiia. 1991; 31:391-393.

Jaeson T.G., Palsson K., Borg-kalson A.K. Evaluation of extracts and oils of tick-repellent plants from Sweden.. Med. Vet. Entomol. 2005; 19:345-352.

Kuusik A., Harak M., Hiiesaar K., Metspalu L., Tartes U. Studies on insect growth regulating and toxic effects of
Ledum palustre extracts on
Tenebrio molitor pupae (
Coleoptera, Tenebrionidae) using calorimetric recordings.. Thermochim. Acta. 1995; 251:247-253.

Palsson K., Jaenson T.G. Plant products used as mosquito repellents in Guinea Bissau, West Afica.. Acta Trop. 1999; 72:39-52.

Blois M.S. Antioxidant determinations by the use of a stable free radical.. Nature. 1958; 181:1199-1200


Re R., Pellegrini N., Proteggente A., Pannala A., Yang M., Rice-Evans C. Antioxidant activity applying an improved ABTS radical cation decolorization assay.. Free Radic. Biol. Med. 1999; 26:1231-1237


Kim O.K. Antidiabetic and antioxidative effects of
Corni fructus in streptozotocin-induced diabetic rats. J Korean Oil Chemists’ Soc.. Soc. 2005; 22:157-167.

Kim H.K., Kim Y.E., Do J.R., Lee Y.C., Lee B.Y. Antioxidative activity and hysiological activity of some Korean medicinal plants.. J. Food Sci. Technol. 1995; 27:80-85.

Kim J.S., Kim K.L. Anti-oxidative and anti-inflammatory effects of
Artemisiae Capillaris extract.. Kor J Aesthet Cosmetol. 2015; 13:805-812.

Arnao M.B. Some methodological problems in the determination of antioxidant activity using chromogen radicals: a practical case.. Trends Food Sci. Technol. 2000; 11:419-421


Kwon Y.R., Youn K.S. Antioxidant and physiological activities of
Hijikia fusiforme by extraction methods.. Korean J Food Preserv. 2017; 24:631-637


Kang J.R., Kang M.J., Shin J.H., Park J.H., Kim D.I., Chung S.Y., Shin J.H. Antioxidant and antidiabetic activities of various solvent extracts from
Stachys sieboldii Miq.. Korean J Food Preserv. 2017; 24:615-622


Cho Y.J. Inhibitory effect of
Koreinsis chinensis leaves extract on proinflammatory responses in lipopolysaccharide-induced Raw 264.7 cells.. J Appl Biol Chem. 2017; 60:191-198


Nam J.H., Seo J.T., Kim Y.H., Kim K.D., Yoo D.L., Lee J.N., Hong S.Y., Kim S.J., Sohn H.B., Kim H.S., Kim B.S., Lee K.T., Park H.J. Inhibitory effects of extracts from
Smilacina japonica on lipopolysaccharide induced nitric oxide and prostaglandin E2 production in RAW 264.7 macrophages.. J. Plant Biotechnol. 2014; 41:201-205


Nam J.H., Kim H.S., Kim B.J., Yu H.S., Chang D.C., Jin Y.I., Yoo D.L., Choi J.K., Park H.J., Lee S.B., Lee K.T., Park S.J. In vitro anti-inflammatory activity of extracts from
Potentilla supina in murine macrophage RAW 264.7 cells.. J. Plant Biotechnol. 2017; 44:76-81


Seo S.J., Choi H.G., Chung H.J., Hong C.K. Time course of expression of mRNA of inducible nitric oxide synthase and generation of nitric oxide by ultraviolet B in keratinocyte cell lines.. Br. J. Dermatol. 2002; 147:655-662


Moncada S., Palmer R.M., Higgs E.A. Nitric oxide: Physiology, pathophysiology, and pharmacology.. Pharmacol. Rev. 1991; 43:109-142.

Van S.J. Interleukin-6 : An overview.. Annu. Rev. Immunol. 1990; 8:253-278.

Delgado AV, McManus AT, Chambers JP. Production of tumor necrosis factor-α, interleukin 1-β, interleukin 2, and interleukin 6 by rat leukocyte subpopulations after exposure to substance P.. Neuropeptides. 2003; 37:355-361.

Maes M. The cytokine hypothesis of depression: Inflammation, oxidative & nitrosative stress (IO&NS) and leaky gut as new targets for adjunctive treatments in depression.. Neuroendocrinol. Lett. 2008; 29:287-291.

Taddesse Y., Oh W.J., Park S.C., Kim T.H., Cho J.Y., Park H.J., Lee I.K., Kim S.K., Hong S.B., Yun B.S., Rhee M.H.
Phellinus baumii ethyl acetate extract inhibits lipopolysaccharide-induced iNOS, COX-2, and proinflammatory cytokine expression in RAW264.7 cells.. J. Nat. Med. 2011; 66:49-54.