서 론
최근 들어 유산균, 효모, 바실러스, 곰팡이 등의 유익한 미생물을 이용한 발효기술 진보로 다당체, 올리고당, 사포 닌, 아미노산, 펩타이드, 피틴산 등의 발효산물을 얻거나 또는 상호간의 시너지 작용에 의해 생리활성효능이 상승되 는 것으로 알려져 왔다(1). 탄수화물과 단백질을 주로 분해 하는 미생물 중의 하나로 곰팡이 균주가 분비하는 효소에 의하여 생성되는 당류, 아미노산류, 유기산류 등의 맛 성분 은 제품의 품질에 결정적인 영향을 줄 뿐만 아니라 bioconversion에 의하여 다당체, 올리고당, 아미노산류, 펩 타이드류, 유기산류, 폴리페놀류 등 의 유효 성분의 생성 및 증가에 의해서 다양한 생리활성작용을 나타내는 것으로 잘 알려져 있다(2). 이들 곰팡이류에는 Aspergillus oryzae(A. oryzae), Aspergillus luchuensis(A. luchuensis), Monascus purpureus(M. purpureus) 등이 있다. A. luchuensis는 구연산 과 내산성 당화효소를 생산하는 균주로 알려져 있어 주류제 조에 많이 이용되고 있으며(2), M. purpureus 균주는 홍국색 소를 생산하므로 식품첨가물로 이용되기도 하고, monacolin K, mevinolin, lovastatin, γ-aminobutyric acid(GABA), acethylcholine과 같은 생리활성작용, 혈전 용해능 및 항산 화 활성과 같은 유효성 검증에 관한 많은 연구결과가 보고 되고 있다(3).
국내에서 Aspergillus 속이나 Rhizopus 속 등의 미생물을 이용하여 전분질 원료를 당으로 전환시킬 수 있는 당화 효소의 생성을 목적으로 곡자, 입국 등을 제조해 막걸리 주조에 이용하고 있다. 또한 곡류 코지를 이용하여 당화시 킨 쌀죽과 딸기죽 등이 개발되고 있다(4,5).
백하수오(Cynanchi wilfordii Radix)는 박주가리과 (Asclepiadaceae)에 속하는 덩굴속 다년초로서 중국과 일본, 한국에서 서식한다. 이명으로는 백수오라 불리며, 적하수 오(Polygoni mulyiflori Radix)와 혼용되기 쉬우나 식물학적 기원이 다르고 그 성분과 효능이 달라 구별에 주의하여야한 다(6). 백하수오의 주성분으로는 gagaminine, wilfoside K1N, wilfoside C1N, cynandione A, cynanchone A 등이 있으 며(7-11), 효능으로는 자양강장, 보혈작용 등이 있다고 알 려져 있다. 특히 gagaminine은 in vitro에서 hapatic aldehydeoxidase에 대하여 억제 활성을 가지고 있으며(12) cynandione A는 신경세포의 손상을 억제하고, 항산화활성 을 가진다고 알려져 있다(13). 백하수오는 중국, 대만 및 일본에서는 거의 사용되지 않는 약재이며 주로 적하수오를 많이 사용하고 있지만 국내에서는 경상북도, 강원도, 충청 북도 등에서 적하수오보다 백하수오를 훨씬 많이 재배되며 사용되고 있다(6).
최근에 천연물 소재는 세계적으로 주목받는 분야로 식물 유래 생리활성물질은 성인병 및 대사증후군을 예방하는 기능성소재로서 각광받고 있으며, 천연물로부터 식물화학 물질을 개발하려는 연구가 활발히 진행되고 있다. 기존 천 연물질을 이용한 추출 방법은 주로 용매나 열수 등을 이용 해 단순 추출하거나 액상발효방법을 활용하여 왔지만 효과 가 낮은 한계가 있으나 최근 다양한 기질에서도 자랄 수 있는 진균 곰팡이류 등의 미생물을 활용해 고체 발효함으로 써 발효 대상 기질을 그대로 이용해 생 변환 효율을 높이는 기술이 각광받는데 이는 미생물이 식물 섬유소 및 각종 천연물을 분해 및 변환하는 능력이 우수하므로 대부분 식물 유래 천연물질을 발효 대상으로 사용할 수 있는 장점 때문 이다(14,15). 현재 미생물 이용을 통한 한약재의 효능 증가 및 새로운 효능을 도출하는 연구(16)가 활발히 진행되고 있다.
따라서 본 연구에서 Rhizopus delemar로 백수오를 발효 하여 기능성뿐만 아니라 이용성을 증진시킨 식품 개발과 더불어 다양한 용도로 쓰일 수 있는 소재를 개발하기 위한 연구의 일환으로 기초연구를 실시하였다.
재료 및 방법
본 실험에 사용된 균주는 국립농업과학원 발효식품과에 서 분리한 R. delemar를 사용하였으며 백수오(Cynanchi wilfordii Radix)은 경북 영주산 2년근으로 경동시장 (Hanbangchon, Yeongcheon, Korea)에서 구입하여 실험에 사용하였다.
균주의 보존용 배지로는 potato dextrose agar(PDA, Difco, Detroit, MI, USA)배지를 사용하여, 30℃에서 5일간 평판 배양한 다음 접종원으로 사용하였다.
백수오 500 g을 세척한 후 3-5 cm로 썬 뒤 멸균 팩에 담아 autoclave(Vision Scientific, Co., Ltd., Daejeon, Korea) 에서 121℃, 15분 멸균시킨 다음, R. delemar를 접종하여 30℃ 온도의 incubater(VS-1203PFHLN, Vision Scientific, Co., Ltd., Daejeon, Korea)에서 8일간 배양하며 발효시켰다. 균 배양한 백수오는 -80℃ 초저온냉동기(deep freezer, Ilsin BioBase Co., Ltd., Dongducheon, Korea)에서 24시간 동결시 킨 후 동결건조기(freeze dryer, Ilsin BioBase Co., Ltd., Dongducheon, Korea)에서 72시간 동결 건조시킨 것을 마쇄 하여 시료로 사용하였다.
동결 건조한 발효 백수오를 사용하여 80% 에탄올 추출물 및 물 추출물을 제조하였다. 80% 에탄올 추출물의 제조는 다음과 같다. 각 동결건조 된 발효물 5 g에 80% 에탄올 수용액 100 mL씩 가하여 ultrasonicator(Power Sonic 420, 50/60 HZ, 700W, Hwashin Co., Seoul, Korea)로 1시간씩 2회 sonication하여 추출한 후 Whatman No. 2 여과지를 이용 하여 여과시킨 후, 여과액을 200 mL로 정용하여 rotary vacuum evaporator(BUCHI, USA)를 이용하여 50℃ 이하에 서 감압·농축하였고, 이를 같은 추출용매로 용해하여 본 실험의 분석용 시료로 사용하였다. 물 추출물의 제조는 다 음과 같다. 각 발효물 5 g에 끓인 증류수 100 mL을 혼합 후 ultrasonication(Power Sonic 420, 50/60 HZ, 700W Hwashin Co., Seoul, Korea) 장비로 1시간씩 2회 반복 추출 한 후 Whatman No. 2 여과지를 이용하여 여과시킨 후, 여과 액을 정용하여 rotary vacuum evaporator(BUCHI, USA)를 이용하여 50℃ 이하에서 감압·농축한 뒤, 이를 같은 추출용 매로 용해하여 본 실험의 분석용 시료로 사용하였다.
발효 백수오의 수분 함량은 적외선 수분 측정기(MS-70, AND Co., Japan)를 이용하여 측정하였으며, pH는 시료 2 g을 칭량하여 8 mL의 증류수를 가하여 균질화한 후 3,000 rpm에서 15분간 원심분리한 후 상등액을 취하여 pH meter(HM-30P, DKK-TOA, Japan)로 측정하였다. 총 산도 는 pH 측정의 시료와 동일한 시료를 3,000 rpm에서 15분간 원심분리한 후 시료액 0.1 mL에 0.9 mL의 증류수를 가하여 1 mL로 정용한 후, 0.1 N NaOH로 pH 8.3에 도달 할 때까지 적정하였으며, 적정에 소비된 NaOH 소비량을 이용하여 acetic acid 함량(%)으로 환산하여 총산 함량을 표시하였다. 실험은 3회 반복하여 그 평균값으로 나타내었다.
환원당은 dinitrosalicylic acid(DNS)법(16)에 따라 시료 1 mL에 DNS reagent 1 mL을 가하여 15분간 끓인 다음, 냉각한 후 증류수 3 mL을 첨가하여 UV-visible spectrophotometer (Synergy Mx, Biotek instruments, Winooski, VT, USA)를 이용하여 546 nm의 파장에서 흡광도를 측정하였다. 이때 당의 정량은 glucose를 표준물질로 사용하여 표준곡선으로 부터 환산하여 함량을 산출 하였다
유리당 분석은 HPLC(Waters 2695, waters Co., Miliford, MA, USA)를 이용하여 분석하였다. 발효 백수오 추출물을 희석하여 0.45 μm PVDF membrane filter를 여과한 것을 시험용액으로 하였고, column은 YMC-PACK Polyamine Ⅱ (5 μm, 4.6×250 mm, YMC Co., Allentown, PA, USA))을 사용하였으며, mobile phase는 acetonitrile:water 혼합액 (75:25, v/v), flow rate는 1.0 mL/min, detector는 RI(Waters 2414, Waters Co., Miliford, MA, USA)를 사용하여 분석하 였다
유리아미노산 분석은 유리아미노산은 80% 에탄올 추출 물에 5% Trichloracetic acid(TCA) 용액을 5배 넣은 후 원심 분리(12,000 rpm, 15분)한 다음 상등액을 취하여 n-hexane 혼합하여 비극성 물질을 처리한 후 0.25 μm syringe filter에 통과시킨 후 아미노산 분석기(Hitachi L-8900, Hitachi High Technologies America, Inc., USA)로 분석하였다. 이때 column은 hitachi 4.6×60 mm(seperation), hitachi 4.6×40 mm(ammonia filtering)을 사용하였으며, column 온도는 5 0℃, mobile phase는 buffer set(PH-SET KANTO), flow rate(mL/min)는 buffer 0.4, ninhydrin 0.35, injection volume 은 20 μL였다.
발효 백수오 80% 에탄올 및 물 추출물 시료의 성분분석 은 HPLC(Waters 2695, Waters Co., Miliford, MA, USA)를 이용하여 분석하였다. 추출물을 0.2 μm PVDF membrane filter 여과한 것을 시험용액으로 하였고, 분석 조건은 다음 과 같다. column은 YMC-Pack Pro C18(5 μm, 4.6×60 mm, YMC Co.), mobile phase 조성은 solvent A water: Thrifluoro-acetic acid(99.5:0.5, v/v)와 solvent B Acetonitril 를 사용하였고, flow rate , 및 column 온도는 각각 0.8 mL/min, 30℃로 detector는 photodiode array detector(Waters 2699, Waters Co.)를 사용하여 검출하였다. 표준물질 cynandione A는 Sigma-Aldrich Co.로부터 구입하였고 HPLC에서 나타난 peak area의 3회 반복 평균값을 취한 후 표준품의 양과 peak area사이의 상관관계를 도출하여 검량 선을 작성하여 계산하였다.
결과 및 고찰
R. delemar를 접종하여 8일간 발효한 백수오의 수분함량 및 pH를 측정 결과는 Table 1과 같다. 수분함량은 대조구는 66.75%, 백수오는 발효 4일차에 68.40%의 함량을 보였다. 발효 백수오의 수분함량은 전반적으로 66.75-68.40%로 거 의 유사하였다. 이는 발효기간이 지남에 따라 발효 백수오 의 수분 함량이 거의 유지되는 것으로 사료된다. pH는 대조 구가 pH 5.90, 백수오는 발효 기간 동안 pH 5.34-5.38로 대조구에 비해 감소하였다. 이는 R. delemar 균주의 생장을 보았을 때 알칼리보다는 pH 4-5범위의 산성에서 배양이 잘된다는 보고와 일치하였다(17) 또한 당이 함유 되어있으 면 pH가 낮아진다는 결과(18)와 비슷한 양상을 보였다. 반 면 산도는 발효 4일차 0.48%로 총 산도가 가장 높았으며 이후 배양 8일차에 0.39%로 초기 산도에 비해 증가하였다. 이러한 결과는 Rhizopus sp.는 발효기간 동안 lactic acid 및 fumaric acid를 다량 생성하여(19,20) 산도를 증가 된 것으로 판단된다. 발효 백수오의 환원당 함량을 측정한 결 과 발효 기간이 지남에 따라 함량 차이를 보였으며 결과는 Table 1과 같다. 환원당 함량을 측정한 결과 발효기간에 따른 함량 차이를 나타냈다. 발효4일차 환원당 함량은 1.69 mg/100 g으로 가장 높은 환원당 함량을 나타냈으며 대조구 환원당 함량 0.49 mg/100 g에 비해 약 3.5배 높은 환원당 함량을 나타냈었다. 이는 R. delemar 를 백수오에 배양하여 발효기간이 지남에 따라 효소활성이 증가되었고, 이러한 결과는 α-amylase를 생성하는 미생물들이 발효식품 제조에 서 전분질 원료를 당화시키는 것으로 알려져 있으며(21) 본 연구결과는 유사한 결과를 나타냈다.
발효 백수오의 추출용매에 따른 유리당 함량을 측정한 결과는 Table 2.과 같다. 대조구의 80% 에탄올 추출물은 rhamnose 2,967.01 mg/100 g, fructose 404.07 mg/100 g, glucose 386.60 mg/100 g, sucrose 4,029.07 mg/100 g이 검출 되었다. 발효 4일차 백수오의 80% 에탄올 추출물의 경우 glucose의 함량이 10,707.93 mg/100 g으로 약 27.7배 증가하 였다. 반면 rhamnose 1,240.18 mg/100 g, fructose 105.70 mg/100 g 및 sucrose 456.01 mg/100 g 로 대조구에 비하여 감소하였다. 발효 8일차 백수오의 80% 에탄올 추출물의 glucose 함량은 대조구에 비해 약 12배 높은 4,570.63 mg/100 g 검출 되었으나 발효 4일차에 비해 감소하였다. 이외의 유리당의 함량은 전체적으로 발효 4일차에 비해 감소하였다. 열수추출물에서 대조구의 유리당 함량은 rhamnose 1,207.76 mg/100 g, fructose 291.49 mg/100 g, glucose 468.04 mg/100 g sucrose 5,462.19 mg/100 g이 검출 되었다. 발효 4일차 백수오의 열수추출물에서도 glucose는 6,997.75 mg/100 g으로 크게 증가한 반면 rhamnose 992.02 mg/100 g, fructose 62.17 mg/100 g 및 sucrose 437.40 mg/100 g으로 감소하였다. 발효 8일차 백수오의 열수추출물의 glucose 함량은 6,578.63 mg/g으로 약 1.1배 차이로 발효 4일차에 비해 감소하였다. 반면에 fructose는 146.84 mg/100 g으로 발효 4일차에 비해 증가하였다. rhamnose 및 sucrose 는 237.04 mg/100 g, 374.75 mg/100 g으로 감소하였다. Lee(22)의 보고에 의하면 발효 미생물이 amylase분해효소 에 의해서 glucose 등과 같은 환원당으로 분해되어져 발효 의 기질로 이용되어 진다고 보고되었다. 이러한 보고는 본 연구의 결과와 유사하였다.
백하수오가 가지는 산 분해(acid hydrolysis)를 통해 얻은 총 아미노산의 조성과 단백질을 구성하지 않는 유리아미노 산의 조성은 Table 3.과 같다. 총 아미노산은 필수아미노산 8종을 포함해서 총 17종이 검출되었다. 배양기간이 지남에 따라 유리 아미노산이 4일차에는 31.72 mg/100 g으로 감소 하였으나 8일차에는 다시 90.36 mg/100 g으로 증가하는 경향을 보였다. 보고에 의하면 발효기간에 따라 미생물 증 식이 왕성해짐으로써 아미노산의 생성보다 소비 증가로 인해 아미노산 함량이 감소한 것으로 보고되었다.(23) 또한 R. delemar의 protease활성으로 백수오의 단백질이 가수 분 해됨으로써 아미노산 생성 증가에 기인하여 함량이 다시 증가한 것으로 판단된다(24). 백수오의 쓴맛을 내는 아미노 산은 arginine, phenylalanine, valine, leucine등으로 발효기 간 동안 대조구에 비해 함량이 감소하는데, arginine은 발효 4일차에 21.34 mg/100 g으로 약 7배 낮은 함량이 검출되었 다. 식품에서 단맛을 내는 아미노산인 alanine, threonine은 대조구에 비해 발효 8일차에 9.24 mg/100 g, 1.53 mg/100 g 으로 약 1.5배, 약 13배 증가하였으며, serine은 대조구에서 검출되지 않았으나, 발효 8일차에 1.23 mg/100 g으로 검출 되었다. 또한 감칠맛을 나타내는 aspartic acid은 발효 8일차 에 1.53 mg/100 g으로 대조구에 비해 약 1.2배 높은 함량을 나타냈다. 이러한 본 연구 결과를 미루어 볼 때 아미노산의 조성과 함량은 발효 미생물 사용 여부 및 원료 및 발효기간 등의 조건에 기인하며(25) 미생물을 활용한 발효로 다양한 특성을 가진 아미노산의 증가뿐만(26) 아니라 독특한 향미 를 제공할 수 있을 것으로 사료된다.
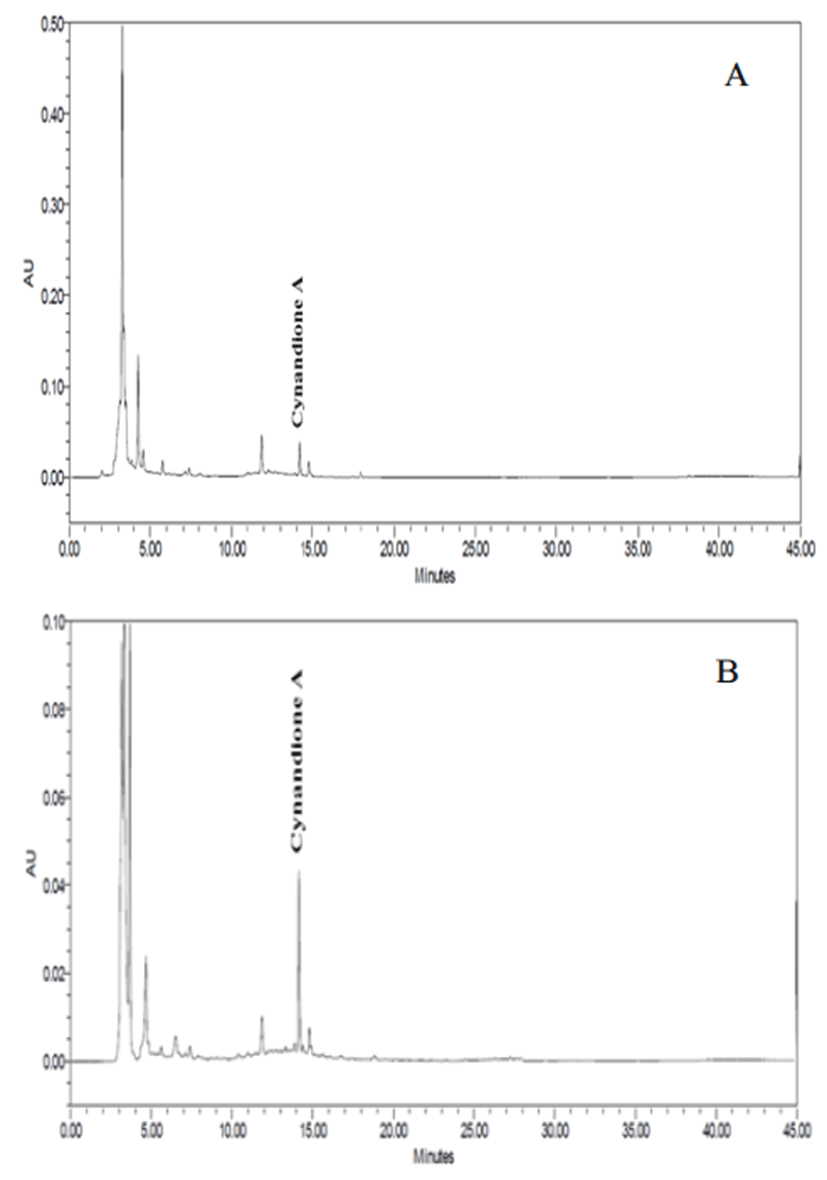
발효 백수오의 추출용매에 따른 성분 함량을 측정하였 다. 본 실험에서는 백수오에 존재하는 지표물질인 cynandione A를 HPLC로 분석을 통해 확인 하였고 함량을 Table 4에 나타내었으며, HPLC 크로마토그램은 Fig. 1 에 나타내었 다. 분석결과 대조구의 80% 에탄올 추출물은 5.06 mg/ 100 g, 물 추출물은 7.10 mg/100 g으로 나타났으며, 발효 백수오 를 분석한 결과 8일차에 80% 에탄올 추출물은 14.09 mg/100 g으로 대조구에 비해 약 2.8배 증가한 함량으로 높은 함량을 나타내었다. 또한 물 추출물은 발효 백수오 8일차에 13.81 mg/100 g으로 대조구보다 약 1.9배 이상 높은 함량을 나타내었다. 본 실험에서 대조구와 비교했을 때 발 효 백수오의 cynandione A 함량이 높게 나타났다. 이러한 발효공정을 통한 약용소재 활성성분의 생물전환은 약재의 효능 증가 및 새로운 효능 도출 할 수 있으며, 체내 이용 및 흡수율 증진 시켜 여러모로 식품산업에서 폭넓은 활용이 가능할 것으로 판단된다(15).
| Fermentation period (day) | Cynandione A | |
|---|---|---|
| Water extract | 80% EtOH extract | |
| 0 | 3.55±0.091)b2) | 2.53±0.05c |
| 4 | 0.76±0.04c | 3.11±0.01b |
| 8 | 6.90±0.41a | 7.04±0.15a |
요 약
본 연구에서는 발효 백수오의 이용성 및 기능성을 증진 시킨 식품 및 소재를 개발하기 위한 연구의 일환으로 기초 연구를 실시하였다. 총산도는 대조구에 비해 증가하는 경 향을 보였고 발효 4일차에 0.48%로 가장 높았다. 환원당 함량 측정결과 발효 4일차 백수오는 대조구 비해 3.5배 증가 하는 경향을 보였다. 유리당 함량 분석결과 발효 4일차 백수 오의 80% 에탄올 추출물의 경우 glucose의 함량이 대조구 에 비해 약 27.7배 증가하였고, 열수추출물에서도 약 15배 증가하였다. 총 아미노산은 필수아미노산 8종을 포함해서 총 17종이 검출되었다. 배양 8일차에는 90.36 mg/100 g 으로 증가하는 경향을 보였다. 백수오의 쓴맛을 내는 아미노산 arginine은 발효기간 동안 대조구에 비해 함량이 감소하였 고, 단맛을 내는 아미노산인 alanine, threonine과 감칠맛을 나타내는 aspartic acid은 증가하였다. 백수오에 존재하는 지표물질인 cynandione A를 분석한 결과 80% 에탄올 추출 물과 물 추출물은 발효 8일차에 가장 높은 함량을 나타내었 다. 본 연구에서 R. delemar의 발효를 통해 백수오의 기능성 을 증대시킬 수 있음을 알 수 있었고, 이러한 R. delemar 균주 발효 백수오를 이용하여 기능성 및 생리활성 효능 등이 증대된 식품소재 및 건강기능식품으로 개발 가능성이 있음을 제시하였다. 따라서 본 연구결과를 기초자료로 하 여 백수오의 기능성을 증대시키기에 적합한 R. delemar 균 주를 이용하여 배양일에 따른 백수오의 이화학적 특성 및 성분분석과 더불어 세포실험 등을 통해 기대되는 생리활성 효능에 대한 검증이 필요할 것으로 생각된다.










