서 론
미세조류는 광합성을 하는 수중 단세포 생물로 일반적으 로 식물성 플랑크톤이라고 불린다. 최근 국내외 연구에 의 해 미세조류에는 당질, 지질, 색소, 비타민, 스테로이드와 기타 의약성분 등과 같은 다양한 생리활성물질들이 함유되 어 있음이 밝혀졌다(1-3). 해양 미세조류 중 녹조류 (cyanobacteria)에 속하는 클로렐라는 다량의 엽록소, 필수 아미노산, 비타민, 미네랄, 핵산과 불포화지방산이 함유되 어있어 다양한 생리활성 효과가 있는 것으로 알려져 있다 (4).
한편, 와편모조류(Dinoflagellate)에 속하는 Amphidinium carterae는 광합성에 의해 쉽게 증식되며, 지질을 다량 함유 한 단세포 미세조류이다(5). 안전성측면에서 해양에 적조 현상으로 인한 어패류의 폐사와 관련해 Amphidinium spp. 의 독성이 연구되었고, Amphidinium operculatum 종이 생산 하는 polyketide(PK)류는 세포독성이 큰 것으로 알려졌다 (6). 하지만, Murray 등(6)은 Amphidinium spp.의 유전학적 다양성(diversity)에 대한 보고에서 Amphidinium spp.와 A. carterae의 유전학적 서열차이가 커서 생산하는 PK류가 다 르다고 하였다. 또한, Kellmann 등(7)에 의하면A. carterae 은 신경성 패독(brevetoxin), 마비성 패 독(saxitoxin) 등의 조류독소(phycotoxin)을 합성하는 유전자를 보유하고 있지 않다고 하였다. A. carterae는 Candida sp.와 Aspergillus niger의 증식을 억제하는 항진균 활성물질로 각각 amphidinol(8-10)과 carteraol E(11) 등을 생성하는 것으로 알려졌다. 따라서, A. carterae는 기능성 물질을 함유한 미세 조류로 그 이용가치에 대해 관심이 증대하고 있다.
미세조류의 기능성에 대한 연구의 결과로 클로렐라는 면역력 증진(12)과 항산화(13)에 도움되는 기능성 식품원 료로 등재되어 있고(14), 클로렐라 세포를 건조 분말화한 원말을 정제 또는 과립으로 가공한 것과 열수 추출물이 건강식품으로 이용되고 있다. A. carterae의 경우 클로렐라 와 비슷한 수준의 당질, 미네랄과 섬유질 등을 함유하고 있고, 특히 지질의 함량이 높은 것으로 보고되어(5) 지용성 기능성 물질에 대한 관심이 증대하고 있다. 최근에는 A. carterae 배양물의 메탄올 추출물 및 용매분획물에서 면역 활성과 항암활성이 우수한 것으로 보고되었다(5). 그러나, A. carterae의 에탄올추출물에 대한 항산화, 항균활성과 항 당뇨효과 등의 기능성 평가(in vitro)에 대한 연구는 미비한 실정이다.
본 연구에서는 건강기능식품의 소재로서 해양 미세조류 인A. carterae의 이용 가능성을 클로렐라와 비교하여 확인 하고자 하였다. 이를 위해 A. carterae와 클로렐라 에탄올 추출물을 동결건조하여 분말화하여, 항산화, 항균활성과 항당뇨 효과를 측정하였고, 그리고 암세포주를 이용한 항 암활성 평가에 대해 농도의존성을 평가하였다. A. carterae 의 기능성 평가결과를 토대로 건강기능성 식품으로서 A. carterae 에탄올 추출물의 가능성을 위한 기초 자료로 활용 하고자 하였다.
재료 및 방법
본 실험에서 사용된 A. carterae는 아쿠아진텍(Busan, Korea)으로부터 분양받아 동결 건조하여 분석시료로 하였 다. 실험 비교군인 클로렐라 분말은 ㈜대상(Gunsan, Korea) 의 제품을 구입하여, -20℃ 이하의 암소에 보관하면서 추출 용 시료로 사용하였다. 추출물은 dimethyl sulfoxide (DMSO; Daejung chemical, Gwangju, Korea)에 녹여 사용하였다.
항균활성측정을 위한 미생물은 Escherichia coli 3종, Micrococcus luteous, Staphylococcus aureus, Listeria monocytogenes, Bacillus subtilis, B. licheniformis, B. cereus 4종과 Pseudomonas aeruginosa를 한국농업미생물자원센 터(Korean Agricultural Culture Collection, KACC, Wanju, Korea)에서 분양받았으며, E. coli KCTC1039와 Klebsiella pneumoniae KCTC 2246를 생물자원센터(Korean Collection for Type Cultures, KCTC, Jeongup, Korea)에서 분양받아 사용하였다. 항암세포 활성 평가를 위한 세포주는 HepG2 (간암세포)와 HT-29(대장암세포)를 한국세포주은행(Korean Cell Line Bank, KCLB, Seoul, Korea)에서 분양받아 사용하 였다.
DPPH(2,2-Diphenyl-1-picrylhydrazyl), ABTS(2,2-azinobis- 3-ethylenebenzothiozoline-6-sulfonic acid), ascorbic acid, pyrogallol, gallic acid, Folin-Ciocalteau reagent, α-glucosidase, 4-PNP-glycoside(p-NPG; p-Nitrophenyl α-D-glucopyranoside) 와 sodium carbonate등은 Sigma-Aldrich사(St. Louis, MO, USA), nutrient broth(NB)와 nutrient agar(NA) 등은 Difco사 (Difco, MD, USA)에서 구입하였고, 그리고 그 밖의 시약들 은 analytical 및 HPLC grade를 사용하였다. 세포활성평가를 위한 Dulbecco’s modified Eagle’s medium(DMEM), penicillin-streptomycin, Fetal Bovine Serum(FBS)와 Phosphate Buffer Saline(PBS)는 Gibco/BRL사(Burlington, ON, Canada) 제품을 구입하였고, Cell Counting Kit-8(CCK-8)은 CCK-8 (Dojindo, Kumamoto, Japan)을 사용하였다.
항온수조(TW-PC-1, Universal Scientific Industrial Co., Ltd., Shanghai, China), 회전증발 농축기(RV 10 basic, IKA, Staufen, Germany)과 동결건조기(Supermodulyo 220, Thermo Electron Co., Waltham, MA, USA)는 추출과 농축을 위하여 사용되었다.
에탄올 추출은 A. carterae 및 클로렐라 분말에 10배의 95% 에탄올을 가한 후, 환류냉각기를 부착시킨 항온수조를 이용하여 1시간동안 70℃에서 가열추출 하였으며, 이 과정 을 3회 반복하였다. 각 추출물은 여과지 Whatman No. 2(Whatman Co., Maidstone, England)로 여과한 다음 rotatory vacuum evaporator로 감압농축한 후 동결건조하여 분말로 제조하였다. 이를 -70℃ 이하의 암소에 보관하면서 DMSO 에 녹여 시료를 제조하였으며 일정농도로 희석하여 항산 화, 항균활성, 항당뇨 활성과 항암활성 측정을 위해 사용하 였다. 각각의 추출물 시료는 chlorella ethanol extract(CE), A. carterae ethanol extract(AE)로 명명하였다.
Anesini(15)의 방법을 이용하여 미세조류 에탄올 추출물 에 대한 총 페놀 함량(total phenolics content, TPC)을 측정하 였다. 시료 1 mL에 10% Folin-ciocalteu’s phenol reagent 5 mL를 가하여 실온에서 3분간 반응시킨 후에 7.5% Na2CO3 용액 4 mL를 첨가하여 실온암소에서 2시간동안 반응시켰다. 이 반응액을 분광광도계(UV-1650PC, Shimadzu Co, Kyoto, Japan)를 이용하여 765 nm에서 흡광도를 측정하 였다. Gallic acid로 작성한 표준 검량곡선을 이용하여 시료 의 흡광도로부터 총 페놀 함량(mg/g)을 구하였다.
Kano 등(16)의 방법을 일부 변형하여 미세조류 에탄올 추출물에 대한 DPPH 라디컬 소거능을 측정하였다. 시료 100 μL에 100 μM DPPH용액 2 mL를 첨가하여 암소에서 20분간 반응시킨 후에 515 nm에서 흡광도를 측정하였으며 비교구로는 ascorbic acid를 사용하였다. DPPH radical 소거 능을 아래의 식으로 계산하였다.
Li 등(17)의 방법을 이용하여 미세조류 에탄올 추출물에 대한 ABTS radical 소거능을 측정하였다. 시료 30 μL에 ABTS radical 용액 3 mL를 첨가하여 암소에서 6분간 반응 시킨 후에 734 nm에서 흡광도를 측정하였으며, 비교구로는 ascorbic acid를 사용하였다. ABTS radical 소거능을 아래의 식으로 계산하였다.
미세조류 에탄올 추출물에 대한 항균활성은 paper disc 확산법으로 비교분석하였다. 각각의 추출물 시료를 DMSO 를 이용하여 100 mg/mL 농도로 stock solution을 조제한 후 일정한 농도범위로 희석하였다. 본 실험에 사용된 세균 은 NB에 접종하여 37℃와 200 rpm에서 18시간 진탕 배양시 켜 활성 시킨 후 멸균된 면봉을 사용하여 NA에 도말하였다. 각 균이 도말된 NA 표면에 6 mm paper disc(ADVANTEC, Tokyo, Japan)을 올리고, 그 위에 시료를 20 μL 점적하여 37℃에서 18시간동안 정치 배양하였다. 이후 paper disc 주 위로 형성된 clear zone(mm)을 측정하여 항균력을 확인하 였고, 항균활성이 확인되는 최소저해농도(minimum inhibitory concentration, MIC)를 측정하기 위해 추출물의 농도를 조정 하여 점적한 후 clear zone의 생성여부을 확인하였다. Clear zone의 생성여부에 따라 최소저해농도를 결정하였다.
미세조류 에탄올 추출물의 항당뇨 효과는 α-glucosidase inhibition(AGI) 활성을 이용하였고, Lim 등(18)의 방법을 실험조건에 맞게 변형하여 사용하였다. 추출물 시료는 각 각 10 mg/mL의 농도로 DMSO에 용해하여 단계적으로 ddH2O로 희석(0.025, 0.05, 0.1, 0.25, 0.5 와 1 mg/mL)하여 사용하였다. 준비된 시료 100 μL에 0.2 mM 4-NPG 200 μL를 가하여 37℃에서 5분간 평형상태를 유지한 후, 0.5 U/mL로 조제된 α-glucosidase 200 μL를 첨가하여 37℃에서 30분간 반응하였다. 30분 경과 후 0.25 M Na2CO3 500 μL를 첨가하여 반응을 종료시키고 405 nm에서 흡광도를 측정하 였다. 대조구(control)는 시료(sample) 대신 증류수를 첨가 하여 반응시켰다. 양성대조구로는 acarbose(100 μg)를 시료 대신 첨가해서 저해활성을 비교하였다. AGI의 활성은 아래 의 식으로 계산하였다.
미세조류 에탄올 추출물의 암세포 생장억제는 HepG2 (간암 세포)와 HT-29(대장암 세포) 세포주의 세포 생존율을 측정하여 평가하였다. DMEM 배지에 penicillin(100 U/mL), streptomycin(100 μg/mL) 그리고 FBS를 10%로 첨가하여 조제하고, 세포 현탁과 배양배지도 사용하였다. 세포 현탁 액은 DMEM 배지를 이용하여 5×104 cells/mL의 농도로 조 절한 후 96 well plate의 각 well에 100 μL씩 분주한 다음, 37℃로 설정된 5% CO2 배양기에서 24시간 배양하였다. 24시간 후 추출물 시료농도가 1 mg/mL가 되도록 DMEM 배지를 사용하여 제조한 후, 이를 단계적으로 희석(31.25, 62.5 와 125 μg/mL)하여 각각 100 μL씩 첨가하고 37℃로 설정된 5% CO2 배양기에서 48시간 배양하였다. 배양 후 기존배지를 제거한 다음 PBS 100 μL, CCK-8 solution 10 μL씩을 각각 첨가한 후, 37℃ 암소에서 2시간 반응시켰다. 이어서 0.1 N HCl을 10 μL 첨가하여 반응을 정지시킨 다음 450 nm에서 흡광도를 측정하였다. 암세포 생장억제능은 흡광도 측정결과를 아래의 식에 대입하여 세포 생존율로써 비교하였다. Blank는 시료액 대신 PBS를 사용하였고, control은 DMSO의 세포 생장 저해활성 고려하고자 시료액 대신 농도별 DMSO를 첨가하여 측정하였다.
결과 및 고찰
미세조류 에탄올 추출물의 총 페놀성 화합물의 함량과 항산화활성 측정결과는 Table 1과 같다. CE와 AE의 TPC는 각각 47.39 mg/g와 8.88 mg/g로 CE의 총 페놀성 화합물의 함량이 AE보다 5.33배 높았다. 클로렐라와A. carterae 에탄 추출물의 DPPH 라디칼 소거활성의 경우, 추출물의 첨가량 이 1-6 mg/mL까지 증가함에 따라 농도 의존적으로 활성이 증가하였으나 CE와 AE의 최고 활성이 각각 22.42%와 20.16%이었고 다중검정의 결과 다른 그룹으로 분류되었다. ABTS 라디칼 소거능의 경우 CE와 AE의 최고활성이 각각 28.58%과 17.69%이었고 농도 의존적으로 증가하였다. Lee 와 Hong(13)에 의하면 클로렐라의 지용성 엽록소가 열수 추출보다 50% 에탄올에 용출이 유리하다고 하였고, Kim 등(19)은 지용성용매 추출물에서 항산화활성이 우수하다 고 하였다. Kumar(20)는 클로렐라의 색소성분인 클로로필 린(chlorophyllin)이 활성 산소종을 제거하는 능력이 있다고 보고하였으므로, 클로렐라 에탄올 추출물의 항산화능은 클 로로필린 같은 색소성분과 페놀성 화합물에 기인된다고 판단되었다. 한편, A. carterae은 에탄올 추출물의 페놀성 화합물 양은 상대적으로 적었으나 항산화능을 보이는 것으 로 나타났다. A. carterae가 6%의 지질을 함유하고, 40%이 상의 무기질을 함유하고 있으며(5), zeaxanthin 같은 carotenoid 합성이 가능하다 하였다(21). 따라서, AE의 항산 화성분은 페놀성 화합물 이외에 지용성 색소나 무기질의 영향으로 추정된다(26).
1) DPPH, DPPH radical scavenging ability; ABTS, ABTS radical scavenging ability; TPC, total phenolic contents.
그람음성세균 6종과 그람양성세균 10종이 도말된 배지 에 추출물을 일정농도(1-10 mg/mL)로 분주하고 성장억제 능을 측정하여 미세조류 에탄올 추출물의 항균활성을 확인 하였다. Disc 주변으로 clear zone의 생성농도를 기록해 최 소저해농도(MIC)로 하였고, 10 mg/mL의 농도로 희석된 추출물의 항균활성 결과는 Table 2와 같다. M. luteous, S. aureus, K. pnumoniae는 항생제에 대한 내성을 가지는 균, E. coli는 오염지표균, L. monocytogenes와B. cereus는 식중 독 유발세균으로, 그리고 기타Bacillus sp.은 내열성 및 내생 포자를 생성하는 균으로 분류된다. 본 연구에 사용된 16종 의 세균류는 면역이 저하된 환자나 균이 오염된 식품의 섭취 시 인체에 유해하며, 식품에 오염되면 품질저하를 일 으킬 수 있어 제어가 필요한 균주이다. 따라서, 이들 세균에 대한 CE의 항균활성은 E. coli 3종과 S. aureus, B. subtilis, B. licheniformis에 대해 확인되었으나, AE의 항균활성은 B. licheniformis를 제외한 모든 실험균에서 CE의 활성보다 높게 나타났다.
A. carterae의 항진균 물질은 amphidinol류와 carteraol E 로 알려졌는데, amphidinol은 메탄올 추출물의 부탄올분획 에서 분리되어 현재까지 18개의 구조가 확인되었다(9). carteraol E는 메탄올 추출물의 에틸아세테이트분획에서 분 리된 지용성 물질이라고 보고되었다(11). A. carterae 에탄 올 추출물에서 항균활성에 대한 연구는 미비한 상태이므로 항균물질에 대한 지속적인 연구가 필요하다. Pagliara와 Caroppo(22)는 A. carterae의 어류의 유전독성연구에서 A. carterae 세포파쇄물의 농도 3.75 mg/mL에서 50%의 저해활 성을 보였고 용혈활성은 미약했다고 보고하여 A. carterae 의 안전성을 제시하였다. 따라서, 천연 항균물질을 탐색하 는 연구에서 해양미세조류인 A. carterae 에탄올 추출물의 항균활성은 높은 기대가치가 있다고 판단된다.
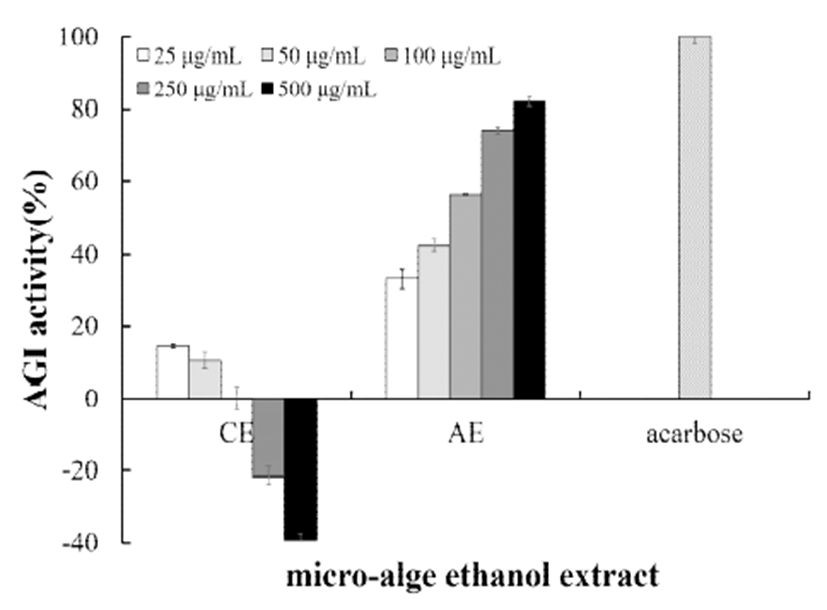
미세조류 에탄올 추출물의 항당뇨 효과(in vitro)를 분석 하기 위해 AGI 활성을 측정하였고, 그 결과를 Fig. 1에 나타 내었다. α-glucosidase의 활성은 CE의 경우 검출 한계치가 100 μg/mL이었으며, 농도증가에 따라 효소의 활성이 촉진 되는 것으로 분석되었다. 반면에 AE는 25-500 μg/mL에서 농도 의존적으로 효소억제활성이 증가하였으며, 500 μ g/mL 농도에서 AGI 활성은 82.07%으로 확인되었다. Lee와 Jeon(23)의 연구에 따르면 감태와 패 같은 갈조류의 phlorotannins이라는 성분이 α-glucosidase를 억제한다고 하 였으며, 조류가 생산하는 fucoxanthin 등의 allenic catotenoid 류에 의한 항당뇨 효과가 보고(24)되었기 때문에, 미세조류 인 A. carterae의 α-glucosidase 억제활성 원인물질에 대한 연구가 필요하다고 생각된다.
간암세포주인 HepG2와 대장암세포주인 HT-29에 대해 미세조류 추출물의 암세포에 대한 생장억제효과로서 세포 에 대한 생존율을 확인한 결과를 Fig. 2에 나타내었다. HepG2의 세포생존율 결과(Fig. 2A)에 의하면 추출물을 녹 이는데 사용된 DMSO는 생장에 억제작용을 하지 않았으며, CE의 경우 추출물 첨가농도의 범위 31.25에서 125 μg/mL까 지 첨가량이 증가함에 따라 세포생장이 촉진되는 것으로 확인되었다. 반면, AE의 경우 첨가농도 62.5 μg/mL에서 생존율이 58%로 감소하였고, 125 μg/mL에서 38%로 유의 적으로 감소하여 간암세포(HepG2)의 생장이 억제됨을 보 였다.
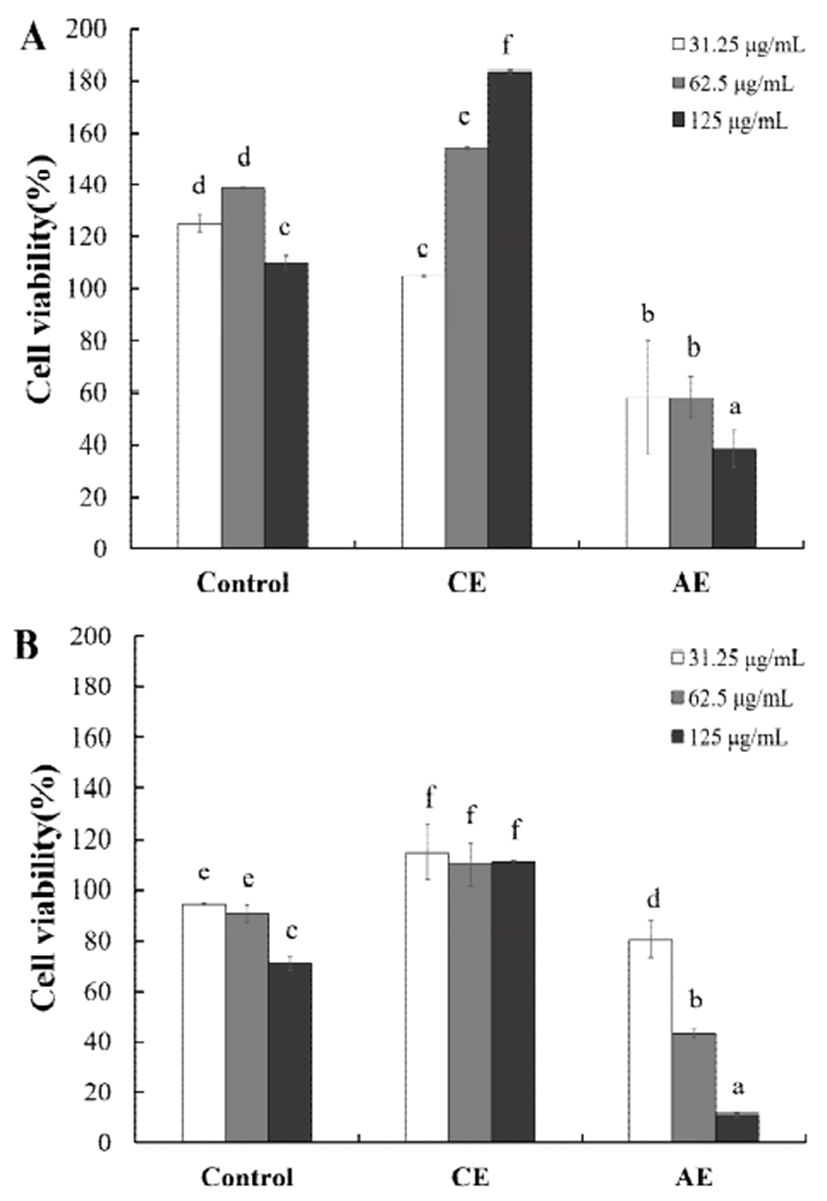
HT-29의 세포 생존율 결과(Fig. 2B)에 의하면 추출물 125 μg/mL을 용해하는데 사용된 DMSO(0.625%)의 농도에서 20%이내의 저해활성이 있었다. DMSO의 HT-29 세포에 대한 저해활성에도 불구하고 CE의 경우 100%이상의 생존 률이 확인됨에 따라 HepG2의 결과와 유사하게 세포성장이 촉진되는 것으로 판단되었다. 한편 AE의 경우 추출물 첨가 량이 증가함에 따라 125 μg/mL농도에서 생존률이 11.27% 로 확인됨에 따라 75.41%의 억제됨이 확인되었다.
다른 연구에 따르면 동물실험에서 클로렐라에 함유된 당단백질이 helper-T 세포를 강하게 활성화하여 암세포를 억제한다고 알려졌으나(25), 암세포에 직접 작용하는 클로 렐라 추출물의 억제효과는 나타나지 않았다. Samarakoon 등(5)에 의해 보고된, A. carterae 메탄올 추출물 용매분획에 서 HL-60(혈액암세포), B16F10(피부암세포), A549(폐암세 포)의 증식억제능 효과와 유사하게 본 연구에서도 A. carterae 에탄올 추출물의 항암세포활성이 클로렐라 에탄 올 추출물보다 우수하였다.
이와 같은 결과를 종합해보면, A. carterae 에탄올 추출물 의 기능성 평가(in vitro)결과 항산화활성, 항당뇨효과와 암 세포 증식저해 활성이 농도의존성으로 증가하였다. 그리고 본 연구에 사용된 모든 세균류에 대한 항균활성이 확인되었 다. 따라서, A. carterae의 기능성 물질이 에탄올에 용출됨을 확인하였고, 페놀성 화합물 이외의 지용성 물질의 성분이 기능성을 보이는 것으로 추정된다. A. carterae 에탄올 추출 물의 기능성 물질 분리조건을 확립하는 지속적인 연구가 필요하다고 판단된다.
요 약
본 연구에서는 해양미세조류A. carterae의 기능성 평가 를 위해 에탄올 추출을 하였고, 기존의 건강기능성식품인 클로렐라를 에탄올 추출하여 기능성을 비교하였다. 클로렐 라 에탄올 추출물(CE)과A. carterae 에탄올 추출물(AE)의 총페놀성 화합물은 각각 47.39 mg/g과 8.88 mg/g 으로 CE가 5.33배 높았으나, DPPH 라디컬소거능은 22.42%와 20.16% 로 비슷한 수준이었다. 반면에 CE와 AE의 ABTS 라디컬 소거능은 각각 28.58%와 17.69%로 CE가 높아 CE의 항산화 능은 페놀성 화합물의 효과로 판단된다. AE(10 mg/mL)의 항균활성은 그람음성균 6종과 그람양성균 10종에서 확인 하였다. 그리고 CE(10 mg/mL)의 항균활성은 그람음성균 3종과 그람양성균 3종에서 확인되었다. α-glucosidase의 억 제활성은 AE(500 μg/mL)에서 82.07%이었고, CE는 효소활 성을 촉진하는 것으로 나타났다. 암세포 생장억제활성은 125 μg/mL 농도의 AE를 첨가했을 때, HepG2와 HT-29의 생존율이 각각 38%와 11.27%이었다. 31.25-125 μg/mL의 농도범위에서 CE 첨가가 HepG2와 HT-29의 생장을 촉진하 는 것으로 확인되었다. 이와 같은 결과를 종합하면, A. carterae 에탄올 추출물은 페놀성 화합물 이외의 항산화 물질을 보유하고, 항균활성, 항당뇨효과와 암세포 억제활 성이 우수한 기능성 물질을 함유하고 있는 것으로 판단되어 기능성 소재로써의 활용가치가 높을 것으로 판단된다.










