서 론
천연물질 중에는 여러 가지 항산화 물질이 다량 존재하 며, 특히 해양생물은 육상생물에 비하여 특유의 대사과정 과 독특한 환경으로 인하여 다양한 신규 생리활성물질을 가지고 있다(1). 따라서 최근엔 해양 동물, 해조류, 해양 미생물 등 해양생물을 통한 기능성 및 생리활성 물질에 대한 연구가 활발히 진행되어 왔으며 (2), 항균, 항암, 항산 화 물질에 관한 연구결과를 토대로 기능성 식품 및 신약개 발 소재로 주목받고 있다(3). 실제로 해양생물은 수십만이 넘는 생물종들이 있으며, 해조류의 경우 우리나라 연안에 서는 750 여종이 서식하고 있고 종류에 따라 특이적 생리활 성을 나타내는 식이섬유와 다양한 유효성분도 함유하고 있으며(4), 이러한 해조류로부터 생산되는 2,400종 이상의 천연물질이 식·의약품 산업에 중요하게 사용되고 있다(5).
미역, 다시마 등이 포함되는 갈조류 중 톳(Hizikia fusiforme)은 우리나라에서는 주로 남해안, 서해안 및 제주 도에 서식하는 해양식물이다. 독특한 맛을 가지며 주로 일 본과 우리나라에서 식용으로 많이 사용하고 칼슘, 비타민 및 섬유소와 각종 미네랄이 풍부하다(2). 톳을 구성하고 있는 다당류 성분은 갈조류의 세포벽을 주로 이루는 alginate로 1→4 linked α-L-guluronic acid와 β-D-mannuronic acid 사슬로 구성되어 있고 체내에서 쉽게 분해되지 않으며 (6) 독특한 구조적 특징으로 생리활성이 높은 물질로 알려 져 있어 건강식품 분야의 기능성 소재로써 이용되고 있다.
생리활성이 우수한 소재를 산업적 소재로 활용하기 위해 서는 생리활성에 대한 탐색과 별도로 소재의 특징을 고려한 최적의 제조공정에 관한 연구 및 검토가 요구되고 있다(7). 생물소재는 생산과정 중 한계를 가지고 있어 적은 공간과 낮은 비용으로 다량의 기능성 물질을 생산할 수 있어야 하며, 저렴한 비용으로 동일한 양의 생물소재로부터 가급 적 다량의 유용물질을 생산할 수 있는 추출공정개발이 필요 하다. 일반적으로 사용되는 열수 추출법은 가용성분 추출 을 위주로 낮은 추출효율을 가지며, 높은 에너지 및 열에 의한 유용성분의 파괴 등과 같은 단점을 지녀 천연물의 추출효율을 증가시키기 위하여 마이크로웨이브 추출, 초음 파 추출, 초임계 및 아임계 추출 등 여러 가지 물리․화학적 추출방법이 시도되고 있으나 초기 설치비용이 높고 추출할 수 있는 양이 제한적이므로 산업적 실용화에 어려운 단점을 가지고 있다(8). 최근에 많이 활용되고 있는 고압추출 공정 기술은 시료가 받는 압력이 증가함에 따라 시료의 유용성분 추출이 단시간에 가능하며, 불순물이 없으며, 세포벽 또는 단백질의 변성 및 파괴에 영향을 주어 세포 내의 용매의 출입이 용이해지므로 유용성분의 추출효율을 증진시킨다 (9,10).
따라서 본 연구에서는 다양한 추출기술을 이용하여 해조 류인 톳에 적용하여 유용성분의 증진 및 생리활성 분석을 통해 추출방법의 효과를 구명하고자 하였다.
재료 및 방법
톳은 2015년 4월에 전남 완도군 (주)금일수산에서 구입 하였다. 톳은 물로 3-4회 수세하여 염분과 이물을 제거한 뒤 천일 건조를 3-4일간 실시하여 수분함량을 5% 이하로 조절한 후 40 mesh로 분쇄하여 사용하였다.
톳의 추출방법은 톳과 증류수는 1:15의 비율로 설정하여 열수추출(water extraction, WE), 고온가압추출(autoclave extraction, AE), 초고압 추출(high-pressure extraction, HPE) 을 실시 후 추출물을 제조하였다. WE는 톳과 증류수를 1:15의 비율로 가한 후 80℃에서 3시간씩 3회 반복추출 하였 다. 고온가압추출은 autoclave(DF-100A, DURI Scientific Inc., Bucheon, Korea)를 이용하여 121℃에서 15분간 추출하 였으며, HPE는 톳 건조분말 100 g에 증류수 1,500 mL를 비닐 팩에 함께 넣어 공기가 들어가지 않도록 밀봉을 실시 한 후 이를 초고압 장치(TFS-SL, TOYO KOTASU Co., Ltd.) 에 넣어 100 MPa, 50℃의 조건으로 5시간 동안 추출하였다. 추출물의 여과를 위하여 여과지(Whatman No. 1)를 이용하 여 여과 후 감압농축기(rotary vacuum evaporator N-N series, Eyela, Tokyo, Japan)로 농축하여 수분을 증발시켰다. 농축 액은 동결건조(FD SFDSM12, Samwon, Busan, Korea)하여 분말을 제조하였으며, 제조한 추출분말은 -50℃에 저장하 면서 실험에 사용하였다.
폴리페놀 함량은 Dewanto 등의 방법(11)을 이용하여 실 험을 진행하였다. 톳 추출 분말을 희석한 시액 100 μL에 2% sodium carbonate 2 mL와 50% Folin-Ciacalteu reagent 100 μL를 가한 후 720 nm에서 흡광도를 측정하였다. 총 폴리페놀 함량은 gallic acid(Sigma-Aldrich Co., St. Louis, MO, USA)의 검량선에 의하여 함량을 산출하였다. 총 플라 보노이드 함량은 Saleh와 Hameed의 방법(12)에 따라 실시 하였다. 톳 추출 분말을 희석한 시액 100 mL에 5% sodium nitrite 0.15 mL를 가하여 충분히 진탕 후 25℃에서 6분간 방치하였다. 그 후 10% aluminium choloride 0.3 mL를 가하 여 충분히 진탕 후 25℃에서 5분간 방치한 다음 1 N NaOH 1 mL를 가하여 510 nm에서 흡광도를 측정하였다. 총 플라 보노이드 함량은 rutin hydrate(Sigma-Aldrich Co.)의 검량선 에 의하여 함량을 산출하였다.
DPPH 라디칼 소거활성은 Blois의 방법(13)에 따라 톳 추출 분말을 희석한 시액 0.2 mL에 0.4 mM 1,1-diphenyl-2- picryl-hydrazyl(DPPH)용액 0.8 mL를 가하여 10분간 방치 한 다음 525 nm에서 흡광도를 측정하였으며 계산식은 DPPH radical scavenging activity(%)=100-[(OD of sample/OD of control)×100]에 의하여 산출하였다. ABTS 라디칼 소거활성(14)은 7.4 mM ABTS 2,2'-azino-bis 3- ethylbenzothiazoline-6-sulfonic acid) diammonium salt]와 2.6 mM potassium persulfate를 혼합하여 실온암소에서 24 시간 동안 방치하여 라디칼을 형성시킨 후 732 nm에서 흡광도가 0.700±0.030이 되도록 phosphate buffer saline (PBS, pH 7.4)로 희석하여 ABTS 용액을 제조하였다. 희석 된 ABTS 용액 950 μL에 톳 추출 분말을 희석한 시액 50 μL를 가하여 암소에서 10분간 반응시킨 후 732 nm에서 흡광도를 측정하였으며, ABTS 계산식은 ABTS radical scavenging activity(%)=100-[(OD of sample/OD of control) ×100]에 의하여 산출하였다.
환원력은 Saeedeh와 Asna의 방법(15)에 따라 톳 추출 분 말을 희석한 시액 1 mL에 % potassium ferricyanide 용액 2.5 mL와 0.2 M phosphate buffer(pH 6.6) 2.5 mL를 혼합한 후 50℃에서 30분간 반응시켰다. 이 후 10% trichloroacetic acid(TCA) 용액 2.5 mL를 가하여 원심분리(1,650 ×g, 10 min)을 실시하였으며, 상등액 2.5 mL에 증류수 2.5 mL와 0.1% FeCl3 용액 0.5 mL를 가한 후 700 nm에서 흡광도를 측정하였다.
Yen 등의 방법(16)에 따라 실험을 진행하였으며 톳 추출 분말을 희석한 시액 1 mL와 80% ethanol 0.8 mL, 2 mM FeCl2․4H2O[iron(II) chloride tetrahydrate]용액 0.1 mL, 5 mM ferrozine [3-(2-pyridyl)-5, 6-diphenyl-1,2,4-triazine -4',4''-disulfonic acid]용액 0.1 mL를 첨가한 다음 혼합하여 실온에서 10분간 반응시킨 후 562 nm에서 흡광도를 측정하 였다. 대조구는 EDTA를 사용하였으며 계산식은 ferrous ion chelating effect(FICA, %)=100-[(OD of sample/OD of control)×100]에 의하여 산출하였다.
1 mM NaNO2 용액 1 mL에 톳 추출 분말을 희석한 시액 1 mL를 가하고 0.2 M citrate buffer(pH 2.5)과 0.1 N HCl를 가하여 총 10 mL로 조정하였다. 그 후 37℃에서 1시간 반응 시킨 후 1 mL를 취하여 2% 초산용액 3 mL와 30% 초산용액 으로 용해한 Griess reagent(1% sulfanilic acid:1% naphthylamine=1:1) 0.4 mL을 가하였다. 이 후 실온에서 15 분간 방치하여 520 nm에서 흡광도를 측정하였다.
Thiobarbituric acid reactive substances(TBARS)는 Buege 와 Aust의 방법(17)에 따라 측정하였다. Fish oil 0.5 mL를 함유하는 0.1 M maleic acid buffer(pH 6.5) 8 mL와 tween-20 50 μL를 혼합하여 제조한 fish oil emulsion 0.5 mL에 FeCl2 및 CuSO4․5H2O를 Fe2+ 및 Cu2+양으로 50 ppm이 되게 한 용액 0.1 mL 및 증류수 1 mL를 가하여 37℃에서 1시간 동안 반응시킨 후 7.2% dibutylhydroxytoluene(BHT) 50 μL 를 가하여 반응을 정지시켰다. 다음에 35% TCA와 0.75% TBA 1 mL씩 가하여 100℃ 수욕상에서 15분간 가열한 다음 원심분리(2,000 ×g, 15 min)를 실시하였으며 상등액만 분리 하여 531 nm에서 흡광도를 측정하였다. TBARS활성은 계산식, TBARS(%)=100-[(OD of sample/OD of control)×100] 에 의하여 산출하였다.
Stirpe와 Corte의 방법(18)에 따라 톳 추출 분말을 희석한 시액 0.1 mL와 0.1 M potassium phosphate buffer(pH 7.5) 0.6 mL에 2 mM xanthine 기질액 0.2 mL를 첨가하고 xanthine oxidase(0.2 U/mL) 0.1 mL를 가하였다. 다음에 3 7℃에서 15분간 반응시킨 후 1 N HCl 1 mL를 가하여 반응을 종결시킨 다음, 반응액 중에 생성된 uric acid의 양을 292 nm에서 흡광도를 측정하였으며 계산식, xanthine oxidase inhibition activity(%)=100-[(OD of sample/OD of control)×100] 에 의하여 산출하였다.
Jung 등의 방법(19)에 따라 톳 추출 분말을 희석한 시액 0.5 mL에 0.175 M phosphate buffer 용액(pH 6.8) 0.2 mL과 5 mM L-DOPA용액 0.2 mL를 혼합하였다. 혼합액에 mushroom tyrosinase(Tyrosinase from mushroom, Sigma, USA, 110 units/mL) 0.1 mL를 첨가하여 37℃에서 3분간 반응시킨 후 475 nm에서 흡광도를 측정하였다. 저해활성은 inhibitory activity(%)=[1-(SAbs-BAbs/CAbs)]×100(SAbs; 시료의 흡광도, BAbs; 효소대신에 증류수를 넣었을 때의 흡광도, CAbs; 시료 추출액 대신에 증류수를 넣었을 때의 흡광도)에 의하여 산출하였다.
Kraunsoe의 방법(20)에 따라 톳 추출 분말을 희석한 시액 (T) 0.1 mL에 0.2 M Tris/HCl buffer용액(pH 8.0) 1.0 mL과 N-succinyl-(Ala)3-p-nitroaniline(10.4 mM) 0.1 mL를 가한 후 25℃에서 5분간 반응시켰다. 다음 elastase(Pancreatic from porcine pancreas, Sigma, USA, 1 μg/mL) 0.1 mL를 가하여 405 nm에서 0 min에서의 흡광도를 측정한 후 다시 25℃에서 20분간 반응한 후의 흡광도를 측정하였다. 대조 군(C)은 시료 대신 buffer 용액을 사용하였다. Elastase 저해 활성도는 계산식은 inhibitory activity(%)=[1-{T(OD 20 min-OD 0 min)/C(OD 20 min-OD 0 min)}]×100에 의하여 산출하였다.
결과 및 고찰
초고압, 열수 및 고온가압 추출방법을 이용하여 톳 추출 물의 총 폴리페놀 및 플라보노이드 함량을 측정한 결과는 Table 1과 같다. 각 추출방법에 따른 톳 추출물의 수율은 열수 추출물이 23.64%, 고온가압 추출물이 27.84%, 초고압 추출물이 29.33%로 초고압 추출 시 가장 높은 수율을 보였 다. 추출방법에 따른 톳 추출물의 총 폴리페놀의 경우 고온 가압 추출이 30.51 mg/g으로 가장 높은 함량을 나타내었으 며 열수 추출(24.44 mg/g), 초고압 추출(19.22 mg/g)의 순으 로 나타났다. 플라보노이드 함량은 전체적으로 4.27-4.78 mg/g의 범위를 나타내어 시료간의 유의적인 차이가 나타나 지 않았다. 본 연구결과에서는 고온가압 및 열수 추출물에 서 폴리페놀 함량이 높게 나타났다. 이는 열처리 및 가공공 정 중 식물체의 세포벽이 파괴되면서 용출되는 불용성 성분 으로부터 폴리페놀 성분이 유리되어 항산화 활성을 가지는 maillard 반응 생성이나 단백질 가수분해 등에 의해 새로운 항산화 물질이 생성된 것으로 판단된다(21).
| Extraction method | Polyphenols (mg GAE1))/g | Flavonoids (mg RHE2))/g |
|---|---|---|
| Water | 24.44±1.993)b4) | 4.36±0.70 |
| Autoclave | 30.51±1.85a | 4.78±0.21 |
| High-pressure | 19.22±0.07c | 4.27±0.06 |
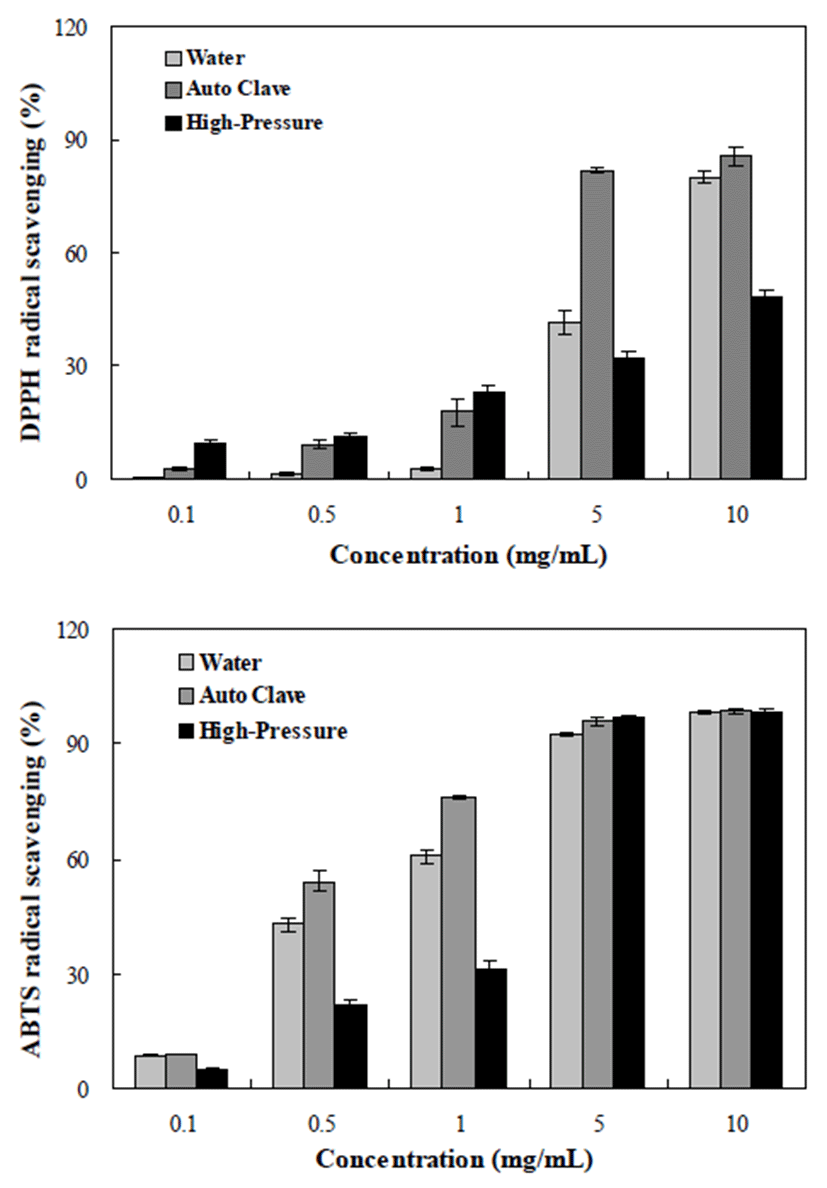
추출방법을 달리한 톳의 DPPH 및 ABTS 라디칼 소거활 성을 측정한 결과는 Fig. 1과 같다. DPPH 라디칼 소거활성 의 경우 전체적으로 농도 의존적으로 증가하는 경향을 나타 내었으며, 0.1-1 mg/mL의 농도의 경우, 초고압 추출물이 높은 소거활성을 나타내었으나 농도가 높아질수록(1-10 mg/mL) 고온가압 추출물에서 높은 소거활성을 보였다. ABTS 라디칼 소거활성의 경우 모든 추출물은 농도가 높아 질수록 소거활성이 증가하였으며 5 mg/mL의 농도의 경우 90% 이상의 높은 소거활성을 나타내었다. 고온가압 추출물 이 모든 농도에서 가장 높은 라디칼 소거활성을 나타내었으 며 이는 Kwon과 Youn(22)의 연구와 일치하였다. 해조류의 경우 압력 뿐만 아니라 온도에 따라 용출되는 성분의 함량 이 차이가 나며 높은 온도와 압력을 가할 경우 항산화 활성 물질 증가와 결합형 폴리페놀이 유리형으로 전환되어 항산 화 활성이 증가하는 것으로 판단된다(23).
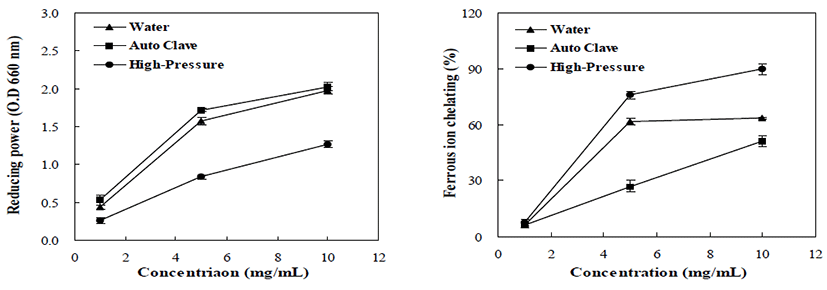
열수, 고온가압, 초고압 추출방법을 이용하여 톳의 환원 력 및 철 이온 소거활성을 측정한 결과는 Fig. 2와 같다. 환원력의 경우 전체적으로 농도 의존적으로 증가하는 경향 을 나타내었으며, 특히 모든 농도에서 고온가압 추출물이 가장 높은 값을 나타내었으며 열수, 초고압 추출물의 순으 로 나타났다. 환원력은 항산화력과 관계가 있으며 일반적 으로 환원제의 존재와 연관되어 있는 것으로 알려져 있어 (24), 가열처리에 의한 항산화 활성 물질의 증가로 인하여 환원력 또한 증가된 것으로 사료된다. 철 이온 소거활성의 경우 전체적으로 초고압 추출물에서 높은 소거활성을 나타 내었으며 열수, 고온가압 추출물의 순으로 나타나 항산화 활성의 경향과는 상반되는 결과를 보였다. 이는 금속이온 을 제거할 수 있는 물질과 radical을 제거할 수 있는 물질 차이에 따른 결과로 판단되며 Kwon 등(25)의 연구결과와 일치하는 경향을 나타내었다.
열수, 고온가압, 초고압을 이용하여 추출한 톳 추출물의 지방산패 억제활성, 아질산염 소거활성 및 잔틴산화 저해 활성을 나타낸 결과는 Table 2와 같다. 1 mg/mL에서 지방산 패 억제활성은 초고압 추출물이 61.93%, 열수 추출물이 19.35%, 고온가압 추출물이 6.25%로 나타나 초고압 추출물 이 다른 추출물에 비하여 높은 억제활성을 나타내는 것을 알 수 있었다. 본 연구에서는 톳 추출물의 지방산패 억제활 성이 라디칼 소거활성에 비하여 높은 활성도를 나타내었는 데 이러한 결과는 해조류에 함유되어 있는 유효성분이 지질 과산화 억제에 많은 영향을 주는 것임을 시사하고 있으며 (26) 특히, 해조류에 다량으로 함유되어 있는 alginates나 fucoidan과 같은 다당체의 역할에 따른 결과로 판단된다. 아질산염 소거활성에서는 고온가압 추출물에서 가장 높은 소거활성(11.15%)을 나타내었으며 열수(8.36%), 초고압 추 출물(4.54%)의 순으로 나타나 지방산패 억제활성과는 반대 의 경향을 나타내었다. 이는 polyphenol과 flavonoid 화합물 의 종류에 따라 차이는 있으나 아질산염을 효과적으로 분해 하여 nitrosamine의 생성을 억제한다는 Yamada 등(27)의 보고와 유사한 경향을 나타내었으며, 또한 Park 등(28)은 해조류 중 갈조류는 홍조류와 녹조류에 비하여 아질산염 소거활성이 뛰어난 것으로 보고하였다. 추출방법에 따른 톳 추출물(1 mg/mL)의 XO 저해활성은 전체적으로 약 25-34% 정도의 값을 나타내었으며 초고압 추출물이 33.68%로 다른 추출물에 비하여 높은 저해활성을 나타내어 가압처리 시 XO 저해활성이 증진됨을 알 수 있었다. 이러한 결과는 돼지감자 잎의 XO 저해활성은 고압추출 시 높게 나타난다는 연구결과(29)와 발아과정 중 가압처리 시 전반 적으로 높은 저해활성을 가지는 연구(30)와 동일한 결과를 나타내었으며 높은 압력으로 처리 시 세포벽의 구조적 변화 로 인해 gallolyl기를 함유한 xanthine oxidase 저해물질이 쉽게 용출되는 것으로 판단된다(31).
추출방법을 달리한 톳의 tyrosinase 및 elastase 저해 효과 를 살펴본 결과는 Table 3과 같다. 멜라닌 생성은 tyrosinase, tyrosinase related protein-1(TRP-1), TRP-2 효소들에 의해 조절되며 tyrosinase는 구리를 포함한 효소로 멜라닌 형성에 중요한 역할을 한다(32). Tyrosinase 저해 활성을 측정한 결과, 1 mg/mL의 농도에서 초고압 추출에서 40.51%, 고온 가압추출이 32.51%, 열수 추출이 16.06%의 순으로 나타나 초고압 추출에서 높은 활성을 나타내는 것을 알 수 있었다. Na 등(33)은 아임계 추출법을 이용하여 추출한 해조류의 tysorinase 저해활성을 측정한 결과 톳과 김에서 가장 높은 효과를 보였고, 아임계 추출법을 이용하였을 경우 기존의 열수 추출에 비하여 높은 저해 활성을 나타냄을 보고하여 본 연구와 유사한 경향을 나타내었다. Elastase는 진피 내 피부 탄력을 유지하는 기질 단백질인 elastin의 분해에 관여 하며, 또한 체내의 elastin을 분해하는 백혈구 과립 효소 중의 하나로 이상조직에서는 활성이 높아져 조직파괴의 직접적인 원인이 되어 피부의 주름 및 탄력성 소실 등을 유발한다(34). Elastase 저해활성에서는 초고압 추출에서 73.79%, 고온가압 추출에서 72.5%로 나타나 유의적인 차이 를 가지지 않았으나 열수 추출(53.48%)에 비하여 높은 활성 을 나타내는 것을 알 수 있었다.
요 약
톳의 산업적 활용도 증진을 위하여 다양한 추출방법(열 수, 고온가압, 초고압)을 이용하여 항산화 및 생리활성 특성 을 평가하였다. 총 폴리페놀 및 플라보노이드 함량의 경우 전체적으로 가압가열 추출물에서 각각 30.51 mg/g, 4.78 mg/g으로 높은 함량을 나타내었다. 추출방법에 따른 톳 추출물의 항산화 활성을 평가하고자 DPPH와 ABTS 라디 칼 소거활성 및 환원력을 실시하였으며 그 결과, 모든 실험 구에서 농도 의존적으로 증가하는 경향을 보였으며 특히 고온가압 추출물이 전체적으로 높은 활성을 보였다. 그러 나 지방산패 및 XO 억제활성의 경우 초고압 처리한 톳 추출물이 1 mg/mL의 농도에서 각각 61.93%, 33.68%로 가 장 높은 활성을 나타내었다. 또한 tyrosinase 및 elastase 저해 활성은 1 mg/mL의 농도에서 초고압 추출물이 각각 40.51%, 73.79%로 가장 높은 활성을 보였으며 고온가압, 열수의 순으로 나타났다. 톳의 경우 온도와 압력을 가했을 때 유용 물질의 용출이 용이해져 다양한 항산화 및 생리활성을 나타 내는 것을 알 수 있었으며 고온가압 및 초고압 추출물은 소재 활용가치가 높은 것으로 사료되며 기능성 증진을 위한 천연 식품소재로 활용 가능할 것으로 판단된다.










