ARTICLE
플라즈마 처리 phloridzin 반응물의 생리활성 평가
정경한, 김태훈*
Evaluation of biological activities of plasma-treated phloridzin
Han Jeong Gyeong, Tae Hoon Kim*
Author Information & Copyright ▼
Department of Food Science and Biotechnology, Daegu University, Gyeongsan 38453, Korea
© The Korean Society of Food Preservation. This is an Open-Access article distributed under the terms of the Creative Commons Attribution Non-Commercial License (http://creativecommons.org/licenses/by-nc/3.0/) which permits unrestricted non-commercial use, distribution, and reproduction in any medium, provided the original work is properly cited.
Received: Mar 9, 2017; Revised: Jun 1, 2017; Accepted: Jun 7, 2017
Abstract
Phloridzin is a predominant member of the chemical class of dihydrochalcones and mainly found in apple. The biological activity of phloridzin treated with dielectric barrier discharge (DBD) plasma was evaluated to investigate whether exposure to plasma can be used as a tools to enhance the biological activity of natural resources. DBD plasma treatment of phloridzin was carried out for three different exposure times. The antioxidant effects of degraded phloridzin for different reaction time were evaluated via radical scavenging assay using DPPH radical. In addition, the anti-diabetic and anti-obesity properties of the degraded phloridzin were measured based on α-glucosidase and pancreatic lipase inhibitory activities. Phloridzin treated for 60 min showed significantly higher radical scavenging, α-glucosidase and pancreatic lipase inhibitory activities compared to the tested positive controls. Degradation of phloridizin induced by DBD plasma might be responsible for enhancing the biological activity of phloridizin.
Keywords: dielectric barrier discharge (DBD) plamsa; phloridzin; biological acitivity
서 론
최근 생활습관성 및 각종 퇴행성 질환이 현대인들의 건 강을 위협하고 있으며, 이는 과도한 산화적 스트레스에 노 출된 것이 그 원인 중 하나 이다. 인체에서는 산화촉진물질 과 산화억제물질이 균형을 유지하기 위하여 자유라디칼의 생성과 항산화 방어체계가 유지되며, 자외선, 흡연, 매연, 약물, 스트레스 및 방사선 등의 과도한 발생에 의하여 그 균형이 붕괴된다. 과도하게 생성된 superoxide(O2 ), nitric oxide(NO), nitrogen dioxide(NO2), hydroxyl(OH), peroxynitrite (NO3⁻) 등과 같은 활성산소종(reactive oxygen species, ROS) 은 산화적 스트레스를 유발하며 세포의 구성성분인 지질, 단백질, 당, DNA 등에 비선택적이고 비가역적 파괴를 촉진 시킨다(1,2). 그로 인하여 노화 및 암, 뇌질환, 심혈관계질환, 피부질환 등의 각종 질병을 유발하는 원인이 된다(3,4). 항 산화물질은 체내에서 활성산소종이나 자유라디칼을 중화 시켜 노화방지, 성인병 예방 등의 기능을 하는 성분을 말하 며, butylated hydroxy anisol(BHA), butylated hydroxy toluene(BHT) 등의 합성 항산화제가 광범위하게 사용되었 으나(5,6), 암 유발 및 지질대사 불균형 등의 부작용으로 인하여 사용 제한을 권고하고 있다(7).
당뇨병은 현대인들에게 가장 많이 발생되는 만성 대사성 질환으로서, 최근 우리나라에서는 경제성장 및 생활수준의 향상으로 인한 식습관의 변화가 가속화됨으로써 당뇨병 환자가 급격하게 증가되고 있으며, 발병연령도 점차 낮아 져 앞으로 더 많은 인구가 당뇨병으로 인해 고통받을 것으 로 예측된다(8). 당뇨병은 크게 두 가지로 나뉘며 제1형은 췌장 베타세포의 병변에 따른 인슐린 결핍으로 인한 인슐린 의존성, 제2형은 인슐린 저항성으로 인한 인슐린 비의존성 당뇨로 정의된다(9,10). α-Glucosidase는 장의 소장점막에 존재하는 당분해 효소로서 이를 저해하면 탄수화물의 소화 를 방해하여 소장에서의 흡수가 지연되므로 식후 급격한 혈당상승을막아준다(11). 지금까지천연물로부터α-glucosidase 저해제의 분리 및 동정에 관한 다수의 연구가 보고되어져 있으며(12), 최근에는 감초 뿌리에서 분리된 벤조산 유도체 인 amorfrutin류의 화합물이 α-glucosidase의 우수한 저해제 로 알려져 있다(13). 대표적인 α-glucosidase 저해제로는 acarbose 및 voglibose가 있으나, 이들을 장기 복용할 경우 염증성 장질환 등의 각종 부작용을 야기할 수 있어 사용이 제한되어지고 있는 실정이다(14,15). 따라서 보다 안전하며 효능이 우수한 천연 기능성 소재의 탐색이 필요하다.
서구화된 식습관과 잘못된 생활습관에 의해 과체중 및 비만인구가 급격하게 증가하고 있다. 비만은 섭취에너지와 소비에너지의 불균형에 의한 에너지 대사이상으로 지방세 포에 중성지방이 과도하게 축적된 상태이다(16). 비만은 단순한 외형상의 문제 외에도 고혈압 및 고지혈증, 제 2형 당뇨병(17), 고혈압, 실장질환, 뇌졸중, 관절염, 동맥경화와 밀접한 연관이 있다(18). 비만의 치료와 예방에 있어서 식이 요법을 동반한 운동이 가장 적절한 방법이나 최근에는 식욕 억제제, 지방흡수 억제제 등의 개발이 진행되고 있다. 대표 적인 항비만 의약품으로 orlistat가 있으나, 최근 위장장애, 과민증, 담즙분비장애, 지용성 비타민 흡수억제 등의 부작 용이 있는 것이 보고됨에 따라 새로운 항비만 물질의 개발 이 요구되고 있다(19).
전리된 가스 상태인 플라즈마에는 전자, 양이온, 음이온, 자유라디칼 및 광자 등을 포함하는 활성산소종이 존재한 다. 최근에는 기존의 식품 살균 기술이 갖고 있는 문제점들 을 최소화시키기 위하여 다양한 기술들이 개발되어 지고 있으며, 그중에서도 비열 플라즈마 처리기술이 주목을 끌 고 있다(20,21). 비열 플라즈마 기술은 식품의 미생물을 저 해하는 기술 이외에 환경, 의료 분야에서 살균 및 소독기술 로 개발되고 있으나, 식품의 성분에 화학적, 기능적 변화에 대한 연구는 아직 미흡한 상황이다. Phloridzin은 phloretin 에 glucose가 결합한 형태의 chalcone 배당체 화합물로서 사과의 과육보다는 비식용부인 껍질이나 씨에 많이 함유되 어 있어, 사람들의 직접적인 섭취는 적은 편이다(22). 본 연구에서는 이전의 연구에서 보고한 비열 플라즈마 처리에 의해 naringin으로부터 생성된 신규 화합물의 항산화 활성 의 상승을 입증한 실험과 동일한 방법(23)으로 플라즈마 처리한 phloridzin으로부터 생성된 생성물에 대해 DPPH 라디칼 소거능, α-glucosidase 저해활성 및 pancreatic lipase 저해활성에 관한 연구를 수행하였다.
재료 및 방법
시약 및 기기
본 실험에서 사용된 시약으로 phloridzin, 1,1-diphenyl-2- picrylhydrazyl(DPPH), (+)-catechin, acarbose 및Saccharomyces cerevisiae 유래의 α-glucosidase는 Sigma-Aldrich Chemical Co.(St. Louis, MO, USA)에서 구입하여 사용하였고, 그 외 에 사용된 용매 및 시약은 모두 일급 이상의 등급을 사용하 였다. HPLC는 Shimadzu LC-10A(Tokyo, Japan)를 사용하 였으며, 이동상인 MeCN, MeOH는 Sigma-Aldrich Chemical Co.(St. Louis, MO, USA)에서 구입하여 사용하여 생성물을 분석하였다.
플라즈마 처리 phloridzin 반응물 제조 및 분석
플라즈마 처리는 dielectric barrier discharge(DBD)(250 W, 15 kHz, ambient air) 플라즈마 기기(137×104×53 mm)를 사용하였다(20). Phloridzin 100 mg을 MeOH 500 mL에 녹인 후, DBD 플라즈마에서 20, 40, 60분 동안 처리한 후 즉시 농축하였다. 각 시간별로 플라즈마로 처리한 phloridzin에 대해서 10% 메탄올(100 mL)에 현탁시킨 후 EtOAc로 분획 하여, 각 EtOAc 가용분획을 56.0 mg(20분 처리), 48.6 mg(40 분 처리), 52.4 mg(60분 처리)을 얻었다. 얻어진 처리 시간별 분획물을 역상 HPLC로 분석하여 화합물의 생성을 확인하 였다. HPLC 분석의 이동상 용매로는 1% formic acid(solvent A)와 acetonitrile(solvent B)를 사용하여 gradient elution을 다음과 같이 수행하였다. 0-5 min, 95% A; 5% B, 5-10 min, 85% A; 15% B, 10-15 min, 70% A; 30% B, 15-20 min, 50% A; 50% B, 20-30 min, 0% A; 100% B의 용매조성으로 물질 분석을 하였으며, 이동상의 유속은 1.0 mL/min을 유지 하였고 280 nm에서 화합물을 검출하였다. HPLC 분석용 칼럼은 YMC-Pack ODS A-302 column(4.6 mm i.d.×150 mm; YMC Co., Ltd., Tokyo, Japan)을 사용하여 분석하였다.
DPPH 라디칼 소거능 측정
플라즈마에 20, 40, 60분 동안 처리한 phloridzin의 전자공 여능은 Blois 방법(24)에 따라 측정하였다. 각 시료용액 120 μL에 0.45 mM의 희석한 1,1-diphenyl-2-picrylhydrazyl (DPPH) 용액 60 μL을 넣고 교반한 후 15분간 방치한 다음 517 nm에서 흡광도를 측정하였다. 전자공여능은 시료용액 의 첨가군과 무첨가군의 흡광도 차이를 백분율로 나타내 었다.
α-Glucosidase 저해활성 측정
α-Glucosidase 저해활성은 Eom(25) 등이 행한 방법을 변 형하여 효소-기질반응을 이용한 분광학적 방법으로 측정하 였다. 즉, 1 U/mL α-glucosidase 90 μL에 시료 혹은 0.1 M sodium phosphate buffer(pH 6.8) 10 μL를 첨가하여 혼합한 후 37℃에서 15분 동안 incubation 시킨다. 반응 후 기질인 1 mM p-NPG 100 μL를 첨가한 후 5분간 반응시킨다. 반응물 을 405 nm에서 ELISA reader를 이용하여 흡광도를 측정함 으로써 기질로부터 유리되어 나오는 p-nitrophenol을 측정 하였다. 양성대조군으로는 α-glucosidase 저해제로 알려진 acarbose를 사용하였으며 α-glucosidase 저해활성은 시료용 액의 첨가군과 무첨가군의 흡광도 감소율로 나타내었다.
Pancreatic lipase 저해활성 측정
Pancreatic lipase 저해활성 측정은 Kim(26) 등이 행한 방 법을 변형하여 실시하였다. 즉 enzyme buffer(10 mM MOPS, 1 mM EDTA, pH 6.8)에 porcine pancreatic lipase를 0.5 g/200 mL의 농도로 4℃를 유지하면서 용해하고 4,000 rpm으로 원심 분리한 후 상층액을 사용하여 169 μL Tris buffer(100 mM Tris-HCl, 5 mM CaCl2, pH 7.0)와 6 μL enzyme buffer를 혼합한다. 샘플은 DMSO로 용해하여 final 농도가 3%가 되도록 한 후 다양한 농도로 희석하여 사용한 다. 기질용액으로 p-nitrophenyl butyrate(p-NPB)을 10 mM 이 되게 DMF에 용해한 후 37℃에서 15분 동안 미리 교반시 킨 효소와 샘플 혼합액에 첨가하여 다시 37℃에서 35분 동안 반응시킨다. 반응물을 shaking incubation 시킨 후 405 nm에서 ELISA reader를 이용하여 흡광도를 측정하였다. Pancreatic lipase 저해활성은 시료용액의 첨가군과 무첨가 군의 흡광도 감소율로 나타내었다.
통계처리
실험결과는 SPSS package program(version 20.0, SPSS Inc., Chicago, IL, USA)을 이용하여 평균과 표준편차를 구 하였으며 실험군간 차이의 유의성은 one-way ANOVA에 의하여 p<0.05 수준에서 검증하였다.
결과 및 고찰
플라즈마 처리 phloridzin의 변화 및 분석
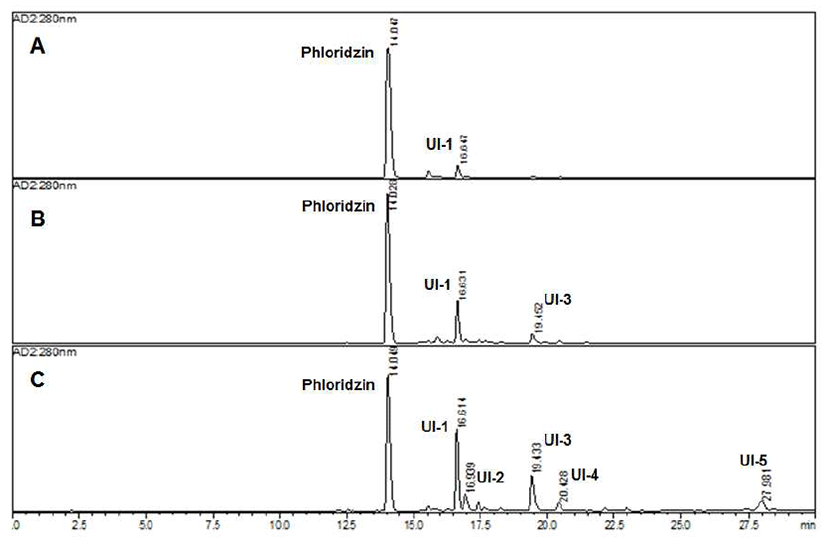
Phloridzin은 phloretin에 glucose가 결합되어 있는 배당체 화합물로서 사과에 많이 함유되어 있는 polyphenol 화합물 이다. 또한 phloridzin은 사과의 과육 보다는 비식용부위인 껍질, 씨, 잎에 가장 많이 함유되어 있어, 버려지는 비식용부 를 원료로 하여 다양한 생물전환 방법을 통한 새로운 천연 생리활성 물질의 개발이 필요한 실정이다(22,27). 본 연구 에서는 사과에 대량으로 존재하는 페놀성의 배당체 화합물 인 phloridzin을 20, 40 및 60분 동안 저온 플라즈마로 처리 후 생성된 미지의 화합물을 1% formic acid 및 MeCN을 이동상으로 하여 280 nm에서 역상 HPLC를 활용하여 분석 하였다. 그 결과, Table 1에서 나타낸 것과 같이 phloridzin의 변화에 의한 생성물이 검출되었으며, 그 중에서도 phloridzin 의 60분 동안 플라즈마 처리한 시료에서 미지의 물질 5종 (UI-1-5)이 생성되는 것을 확인하였으며, UI-1(tR: 16.6 min) 의 경우 20분 동안 처리한 phlorizin의 시료에서 검출이 되었 고, 60분 동안 처리한 phloridizin의 시료에서 UI-1의 상대 함량은 24.2%로 phlorizin 다음으로 가장 높은 상대 함량을 확인하였다. 또한, 20분 처리한 phlorizin의 시료에서 검출 되지 않았던 UI-3(tR: 19.3 min) 경우는 40분 처리한 phlorizin 의 시료에서 검출이 되었고, 60분 처리한 phlorizin의 시료 결과물에서 13.9%의 상대함량으로 UI-1 다음으로 높은 상 대 함량을 확인하였다(Table 1, Fig. 1). UI-2, 4 및 5는 60분 처리한 phlorizin의 시료에서 모두 검출이 되었고, 플라즈마 에 노출되는 시간이 늘어남에 따라 phloridzin으로부터 소 량 생성되는 것을 확인하였다. 플라즈마에 의해 천연물의 구조 변화 및 기능성 증가와 관련된 연구의 일환으로서 진피의 쓴맛 성분인 naringin을 DBD 플라즈마 처리에 의해 당 부분에 methoxymethyl기가 결합된 신규 화합물의 생성 과 이들 화합물의 우수한 DPPH 및 ONOO 소거 활성을 확인하였다(23). 본 연구를 통해 생성된 화합물에 대해 UV lmax값이 288 nm 부근에서 최대 흡수파장을 나타낸 점과 HCl로 산가수분해를 통하여 얻어진 당부분을 TLC로 분석 하여 glucose로 동정한 자료를 바탕으로 향후 화합물의 생 성 기작 및 활성성분의 동정을 위하여 칼럼크로마토그래피 를 활용한 물질의 분리 및 구조결정이 필요하다고 사료된 다.
Table 1.
Relative amounts of individual components in the degraded mixtures
| Compouds |
Retention time (min) |
Content (%) |
| A (20 min) |
B (40 min) |
C (60 min) |
| Phloridzin |
14 |
93.5 |
78.8 |
47.1 |
| UI1)-1 |
16.6 |
6.5 |
16.6 |
24.2 |
| UI-2 |
16.9 |
- |
- |
6.1 |
| UI-3 |
19.4 |
- |
4.6 |
13.9 |
| UI-4 |
20.4 |
- |
- |
3.3 |
| UI-5 |
27.9 |
- |
- |
5.4 |
Download Excel Table
Fig. 1.
HPLC chromatograms of plasma-treated phloridzin for three different times 20 (A), 40 (B), and 60 (C) min.
Experimental condition in the materials and methods section. UI is unidentified compounds.
Download Original Figure
DPPH 라디칼 소거능 측정
보라색의 DPPH 라디칼은 수용성 물질로 520 nm 부근에 서 최대 흡광도를 가지며 항산화 활성이 우수한 물질과 반응하여 보라색이 노란색으로 변색되고 흡광도 값이 감소 하게 된다(28). Phloridzin을 플라즈마로 20, 40 및 60분 처리 하여 얻어진 각 결과물에 대하여 DPPH 라디칼 소거활성을 평가하였다. 그 결과 Table 2에서 phloridzin의 경우 IC50 값이 500 μg/mL 이상으로 라디칼 소거능이 상대적으로 약 한 활성을 확인하였다. 플라즈마에 20 min 처리한 phloridzin 반응물의 경우의 IC50 값이 500 μg/mL 이상, 40 min 플라즈마 처리한 결과물의 경우 IC50 값이 198.3±2.1 μg/mL, 60 min 처리한 결과물의 경우 IC50 값이 100.5±2.9 μg/mL로 플라즈마 처리 시간에 따라 라디칼 소거 활성이 증가하는 것을 확인 하였다. 60분 동안 플라즈마 처리한 phloridzin 변화물의 라디칼 소거활성은 positive control로 사용된 천연 항산화 성분인 (+)-catechin의 IC50 값인 13.0±1.0 μg/mL 보다는 다소 약하지만 플라즈마 처리 전보 다 5배 이상의 우수한 활성을 나타내어 강한 활성을 나타내 는 미지 화합물의 존재가 시사되었다. 최근 DPPH 라디칼 소거능은 페놀성 화합물의 함량과 밀접한 상관관계가 있다 는 보고(29)에 근거하여 phloridzin 플라즈마 처리에 의한 변화 생성물은 Fig. 1 및 Table 1에서 나타낸 바와 같이 phloridzin 이외에 새롭게 생성된 미지의 화합물과 깊은 상 관관계가 있음이 시사되었다. 최근 연구 결과에 따르면 아 조베나무(Lophira alata)의 줄기 껍질에서 분리된 chalcone 화합물인 lophirone B 및 lophirone C가 우수한 라디칼 소거 활성을 나타내었으며(30), 이들 chalcone 유도체의 항산화
Table 2.
DPPH radical scavenging activities of plasma-treated phlor idzin for three different times 20, 40 and 60 min.
| Samples |
Inhibition (%) |
IC50 (μg/mL) |
| 500 |
250 |
125 |
62.5 |
31.3 |
| Phloridzin |
10.4±0.5e1) |
6.5±0.4d |
3.9±0.3d |
2.4±0.3d |
0.5±0.1d |
>500 |
| 20 min treated phloridzin |
23.5±1.1d |
10.8±0.8d |
6.1±0.9d |
4.8±1.2d |
3.6±0.5d |
>500 |
| 40 min treated phloridzin |
78.5±1.5c |
54.5±1.3c |
38.0±1.2c |
20.5±0.9c |
8.7±0.7c |
198.3±2.1 |
| 60 min treated phloridzin |
84.3±1.8b |
73.9±1.7b |
56.0±1.3b |
39.4±0.8b |
21.2±0.9b |
100.5±2.9 |
| (+)-Catechin2) |
99.9±1.1a |
95.7±1.3a |
91.5±1.3a |
88.2±1.0a |
74.0±1.0a |
13.0±1.0 |
Download Excel Table
활성 성분으로서의 가능성을 제시하였다. 또한 naringin 의 플라즈마 처리를 통하여 얻어진 신규 화합물인 narinplasmin A 및 narinplasmin B의 DPPH 라디칼 소거능은 플라즈마 처리를 하지 않은 naringin의 IC50 값(300 μM 이상) 보다 우수한 IC50 값인 57.3±2.3 μM 및 148.2±3.8 μM의 값을 보였다(23). 향후, 플라즈마 처리 후 phloridzin 반응물 의 효능 상승 및 신규 생성 미지 화합물인 UI-1-5의 분리를 통한 DPPH 라디칼소거활성 성분의 구조 동정이 필요하다 고 사료된다.
α-Glucosidase 저해 활성 측정
항당뇨 목적으로 시판되는 대표적인 당뇨 치료제로 acarbose와 voglibose 등이 있으며, 이들 화합물은 섭취한 탄수화물을 단당류로 분해하는데 관여하는 효소인 α -glucosidase를 저해하는 기전으로 활성을 나타낸다(31). 하 지만 이들 당뇨 치료제로 장기간 복용할 경우 구토, 설사를 비롯한 복부팽만감 등의 심각한 부작용이 초래 할 수 있으 므로 보다 안전하면서 식후에 혈당 강하의 효능이 뛰어난 천연소재로의 대체에 관한 연구의 필요성이 대두되고 있다 (32). 사과에 다량 존재하는 천연 배당체인 phloridzin을 플 라즈마로 처리하여 얻어진 결과물에 대하여 항당뇨 선도물 질 개발을 목표로 α-glucosidase 저해활성 평가를 수행하였 다. 그 결과 Table 3에서 나타낸 바와 같이 플라즈마 처리를 하지 않은 phloridzin의 경우 IC50 값이 300 μg/mL 이상으로 비교적 낮은 저해활성을 나타내었고, 20분 처리한 결과물 의 경우도 IC50 값이 300 μg/mL 이상으로 낮은 저해활성이 나타내었다. 플라즈마로 40분 처리한 phloridzin 반응물의 IC50 값은 71.5±2.3 μg/mL, 60분 처리한 결과물의 IC50 값은 43.5±2.2 μg/mL를 나타내어 활성이 증가함을 확인하였으 며, 이들 활성은 positive control인 acarbose의 IC50 값인 541.3±1.9 μg/mL보다 강한 활성을 나타내었다. 이들 플라 즈마 처리 phloridzin의 활성 상승은 Table 1에서 나타낸 바와 같이 phloridzin의 함량감소 및 미지 화합물의 생성증 가와 깊은 연관성을 시사하였다.
Table 3.
α-Glucosidase inhibitory effects of plasma-treated phlor idzin for three different times 20, 40 and 60 min.
| Samples |
Inhibition (%) |
IC50 (μg/mL) |
| 200 |
100 |
50 |
25 |
12.5 |
| Phloridzin |
31.2±1.3c1) |
21.6±1.1c |
6.1±0.5c |
3.2±0.8c |
0.4±0.1b |
>300 |
| 20 min treated phloridzin |
34.2±0.6c |
26.1±0.6c |
8.3±0.3c |
5.3±1.1c |
2.4±0.9b |
>300 |
| 40 min treated phloridzin |
88.8±1.6b |
68.9±0.7b |
29.5±0.5b |
11.2±0.5b |
4.3±0.2b |
71.5±2.3 |
| 60 min treated phloridzin |
98.2±1.1a |
84.7±1.1a |
53.7±1.0a |
27.0±0.9a |
12.9±03a |
43.5±2.2 |
| (+)-Catechin2) |
38.8±2.1c |
29.9±2.1c |
24.1±1.5b |
17.4±2.1b |
14.4±1.1a |
541.3±1.9 |
Download Excel Table
이전의 연구에서 단풍취(Ainsliaea acerifolia) 전초 추출 물의 IC50 값은 482.5 μg/mL(33), 베트남산 도꼬마리 (Xanthium strumarium) 열매 추출물의 IC50 값은 35.0 μg/mL, 차전초(Plantago asiatica) 지상부의 IC50 값은 55.0 μg/mL, 오록실룸 인디쿰(Oroxylum indicum) 심재의 IC50 값은 31.9 μg/mL(34)의 α-glucosidase에 대한 저해활성이 보고되어 있 다. 또한 뽕나무과에 속하는 홉(Humulus lupulus L.)에서 분리된 prenylated chalcone 화합물인 xanthohumol의 IC50 값이 8.8 μM로 강한 α-glucosidase 저해 활성이 보고되어 있다(35). 본 연구에서는 저온 플라즈마로 처리한 phloridzin 의 반응물에 대하여 항당뇨 활성 평가의 1차 스크리닝에 활용되는 α-glucosidase 저해활성을 평가하여 플라즈마 처 리 후 생성되는 변화물의 기능성 소재로서의 가능성을 확인 하였다. 향후 플라즈마 처리 후 phloridzin으로 부터 생성된 미지의 화합물을 칼럼크로마토그래피 및 기기분석을 통하 여 분리 및 구조 결정을 수행하여 이들 물질의 활성 검증 및 수율 개선 연구의 진행이 필요하다고 사료된다.
Pancreatic lipase 저해활성 측정
시판중인 대표적인 비만 치료제로 orlistat가 있으며, 이는 triglyceride를 분해하는 작용을 하는 pancreatic lipase를 불 활성화시킴으로써 triglyceride 및 cholesterol의 흡수를 조절 함과 동시에 배설시키는 기작으로 항비만 효능을 나타내는 것이 알려져 있다. 하지만 이러한 항비만 치료제를 복용하 면 복부고통 및 설사 등의 부작용이 문제점으로 인하여(36), 이들 부작용이 없는 천연 항비만 소재 개발을 위한 연구가 활발하게 이루어 지고 있다. 생물전환을 통한 항비만 선도 물질개발을 목표로 phloridzin을 플라즈마 20, 40 및 60분 처리를 한 결과물에 대하여 pancreatic lipase 저해활성을 평가 하였다. 그 결과 Table 4에서 나타난 바와 같이 플라즈 마를 처리하지 않은 phloridzin의 경우 IC50 값이 300 μg/mL 이상으로 낮은 활성을 나타내었고, phloridzin을 플라즈마 20분 처리한 phlorizin 반응물의 경우 역시 IC50 값이 300 μg/mL의 낮은 활성이 나타났다. Phloridzin을 플라즈마 40 분 처리한 phlorizin 반응물은 IC50 값이 65.5±2.1 μg/mL, 플라즈마를 60분 처리한 phlorizin 반응물의 경우 IC50 값이 29.8±2.0 μg/mL로 활성이 증가한 것을 확인 하였다.
Table 4.
Pancreatic lipase inhibitory effects of plasma-treated phloridzin for three different times 20, 40 and 60 min.
| Samples |
Inhibition (%) |
IC50 (μg/mL) |
| 200 |
100 |
50 |
25 |
12.5 |
| Phloridzin |
27.9±1.0c1) |
20.5±1.2c |
19.3±0.5c |
17.4±0.9c |
12.1±0.1b |
>300 |
| 20 min treated phloridzin |
25.3±1.1c |
18.4±0.8c |
16.2±0.3c |
15.0±1.1c |
14.6±0.6b |
>300 |
| 40 min treated phloridzin |
57.3±1.2b |
54.1±0.5b |
51.0±0.5b |
48.3±0.5b |
29.7±0.1b |
65.5±2.1 |
| 60 min treated phloridzin |
75.8±1.1a |
65.9±1.1a |
64.3±1.0a |
46.4±0.7a |
36.0±0.2a |
29.8±2.0 |
| (+)-Catechin2) |
99.8±1.1c |
94.2±1.2c |
90.3±1.1b |
87.8±1.1b |
81.0±1.1a |
0.2±0.1 |
Download Excel Table
이전의 연구에서 감초(Glycyrrhiza uralensis)에서 분리된 licochalcone A 화합물이 pancreatic lipase 저해활성 실험에 서 IC50 값이 103.4 μM의 우수한 활성을 나타내었으며(37), 뽕나무(Morus alba)의 잎에서 분리된 morachalcone A의 화 합물이 IC50 값이 6.2 μM으로 강한 pancreatic lipase 저해활 성이 보고된바 있다(38). 향후 플라즈마 처리한 phloridzin의 미지의 화합물을 분리하여 pancreatic lipase 저해활성 성분 의 구조 동정이 필요하다고 사료된다.
요 약
본 연구에서는 저온 플라즈마를 활용하여 phloridzin을 20, 40 및 60분 동안 처리하여 얻어진 결과물에 대하여 DPPH 라디칼 소거, α-glucosidase 및 pancreatic lipase 저해 활성을 평가하였다. 그 결과, DPPH 라디칼 소거활성은 플 라즈마로 처리하지 않은 phloridzin의 IC50 값이 500 μg/mL 이상이었으며, 이와 비교하여 플라즈마 60분 처리 반응물 의 경우 IC50 값이 100.5±2.9 μg/mL 나타내어 항산화 활성이 상승한 것을 확인하였다. 또한 α-glucosidase 저해활성은 60 분 동안 플라즈마 처리한 phloridzin의 IC50 값이 43.5±2.2 μg/mL의 가장 우수한 저해활성을 나타내었으며 이 활성은 양성대조군인 acarbose의 IC50 값인 541.3±1.9 μg/mL 보다 10배 이상 강한 활성이었다. Pancreatic lipase 저해활성은 60분 플라즈마를 처리한 phloridzin의 IC50 값이 29.8±2.0 μg/mL로 가장 우수한 활성을 나타내었다. 향후 이들 반응을 통하여 생성된 화합물의 대량생산을 통한 물질 분리 및 구조 동정을 통하여 DPPH 라디칼 소거활성, α-glucosidase 및 pancreatic lipase 저해활성 메커니즘 검증을 수행할 필요 성이 있다고 사료된다.
감사의 글
이 논문은 2017년도 정부(교육부)의 재원으로 한국연구 재단의 지원을 받아 수행된 기초연구사업임(No. 2017R1A2B4003145).
References
Videla LA, Fermandez V. 1988; Biochemical aspects of cellular oxidative stress. Arch Biol Med Exp. 21:85-92.

Halliwell B, Aruoma OI. 1991; DNA damage by oxygen-derived species Its mechanism and measurement in mammalian systems. FEBS Lett. 281:9-19


Jennings PE, Barnett AH. 1988; New approaches to the pathogenesis and treatment of diabetic microangiopathy. Diabetic Med. 5:111-117


Shim JS, Kim SD, Kim TS, Kim KN. 2005; Biological activities of flavonoid glycosides isolated from Angelica keiskei. Korean J Food Sci Technol. 37:78-83.

Farag RS, Badei AZMA, Hewedi FM, GSA EL-Baroty. 1989; Antioxidant activity of some spice essential oils on linoleic acid oxidation in aqueous media. J Am Oil Chem Soc. 66:792-799


Frei B. 1994; National Antioxidants in Human Health and Disease. Academic Press San Diego CA. USA. p:44-55.

Branen AL. 1975; Toxicology and biochemistry of butylated hydroxyanisole and butylated hydroxytoluene. J Am Oil Chem Soc. 52:59-63


Bray GA, Popkin BM. 1998; Dietary fat intake dose affect obesity. Am J Clin Nutr. 68:1157-1173


Rubin RR, Peyrot M. 1999; Quality of life and diabetes. Diabetes Metab Res Rev. 15:205-218.

Lee SH, Lee JK, Kim IH. 2012; Trends and perspective esin the development of antidiabetic drugs for type 2 diabetes mellitus. Korean J Microbiol Biotechnol. 40:80-185.

Asano N, Tomoika E, Kizu H, Matsui K. 1994; Sugars with nitrogen in the ring isolated from the leaves of Morusbombycis. Carbohydr Res. 253:235-245


Robertson RP, Harmon J, Tran PO, Poitout V. 2004; β-Cell glucose toxicity, lipotoxicity, and chronicoxidative stress in type 2 diabetes. Diabetes. 53:S119-S124


Zhang A, Ye F, Lu J, Zhao S. 2013; Screening α -glucosidase inhibitor from natural products by capillary electrophoresis with immobilised enzyme onto polymer monolith modified by gold nanoparticles. Food Chem. 141:1854-1859


Rios JL, Francini F, Schinella GR. 2015; Natural products for the treatment of type 2 diabetes mellitus. Planta Med. 81:975-994.

Tsujimoto T, Shioyama E, Moriya K, Kawaratani H, Shirai Y, Toyohara M, Mitoro A, Yamao J, Fujii H, Fukui H. 2008; Pneumatosis cystoides intestinalis following α -glucosidase inhibitor treatment A case report and review of the literature. World J Gastroenterol. 14:6087-6092.

Kihara Y, Ogami Y, Tabaru A, Unoki H, Otsuki M. 1997; Safe and effective treatment of diabetes mellitus associated with chronic liver diseases with an α -glucosidase inhibitor acarbose. J Gastroenterol. 32:777-782.

Levinson ML. 1977; Obesity and health. Prev Med. 6:172-180.

Rexrode KM, Manson JE, Hennekens CH. 1996; Obesity and cardiovascular disease. Curr Opin Cardiol. 11:490-495.

Sjostrom LV. 1992; Morbidity of severely obese subjects. Am J Clin Nutr. 55:508S-515S.

Jung S, Kim HJ, Park SH, Yong HI, Choe JH, Jeon HJ, Choe WH, Jo C. 2015; Color developing capacity of plasma-treated water as a source of nitrite for meatcuring. Korean J Food Sci Anim Resour. 35:703-706


Lee H, Yong HI, Kim HJ, Choe W, Yoo SJ, Jang EJ, Jo C. 2016; Evaluation of the microbiological safety, quality changes, and genotoxicity of chicken breast treated with flexible thin-layer dielectric barrier discharge plasma. Food Sci Biotechnol. 25:1189-1195


Jones OP. 1976; Effect of phloridzin and phloroglucinol on apple shoots. Nature. 262:392-393


Kim TH, Jang SJ, Chung HW, Kim HJ, Yong HI, Choe W, Jo C. 2015; Enhancement of antioxidant effects of naringin after atmospheric pressure dielectric barrier discharge plasma treatment. Bioorg Med Chem Lett. 25:1236-1239


Blois MS. 1958; Antioxidant activity determination by the use of a stable free radical. Nature. 181:1199-1200.

Eom SH, Lee SH, Yoon NY, Jung WK, Jeon YJ, Kim SK, Lee MS, Kim YM. 2012; α-Glucosidase and α -amylase inhibitory activities of phlorotannins from Eisenia bicyclis. J Sci Food Agric. 92:2084-2090.

Kim JH, Kim HJ, Park HW, Youn SH, Choi DY, Shin CS. 2007; Development of inhibitors against lipase and ?-glucosidase from derivatives of monascus pigment. FEMS Microbiol Lett. 276:93-98


Lu Y, Foo LY. 1997; Identification and quantification of major polyphenols in apple pomace. Food Chem. 59:187-194


Uchida K. 2000; Role of reactive aldehyde in cardiovascular diseases. Free Radical Biol Med. 28:1685-1696


Wang SY, Chang HN, Lin KT, Lo CP, Yang NS, Shyur LF. 2003; Antioxidant properties and phytochemical characteristics of extracts from Lactuca indica. J Agric Food Chem. 51:1506-1512


Ajiboye TO, Yakubu MT, Oladiji AT. 2013; Cytotoxic, antimutagenic, and antioxidant activities of methanolic extract and chalcone dimers (lophirones B and C) derived from Lophira alata (Van Tiegh. Ex Keay) stem bark. J Evidence Based Complementary Altern Med. 19:20-30.

Shin JA, Lee JH, Kim HS, Choi JH, Cho JH, Yoon KH. 2012; Prevention of diabetes A strategic approach for individual patients. Diabets Metab Res Rev. 28:79-84


Bischoff H. 1995; The mechanism of α-glucosidase inhibition in the management of diabetes. Clin Invest Med. 18:303-311.

Lee EW, Kim TW, Kim HS, Park YM, Kim SH, Im MH, Kwak JH, Kim TH. 2015; Antioxidant and α -glucosidase inhibitory effects of ethanolic extract ofAinsliaea acerifolia and organic solvent-soluble fractions. Korean J Food Preserv. 22:275-280.

Nguyen MTT, Nguyen NT, Nguyen HX, Huynh TNN, Min BS. 2012; Screening of α-glucosidase inhibitory activity of Vietnamese medicinal plants Isolation of active principles from Oroxylum indicum. Nat Prod Sci. 18:47-51.

Liu M, Yin H, Liu G, Dong J, Qian Z, Miao J. 2014; Xanthohumol, a prenylated chalcone from beer hops, acts as an α-glucosidase inhibitor in vitro. J Agric Food Chem. 62:5548-5554


Cooke D, Bloom S. 2006; The obesity pipeline Current strategies in the development of anti-obesity drugs. Nat Rev Drug Discovery. 5:919-931


Won SR, Kim SK, Kim YM, Lee PH, Ryu JH, Kim JW, Rhee HI. 2007; Licochalcone A A lipase inhibitor from the roots of Glycyrrhiza uralensis. Food Res Int. 40:1046-1050


Jeong JY, Jo YH, Kim SB, Liu Q, Lee JW, Mo EJ, Lee KY, Hwang BY, Lee MK. 2015; Pancreatic lipase inhibitory constituents from Morus alba leaves and optimization for extraction conditions. Bioorg Med ChemLett. 25:2269-2274