서 론
염증은 외부자극에 대한 생체 조직의 활성화된 면역세포 에 의한 방어반응으로서 면역세포가 세균, 바이러스 및 생 체 이물질 등을 인식하면 활성화되고, 활성화된 면역세포 에서 염증반응의 원인이 되는 많은 인자를 분비하여 유발된 다(1). 염증반응은 병원체의 감염, 화학적 또는 물리적 조직 손상 등으로부터 인체를 보호하기 위해 일어나는 1차적 면역반응이지만, 염증반응이 과도해지면 동맥경화증, 류마 티스 관절염, 천식, 기관지염, 다발성 경화증 등을 유발하는 원인이 됨으로 염증반응을 조절할 수 있는 항염증제의 개발 은 다양한 만성 질환을 예방 및 치료하는데 매우 중시 되고 있으며 일부 합성 염증 억제제는 그 효능과 부작용이 확실 히 검증되지 않아 소재를 식물체로부터 개발하기 위한 노력 들이 많이 시도되고 있다(2,3).
마늘(Allium sativum L.)은 다른 약용 식물들과 비교하여 수분 함량은 낮고 황화합물의 함량이 높은데 이들 황화합물 에 기인하는 다양한 기능성으로는 항균활성, 항암, 항혈전 성, 혈압강화작용, 콜레스테롤 저하, 노화방지작용 및 항산 화 활성 등이 알려져 있고(4), 또한 피토케미칼이 풍부하여 ROS(reactive oxygen species)를 제거하고 지질과산화물과 LDL(low density lipoprotein cholesterol) 형성을 억제하며 항산화 체계를 증대시킨다(5). 마늘의 다양한 생리활성은 염증반응에도 우수한데, 염증반응에서 과발현된 nitric oxide(NO)는 다양한 질환을 유발하여 염증을 심화시고 세 포와 조직손상을 일으켜 만성 염증질환 및 자가 면역질환을 발생시키는데, 여기에 마늘 추출물이 효과가 있다고 알려 져 있으며(6), 마늘의 allicin은 transforming growth factor (TGF)-β1, interleukin(IL)-10, IL-10R의 발현을 증가시키며 (7), 황화합물 성분은 HepG2 세포의 DNA 손상을 보호하고 (8) 전사인자 nuclear factor-erythroid 2-related factor 2(Nrf2) 의 활성을 통하여 산화적 스트레스에 대항하여 세포 내 redox(reduction-oxidation) 균형을 유지하는 산화 인자인 heme oxygenase-1(HO-1) 등의 증가를 유도하는데, 특히 마 늘 추출물 중 diallyl sulfide(DAS)가 Nrf2 및 MAPK의 활성 촉진하여 HO-1의 발현을 유도한다는 연구결과가 있다(9).
최근 들어 마늘의 매운맛과 냄새를 감소시켜 섭취를 용 이하게 함과 동시에 기능성을 증대시킨 마늘 가공품이 다양 하게 출시되고 있는데, 마늘을 열처리하여 제조한 흑마늘 은 가공 공정 중 페놀 화합물 및 갈변물질 등 유효성분이 생마늘보다 증가되며, 이들 유효성분에 의존적으로 항산화 활성, 체내 지질 저하 및 항비만 활성이 높은 것으로 보고된 바 있다(10). 또 다른 숙성마늘 가공품인 홍마늘은 흑마늘 제조에 소요되는 고온 장기간의 숙성과정을 단축함으로써 붉은 색을 띄며 생마늘보다는 항산화 활성, 체지방 축적 억제 및 지질 저하 작용 등의 생리활성이 높고(11) 담배연기 로 유도된 기관지 염증에 효능을 나타내는 것으로 보고되어 (12) 새로운 마늘 가공품으로 관심이 조명되면서 홍마늘의 항염증 및 다양한 효능에 관한 연구가 진행 중에 있다.
본 연구에서는 홍마늘의 기능성에 기반한 제품개발 연구 의 일환으로 항염증 활성 증강 작용이 있는 천연 식물재료 와 홍마늘의 혼합 추출물을 제조함에 있어 추출온도와 용매 를 달리한 후 이에 대한 유효성분 및 항염증 활성을 분석하 여 가공조건 확립을 위한 기초자료를 확보하고자 하였다.
재료 및 방법
본 실험에 사용한 홍마늘은 (재)남해마늘연구소에서 등 록한 특허(10-1178592, 2012.08.24) 방법으로 -80℃에서 24 시간 1차 동결처리 후 상온에서 천천히 해동하여 60-80℃에 서 58-60시간 동안 숙성시켜 제조하였다. 생약재는 문헌조 사를 통해 항염증활성이 있는 소재인 생강(ginger, Zingiber officinale Roscoe), 도라지(doraji, Platycodon grandiflorum), 모과(quince, Chaenomeles sinensis), 진피(Citrus peel, Citri Pericarpium) 및 박하(Mint, Mentha arvensis)를 선발하였으 며 이들은 진주시 소재 한약재 도매상에서 구입하여 사용하 였다.
문헌조사를 통해 선발된 천연식물 소재는 예비실험을 통해 각각을 동량의 무게비로 혼합하여 천연식물 간의 혼합 비를 설정하였으며 이것을 홍마늘과 1:1로 혼합하여 이 시 료 10 g에 물과 에탄올을 각각 90 mL를 첨가하여 각각의 추출물 제조용 시료로 사용하였다. 이때 홍마늘과 천연식 물 재료가 혼합된 시료에 각각의 추출용매(water, ethanol) 을 가하여 70℃와 95℃에서 3시간 동안 추출한 후 여과지 (No. 2, Advantec, Tokyo, Japan)로 여과한 여액을 실험에 사용하였다.
총 페놀 화합물의 함량은 페놀성 물질이 phosphomolybdic acid와 반응하여 청색을 나타내는 원리인 Foiln-Denis 방법 (13)을 이용하여 정량하였다. 시료액 1 mL에 Foline- Ciocalteau 시약(Sigma-Aldrich Co., St. Louis, MO, USA) 및 10% NaCO3 용액(Daejung, Siheung, Gyenggi, Korea)을 각 1 mL씩 차례로 가한 다음 실온에서 1시간 정치한 후 분광광도계(Libra S 35, Biochrom, Cambridge, England)로 760 nm에서 흡광도를 측정하였다. 표준물질로 gallic acid(Sigma-Aldrich Co.)를 사용하여 시료와 동일한 방법으 로 분석하여 얻은 검량선으로부터 총 페놀 화합물의 함량을 계산하였다.
Alliin 함량은 시료를 0.45 μm syringe filter로 여과하여 HPLC-DAD(Agilent 1260 infinity, Agilent, Santa Clara, CA, USA)로 분석하였다. 분석용 칼럼은 syncronis C18(3×150 mm, 5 μm, Thermo scientific, Waltham, MA, USA)를 사용하 였고, 이동상 A용액은 20 mM Na2HPO4와 10 mM sodium 1-heptanesulfonate 용액을 혼합하여 인산으로 pH 2.0으로 조절하였으며, B용액은 methanol:water를 80:20(v/v)의 비 율로 혼합하고 포름산을 이용하여 pH 3.0으로 조절 하였다. 이동상의 속도는 0.4 mL/min으로 하고, A용액과 B용액을 시간에 따라 혼합비율을 달리하면서 분석하였다. 컬럼 온 도는 30℃, 시료 주입량은 10 μL로 하였으며, UV 검출기로 208 nm에서 검출하였다(14).
SAC 함량은 시료를 0.22 μm syringe filter로 여과하여 HPLC-PDA-MS/MS(TSQ Quantum LC-MS/MS, Thermo scientific, Waltham, MA, USA)로 분석하였다. 분석용 칼럼 은 Agilent Zorbax SB-C18(4.6×250 mm, 5 μm)를 사용하였 고, 이동상 용매는 positive mode에서 이동상 A(0.1% formic acid containing water)와 B(0.1% formic acid containing acetonitrile)을 시간에 따라 혼합비율을 달리하면서 분석하 였다. 이동상의 속도는 0.7 mL/min, 시료 주입량은 10 μL, scan type은 SRM mode로 하여 분석을 실시하였다.
DPPH(1,1-Diphenyl-2-picrylhydrazyl) 라디칼 소거활성 은 DPPH에 대한 전자공여 활성으로 나타낸 것으로 시료액 과 DPPH 용액(5 mg/100 mL methanol)을 동량으로 혼합한 다음 실온에서 20분간 반응시킨 후 분광광도계를 이용하여 525 nm에서 흡광도를 측정하였다(15).
ABTS(2,2-azinobis-(3-ethylbenzo-thiazoline-6-sulphonate) 라디칼 소거활성은 7 mM의 ABTS 용액에 potassium persulfate(Sigma-Aldrich Co.)를 2.4 mM이 되도록 용해시킨 다음 암실에서 12-16시간 동안 반응시킨 후 415 nm에서 흡광도가 1.5가 되도록 증류수로 조정한 ABTS 용액을 사용 하였다. ABTS 용액 150 μL에 시료액 50 μL를 혼합하고 실온에서 반응시킨 다음 분광광도계를 이용하여 415 nm에 서 흡광도를 측정하였다(16). DPPH 및 ABTS 라디칼 소거 활성은 시료 무첨가구에 대한 시료첨가구의 흡광도비로 계산하여 %로 나타내었다.
실험에 사용된 마우스의 대식세포주인 RAW264.7 세포 는 한국세포주은행(KCLB, Korea)에서 분양받았으며, 세포 배양을 위해 10% fetal bovine serum(FBS)과 1% penicillinstreptomycin을 포함하는 dulbecco’s modified eagle's medium (DMEM) 배지를 사용하였다. 세포는 CO2 incubator(37℃, 5% CO2)에서 배양하였으며 추출물의 세포에 대한 독성 측정은 3-(4,5-dimethylthiazole-2-yl)-2,5-diphenyltetrazolium bromide(MTT) 환원방법을 이용하여 측정하였다. 세포를 96 well-plate에 well당 5×104개가 되도록 분주하고 24시간 부착시킨 후, 추출물들을 각기 일정한 농도로 희석하여 세 포에 처리한 다음 30분 후 1 μg/mL 농도의 lipopolysaccharide (LPS, Sigma-Aldrich Co.)를 처리하여 24시간 동안 배양하 였다. 이후 시료를 포함하는 배지를 제거한 후 serum-free 배지와 5 mg/mL 농도의 MTT 용액을 첨가하여 37℃에서 2시간 더 배양한 다음 DMSO를 분주하여 sonication하고 10분간 교반한 뒤 570 nm에서 흡광도를 측정해 세포생존율 을 구하였다. 세포생존율은 무처리군에 대한 백분율로 나 타내었다.
마우스 대식세포 RAW264.7을 5×105 cell/well의 농도로 24-well plate에 분주하여 24시간 배양한 후 각각의 추출물 을 농도별로 처리하였다. 이것을 30분 배양한 후에 LPS(1 μg/mL)를 처리하여 20시간 또는 24시간 배양한 후 세포 상등액을 회수하였다. 회수한 세포 배양 상등액을 원심분 리(1,000 rpm, 10 min, 4℃) 한 다음, 50 μL를 취해 sulfanilamide solution 50 μL와 혼합하여 5분간 빛을 차단하 고 반응시킨 후 NED solution 50 μL와 혼합하여 상온에서 10분간 반응시켜, ELISA reader(Epoch, Bioteck, Winooski, VT, USA)를 이용하여 540 nm에서 흡광도를 측정하였고, LPS 처리세포군에 대한 상대적인 생성율로 나타내었다.
추출물의 intracellular ROS 측정은 intracellular ROS assay kit(Cell Biolabs, INC, San Diego, CA, USA)을 이용하 여 측정하였다. 96 well black plate에 5×104 cell/well의 RAW264.7 cell을 분주하여 배양 한 후 serum free DMEM 배지로 교환하였다. 다시 세포를 24시간 배양한 후 시료를 농도별로 처리하여 37℃, 5% CO2 조건에서 24시간 배양하 였다. PBS(pH 7.4)로 3회 세척한 후 dichloro-dihydro-fluorescein diacetate(DCFH-DA)를 배지에 100 μL 첨가하여 37℃, 5% CO2에서 1시간 배양한 후 또 다시 PBS로 3회 씻어냈다. Lysis buffer 100 μL를 첨가하여 혼합한 후 fluorescence microplate reader(Perkin-Elmer Inc., Waltham, MA, USA)를 이용하여 excitation 485 nm, emisssion 535 nm에서 형광을 측정하여 무처리군과 대조군 에 대한 ROS 생성을 비교하여 상대적인 값으로 나타내었 다.
총 RNA는 RAW264.7 세포(1.0×106 cells/mL)를 24시간 배양하고 다양한 농도로 조제된 추출물들과 LPS(1 μg/mL) 를 동시 처리하여 시간별로 배양 한 후 TRI Reagent(MRC Inc., Cincinnati, OH, USA)를 이용하여 분리하였다. 세포에 TRI-reagent를 첨가하여 균질화 한 후, 클로로포름을 첨가 하여 원심분리(10,000 rpm, 10 min) 하였다. 상층액에 동량 의 이소프로판올을 첨가하여 원심분리(10,000 rpm, 8 min) 하여 RNA를 침전시키고 75%의 diethyl pyrocarbonate (DEPC) 처리된 에탄올로 세척한 후, 건조시켜 DEPC 처리 된 증류수에 녹였다. 260 nm의 흡광도를 측정하여 RNA를 정량하였고, A260/A280 nm의 비율이 1.7-1.9 범위 내의 값을 갖는 RNA를 실험에 사용하였다. 모든 실험은 RNase-free한 조건하에서 이루어졌다.
cDNA 합성은 RNA to cDNA EcoDry premix(Clontech, Mountain View, CA, USA)를 이용하였고, 1 μg의 total RNA 를 oligo(dT) 18 primer, deoxy-nucleotide tri-phosphate (dNTP, 0.5 M), 1 unit RNase inhibitor 그리고 reverse transcriptase(2 Unit)가 섞여있는 premix에 넣고 70℃에서 5분, 37℃에서 5분, 37℃에서 60분, 그리고 70℃에서 10분간 가열시킴으로서 반응을 중지시켰다. Polymerase chain reaction(PCR)은 합성된 cDNA로부터 iNOS, COX-2, TNF-, IL-1β 및 β-actin을 증폭시키기 위하여 2 μL cDNA, 4 μM의 5' 과 3' primer, 10×buffer(10 mM Tris-HCl, pH 8.3, 50 mM KCl, 0.1% Triton X-100), 250 μM dNTP, 25 mM MgCl2, 1 unit Taq polymerase(Promega, Madison, WI, USA)를 섞고 증류수로 최종 25 μL로 맞춘 다음 C1000 Thermal Cycler (Bio-Rad, Hercules, CA, USA)를 이용하여 PCR을 실시하였 다. 이때 PCR 조건은 94℃ 30초, 55℃ 30초, 72℃ 40초, 35 cycle이며, PCR에 의하여 생성된 산물은 RedSafe (INtRON Biotech., Sungnam, Korea)를 넣은 1.2% agarose gel에서 전기영동을 실시하여 특정 band를 확인하였다.
결과 및 고찰
홍마늘과 천연식물 5종 혼합물을 추출용매 및 온도를 달리하여 추출하여 총 페놀 화합물 함량을 측정한 결과는 Table 1과 같다. 각 추출물 중의 총 페놀 화합물은 E-70이 608.60 mg/100 g으로 높았고 다음으로 E-95에서 535.40 mg/100 g이었다. 물로 추출한 W-70은 449.15 mg/100 g, W-95는 437.63 mg/100 g으로 두 시료간에는 유의적인 차이 가 없었다. 추출물의 총 페놀 화합물은 물 추출물에 비해 에탄올 추출물에서 더 높게 정량되었고 95℃추출시에 비해 70℃에서 추출할 때 그 함량이 더 높았다.
| Samples1) | Total polyphenol contents (mg/100 g) |
|---|---|
| E-70 | 608.60±7.182)c3) |
| E-95 | 535.40±7.00b |
| W-70 | 449.15±14.92a |
| W-95 | 437.63±5.07a |
Kwon과 Park(17)의 보고에 따르면 오미자 추출시 물 추 출물에 비해 에탄올 추출물에서 총 페놀 화합물의 함량이 더 높았고, 구릿대 잎 추출물도 물보다는 에탄올에서 더 많은 폴리페놀 화합물이 추출되는 것으로 알려져 있는데 (18), 본 실험에서도 물 추출물 보다는 에탄올 추출물에서 총 페놀 화합물 함량이 더 높아 유사한 경향이었다. 또한 추출온도에 따른 실험결과 95℃보다 70℃에서 추출하였을 때 총 페놀 화합물의 함량이 더 높았는데, 이는 인삼을 85℃ 와 95℃로 추출한 시료에서 진세노사이드의 총량을 비교한 결과 85℃에서 추출할 때 23.5 mg/g으로 더 높은 함량이라 고 한 Park 등(19)의 보고와 유사한 경향이었다.
항염증 활성이 있는 홍마늘 복합조성물 중 마늘의 주요 성분인 alliin과 SAC 함량을 측정한 결과(Table 2) alliin 함량 은 추출온도에 따른 통계적인 유의차는 없었으며 추출용매 에 따라 차이가 있었다. 즉 W-70의 alliin 함량은 1.29 mg/g 이었고 W-95에서는 1.18 mg/g으로 두 시료간에는 유의차 가 없었으나 에탄올로 추출한 E-70(0.81 mg/g)에 비해서는 유의적으로 높은 함량이었다. SAC 또한 alliin의 함량과 동일한 경향으로 에탄올 추출물인 E-70과 E-95에서 각각 1.52와 1.98 mg/g이 정량된데 반해 W-70과 W-95에서는 각각 2.60과 2.34 mg/g으로 더 함량이 높았다.
| Samples1) | Alliin | SAC |
|---|---|---|
| E-70 | 0.81±0.132)a3) | 1.52±0.20a |
| E-95 | 0.85±0.11a | 1.98±0.15b |
| W-70 | 1.29±0.09b | 2.60±0.32c |
| W-95 | 1.18±0.03b | 2.34±0.08bc |
Alliin은 생마늘 중에 존재하는 무취인 수용성 황 함유 아미노산으로 생마늘이 파쇄되면 마늘 중에 존재하는 S-allyl-L-cysteine sulfoxide lyase(alliinase)에 의하여 S-Prop- 2-en-1-yl prop-2-ene-1-sulfinothioate(allicin)으로 변하지만 (20) alliinase가 불활성화 되었을때에는 alliin으로써 함량이 유지되며, 열이나 산에 안정하여 증숙마늘, 흑마늘 및 초절 임 마늘에서도 존재하며(21), 항암, 고지혈증 감소, 항당뇨, 항산화 효과를 갖는 것으로 알려져 있다(22).
Lee HS 등(23)은 수용성 유황화합물인 SAC는 생마늘에 서의 그 함량이 30 ppm정도이며 숙성 마늘에서는 숙성 10일 및 15일에 각각 952 ppm, 1,140 ppm으로 증가한다고 보고하였다. 본 연구에서 검출된 SAC도 숙성과정을 거친 홍마늘로부터 유래되어 그 함량이 높으며, 물로 추출할 때 보다 용이하게 추출됨을 알 수 있다.
DPPH 및 ABTS 라디칼 소거활성을 통해 항산화 활성을 평가한 결과는 Table 3과 같다. DPPH 라디칼 소거활성은 E-70이 15.96-73.65%로 활성이 가장 높았고 다음으로 E-95 에서 8.40-62.56%로 활성이 높았다. 물 추출물은 6.22- 47.44%의 범위로 에탄올 추출물 보다 활성이 낮았다. 2,500 μg/mL 농도에서 DPPH 라디칼 소거활성은 70℃에서 추출 한 시료의 경우 물 추출물(26.73%)에 비해 에탄올 추출물 (52.95%)의 활성이 2배 이상 높아 라디칼 소거활성은 추출 온도 보다는 추출용매에 따라 활성에 차이가 있었다.
추출용매에 따른 아로니아 추출물의 생리활성을 비교해 본 결과 열수추출물의 경우 4.99-47.78%로 가장 낮은 활성 을 나타내었으며, 50% 에탄올 및 50% 메탄올 추출물이 각각 7.96-70.01% 및 8.90-69.21%로 유의적으로 높은 활성 을 나타내었다는 Park 등(24)의 보고는 본 연구의 결과와 동일한 경향이었다. 추출용매를 달리한 무순 추출물의 DPPH 라디칼 소거능은 물추출물이 86.67%로 활성이 가장 높았고 다음으로 에탄올 추출물과 메탄올 추출물은 유의차 가 없었으며 아세톤 추출물이 77.23%로 활성이 가장 낮았 다는 보고(25)도 있는데, 이들 결과로부터 라디칼 소거활성 은 추출용매의 영향을 받으며, 이는 추출 원료의 특성에 따라 용출되는 유효성분이 서로 상이하기 때문으로 추정된 다.
ABTS 라디칼 소거활성은 E-70에서 5.71-77.19%로 가장 높았으며 5,000 μg/mL의 농도에서 E-95는 55.33%, W-95 및 W-70은 42.48과 37.10% 였으며 DPPH 라디칼 소거활성 과 동일한 경향이었다. 이처럼 추출용매, 추출온도에 따라 라디칼 소거활성에 차이가 있는 것은 추출조건에 따라 용출 되는 유효성분이 서로 상이하기 때문으로 생각된다.
Kwon 등(26)이 추출용매에 따른 비단풀 추출물의 항산 화 활성비교 연구에 의하면 ABTS 라디칼 소거활성의 경우 0.5 mg/mL의 농도에서 메탄올 추출물이 84.83%, 에탄올 추출물이 75.79%, 물 추출물이 60.01%였는데, 이는 비단풀 추출물의 폴리페놀 함량은 메탄올, 에탄올, 물 추출물에서 각각 293.25 mg/g, 261.27 mg/g 및 197.28 mg/g으로 차이가 있기 때문이라고 보고되어 있다.
DPPH와 ABTS 라디칼 소거활성은 총 폴리페놀 화합물 의 함량과 양의 상관관계를 나타내는데(27), 본 연구에서도 물 추출물보다 에탄올 추출물에서 총 폴리페놀 함량이 18.2-26.2% 더 높았고 라디칼 소거활성 또한 에탄올 추출물 에서 더 높았다.
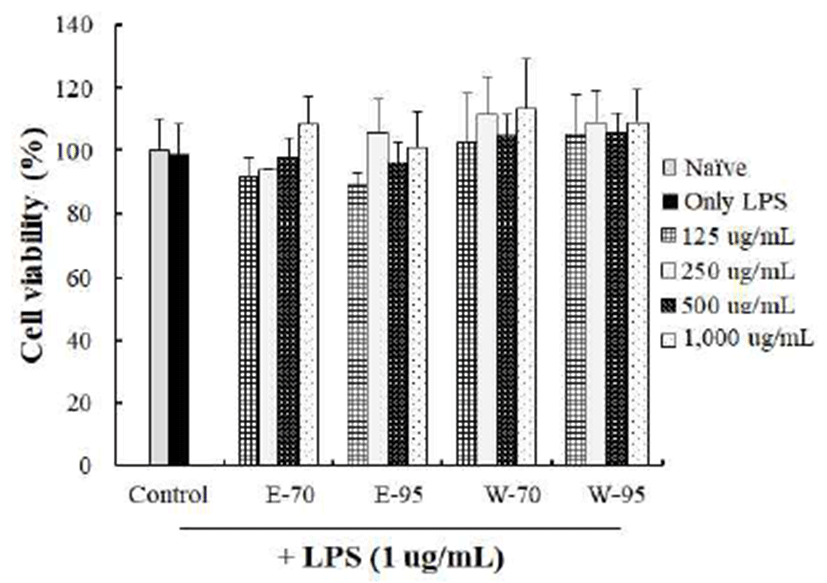
RAW264.7 세포에 홍마늘 복합조성물을 농도별(0, 120, 250, 500 및 1,000 μg/mL)로 24시간 동안 처리한 결과(Fig. 1), 1,000 μg/mL 농도까지의 모든 시료에서 생존율은 대조 군 대비 유의성 있는 변화를 나타내지 않았다.
NO는 생체 내에서 nitric oxide synthase(NOS)에 의하여 L-arginine으로부터 생성되는 반응성이 강한 자유라디칼이 며, 혈압조절과 신경전달 매개체로 작용하며, 혈액응고, 면 역기능 등의 역할을 하는 것으로 알려져 있는데 NO가 필요 이상으로 생성이 되면 염증 반응을 일으키고 조직의 파괴 및 면역 체계의 이상을 나타낸다(28).
LPS를 처리해 염증을 유도한 RAW264.7세포에 홍마늘 복합 추출물을 125, 250, 500 및 1,000 μg/mL 농도로 처리 한 후 NO 생성억제 효과를 확인한 결과는 Fig. 2와 같다. 125 μg/mL 처리시는 LPS 단독 처리구에 비해 유의적인 차이를 나타내지 못했으나 그 이상의 농도에서는 농도 의존 적으로 NO 생성이 감소하였다. 물 추출물 보다는 에탄올 추출물의 NO 생성 억제 활성이 더 높았으며, E-70 보다는 E-95 활성이 더 높았다.
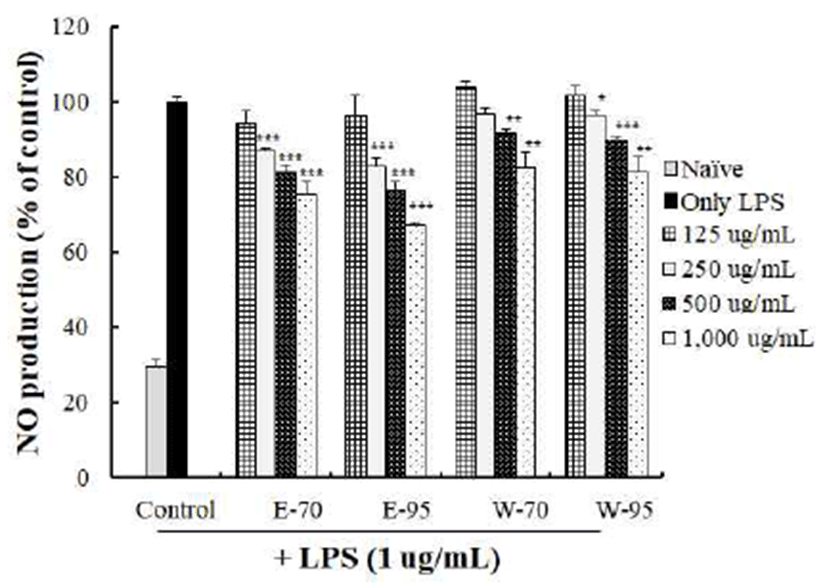
Koh 등(29)은 추출 온도를 달리한 민들레 잎의 열수추출 물의 NO 생성 저해능은 추출 온도가 낮을수록 더 활성이 높아져 민들레 잎에 함유된 항염증 활성물질이 열에 상당히 민감하다고 하였는데, 본 연구의 결과에서는 70℃보다 9 5℃에서 추출하였을 때 NO 생성억제율이 더 높아 상이한 결과였다. 이러한 차이는 길경, 황기 및 오미자 추출물의 NO 생성 억제 활성은 서로 상이하여 황기는 30℃, 오미자는 20-30℃에서 추출하였을 때 가장 효과적이었으나 길경은 추출온도에 영향을 받지 않아 소재에 따라 유효성분이 추출 되는 조건이 서로 상이하다는 Kang 등(30)의 보고로 미루어 볼 때 원료들의 특성에 기인하는 것으로 추정된다. 또한 마늘의 주요 유효성분인 alliin 및 SAC를 포함한 수용성 황화합물들이 비교적 열에 안정하며, 이들이 복합적으로 영향을 미쳤기 때문으로 생각된다.
추출조건을 달리하여 제조한 홍마늘 복합조성물의 ROS 생성억제 효능은 대식세포에 시료를 농도별로 처리하고 LPS로 세포 내 염증반응을 유도하여 확인하였다(Fig. 3). 1,000 μg/mL 농도에서 LPS 단독처리시 ROS 생성율에 비해 E-70 처리시 72.37%의 생성율을 보였고, E-95은 64.92%, 물 추출물은 W-70은 79.46%, W-95는 84.23%를 나타내어 E-95의 ROS 생성 억제 효과가 가장 높았다.
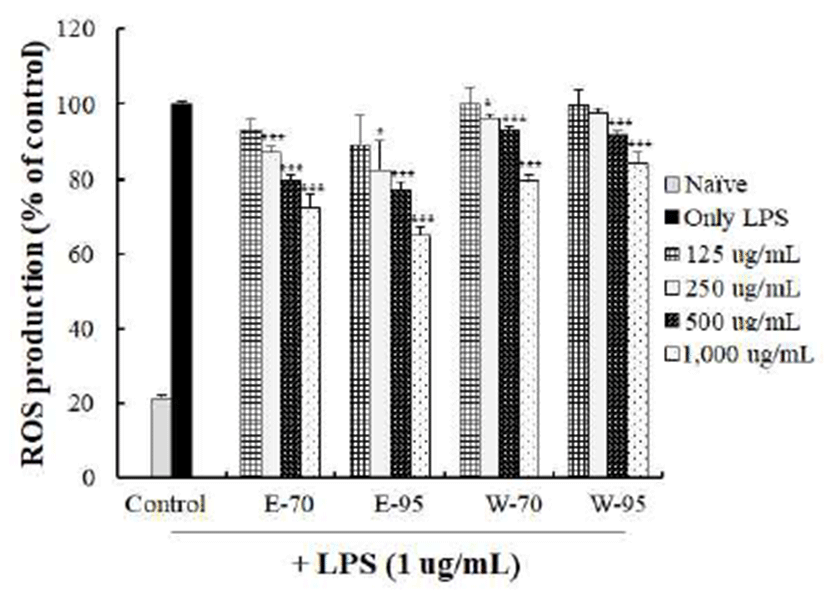
추출방법에 따른 육미지황탕의 ROS 생성율을 측정한 결과 200 μg/mL의 농도에서 대조군에 비해 물추출물은 22.3%, 에탄올 추출물은 53.8% 감소하여 물 추출물 보다는 에탄올 추출물에서 효능이 있었다는 Lee 등(31)의 보고는 본 연구 결과와 일치하는 경향이었다.
염증 반응에 관여하는 주요 세포는 macrophage로 알려져 있으며, 여러 자극이나 면역세포들이 분비하는 사이토카인 등에 의해 활성화 되어, 염증 반응을 유발하고, 염증 부위로 면역 세포의 이동을 촉진시킨다(32). 대식세포는 염증 유발 물질 LPS에 의해 COX-2, prostaglandin E2(PGE2), iNOS 및 NO의 생성이 증가되고 염증성 cytokine인 tumor necrosis factor(TNF)-α, IL-1, IL-6 분비가 증가된다고 알려져 있다 (33).
홍마늘 복합조성물의 물과 에탄올 추출물의 NO 및 ROS 생성 억제효과를 살펴본 결과 물 추출물보다는 에탄올 추출 물에서 활성이 더 높아 염증성 cytokines 측정은 에탄올 추출물을 대상으로 실시하였다. RAW264.7 세포에 LPS를 처리한 후, 홍마늘 조성물을 70℃와 95℃에서 에탄올로 추 출한 추출물을 500과 1,000 μg/mL 농도로 처리하여 RT-PCR 방법으로 유전자 발현량을 측정하였다. 그 결과 Fig. 4에서와 같이 cytokine의 종류에 따라 서로 다른 발현 양상이 확인되었는데 1,000 μg/mL 농도로 처리하였을 때 E-95는 iNOS와 IL-1β의 발현량이 LPS 단독처리 대조군 대비 유의성 있게 감소하였고 반면 E-70은 iNOS를 제외하 고는 발현량에 영향을 미치지 않았다. 이러한 결과로 볼 때 추출시 추출온도에 따라 RAW264.7 세포에서 염증 매개 성cytokine을억제하는활성은서로상이할것으로추측된다.
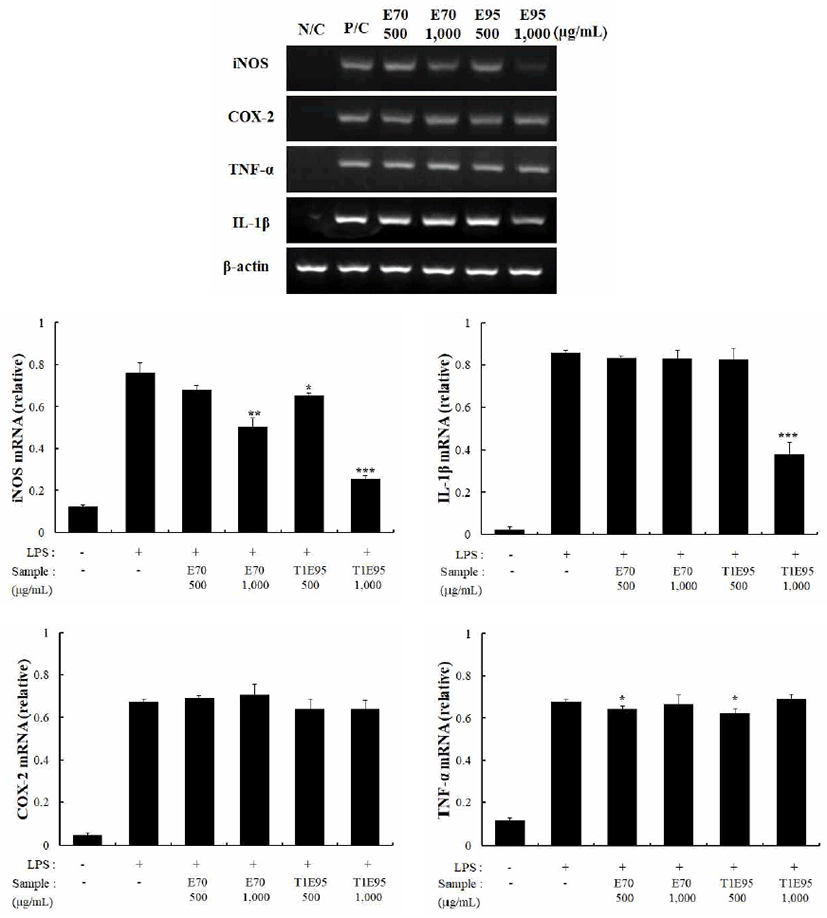
흑마늘 추출물을 소재로 한 연구에서 TNF-α, IL-2와 같은 사이토카인의 생성이 유도되어 자연면역에 의한 T 림프구 의 생성인자로 작용하며, 한편으로는 IL-4, IL-6, IL-10과 같은 사이토카인의 생성으로 B 림프구의 활성화를 통한 면역증진에 기여한다는 보고가 있다(34). 홍마늘이 50% 이상 함유된 생약재 복합조성물은 추출온도에 따라 활성정 도에는 차이가 있지만 염증 매개인자의 활성을 감소시켰으 며 특히 E-95는 iNOS 및 IL-1β의 발현량을 감소시켜 항염증 효과가 있을 것으로 기대된다.
요 약
홍마늘과 생약재 5종(생강, 도라지, 모과, 진피, 박하)이 혼합된 조성물의 항염증 활성을 검증하고자 홍마늘 50%와 천연식물류 5종을 각각 10%씩 혼합한 조성물을 물과 에탄 올로 70℃ 및 95℃에서 3시간 동안 추출하여 각각의 추출물 을 제조하였다. 총 페놀화합물은 70℃에서 에탄올로 추출 시 608.60 mg/100 g으로 가장 높은 함량이었으며 물 추출물 에서는 이보다 낮은 함량이었다. 홍마늘의 유효성분인 alliin과 SAC는 70℃에서 물로 추출하였을 때 각각 1.29 mg/g과 2.60 mg/g으로 에탄올 추출물에 비해 유의적으로 높은 함량이었다. 홍마늘과 5종 천연식물류 복합추출물의 DPPH와 ABTS 라디칼 소거활성은 70℃에서 에탄올로 추 출하였을 때 각각 15.96-73.65%와 5.71-77.19%로 가장 높았 다. NO 생성억제 활성은 물 추출물 보다는 에탄올 추출물에 서 더 높았으며 70℃ 보다는 95℃에서 추출하였을 때 더 활성이 높았다. ROS 생성은 에탄올 95℃ 추출물이 1,000 μg/mL 농도에서 대조군 대비 약 64.92%로 가장 활성이 높았다. iNOS와 IL-1β의 발현량은 1,000 μg/mL 농도의 9 5℃ 에탄올 추출물에서 LPS 단독처리군에 비해 유의적으 로 감소되었다. 이상의 결과를 종합하여 볼 때 홍마늘 및 생약재 복합 추출물의 항산화와 항염증 활성은 서로 다른 유용물질의 영향으로 발현이 되며, 이들 유용물질은 추출 용매와 온도에 따라 함량이나 구성이 서로 상이하였다.










