서 론
식품의 기능은 여러 가지가 있지만 일반적으로 3가지로 분류할 수 있다. 식품의 1차적 기능은 영양 기능으로 식품의 영양소를 신체의 구성성분 및 에너지원으로 이용하고, 2차 적 기능은 감각기능으로 식품의 맛, 향기, 물성 등이 풍요로 운 식생활을 즐길 수 있게 하며, 3차적 기능은 생리 조절기 능으로 식품 중에 있는 여러 생리활성 성분이 생체를 조절 함으로써 질병예방과 건강향상에 도움을 준다(1). 과거에 는 1, 2차적 기능 위주의 식생활이었다면, 현대사회는 기술 이 발달되면서 생활수준이 향상되고 건강에 대한 관심이 증가하여 3차적 기능의 식품 수요가 높아져 건강 증진을 목적으로 하는 기능성 식품이 등장하게 되었다(2).
기능성 식품이란 알레르기 면역력을 향상시키는 생체방 어기능, 당뇨병과 같은 질병의 예방과 회복기능, 소화 기능 조절 등의 생체리듬의 조절기능, 과산화지방 생성억제 등 의 노화억제기능 등이 있다(3).
기능성 식품은 활성산소를 감소시킴으로써 질병의 예방 과 생체조절 기능을 할 수 있도록 도와준다(4). 활성산소는 우리 몸 내부에서 섭취한 영양소가 에너지를 생성하는 과정 에서 생긴 부산물이며 대부분 미토콘드리아에서 생성된다 (5). 또한 활성산소는 우리 몸 내부에 세균이나 바이러스와 같은 유해성분이 들어오거나 고강도의 운동을 하는 등 체내 의 항산화 방어계의 균형이 깨졌을 때 주로 생성된다(6,7). 활성산소생성 반응은 연쇄적으로 일어나며 체내에서 활성 산소는 계속하여 생산된다. 활성산소의 연쇄적 반응을 억 제하기 위해서는 활성산소를 조절하는 항산화제가 필요하 다(8). 식물은 산화적인 손상으로부터 자신을 보호하기 위 해 다양한 phytochemical을 생산하는 것으로 알려져 있다 (9). 대부분의 약리식물들은 폴리페놀 화합물을 많이 함유 하고 있는데, 이러한 다양한 종류의 페놀성 화합물은 천연 항산화제 또는 항암효과 등의 다양한 생리활성을 나타내고 있어 많은 관심을 모으고 있다(10).
협죽도과(Apocynaceae)에 속하는 마삭줄(Trachelospermum asiaticum var. intermedium Nakai)은 바위나 나무위에 기어 오르는 상록활엽의 덩굴성 수목으로 길이는 5 m에 이르며, 한방에서는 7월에 열매를 채취하여 절골통치료에 사용하 거나 가을에 잎을 채취하여 수분을 스며들게 한 후 햇볕에 말려 거풍, 지혈, 비통, 토혈 등에 달여 복용한다(11). 마삭 줄, 고련피, 희첨 복합 추출물이 항알러지와 항염증에 효과 가 있다는 연구결과(12)는 알려져 있지만 마삭줄의 그 외 생리활성에 관한 연구는 아직까지 미비하다.
본 연구에서는 천연 기능성 소재로서의 마삭줄의 항산 화 효과와 항통풍, 항당뇨 실험을 통해 마삭줄의 기능성 식품으로 활용하기 위한 기초자료를 검토하였다.
재료 및 방법
본 연구에서 사용한 마삭줄(Trachelospermum asiaticum var. intermedium Nakai)은 2014년 지리산 지역에서 재배된 것을 시중에서 유통되는 것을 구입하여 사용하였다. 시료 는 실온 그늘에서 건조시킨 후 40 mesh로 분말화하여 4°C에 서 보관하며 시료로 사용하였다.
시료 추출은 물 추출물의 경우 건조 마삭줄 분말시료 1 g에 증류수 200 mL를 가하고 용액이 100 mL가 될 때 까지 가열하여 증발시킨 후 냉각하여 24시간 동안 상온에 서 교반 추출하였으며, ethanol 추출물은 시료 1 g에 70% ethanol 100 mL를 추출용매로 가하여 24시간 동안 상온에 서 교반 추출하였다. 추출액은 Whatman No. 1 filter paper (Whatman, Maidstone, UK)로 여과한 후 4°C 저온고에서 보관하며 시료로 사용하였다.
Total phenolic compounds 함량 측정은 Folin과 Denis의 방법(13)에 준하여 측정하였으며, 시료 1 mL에 95% ethanol 1 mL와 증류수 5 mL를 첨가하고 1 N Folin-Ciocalteu reagent(Junsei, Tokyo, Japan) 0.5 mL를 넣어 잘 섞어주고, 5분간 방치한 후, 5% Na2CO3 1 mL를 가한 후, 흡광도 725 nm에서 1 시간 이내에 측정하여 gallic acid를 이용한 표준 곡선으로부터 양을 환산하였다(Total phenolic compounds content in gallic acid(10-200 μg/mL) was calculated using the following equation based on the calibration curve: y=0.0101x-0.0403, R2=0.996, where y was the absorbance, and x was the gallic acid equivalent(μg/mL).
α,α-diphenyl-β-picrylhydrazyl(DPPH) radical에 대한 소거 능력은 Blois의 방법(14)에 준하여 측정하였다. 시료의 phenolic compounds 농도를 50, 100, 150, 200 μg/mL로 맞추 어 각 시료 1 mL에 60 μM DPPH 3 mL를 넣고 vortex한 후 15분 동안 방치한 다음 517 nm에서 흡광도를 측정하였 다. DPPH radical에 대한 소거능은 1-(반응구의 흡광도/대조 구의 흡광도)×100으로 나타내었다.
ABTS radical cation decolorization의 측정은 Pellegrini의 방법(15)에 준하여 측정하였다. 7 mM ABTS 5 mL과 140 mM K2S2O8 88 μL를 섞어 어두운 곳에 16시간 이상 방치한 용액 1 mL와 ethanol 88 mL를 혼합한 ABTS solution 1 mL를 50, 100, 150, 200 μg/mL의 phenolic compounds 농도 를 가지는 시료용액 50 μL와 혼합하여 30초간 진탕한 후 2분 30초간 incubation하고 734 nm에서 흡광도를 측정하였 다. ABTS radical cation decolorization 효과는 1-(반응구의 흡광도/대조구의 흡광도)×100으로 나타내었다.
PF는 Andarwulan과 Shetty의 방법(16)에 준하여 측정하 였다. 10 mg의 β-carotene/50 mL chloroform 용액 1 mL를 evaporator용 수기에 넣고 40°C water bath에서 chloroform을 증류시킨 후, 20 μL linoleic acid, 184 μL Tween 40과 50 mL H2O2를 가하여 emulsion을 만들고, 5 mL의 emulsion을 50, 100, 150, 200 μg/mL의 phenolic compounds 농도를 가지 는 시료용액 100 μL에 혼합하여 잘 섞어준 뒤 50°C에서 30분간 반응시켜 냉각시킨 다음, 470 nm에서 흡광도를 측 정하였다. PF는 (시료첨가구의 흡광도/시료무첨가구의 흡 광도)의 비로 나타내었다.
TBARs는 Burge와 Aust의 방법(17)에 준하여 측정하였 다. 1% linoleic acid와 1% tween 40으로 emulsion을 만들었 다. Emulsion 0.8 mL와 50, 100, 150, 200 μg/mL의 phenolic compounds 농도를 가지는 시료 0.2 mL를 섞은 후 50°C water bath에서 8시간 반응시켰다. 반응액에 TBA/TCA 시 약 4 mL를 넣고 15분간 끓인 후 10분 동안 냉각시킨 다음 2,000 rpm으로 20분간 원심분리 하였다. 원심분리 후 상등 액을 532 nm에서 흡광도를 측정하였다. TBARs radical 소 거능은 1-(반응구의 TBARs μM/대조구의 TBARs μM)×100 으로 나타내었다.
Xanthine oxidase 활성저해 측정법은 Stirpe와 Corte의 방 법(18)에 준하여 측정하였다. 반응구는 0.1 M potassium phosphate buffer(pH 7.5)에 2 mM xanthine을 녹인 기질액 3 mL에 효소액 0.1 mL와 50, 100, 150, 200 μg/mL의 phenolic compounds 농도를 가지는 각 시료용액 0.3 mL를 넣고 대조 구에는 추출용액 대신 증류수를 0.3 mL 첨가하여 37°C에서 30분간 반응시키고 20% trichloroacetic acid(TCA) 1 mL를 가하여 반응을 종료시킨 다음 원심 분리하여 단백질을 제거 한 후 반응액 중에 생성된 uric acid를 흡광도 292 nm에서 측정하여, uric acid를 사용한 표준곡선으로 환산, 정량한 후 percentage inhibition(%)을 구하였다. Percentage inhibition (%)은 1-(반응구의 uric acid의 양/대조구의 uric acid의 양)×100으로 나타내었다.
α-Glucosidase 저해 활성은 Tibbot 등의 방법(19)에 준하 여 측정하였다. 혼합액 100 mL sodium succinate buffer(pH 6.8)에 4-nitrophenyl α-D-glucopyranoside를 0.152 g 용해시 켜 기질을 만들었다. 효소액 0.1 mL를 37°C water bath에서 10분간 반응시키고 50, 100, 150, 200 μg/mL의 phenolic compounds 농도를 가지는 시료 0.1 mL와 기질 2 mL를 넣어 37°C water bath에서 20분간 반응시켰다. 대조구는 증 류수 0.1 mL를 사용하였다. 반응시킨 후 종료시약으로 5% Na2CO3 3 mL를 넣은 후 470 nm에서 흡광도를 측정하였다. 이때 생성된 p-nitrophenol(PNP)은 다음의 식으로 저해율을 구하였다. 저해율(%)은 [1-(반응구의 PNP 생성량/대조구의 PNP 생성량)]×100으로 나타내었다.
결과 및 고찰
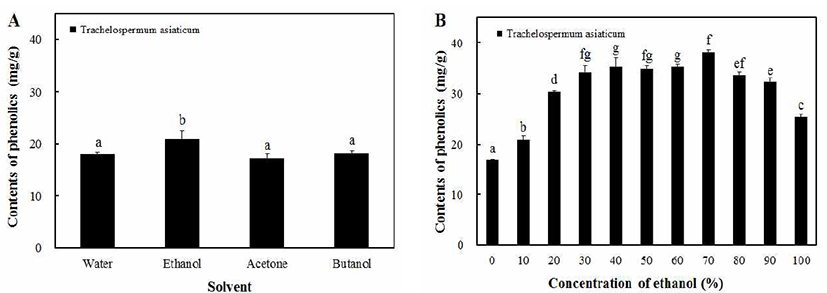
Phenolic compounds는 식물의 방어기작에 의하여 생산 되는 1,000여 가지의 2차 대사산물 중 한 종류이고 benzene 고리에 -OH기 여러 개가 치환되어있는 천연 항산화제로 널리 알려져 있다(20,21). 또한 phenolic hydroxyl기에 의해 단백질 등의 거대 분자들과 결합하는 특성을 가지고 있어 항산화, 항암, 항당뇨 등의 생리기능을 나타낸다고 알려져 있다(22). 본 연구에서는 마삭줄 추출물에 포함되어 있는 phenolic compounds의 성분 함량의 최적조건을 알아보기 위하여 용매별, 농도별로 조제하고 추출수율을 측정하였 다. 마삭줄의 용매별 추출은 water, ethanol, acetone, butanol을 100% 농도로 추출하였다. 용매별로 추출한 결과, Fig. 1A에 서와 같이 water, ethanol, acetone, butanol 순으로 18.08, 20.87, 17.20, 18.20 mg/g의 용출량을 나타내었으며, ethanol 추출물에서 20.87 mg/g로 가장 높은 함량을 나타냈다. 식품 에 적용이 가능한 ethanol을 이용하여 10-100%의 농도로 추출하여 최적 phenolic compounds의 용출 조건을 알아보 았다. 그 결과 Fig. 1B와 같이 70% ethanol 추출물에서 38.10 mg/g으로 가장 높은 phenolic compounds의 용출량을 나타내었다. 건강기능성 식품으로의 가능성을 확인하기 위 해서 안정성이 높은 물과 ethanol을 이용하여 실험을 진행 하였다. 마삭줄의 물 추출물과 phenolic compounds 용출량 이 가장 높았던 70% ethanol 추출물을 50, 100, 150, 200 μg/mL의 특정 농도로 설정하여 시료로 사용하였다.
DPPH는 ascorbic acid, tocopherol, polyhydroxy 방향족 화합물, 아민류에 의해서 환원되어 보라색이 탈색됨으로써 항산화 물질의 전자 공여능을 측정할 때 사용되며, 전자공 여 작용은 산화성활성 free radical에 전자를 공여하여 산화 를 억제시키는 척도가 된다(23). 마삭줄 추출물은 100 μ g/mL phenolics 농도를 기준으로 Table 1과 같이 물과 70% ethanol 추출물의 radical 소거능은 80.9%와 83.1%로 나타내 어, 물 추출물보다 70% ethanol 추출물에서 radical 소거능이 더 높은 것을 확인할 수 있었다. Kim(24)은 병솔 꽃나무 가지를 70% ethanol로 추출하여 100 μg/mL 농도로 DPPH를 측정한 결과, 83%의 radical 소거능을 나타내어 마삭줄과 비슷한 효능을 나타내었다. Hong 등(25)은 흰씀바귀고채 뿌리의 물 추출물을 125 μg/mL 농도로 DPPH를 측정한 결과, 9%의 radical 소거능을 나타내었고, 2,000 μg/mL 농도 에서 91%의 radical 소거능을 나타내었다. 이러한 결과에 따라 마삭줄 추출물은 저농도에서도 높은 radical 소거효과 를 가짐을 알 수 있었다.
ABTS radical 소거능은 ABTS와 potassium persulfate를 암실에 방치하였을 때 ABTS+ radcal이 생성되고, 시료의 항산화력에 의해 ABTS+ radical이 제거되어 radical 특유의 색인 청록색이 탈색되는 것을 이용한 방법이다(26). 마삭줄 의 물과 70% ethanol 추출물을 phenolic compounds 농도를 50, 100, 150, 200 μg/mL으로 조절하여 ABTS radical 소거능 을 측정한 결과, Table 1B에서와 같이 물 추출물은 최소 36.28%에서 최대 94.98%의 ABTS 소거능을 나타내었고 70% ethanol의 경우, 최소 37.54%에서 최대 95.84%의 ABTS 소거능을 나타내었다. Positive control인 BHT의 경 우, 마삭줄 추출물과 동일 농도에서 최대 70.27%의 소거능 을 나타내었고, Ham(27)의 백합나무 변재와 심재 아세톤 추출물의 ABTS radical 소거능을 측정한 결과, 10 μg/mL의 농도에서 6%와 26%, 50 μg/mL의 농도에서 7%와 35%의 ABTS radical 소거능을 나타내어 마삭줄 추출물은 표준 항산화제와 또 다른 천연물에 비해 ABTS radical 소거능이 더 우수한 것을 확인할 수 있었다.
마삭줄 추출물의 phenolic compounds 농도를 50, 100, 150, 200 μg/mL으로 설정하여 PF의 차이를 측정한 결과, Table 1C에서와 같이 물 추출물의 경우 2.29-2.51 PF, 70% ethanol 추출물의 경우 2.15-2.63 PF를 나타내었다. 위의 결과에서는 물 추출물과 70% ethanol 추출물이 큰 차이를 보이지 않는다고 판단했다. Bang(28)의 청일뽕 오디 80%ethanol 추출물은 1.46 PF의 결과를 나타내었다는 보고 에 비교하면, 마삭줄 70% ethanol 추출물은 2.15 PF 이상의 결과를 보여 보다 높은 PF 측정 결과를 확인할 수 있었고, 물질에 대한 PF가 1.2 이상이 되었을 때, 항산화 능력이 우수하다고 평가되는데(29), 마삭줄 추출물의 경우 지용성 물질에 대한 높은 PF를 가진다고 확인할 수 있었다.
TBARs값은 지방산패도를 나타내며, TBA 시약과 반응 하여 붉은색이 되는 malondialdehyde의 생성량을 나타낸 것이다(30). Table 1D에서와 같이 100 μg/mL phenolic compounds 농도를 기준으로 물과 70% ethanol 추출물의 TBARs값은 70%와 80%로 나타내었고, 200 μg/mL phenolic compounds 농도에서는 두 추출물 모두 89%의 높은 결과를 나타내었다. Kim 등(31)은 호두를 60% ethanol로 추출하여 200 μg/mL phenolic compounds 농도를 기준으로 TBARs값 을 측정하여 75%의 결과를 나타내었고, Kim(32)은 머위 엽병을 95% ethanol로 추출하여 100 μg/mL 농도에서 43.37%의 측정 결과를 나타내었다고 보고한 것과 비교하면 마삭줄의 지질과산화 억제효과가 더 큰 것으로 확인되었 다. 이러한 결과로 보아 마삭줄 추출물은 수용성 및 지용성 물질에 대하여 높은 항산화 활성을 나타내었으며, 추출물 의 phenolic compounds에 농도 의존적인 양상을 나타내는 것으로 확인되었다.
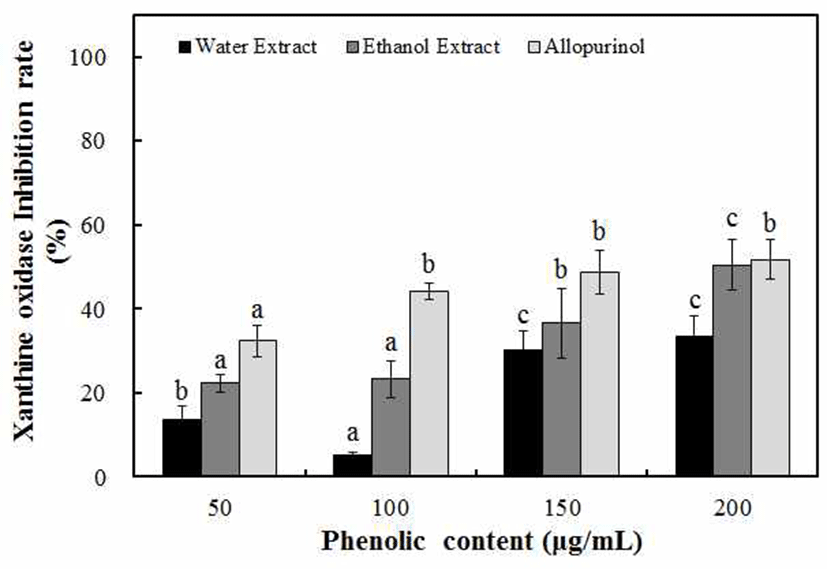
Xanthine oxidase(Xoase)는 purine 대사에 관여하는 효소 이고 xanthine 또는 hypoxanthine으로부터 산소를 떼어내고 과산화수소와 uric acid를 만들어 낸다. 형성된 uric acid는 혈장 내에서 증가되고, 침상모양의 결정이 골절에 축적되 어 심한 통증을 유발하는 통풍(gout)과 신장에 침착되어 신장질환을 일으키는 효소로 알려져 있다(33). 마삭줄의 물과 70% ethanol 추출물을 50-200 μg/mL의 phenolic compounds 농도로 첨가하여 xanthine oxidase 저해 효과를 측정하였다. 마삭줄 추출물의 xanthine oxidase 저해 활성은 물 추출물에 비해 70% ethanol 추출물에서 억제효과가 높은 것을 알 수 있었으며, phenolic compounds의 농도 의존적으 로 저해 효과가 높아지는 것을 확인할 수 있었다. 현재 시중 에서 통풍 치료제로 사용되고 있는 allopurinol(34)은 Fig. 2에서와 같이 200 μg/mL의 phenolic compounds 농도에서 52.7%의 억제효과를 나타내었는데, 마삭줄 70% ethanol 추 출물은 이와 비슷한 수준인 50.52%의 억제력을 나타내어 통풍 치료제로서 활용이 가능할 것으로 판단되었다. Kim(35)은 댕댕이덩굴 물 추출물을 1,000 μg/mL phenolic compounds의 농도로 측정한 결과, 8.33% 저해 효과를 나타 내었고, Yoon 등(36)의 미숙, 완숙 뜰보리수 추출물은 1,000 μg/mL의 농도에서 30.0%, 28.2%의 xanthine oxidase 저해 효과를 나타내었고, Cho(37)는 70% ethanol 감국 추출물에 서는 51.12%의 저해 효과를 나타내었다고 보고하였다. 위 의 결과들과 비교하였을 때 마삭줄의 xanthine oxidase 저해 효과가 매우 우수한 것으로 확인되었다.
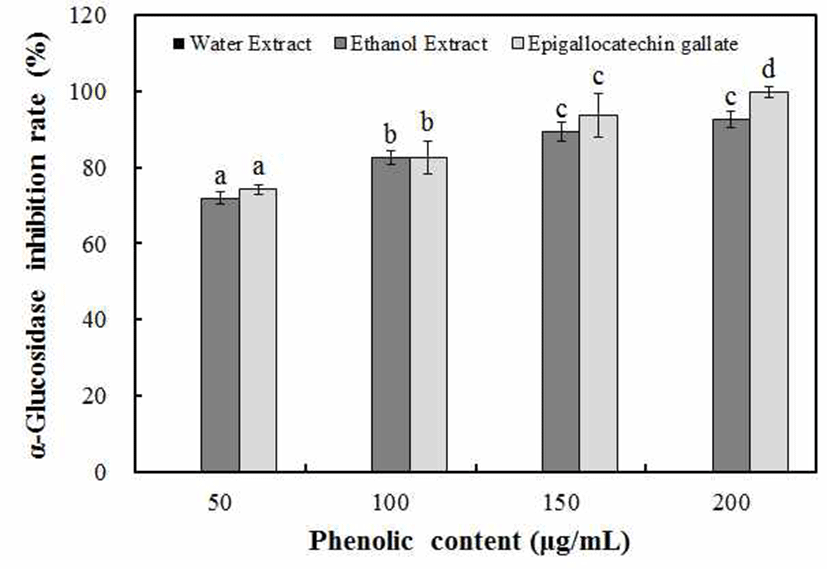
α-glucosidase는 과당류 등과 결합해 단당류로 분해시키 는 작용을 하여 탄수화물의 소화에 중요한 역할을 하므로 α-glucosidase의 저해가 식후 고혈당 방지에 도움이 되며, 생체 내 음식과 같이 투여되었을 때 α-glucosidase 저해제들 은 당류들의 소화를 저해하여 소장에서 소화를 지연시켜 식후 혈당치의 증가를 낮춰준다(38). 마삭줄 추출물의 α -glucosidase 저해 효과 측정 결과, Fig. 3에서와 같이 물 추출물에서는 저해 효과가 나타나지 않았으나 70% ethanol 추출물에서는 100 μg/mL phenolic compounds 농도에서 82.6% 저해효과를 나타내었으며, phenolic compounds 농도 가 증가할수록 농도 의존적으로 저해 효과가 증가하여 200 μg/mL phenolic compounds 농도에서 92.6%의 저해 효과를 나타내었다. Sin(39)은 노랑느타리버섯을 12시간 물 추출 하여 α-glucosidase 저해 효과를 측정한 결과, 80%의 저해 효과를 나타내었고, Son(40)은 구지뽕나무 뿌리 추출물을 300 μg/mL 농도에서 측정한 결과, 77%의 저해 효과를 나타 내었다. Kim(41)등은 Ecklonia cava, Eisenia bicyclis, Sargassum thunbergii를 1,000 μg/mL 농도로 측정한 결과, 98% 저해 효과가 나타나 마삭줄 추출물의 α-glucosidase 저해 효과는 저농도에서도 보다 우수한 저해 효과를 가진다 고 확인할 수 있었다.
위의 결과들로 미루어 보았을 때 마삭줄 추출물 항산화 효과, 통풍 억제 및 항당뇨 효과를 가진 건강 기능성 식품으 로서 적용 가능성을 기대할 수 있었다.
요 약
본 연구에서 마삭줄(Trachelospermum asiaticum var. intermedium Nakai)을 용매별과 ethanol 농도별로 추출한 결과, 용매별 추출에서 ethanol 추출물이 20.8 mg/g으로 가 장 높은 phenolic compounds 용출량을 보였고, 농도별 추출 에서 70% ethanol 추출물이 38.1 mg/g으로 가장 높았다. 물 추출물은 16.8 mg/g의 phenolic compounds 용출량을 보 였다. 마삭줄을 물과 ethanol을 추출용매로 사용하여 항산 화 효과와 항통풍 및 항당뇨 효과를 확인하여 건강 기능성 식품으로의 가능성을 증명 하고자 하였다. DPPH radical 소거능 측정 결과, 100 μg/mL phenolic compounds의 농도에 서 물 추출물은 80.9%, 70% ethanol 추출물은 83.1%의 활성 을 나타내었다. ABTS radical 소거능 측정 결과 200 μg/mL phenolic compounds의 농도에서 물 추출물은 95.0%, 70% ethanol 추출물은 95.8%의 소거능력을 나타내었다. PF 측정 결과, 100 μg/mL phenolic compounds의 농도에서 물 추출물 은 2.43 PF, 70% ethanol 추출물에서는 2.45 PF를 나타내었 다. TBARs 측정 결과, 200 μg/mL phenolic compounds의 농도에서 물과 70% ethanol 추출물에서 89.9%와 89.3%의 활성을 나타내었다. 통풍 억제 효과 측정 결과, 200 μg/mL phenolic compounds의 농도에서 물 추출물은 33.3%, 70% ethanol 추출물은 50.5%의 저해 효과를 나타내었다. α -glucosidase 저해 효과 측정 결과, 물 추출물에는 저해 효과 가 나타나지 않았고, 70% ethanol 추출물에서는 200 μg/mL phenolic compounds의 농도에서 92.6%의 저해 효과를 나타 내었다. 이러한 결과들로 미루어 보았을 때 마삭줄 추출물 은 항산화 작용과 건강 기능성 식품으로 활용 가능성을 확인할 수 있었다.










