ARTICLE
녹각 및 목이버섯의 젖산발효를 통한 GABA 생산 및 항염증활성 효과
권순영1, 황기1, 이삼빈1,2,*
Anti-inflammatory effects and GABA production of old antler and Auricularia auricula-judae extract fermented by Lactobacillus plantarum
soon young Kwon1, ki Whang1, sam pin Lee1,2,*
Author Information & Copyright ▼
2계명대학교 전통미생물자원계발 및 산업화연구센터
1Department of Food Science and Technology, Keimyung University, Daegu 42601, Korea
2The Center for Traditional Microorganisim Resource (TMR), Keimyung University, Daegu 42601, Korea
*Corresponding author. E-mail:
splee@kmu.ac.kr; 82-53-580-5554, 82-53-580-5729
© The Korean Society of Food Preservation. . This is an Open-Access article distributed under the terms of the Creative Commons Attribution Non-Commercial License (http://creativecommons.org/licenses/by-nc/3.0/) which permits unrestricted non-commercial use, distribution, and reproduction in any medium, provided the original work is properly cited.
Received: Jan 23, 2017; Revised: Apr 04, 2017; Accepted: Apr 10, 2017
Abstract
The optimization of lactic acid fermentation was conducted to produce an old antler fortified with functional ingredients. For the over-production of gamma aminobutyric acid (GABA), the extract of old antlers (OA) was fermented by Lactobacillus plantarum EJ2015 with 0.5% YE, 1.5% glucose, and 3.5% MSG at 30°C for 7 days. The lactic acid fermented OA showed high viable cell counts of 2.0×108 CFU/mL, pH 6.56 and 0.77% acidity after 7 days. Addition of Auricularia auricula-judae (AAJ) enhanced the cell growth of L. plantarum EJ2014, resulting in higher viable cell counts of 2.0×109 CFU/mL and acid production after fermentation for 1 day. In particular, acidity was greatly decreased after fermentation for 3 days and 1.4% GABA was produced by converting efficiently mono sodium glutamate as a substrate. Fermented OA/AAJ mixture indicated the reduced cytotoxicity compared with that of unfermented OA. The fermented OA/AAJ mixture indicated anti-inflammatory effect with less production of NO in microphage cells. The production of NO dropped to 17.75 μM at 4 mg/mL, and to 5.58 μM at 6 mg/mL old antler after fermentation. Thus, lactic acid fermented OA with AAJ could fortify GABA, probiotics and dietary fiber.
Keywords: GABA; Lactobacillus plantarum; nitric oxide; cytotoxicity; antioxidant activity
서 론
전통발효식품에서 분리된 락토바실러스 플랜타룸 (Lactobacillus plantarum) 균주는 포도당으로부터 젖산을 주로 생산하여 발효제품의 신맛과 저장성을 향상시켜주며, 기능성물질인 γ-amino butyric acid(GABA)를 고농도로 생 산하는 특징을 가지고 있다(1,2). 자연 상태에서의 식품 중 GABA 함유량으로는 약리작용을 발휘하기에 부족하여, 자 연적인 섭취로 GABA의 생리작용을 기대하기는 힘든 실정 이다(3,4). 식품의약품안전처에서 혈압이 높은 사람에게 도 움을 줄 수 있는 개별인정원료로 L-glutamic acid 유래로 생성된 GABA 물질이 인정됨에 따라 최근 GABA 함량을 증진시키기 위해 다양한 미생물을 이용한 발효 방법이 활발 히 연구되고 있다(5).
목이버섯 Auricularia auricula-judae(AAJ)은 다른 버섯 및 식품들에 비해 월등히 많은 식이섬유를 함유하고 있어서 영지버섯 자실체 추출물과 함께 식품의약품안전처에서 배 변활동에 원활한 도움을 주는 건강기능성 원료로 등재되어 있다. 또한 vitamin D의 함량도 풍부하며 장내 Ca 흡수 및 신장에서 Ca의 재흡수를 증가시키고 조골세포의 분화를 자극하는 것으로 알려져 있다(6). 각종 약리작용에 의한 민간요법제 등 다양한 용도로 이용되어 왔다(7).
염증에 관여하는 주요 세포는 macrophage로 알려져 있으 며, 자극이나 면역세포들이 분비하는 사이토카인 등에 의 해 활성화되어(8), proinflammatory cytokine, nitric oxide (NO)와 prostagladin E2(PGE2)를 생성함으로서 통증, 혈관 투과성, 열, 부종 등의 염증반응을 유발하고, 면역세포의 이동을 촉진시킨다(9). 그 중 NO는 건강과 질병에 관여하는 자유라디칼 성분이며(10), 이는 L-arginine으로부터 NO synthase (NOS)에 의해 합성된다. NOS 중 inducible NOS (iNOS)는 lipopolysaccharide(LPS)나 염증성 cytokine 등에 의해 유도되고, iNOS에 의해 과다 생성된 NO는 염증 반응 을 심화시켜 유전자 변이, 조직의 손상 및 신경 손상 등을 일으키며(11,12), 관절염, 다발성 경화증 및 천식 등의 만성 염증질환이나 당뇨병 및 심혈관 질환 등의 각종 질병을 발생시키는 것으로 보고되어 있다(13).
녹각(old antler, Cornu cervi)은 녹과에 속한 매화록 (Cervus nippon termminok)의 털이 없고 골화되어 자연 탈락 하는 각(角, old antler)을 일컫는다(14). 녹각은 발육촉진작 용, 조혈작용, 강심작용 등의 약리작용이 있고(15), 면역기 능과 간장 해에 대한 영향(16-18), 그리고 골다공증(19)에 대한 연구가 진행되었다. 또한 젖산 발효 및 곰팡이발효를 통해 기존 한약재의 약효를 증가시키는 것으로 보고되고 있다(20-22). 한편, 녹용에 비해 저렴한 녹각을 이용한 건강 제품의 개발이 필요하며, 특히 발효를 통한 기능성을 강화 시킨 소재의 개발에 대한 연구는 미비한 실정이다.
따라서 본 연구는 녹용의 부산물인 녹각 및 목이버섯을 이용한 고부가가치 건강식품소재 개발을 위해서 젖산발효 의 최적화를 수행하였다. 이를 위하여 유용 젖산균을 이용 하여 기존 녹각이 가지고 있는 효능과 더불어 젖산 발효를 통해서 생리활성물질이 강화된 기능성 소재를 개발하였으 며, 대식세포를 이용한 세포독성과 염증완화 효능평가를 수행하였다.
재료 및 방법
재 료
본 실험에 사용한 녹각(Cervi cornu)은 2014년 보광약업 사(Daegu, Korea)에서 구입하여 사용하였고, 목이버섯 (Auricularia auricula-judae)은 2015년 자연그대로(Daegu, Korea)에서 구입하여 사용하였다.
스타터배양
미강으로부터 분리하여 종균협회에 기탁한 GABA 생산 균주인 Lactobacillus plantarum EJ2014(KCCM 11545P)를 이용하여 젖산발효를 수행하였다. L. plantarum EJ2014를 Difco™ Lactobacilli MRS broth agar(Becton, Dickinson and Company, Sparks, MD, USA)배지에 도말한 후, 30°C 항온배 양기 IS-971R(Jeio Tech. Kimpo, Korea)에서 24시간 배양 하였다. 그 다음 단일 콜로니를 취하여 2회 계대배양한 후, 121°C에서 15분간 멸균한 MRS broth에 L. plantarum EJ2014를 한 백금이 접종하여, 30°C에서 24시간 배양하여 스타터로 사용하였다.
녹각 및 목이버섯 추출물의 젖산발효
녹각을 세척한 후, 녹각 5%(w/w)를 증류수에 첨가하여 한약추출기를 이용하여 추출을 진행하였다. 추출액은 농축 과정 없이 시료로 사용되었으며, GABA 생산을 위한 젖산 발효는 추출물 100 mL에 목이버섯 0-2.5 g 농도별로 첨가하 였고, 미생물의 탄소원인 glucose를 1.5 g, 질소원 YE 0.5 g 첨가하였다. GABA생성 전구물질인 MSG 3.5 g 첨가 후, 121°C에서 15분간 멸균하였으며 L. plantarum EJ2014 starter 1%(v/v)를 접종하여 30°C 항온배양기에서 7일간 발 효하였으며, 6 mg/mL 농도의 발효물을 이용하여 분석에 사용하였다.
녹각 및 목이버섯 발효물의 이화학적 분석
pH는 pH meter(model 420+, Thermo Orion, USA)로 측정 하였다. 적정 산도는 시료 1 mL에 증류수 9 mL을 첨가하여 0.1 N NaOH를 이용해 pH 8.3까지 적정한 소비량을 젖산 함량(%, v/v)으로 환산하였다.
생균수는 발효물 1 mL에 멸균수 9 mL을 첨가하여 10배 희석법을 이용하여 104, 105, 106 배로 희석된 것을 MRS agar plate에 20 μL 도말한 후, 30°C 항온배양기에서 48시간 배양한 후 생균수를 colony forming unit(CFU)/mL으로 나타 내었다(23).
Thin layer chromatography(TLC) 분석
MSG 및 GABA의 정성 분석을 위해 silica gel TLC plate는 10×20 cm의 크기로 잘라서 사용하였고, TLC 전개는 사각 chamber(30×25×10 cm)에서 수행하였다(24). MSG 잔존량 과 GABA 함량 비교를 위한 standard로 MSG 0.5-2%와 GABA 0.5-1%를 사용하였다. 전개용매는 acetic acid glacial:n-butylalcohol:distilled water를 1:3:1(v/v)의 비율로 혼합하여 실온에서 3시간 이상 포화시켰다. 발효물은 증류 수로 2배 희석한 후 각각 시료와 standard 용액을 TLC plate 의 아래에서 15 mm 되는 위치에 2 μL를 점적하였고, 간격은 10-15 mm를 유지하였다. 점적 후 TLC plate의 sample을 건조한 다음 전개하였고, 전개가 끝난 TLC plate는 50°C 감압건조기에서 건조시킨다. 건조된 TLC plate에 발색시약 인 0.2% ninhydrin 용액을 뿌리고, 100°C 감압건조기에서 5-10분 동안 발색 시킨 후 발효물의 glutamic acid와 GABA spot을 확인하였다.
High performance liquid chromatography(HPLC) 분석
유리 아미노산 함량 측정은 건조시킨 시료를 실온에서 30분 동안 유도체화 하여 건조시킨 후 A 용매(140 mM NaHAc, 0.1% triethanolamine, 6% CH3CN, pH 6.1)와 함께 혼합하여 원심분리 하였다(25). 상등액을 0.45 μm syringe filter로 여과하여 분석시료로 사용하였으며 HPLC 분석에 사용된 조건과 용매는 각각 A 용매 100%로 elution후 25분 동안 B(60% CH3CN) 100%가 되도록 혼합하면서 분당 1 mL로 흘려주었다. 아미노산 측정은 254 nm에서 UV 흡광 도를 측정하였다.
총 폴리페놀 함량 측정
총 폴리페놀 함량은 AOAC법에 의하여 측정하였다(26). 시료를 5배로 희석한 다음 60 μL을 취하여 2배 희석한 Folin 시약을 60 μL를 가하여 3분간 방치한 후 10% Na2CO3 용액 60 μL를 가하여 반응시켜 반응액의 흡광도를 700 nm에서 측정하였다. 표준곡선은 gallic acid를 0, 20, 40, 60, 80, 100 μg/mL 용액이 되도록 조제하고, 이를 일정량 취하여 위와 같은 방법으로 700 nm에서 흡광도를 측정하여 계산하였다.
총 플라보노이드 함량 측정
시료 중의 총 플라보노이드 함량은 Nieva Moreno등(27) 의 방법을 이용하여 측정하였다. 시료 0.5 mL에 10% aluminium nitrate와 1 M potassium acetate를 각각 0.1 mL, 80% ethanol 4.3 mL을 가하여 실온에 40분 방치한 뒤 415 nm에서 흡광도를 측정하였다. 표준물질 quercetin을 0, 20, 40, 60, 80, 100 μg/mL 용액이 되도록 조제하고 이를 일정량 취하여 위와 같은 방법으로 415 nm에서 흡광도를 측정하여 계산하였다.
α-α-Diphenyl-β-picrylhydrazyl(DPPH) free radical 소거 활성측정
녹각 추출물 젖산 발효물의 free radical 소거 활성은 DPPH에 대한 환원력을 측정한 것(27)으로 시료 160 μL와 에탄올에 녹인 0.15 mM DPPH 용액 40 μL를 가하여 실온에 서 30분 방치한 후 517 nm에서 흡광도를 측정하였다. 각 시료의 free radical 소거 활성은 시료를 첨가하지 않은 대조 구의 흡광도를 1/2로 환원시키는데 필요한 시료의 농도인 IC50 값으로 나타내었다. 이 때 상대 활성의 비교를 위하여 대조군으로 trolox를 사용하였다.
2,2’-Azino-bis(3-ethylbenzothiazoline-6-sulphonic acid) radical(ABTS+·) 소거 활성 측정
ABTS radical 소거활성 측정 실험은 Re 등(28)의 방법을 변형하여 측정하였다. 최종 농도 7 mM 2,2-azino-bis(3- ethylbenzthiazoline-6-sulfonic acid)와 2.45 mM potassium persulfate를 혼합하여 실온인 암소에서 24시간 동안 반응하 여 ABTS+를 형성시킨 후 732 nm에서 흡광도 값이 0.70±0.02이 되게 phosphate 완충액 식염수(phosphate buffer saline; PBS, pH 7.4)로 희석하였다. 희석된 용액 180 μL에 희석된 시료를 20 μL를 가하여 정확히 1분 동안 반응 후 흡광도를 측정하였다. Free radical 소거 활성은 시료를 첨가 하지 않은 대조구의 흡광도를 1/2로 환원시키는데 필요한 시료의 농도인 IC50 값으로 나타내었다. 이 때 상대 활성의 비교를 위하여 대조군으로 trolox를 사용하였다.
RAW 264.7 대식 세포 배양
마우스 유래 대식세포주인 RAW 264.7 세포는 한국세포 주은행(KCLB)에서 분양을 받았으며 세포배양을 위해 10% fetal bovine serum(FBS)와 1% antibiotics (penicillin)를 첨가 한 DMEM 배지를 이용하여 5% CO2가 존재하는 37°C incubator에서 1주일에 2, 3회 계대배양을 실시하였다.
세포 생존율 측정
세포에 대한 독성 여부를 알아보기 위해 Green 등(29)의 방법에따라3-(3,4-dimethyl-thiazolyl-2)-2,5-diphenyl tetrazolium bromide (MTT) assay 방법을 이용하여 측정하였다. MTT assay는 미토콘드리아의 탈수소 효소작용에 의하여 노란색 의 수용성 기질인 MTT가 불용성의 보라색 formazan으로 환원되는 원리를 이용한 방법으로, 생성된 formazan의 흡광 도는 살아있거나 대사가 왕성한 세포의 농도를 반영 한다 (30). 배양된 대식 세포주를 1×105 cells/well의 농도로 96 well plate에 분주하여 5% CO2 incubator에서 24시간 동안 배양한 후 시료를 농도별로 처리하여 24시간 배양한 세포 에 PBS에 녹인 MTT(5 mg/mL) 용액 10 μL를 각 well에 넣고 incubator에서 4시간 동안 반응시킨다. 배양 종료 후 상등액을 제거하고, 각 well에 100 μL의 dimethyl sulfoxide (DMSO)를 첨가하여 생성된 formazan crystal을 용해시켜 550 nm 파장에서 microplate reader(Epoch, BioTek, USA)로 흡광도를 측정하였다. 세포생존율은 시료를 처리하지 않고 세포만 배양한 무처리군의 100% 생존율을 기준으로 상대 적인 세포생존율(cell viability, %)을 계산하였다.
Nitric oxide(NO) 생성량 측정
NO의 농도는 배양액 내의 nitrite 농도를 Griess Reagent System(31)의 방법을 이용하여 측정하였다. RAW 264.7 세 포를 1×105 cells/well의 농도로 96 well plate에 분주 후 37°C, 5% CO2 incubator를 이용하여 24시간 동안 배양하였다. 배 양 후 시료를 농도별로 처리한 후, 24시간 동안 배양하여 배양 상등액 100 μL를 새로운 96 well plate에 취하고 여기에 동량의Griess 시약(1%sulfanilamide, 0.1%naphthylethylendiamine in 2.5% phosphoric acid)을 첨가하여 10분간 반응 후 microplate reader(Epoch, BioTek, USA)를 이용하여 540 nm 의 흡광도로 측정하였다. Nitrite의 농도(μM)는 sodium nitrite(NaNO2)를 사용하여 얻은 표준 직선과 비교하여 산출 하였다.
통계처리
실험결과는 평균값과 표준편차(mean±SD)로 나타내었 으며, 통계처리는 SPSS(statistical package for social science, 21.05, SPSS Inc., Chicago, IL, USA)를 이용하여 one-way ANOVA 분석을 실시한 후 Duncan’s multiple range test로 유의성을 p<0.05 수준에서 검증하였다.
결과 및 고찰
목이버섯 첨가에 따른 젖산발효물의 이화학적 분석
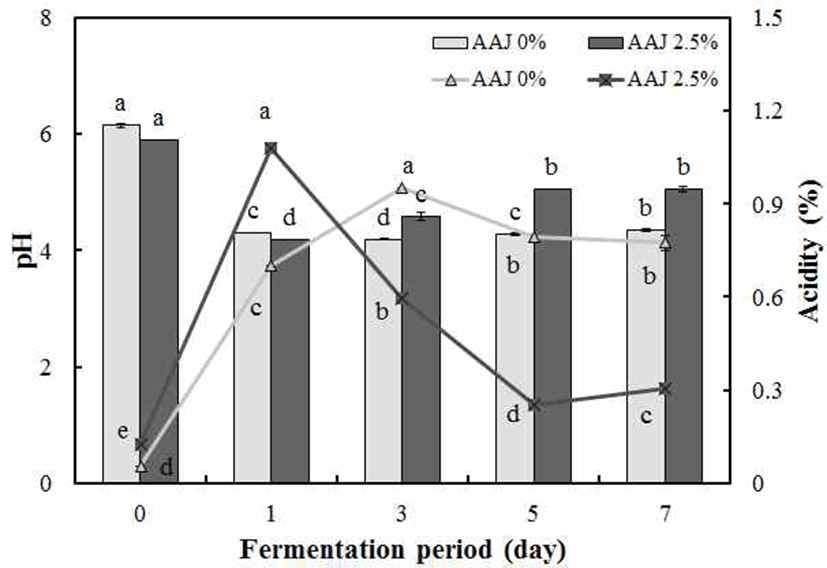
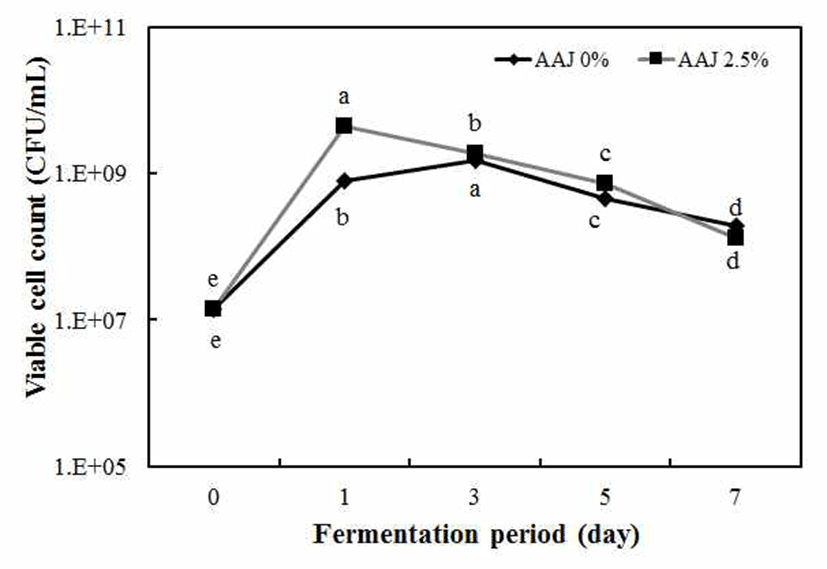
녹각을 한약추출기를 이용하여 추출 후 3.5% MSG, 1.5% glucose, 0.5% YE 첨가한 후 젖산발효 했을 때 GABA 생성 이 가장 우수한 것으로 나타났다. GABA 생성 최적조건에 서 목이버섯을 0-2.5% 첨가하여 젖산발효를 진행했을 때, pH 및 산도를 측정한 결과는 Fig. 1에 나타내었다. 목이버섯 0%, 2.5% 조건에서 발효 0일 각각 pH 6.15, pH 5.91이였고 발효 1일 pH 4.30, pH 4.20으로 젖산발효가 진행됨에 따라 떨어졌다. 목이버섯 농도 0% 조건에서 발효 3일 pH 4.2에서 발효 7일 pH 4.35로 유지되었고, 목이버섯 농도 2.5% 조건 에서 발효 3일 pH 4.59에서 발효 7일 pH 5.06으로 증가되었 다. 산도의 결과 발효 0일 각각 0.13%, 0.05%였으며, 목이버 섯 0% 조건에서 발효 1일 1.08%로 급격히 증가하여 발효 7일 0.31%로 감소하였다. 목이버섯 2.5% 조건에서 발효 3일 0.95%로 급격히 증가하였고 발효 7일 0.77%로 감소하 는 것으로 나타났다. Lim, Kim(32,33)에 따르면 이는 미생 물에 의한 GABA가 생성될 때 glutamate decarboxylase (GAD)에 의한 glutamate가 GABA로 전환될 때 proton이 소비됨으로써 GABA의 생성과 더불어 pH를 증가시키는 것으로 보고하였다. 따라서 젖산균 발효에 의해 GABA가 생성되면서 pH가 유지되거나 상승하는 결과로 보아 MSG 가 GABA로 전환되는 것으로 사료된다. 젖산균 생균수를 측정한 결과는 Fig. 2에서 보는바와 같이 녹각 추출물의 목이버섯 첨가에 따른 젖산발효를 수행하였을 때, 발효 1일 각각 8.0×108 CFU/mL, 4.5×109 CFU/mL로 균수가 급격히 상승하였고, 목이버섯 2.5% 조건에서 균수가 가장 높게 나타났다. 발효 3일 1.5×109 CFU/mL, 1.9×109 CFU/mL에서 발효 7일째 각각 1.9×108 CFU/mL, 1.3×108 CFU/mL로 발효 시간이 지남에 따라 약간 감소하는 것으로 나타났으나 높은 생균수를 유지하였다.
Fig. 1.
Effect of Auricularia auricula-judae (AAJ) on pH and acidity of the lactic acid fermented old antler extract (OAE).
Data represent the mean±SD (n=3). Different letters indicate significant differences at p<0.05 by Duncan’s multiple range test.
Download Original Figure
Fig. 2.
Effect of Auricularia auricula-judae (AAJ) on viable cell counts of the lactic acid fermented old antler extract (OAE).
Data represent the mean±SD (n=3). Different letters indicate significant differences at p<0.05 by Duncan’s multiple range test.
Download Original Figure
GABA분석
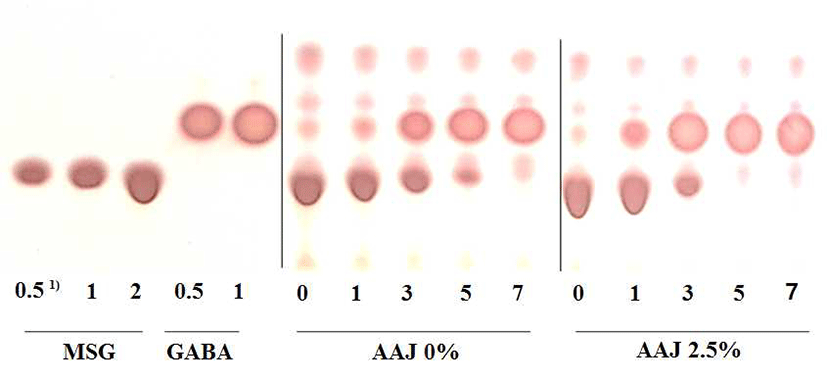
Fig. 3에 나타낸 것처럼 TLC를 이용하여 정성 분석을 했을 때 목이버섯 농도 0% 조건에서 발효 3일째 GABA spot이 생성되었으며 발효 5일째 MSG가 약간 잔존하였고, 발효 7일째 MSG가 모두 GABA로 전환되는 것으로 나타났 다. 목이버섯 농도 2.5% 조건에서 발효 1일째 GABA spot이 나타났고 발효 3일째 MSG spot이 작아지면서 발효 5일째 MSG가 GABA로 모두 전환되었다. 목이버섯 농도 0% 조건 에서 MSG가 GABA로 7일째 전환 되었으나 목이버섯 농도 2.5%에서 5일째 모두 전환되어 약 1% 이상 GABA가 생성 되었다. 따라서 목이버섯 첨가가 젖산발효를 통한 단기간 에 GABA 생성에 영향을 주는 것으로 사료되었다. HPLC를 이용하여 glutamic acid와 GABA를 정량 분석하였다. 목이 버섯 0% 조건에서 glutamic acid 함량은 발효 전 19,499 μg/mL에서 젖산균발효 후 4,835 μg/mL로 감소하였으며, GABA 함량은 젖산발효 후 14,328 μg/mL로 생성되는 것을 확인하였다. 목이버섯 2.5% 조건에서 glutamic acid 함량은 발효 전 19,916 μg/mL에서 젖산발효 후 1,586 μg/mL로 감소 하였으며, GABA 함량은 젖산균 발효 후 14,446 μg/mL로 생성되는 것을 확인하였다. 초기에 첨가된 3.5% MSG는 이온화되어 1.9% glutamic acid로 분석되었고, 젖산발효를 통해서 감소되면서 0.45% glutamic acid가 잔존하면서 GABA 전환율이 76%를 나타내었다. 미생물에 의한 GABA 의 생산으로 B. subtilis M31과 L. sakei 383를 혼합 발효한 청국장에서 0.47±0.0027 mg/g으로 나타났으며(34), 우유를 이용한 고초균과 젖산균의 혼합발효에서 0.18 μg/mL 생성 되었다(35). 따라서 젖산균을 이용한 단일 발효를 통해 단기 간에 1% 이상의 GABA를 생성함으로써 고농도 GABA를 함유한 녹각 추출물 발효물을 생산할 수 있었다. (Table 1).
Fig. 3.
TLC profile of GABA in lactic acid fermented old antler extract (OAE) with Auricularia auricula-judae (AAJ).
1)Fermentation period (day).
Download Original Figure
Table 1.
Changes in content of glutamic acid and GABA during fermentation (µg/mL)
| AAJ1) |
fermentation period (day) |
Glutamic acid |
GABA |
| 0% |
0 |
19,499±51.752) |
0 |
| 7 |
4,835±41.27 |
14,328±55.21 |
| 2.5% |
0 |
19,916±61.22 |
0 |
| 7 |
1,586±45.85 |
14,446±54.22 |
Download Excel Table
총 폴리페놀 함량
젖산발효 녹각의 기준물질로 gallic acid를 사용했으며, 발효 전, 후의 폴리페놀 함량은 목이버섯 2.5% 조건에서 발효 전 19.40 mg/mL, 발효 후 22.55 mg/mL로 약간증가하 였다. 젖산발효 녹각의 기준물질로 quercetin을 사용했으며 발효 전, 후의 플라보노이드 함량은 목이버섯 2.5% 조건에 서 발효 전 18.25 mg/mL에서 발효 후 13.69 mg/mL로 감소 하였다. Kang(36)의 연구에서 한약재의 종류에 따른 총 플 라보노이드 함량은 금은화 21 mg/mL, 옻나무 18 mg/mL, 구지뽕 10 mg/mL, 상백피 7 mg/mL, 포공영 5 mg/mL, 도인 총 3 mg/mL로 나타났으며, 다른 한약재의 함량 결과와 유사 하게 나타났다(Table 2).
Table 2.
Total polyphenol content of old antler extract (OAE) fermented with Auricularia auricula-judae (AAJ)
|
|
Fermentation period (day) |
| 0 |
7 |
| Polyphenol content (mg/mL) |
19.40±1.071) |
22.55±1.05 |
| Flavonoid content (mg/mL) |
18.25±0.02 |
13.69±0.28 |
Download Excel Table
α-α-Diphenyl-β-picrylhydrazyl(DPPH) free radical 소거활성 측정
목이버섯 2.5% 조건에서 발효 전 0.12 mg/mL에서 발효 후 0.16 mg/mL로 발효에 따른 radical 소거활성은 차이가 없음을 확인할 수 있었다. Lee등(37)은 뉴질랜드산 녹용 상대를 열탕 추출하여 DPPH 라디칼 소거 활성을 측정한 결과 100 mg/mL 농도에서 67.1%의 소거 활성을 나타낸다 고 하였다. 또한 녹용 함량이 약 70 mg/mL 정도 함유하는 녹용대보탕의 항산화 활성이 0.9%였다는 Lee등(38)의 보 고와 비교할 때 한약탕제의 생약 성분들이 중요한 항산화 역할을 하는 것으로 추정된다. 따라서 본 연구에서 열수 추출법을 사용함으로써 많은 생리활성 물질이 추출되었음 을 알 수 있었다(Table 3).
Table 3.
Scavenging effect of trolox and old antler extract (OAE) fermented with Auricularia auricula-judae (AAJ) against α- α -Diphenyl-β-picryhydrazyl (DPPH•)
| Fermentation period (day) |
IC501) (mg/mL) |
| AAJ 2.5% |
0 |
0.12±0.012) |
| 7 |
0.16±0.03 |
| Trolox |
3.25 µg/mL |
Download Excel Table
2,2’-Azino-bis(3-ethylbenzothiazoline-6-sulphonic acid) radical(ABTS+·) 소거활성 측정
목이버섯 2.5% 조건에서 발효 전 2.62 mg/mL에서 발효 후 2.71 mg/mL로 발효에 따른 radical 소거활성은 차이가 없음을 확인할 수 있었다(Table 4).
Table 4.
Scavenging effect of trolox and old antler extract (OAE) fermented with Auricularia auricula-judae (AAJ) against 2,2-azino-bis (3-ethylbenzthiazoline-6-sulfonic acid) radical (ABTS+•)
| Fermentation period (day) |
IC501) (mg/mL) |
| AAJ 2.5% |
0 |
2.62±0.032) |
| 7 |
2.71±0.07 |
| Trolox |
5.28 µg/mL |
Download Excel Table
세포생존율
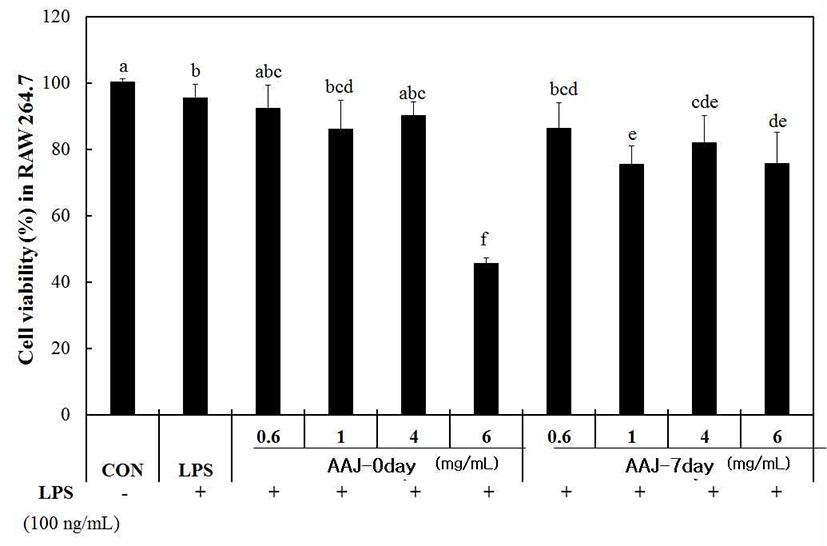
목이버섯 발효 전 6 mg/mL에서 세포독성이 나타났고, 발효 후 80% 이상의 세포 생존율로 나타났다(Fig. 4). Kim(39)의 연구에서 대황과 발효대황 물 추출물의 0.1-1 mg/mL 농도에서 세포생존율을 측정하였을 때, 대황은 1 mg/mL에서 세포독성이 나타났으며, 발효대황은 모든 농도 구간에서 세포독성이 나타나지 않았다. 마찬가지로 젖산발 효를 통해서 발효물의 세포독성이 완화되는 것으로 판단되 었다.
Fig. 4.
Effect of old antler extract(OAE) fermented with Auricularia auricula-judae(AAJ) on RAW 264.7 cell viability.
Data represent the mean±SD (n=3). Different letters indicate significant differences at p<0.05 by Duncan’s multiple range test.
Download Original Figure
NO소거활성
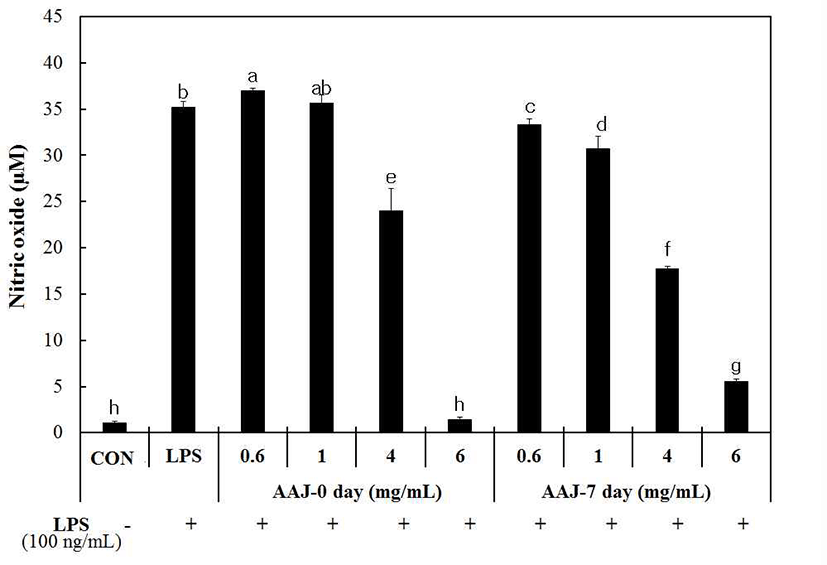
대식세포는 lipopolysaccharide(LPS)에 의해 자극될 때 iNOS가 발현되어 NO을 생성하게 되는데 이렇게 생성된 NO는 염증반응을 매개하는 역할을 하게 된다(40). 따라서 목이버섯 2.5% 조건에서 대조군, LPS에 의한 양성대조군 각각 1.1 μM, 34.1 μM이였고 발효 전 4 mg/mL 농도에서 24.01 μM로 감소하였으며, 6 mg/mL 농도에서는 대조군과 동일하게 NO 생성이 저해되는 것으로 나타났으나, 세포독 성으로 인해 NO 생성이 저해되는 것으로 사료된다. 발효 후 4 mg/mL 농도에서 17.75 μM로 감소하였으며, 6 mg/mL 농도에서는 5.58 μM로 발효 후 NO 생성이 감소되는 것으로 나타났다(Fig. 5). 따라서 4 mg/mL 농도에서 발효 후의 NO 생성량이 낮은 것을 알 수 있었다. Tak 등(41)은 흑마늘 발효물이 LPS 유무에 관계없이 모두 대식세포의 NO 생성 을 유의적으로 억제하였는데, 이 결과는 흑마늘 발효물이 염증반응 억제에 효과가 있음을 의미한다고 보고한 바 있 다. 이는 본 연구의 결과에서도 동일한 경향으로 녹각 젖산 발효물은 외부의 자극으로부터 유도되는 NO 생성을 효과 적으로 감소시킬 수 있음을 확인하였다.
Fig. 5.
Effect of old antler extract (OAE) fermented with Auricularia auricula-judae (AAJ) on NO production.
Data represent the mean±SD (n=3). Different letters indicate significant differences at p<0.05 by Duncan’s multiple range test.
Download Original Figure
요 약
본 연구에서는 젖산발효를 통해서 얻어진 목이버섯과 녹각 추출액 혼합물의 항산화 및 생리활성평가를 수행하였 다. 녹각 추출액의 GABA생성 최적조건에서 probiotics 및 기능성 강화를 위해 목이버섯을 2.5% 첨가하여 30°C에서 7일간 젖산발효를 하였다. 발효 7일 pH 5.06, 산도 0.77%로 나타났으며 1.3×108 CFU/mL로 높은 균수를 유지하였고 GABA를 1.4% 생성하는 것으로 나타났다. 목이버섯을 첨 가했을 때 젖산균 발효물의 물성이 개선되며 단기간에 고농 도의 GABA를 생성하는 것으로 나타났다. 녹각 추출액의 젖산발효물의 세포 생존율을 실험한 목이버섯 2.5% 조건에 서 발효 전 6 mg/mL에서 독성이 나타났으나 발효 후 독성이 완화되는 것으로 나타났다. 발효 후 6 mg/mL 농도에서는 5.58 μM로 발효 후 NO 생성이 감소되는 것으로 나타났다. 결론적으로 녹각 추출액과 목이버섯 혼합물의 젖산균을 이용한 정치배양을 통해 단기간에 고농도의 GABA 생산이 가능하였으며, 젖산 발효물은 세포독성 완화 효과 및 NO 생성을 저해하는 것으로 나타났다. 따라서 발효물은 GABA, probiotic, 식이섬유 등을 함유하여 기능성 식품소재 로 이용이 가능할 것으로 기대된다.
감사의 글
본 결과물은 농림축산식품부의 재원으로 농림수산식품 기술기획평가원의 기술사업화지원사업의 지원을 받아 연 구되었음(No. 314082-3)
REFERENCES
Han SB, Kim YH. Production method of γ-aminobutyric acid-enforced fermentative products by lactic acid bacteria, γ-aminobutyric acid-enforced fermentative products produced by the method and their utilization. Korea Patent No. 10-0547018. 2006
Jeun JH, Kim HD, Lee HS, Ryu BH. Isolation and identification of
Lactobacillus sp produced γ -aminobutyric acid (GABA) form traditional slat fermented anchovy. J Korean Soc Food Sci Nutr. 2004; 17:72-79.

Bouche N, Fromm H. GABA in plant just a metabolite?. Trends Plant Sci. 2004; 9:110-115.

Kang TJ, Oh SH. Produce and using to GABA. Biowave. 2007; 9:3.

Lee EG. Producing development for GABA industry. Korea research institute of bioscience and biotechnology. 2009; :1-57.

Tsushida T, Murai T. Conversion of glutamic acid to γ-aminobutyric acid in tea leaves under anaerobic conditions. Agric Biol Chem. 1987; 51:2865-2871


Cagno RD, Mazzacane F, Rizzello CG, Angelis MD, Giuliani G, Meloni M, Servi BD, Gobbetti M. SynThesis of γ-aminobutyric acid (GABA) by
Lactobacillus plantarum DSM1946,3: functional grape must beverage and dermatological applications. Appl Microbiol Biotechnol. 2010; 86:731-741.

Lis-Balchin M. Essential oils and aromatherapy their modern role in healing. J R Soc Health. 1997; 117:324-329


Buckle J. Use of aromatherapy as a complementary treatment for chronic pain. Altern Ther Health Med. 1999; 5:42-51.

Kendall HK, Marshall RI, Bartold PM. Nitric oxide and tissue destruction. Oral Dis. 2001; 7:2-10


Lee TH, Kwak HB, Kim HH, Lee ZH, Chung DK, Baek NI, Kim J. Methanol extracts of Stewartia koreana inhibit cyclooxygenase-2 (COX-2):and inducible nitric oxide synthase (iNOS) gene expression by blocking NF-kappa B transactivation in LPS-activated RAW 264 cells. Mol Cells. 2007; 23:398-404.

Ko WM, Lee DS, Jang M, Kim KS, Lee HS, Baek HY, Oh HC, Kim YC. A comparison of anti-inflammatory effects of sophorae flos ethanol extracts at the different flowering stages on LPS-induced inflammation in RAW 264 cells. Korean J Pharmacogn. 2013; 44:291-297.

Park SH, Kim JI, Jeong YK, Choi YH. Extracts of allium fistulosum attenuates pro-inflammatory action in the lipopolysaccharide-stimulated BV2 microglia Cells. J Life Sci. 2011; 21:796-804


Han JS. Manual of individual nutrition. Korean association of individual nutrition. 2006; :78-79.

Ann YG. A study on overgrown antler Kimchi. J Korean Soc Food Sci Nutr. 2003; 16:123-129.

Kim YE, Lee SG, Yoon WC. Studies on the components and biological functions of animal hard tissue A study of a scleroprotein extracted from deer horn. Korean Biochemb J. 1973; 6:13-26.

Kim MJ. Effect of old antler extracts on the benzo (a)phytene-induced hepatotoxicity in rat. MS Thesis Yeungnam University Korea. 1991; p. 1-2.

Hwang JS. Effect of
cervi cornu on treatment of osteoporosis in ovariectomized rats. MS Thesis Daegu haany University Korea. 2010; p. 1-2.

Park HI. Comparison of the effects of deer antler, old antler, and antler glue on osteoporosis in ovariectomized rats. PhD Thesis Sangji University Korea. 2017; p. 1-2.

Choi YK, Sul JU, Park SK, Yu SN, Kim SH, Rhee MS, Ahn SC, Shin MS. Research trends of fermented medicinal herbs - Based on their clinical efficacy and safety assessment. J Life Sci. 2012; 22:1729-1739


Kim MK, Jung EY, Shin KS, Kim YK, Ra KS, Park CS, Woo MJ, Lee SH, Lee HS, Kim JS, Suh HJ. Isolation of strain for the preparation of the fermented antler and its physiological activities. J Korean Soc Food Sci Nutr. 2009; 38:1237-1242


Lee HS, Kim MK, Kim YK, Jung EY, Park CS, Woo MJ, Lee SH, Kim JS, Suh HJ. Stimulation of osteoblastic differentiation and mineralization in MC3T3-E1 cells by antler and fermented antler using
Cordyceps militaris. J Ethnopharmacol. 2011; 133:710-717


Lee IS, Lee SO, Kim HS. Preparation and quality characteristics of yogurt added with
Saururus chinensis (Lour) bail. J Korean Soc Food Sci Nutr. 2002; 31:411-416.

Kang SK. Changes in organic acid, mineral, color, curcumin and bitter substance of
Curcuma Longa, L And
Curcuma atomatica Salib according to picking time. Korean J Food Preserv. 2007; 14:633-638.

Jung SH. Optimization of curcumin extraction from turmeric (
Curcuma longa L) using supercritical fluid and related physiological effects. Ph D Thesis Chungnam National University Korea. 2003.

Shon MS, Kim GN. Anti-oxidant and anti-obese activities of turmeric (
Curcuma longa L) extract in 3T3-L1 Cells. Kor J Aesthet Cosmetol. 2014; 12:169-175.

Nivea M, Sampietro A, Vattuone M. Comparison of the free radical scavenging activity of propolis from several regions of Argentina. J Ethnopharmacol. 2000; 71:109-114.

Re R, Pellegrini N, Proteggente A, Pannala A, Yang M, Rice-Evans C. Antioxidant activity applying an improved ABTS radical cation decolorization assay. Free Radic Biol Med. 1999; 26:1231-1237


Green LM, Reade JL, Ware CF. Rapid color metric assay for cell viability : Application to the quantitation of cytotoxic and growth inhibitory lympolines. J Immuno Methods. 1984; 70:257-268.

Choi JH. Effect of
Rosmarinus offcinalis, L On anti-inflammation and anti-gout. MS Thesis Keimyung University Korea. 2010; p. 12.

Wang SJ, Chen Y, He DD, He LY, Yang YM, Chen JZ, Wang XX. Inhibition of vascular smooth muscle cell proliferation by serum from rats treated orally with gastrodia and uncaria decoction A traditional Chinese formulation. J Ethnopharmacol. 2007; 114:458-462


Lim JS, Lee SP. Production of Set-type Yogurt Fortified with Peptides and γ-aminobutyric acid by Mixed Fermentation Using
Bacillus subtilis and Lactococcus lactis. Korean J Food Sci Technol. 2014; 46:165-172


Kim DS. Study on the condition of fermentation in lactic acid bacteria for the production of γaminobutyric acid. MS Thesis Hannam University Korea. 2009; p. 1-4.

Lee HS, Chang MJ, Kim SH. Effects of poly-γ -glutamic acid on serum and brain concentrations of glutamate and GABA in diet-induced obese rats. Nutr Res Pract. 2010; 4:23-29


Choi SN, Choi EH, Yoo SS. Quality characteristics and antioxidative activities of majakgwa added with fermented turmeric powder. Korean J Food Cookery Sci. 2013; 29:223-231


Kang MJ. Antioxidative activity of
Rhus verniciflua Stokes and effect of its extracts on quality of pork. PhD Thesis Gyeongsang National University Korea. 2005; p. 19-20.

Lee KA, Chung HY. The biological activity of deer antler extract
in vitro. J Korean Soc Food Sci Nutr. 2007; 20:114-119.

Lee KA, Chung HY. Biological activities of a Korean traditional prescription,
Nogyongdaebotang. J Korean Soc Food Sci Nutr. 2004; 33:28-33.

Kim NY. Comparison of the anti-inflammatory effects of water fermented and ethanol fermented extracts from Rhei Radix et Rhizoma. Ph D Thesis Wonkwang University Korea. 2010; p. 9-10.

Kawamata H, Ochiai H, Mantani N, Terasawa K. Enhanced expression of inducible nitric oxide synthase by Juzen-taiho-to in LPS activated RAW 264 cells a murine macrophage cell line. Am J Chin Med. 2000; 28:217-226.

Tak HM, Kang MJ, Kim KM, Kang DW, Han SK, Shin JH. Anti-inflammatory activities of fermented black garlic. J Korean Soc Food Sci Nutr. 2014; 43:1527-1534