서 론
전통된장은 메주로 장을 담근 후 장물을 떠내고 남은 건더기로 만든 장으로 정의되고 이미 오래전부터 한국인의 애용 식품으로 이용되어 왔으며 단백질과 지방 함량이 높아 영양적으로도 아주 우수한 발효식품이다(1). 된장은 제조 방식에 따라Aspergillus oryzae 등의 국균을 이용한 개량식 과 전통식으로 구별되며 현재에는 생활환경의 변화로 인해 산업화에 따른 개량식 된장의 소비가 급증한 상태이다(2). 된장의 주성분인 대두는 본래 항산화 물질을 함유하고 있지 만 발효와 숙성 과정 중에 새로이 생성되는 이소플라본 비배당체, 유리아미노산, 갈변물질 등을 함유하게 된다. 이 러한 기능성 물질들에 의해 된장은 항암효과(3), 혈전용해 능(4), 면역증가(5) 등의 수많은 이점을 지니고 있어 이제는 조미료 역할보다는 항암식품으로 더욱 주목을 받고 있다. 따라서 이러한 전통식품을 현대인의 기호에 맞게 변형시킨 결과 다시마, 미역, 멸치 분말 첨가 된장(2), 버섯된장(6), 버섯 균사체 된장(7) 등 기능성 소재를 첨가하여 강화시키 는 연구가 활발히 진행되고 있다.
여주(Momordica charantia L.)는 쓴맛과 향을 지닌 한해 살이 박과식물로 서양에서는 bitter melon, 아프리카에서는 wild cucumber, 일본은 고야, 한국에서는 여주라는 다양한 이름을 가지고 있다(8). 일본에서는 이미 오래전부터 여주 산업이 발달한 상태이며 동남아시아에서는 기능성 채소로 많이 사용한다고 알려져 있다(9). 한국에서는 주로 관상용 으로만 사용하였으며 식욕 저하 시 여주의 쓴맛 성분이 위를 자극하여 소화액 분비를 촉진시키므로 강장작용에 이용하였고 한방에서는 해열 및 거담 등의 약용작물로 쓰이 고 있다(10). 하지만 여주의 강한 쓴맛 때문에 여전히 이용 하는데 어려움을 겪고 있어 볶음 처리를 하여 쓴맛을 저감 시키는 연구 결과도 있다(8). 한편 여주는 비타민 C와 A, Fe 등을 다량 함유하고 있으며 항암, 항괴사, 항고혈당, 항당 뇨의 효능이 있다(11,12). 특히 여주의 열매와 종자에 함유 되어있는 charantin이라는 성분은 항당뇨에 큰 효과가 있다 고 알려져 있다(8). 당뇨는 완치가 어렵지만 식이요법으로 조절이 필요한 질환으로 남미나 인도 등에서는 당뇨 환자의 30%에 대해서 여주를 대체식품으로 사용하지만 한국의 경우에는 아직까지 대중적인 소비가 이루어지지 않고 있다 (13).
따라서 본 연구에서는 여주의 이용성 증대를 위해 여주 분말을 첨가하여 된장을 제조하고 발효 중 품질 특성, phytochemicals, 항산화 활성과 α-glucosidase 저해활성을 분석하였다.
재료 및 방법
된장 제조에 사용된 콩은 경상남도 함양군 농협 가공사 업소에서 제공받아 사용하였다. 여주는 함양군 수동면 일 대에서 생산된 것을 함양영농조합법인으로부터 제공받아 사용하였다. Phenolic acid 표준품(gallic acid, chlorogenic acid, para-hydroxylbenzoic acid, protocatechuic acid, vanillic acid, para-coumraic acid, ferulic acid, veratric acid 및trans-cinnamic acid(t-CnA))은 Sigma Chemical Co.(St. Louis, MO, USA)에서 구입하였다. 이소플라본 비배당체(daidzein, glycitein 및 genistein)는 Sigma-Aldrich사(St. Louis, MO, USA)에서 구입하였고 배당체(daidzin, glycitin 및 genistin) 는 Indofine사(Hillsborough, NJ, USA)에서 구입하였다. Folin–Cicalteu phenol, 2,2-diphenyl-1-picrylhydrazyl(DPPH), potassium ferricyanide, trichloroacetic acid(TCA), 2,2'- Azino-bis(3-ethylbenzothiazoline-6-sulfonic acid) diammonium salt(ABTs), 2,4,6-tri(2-pyridyl)-1,3,5-triazine(TPTZ), 2- thiobarbituric acid, trichloroacetic acid, 2- deoxyribose, ρ -nitrophenyl-α-D-glucopyranoside(NPG), α-glucosidase(Type I : from Bakers Yeast) 또한 Sigma-Aldrich사에서 구입하여 사용하였다.
발효 균주는 이전 연구에서 청국장 제조 시 이취가 없는 Bacillus subtilis CSY191 균주를 사용하였으며(14), 밀 곡자 제조에 사용된 곰팡이는 Rhizopus oryzae CCS01를 사용하 였다(15). 된장 제조에 앞서 밀 곡자는 밀가루 2 kg에 R. oryzae CCS01현탁액 90 mL를 첨가하여 20℃에서 48시간 배양한 후 55℃에서 2일간 건조시켜 분말 형태로 제조하였 다. 청국장 제조는 콩을 12시간 수침한 후 물기를 제거하고 121℃에서 1시간 증자 처리를 하였다. 이후 적당히 시키고 미리 배양한B. subtilis CSY191 균주 배양액을 2.5% 접종하 여 37℃에서 3일 발효 시킨 후 55℃에서 2일간 건조하여 분말 형태로 제조하였다. 한편 여주 첨가량은 된장 총 부피 의 무첨가(대조군)와 5 및 10%에 해당하는 양을 분말 형태 로 첨가하여 여주 된장을 제조하였으며 멸균된 유리병에 담아 상온에서 6주간 숙성시키면서 실험을 진행하였다.
pH는 시료 5 g을 증류수 50 mL에 용해하여 여과한 여액 을 일정량 취하여 pH meter(MP 220 pH meter, Jenway, England)를 사용하여 측정하였다. 총산은 여액에 대해서 0.1 N NaOH 용액으로 pH 8.4까지 중화시킨 후 초산 양으로 환산하였다. 염도는 된장 시료 5 g에 증류수 50 mL를 첨가 하여 혼합한 후 원심분리 하여 얻은 상등액을 염도계(Atago ES-421, Atago Co., Tokyo, Japan)로 측정하였다.
여주 첨가 된장 발효 과정 중B. subtilis CSY191 균주와 효모의 생균수를 측정하였다. 여주 된장 10 g에 멸균 증류수 90 mL를 가하고 혼탁 시킨 후 이를 적절히 희석하여 사용하 였으며 고초균의 경우에는 tryptic soy agar(TSA) 배지를 사용하였고 효모는 chloramphenicol 100 μg/mL가 함유된 potato dextrose agar(PDA) 배지에 도말한 후 30℃에서 48시 간 동안 배양하여 형성된 집락을 계수하여 생균수를 CFU/g 으로 나타내었다.
여주 첨가 된장 1 g에 증류수 5 mL를 가해 60℃에서 1시간 가수분해 시킨 후 10% 5-sulfosalicylic acid 1 mL를 첨가하여 4℃에서 2시간 방치시켜 단백질을 침전시켰다. 3분간 원심분리 후 syringe 필터로 여과 하여. 60℃에서 감압 농축하였다. 농축 후에는 pH 2.2 lithium buffer 2 mL에 용해 하고 0.45 μm membrane filter로 여과시켜 아미노산 자동분 석기로 분석하였다.
발효 기간별 여주 첨가 된장은 동결 건조하여 얻은 분말 을 50% 메탄올에 12시간 추출하고 0.45 μm membrane filter(Dismic-25CS, Toyoroshikaisha, Ltd., Tokyo, Japan)로 여과하여 제조하였다. 이 추출물은 총 phenolics, isoflavone 함량 및 항산화 활성 등을 측정하는데 사용하였다.
추출물 0.5 mL를 시험관에 분주하고 25% Na2CO3 용액 0.5 mL를 첨가하여 3분간 정치시키고 다시 2 N Folin- Ciocalteu phenol 시약 0.25 mL를 첨가하여 혼합한 다음 상온에서 1시간동안발색시켰다. 이후분광광도계(Spectronic 2D)를 이용하여 750 nm에서 흡광도를 측정하였고 gallic acid를 이용하여 작성한 표준곡선으로부터 함량을 구하였 다(14).
Isoflavone 함량 분석은 Cho와 Joo 등(14)의 방법에 준하 여 High performance liquid chromatography(HPLC, Agilent 1200 series, Agilent Co., Forest Hill, Australia)로 분석하였 다. 분석 column은 Lichrophore 100 RP C18 column(4.6×250 mm, 5 μm, Merck, Darmstadt, Germany)을 사용하였고 이동 상 용매는 0.2% glacial acetic acid in water(solution A)와 0.2% acetonitrile in glacial acetic acid(solution B)로 분석하 였다. 이동상 조건은 A 용매 기준으로 0분-100%, 15분-90%, 25분-80%, 35분-75%, 45분-65% 및 50분-65%로 유지하였 다. 시료는 20 μL를 주입하였으며, 이동상 속도는 30℃에서 1 mL/분으로 유지하였다. 검출기는 diode array detector (DAD)를 사용하여 UV 254 nm에서 검출하였다.
Phenolic acid 분석은 Lee 등(16)의 분석법을 변형하여 HPLC(Agilent 1200 series, Agilent Co.)로 분석하였다. 분석 column은 XTerraTM RP C8 column(4.6×250 mm, 5 μm, Waters Corp., Milford, MA, USA)과 HPLC(Agilent 1200 series, Agilent Co.)을 이용하여 분석하였다. 이동상 용매는 2% glacial acetic acid in water(solution A)와 2% glacial acetic acid in acetonitrile(solution B)로 분석하였고, 이동상 조건은 solvent B 기준으로 각각 10, 15, 20, 25, 30, 35, 40, 45, 55 및 60 min 동안 15%, 5%, 15%, 5%, 10%, 50%, 50%, 60%, 80% 및 90%로 유지시켰다. 시료는 20 μL를 주입하였 고 이동상의 속도는 30℃에서 1 mL/min로 유지하였고 phenolic acids 물질은 diode array UV detector(Agilent 1200 series, Agilent Co.)의 흡광도 280 nm에서 정량하였다.
Hwang 등(17)의 방법을 따라 라디칼 소거활성을 측정하 였다. 1.5×10-4 M DPPH(1,1-diphenyl-2-picryhdrazyl) 용액 0.8 mL와 여과액 및 발효 원심분리 상등액 0.2 mL를 가한 후 10 초간 vortex하고 실온에서 30분 방치한 후 분광광도계 (Spectronic 2D)를 이용하여 525 nm에서 흡광도를 측정하 였다. 각 실험은 3회 반복하여 수행하였다. 음성 대조구 실험은 시료 대신에 증류수를 0.2 mL를 취하여 실험하였다. DPPH 라디칼 소거활성은 실험구와 음성 대조구의 흡광도 를 구하여 백분율(%)로 표시하였다.
7 mM ABTs 용액과 2.45 mM Potassium persulfate (K2S2O8, FW 270.3, Sigma 9392)을 1:1로 섞고, 실온의 어두 운 곳에서 12-16시간 보관하여 ABTS radical(ABTS+⋅)을 만 들었다. ABTS radical(ABTS+⋅)은 732 nm에서 absorbance가 0.7±0.02가 되도록 메탄올로 희석하여 사용하였다. 메탄올 로 희석된 ABTS 용액(Abs 0.7±0.02) 0.9 mL와 여과액 및 발효 원심분리 상등액 0.1 mL를 섞고, 정확히 3분 후 분광광 도계(Spectronic 2D)를 이용하여 732 nm에서 흡광도를 측 정하였다(16).
Hydroxyl(⋅OH) 라디칼 소거능은 10 mM FeSO4.7H20- EDTA 0.2 mL, 10 mM 2-deoxyribose 0.2 mL, 10 mM H2O2 0.2 mL, 추출물 1.4 mL를 혼합하고 37℃에서 4시간 동안 반응시켰다. 이 혼합액에 1% thiobarbituric acid와 2.8% trichloroaceric acid를 각각 1 mL를 가하여 100℃에서 20분 간 가열하여 발색 및 냉각시킨 후 520 nm에서 흡광도를 측정하였다. 음성대조구 실험은 시료 대신에 PBS 완충액 (NaCl 8.76 g, NaH2PO4 0.11 g, Na2HPO4 0.596 g)을 사용하 였고 라디칼 소거능은 시료용액의 첨가구와 무첨가구 사이 의 흡광도의 차이를 백분율(%)로 나타내었다(8).
여과액 혹은 발효 원심분리 상등액 50 μL, 0.5 U/mL α -glucosidase 효소액 50 μL, 200 mM sodium phosphate buffer(pH 6.8) 50 μL와 혼합하여 37℃에서 10분간 예비 배양한 후 sodium phosphate buffer(pH 6.8)에 5 mM p-nitrophenol-α-D-glucopyranoside(NPG)을 100 μL 가하여 37℃에서 10 분간 반응시켰다. 반응액에 100 mM Na2CO3 750 μL로 반응을 정지시키고 420 nm에서 흡광도를 측정하 고 저해율을 계산하였다. 음성 대조구로 100% 증류수를 사용하였다(8).
결과 및 고찰
여주 첨가 된장의 이화학적 특성 변화는 Table 1과 같았다.
pH는 발효 후 증가하였고, 이에 반대로 산도는 증가하였 다. 발효 초기 된장의 pH는 여주 첨가량이 증가할수록 점차 낮아지는 경향을 나타내었다. 여주를 첨가하지 않은 된장 의 초기 pH는 6.41이었고 5%는 6.05로 이보다 좀 더 낮게 측정되었고 10%(5.83) 역시 첨가량에 비례하여 pH가 낮아 졌다. 또한 발효 60일째 pH는 감소하는 경향을 나타내었고 10% 여주를 첨가한 된장의 pH는 5.24로 이들 중 가장 낮은 것으로 나타났다. 산도는 pH 감소에 따라 조금씩 증가하였 고 이 역시 10% 여주 첨가 된장이 발효 60일째 1.48%로 가장 높은 산미를 형성하였다(Table 1).
염도는 발효 후 약간 증가하는 경향을 보여 여주를 첨가 하지 않은 된장은 11.8%에서 12.6%로, 5% 첨가 된장은 11.4%에서 13.8%로, 10% 첨가 된장은 11.8%에서 13.2%로 증가하였다. 한편Bacillus와 효모의 생균수 측정 결과 균수 는 발효 후 약간 증가하였으며, Bacillus 균주는 발효 후 각각 10.7 log CFU/g, 11.46 log CFU/g 및 9.72 log CFU/g 있었고, 효모 균수는 각각 7.02 log CFU/g, 6.86 log CFU/g 및 6.84 log CFU/g 있었다(Table 1).
일반적으로 된장은 발효 과정 중에 발효 미생물에 의해 당과 단백질이 분해되어 각종 유기산과 유리아미노산이 생성되므로 결과적으로 pH는 감소하고 총산은 증가한다고 알려져 있다(18). Hong 및 Rhee (19)도 된장 숙성 중 유기산 이 생성되어 pH가 감소한다고 보고하였고 Yang 등(20)도 acetic acid, lactic acid와 같은 유기산이 검출된다고 하였으 므로 본 연구에서도 여러 종류의 유기산이 생성된 것으로 추측된다. Cho 등(18)은 마늘 된장 숙성 중에 소금 농도가 증가할수록Bacillus 및 효모의 수가 모두 완만히 감소하였 고 이는 삼투압 영향을 받은 것으로 판단된다. Jun 및 Song(21)은 마 첨가 된장 숙성 중에 Bacillus보다 효모의 수가더 많다는연구결과를볼 때이는된장제조시 첨가되 는 부재료 종류에 따라 미생물의 생육 양상이 달라지는 것으로 판단된다. 따라서 본 연구에서는 효모 균수는 조금 씩 감소하였으나 Bacillus 균주들은 오히려 증가했으므로 여주 첨가량에 따른 미생물 생육에는 큰 영향을 받지 않는 것으로 추측 된다. 한편 Cho 등(14)의 연구에 따르면 여주를 첨가하여 제조한 청국장의 관능평가를 실시한 결과 외관은 일반 청국장보다 낮은 점수를 획득하였으나 맛과 향 그리고 전체적인 기호도 측면에서는 여주 청국장이 높은 점수를 획득하였고 특히 여주 첨가량이 증가할수록 청국장 특유의 냄새는 감소하는 것으로 보고하였다. 본 연구 또한 여주 첨가량이 많을수록 이취도가 감소하였고 이는 Cho 등(14) 의 결과와 일치하였다. 따라서 부재료로 첨가된 여주는 콩 발효 과정 중 미생물 효소작용 등에 의해 특유의 쓴맛이 감소될 것으로 기대된다. 한편 Ahn 등(22)은 여주를 볶음처 리 함으로써 특유의 쓴맛 감소 효과를 보고하였으므로 볶음 처리 후 부재료로 첨가한다면 콩 발효식품의 맛과 향을 살리면서 여주 특유의 쓴맛 감소 효과를 볼 수 있을 것으로 사료된다.
여주 첨가 된장의 유리아미노산 함량을 분석한 결과는 Table 2에 나타내었다. 비필수 아미노산 중 phosphoserine은 발효 초기에는 검출되었지만 발효 후에는 검출되지 않았고 10% 여주를 첨가한 된장에서만 발효 후에 50.38 mg/100 g이 생성되었다. Taurine은 모두 발효 초기에는 검출되지 않았으나 발효 60일째에 조금씩 생성되었고 proline은 여주 첨가 10% 된장을 제외하고 모두 발효 초기에 여주 첨가량 이 증가할수록 proline 함량도 증가하는 경향을 나타내었고 발효 후에는 모두 증가하였다. 이외에도 aspartic acid, serine, aminoadipic acid, glycine, alanine, citrulline 등 대부분 의 비 필수아미노산들은 모두 발효 초기보다 후에 증가하는 경향을 나타내었다. 한편 발효 초기의 주요 아미노산은 glutamic acid로 0%(603.87 mg/100 g), 2.5%(528.64 mg/100 g), 5%(473.98 mg/100 g), 7.5%(486.78 mg/100 g), 그리고 10% 여주된장은 465.06 mg/100 g을 함유하고 있었다. 발효 가 진행됨에 따라 glutamic acid는 더욱 증가하였고 이때 10% 여주된장이 1,676.82 mg/100 g으로 가장 높은 함량을 나타내었다. γ-Aminobutryic acid(GABA)는 여주를 첨가하 지 않은 된장을 제외하고는 모두 발효 초기보다 후에 증가 하였고 이 역시 10% 여주된장이 129.87 mg/100 g으로 가장 높은 것으로 나타났다. 한편 필수 아미노산 중에서는 leucine, phenylalanine 및 lysine이 가장 많이 존재하였고 이 또한 발효 과정 중 크게 증가하였다. 한편 10% 여주된장 의 경우 각각 586.08, 454.54, 및 465.54 mg/100 g으로 가장 많이 함유하고 있었으며 총 유리아미노산 함량 역시 8,249.25 mg/100 g으로 가장 높았다(Table 2).
Park 등(23)과 Park 등(24)은 시판된장의 경우 glutamic acid가 가장 많았으며 필수 아미노산 중에서는 leucine, lysine, valine 순이라 하여 본 연구와도 결과와도 유사하였 다. 또한 된장 종류에 따라 유리아미노산 조성은 다소 차이 가 있을 수 있지만 일반적으로 glutamic acid등이 비교적 많이 검출된다고 Park 등(25)은 보고하였고, Kim 및 Rhee(26)의 연구 결과 또한 유사한 것으로 나타났다. 이와 같은 유리아미노산 조성은 된장 제조 시 발효 미생물의 사용여부와 함께 재료 배합, 발효기간, 발효 조건 등에 따라 유리아미노산 함량이 다르게 나타날 수 있을 것으로 판단되 었다.
여주 첨가 된장 발효 중 총 phenolics 함량 변화는 Fig. 1과 같았다.
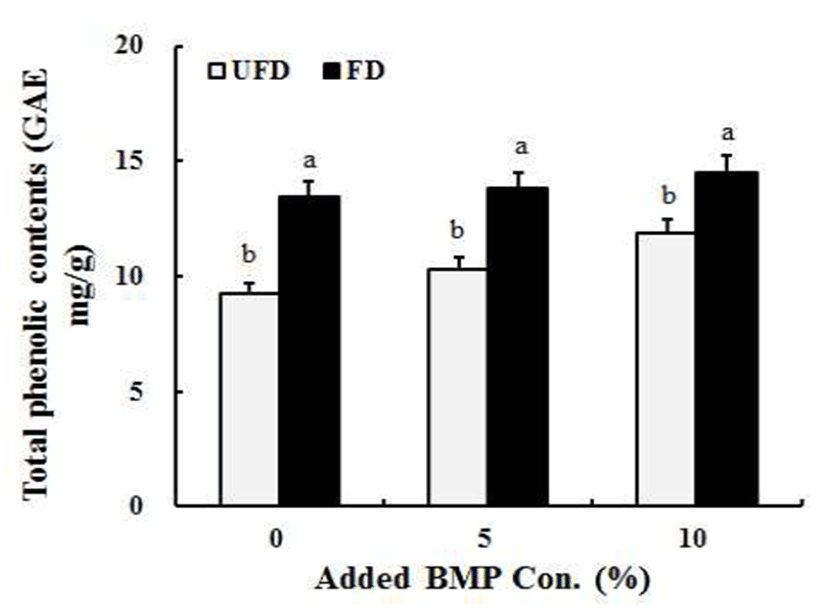
총 phenolics 함량은 숙성 초기에 여주를 10% 첨가한 된장이 가장 높았으며 여주를 첨가하지 않은 된장은 가장 낮은 함량을 나타내었다. 여주를 첨가하지 않은 된장의 경 우에는 발효 전 9.27 GAE mg/g에서 발효 후에는 13.49 GAE mg/g으로 증가하였고 5%는 10.30 GAE mg/g에서 13.62 GAE mg/g, 10%는 11.87 GAE mg/g에서 14.52 GAE mg/g의 수준으로 여주 분말의 첨가량과 된장의 발효 기간 이 증가할수록 총 phenolics 함량도 증가하였다(Fig. 1).
식물체내의 phenolics 화합물들은 2차산물로 생리활성을 나타낸다고 알려져 있으며(27), 일반적으로 된장과 청국장 (28)이나 두유와 같은 콩을 발효 시킬 때 많이 증가한다는 보고들도 있다(17). 한편 Boo 등(29)은 품종별 여주들에 대해 총 phenolics 화합물을 비교 분석하였고 한국 재래종의 경우 16.82 μg/g로 가장 많은 양을 함유한다고 하였다. 따라 서 이러한 결과를 바탕으로 본 연구의 여주 첨가 된장의 경우 역시 본래 여주가 함유하고 있는 phenolics 화합물과 된장의 발효 과정 중 발효미생물에 의해 콩으로부터 phenolics 화합물들이 증가한 것으로 판단된다. 한편 phenolics 화합물들의 높은 함량은 항산화 활성과도 상호관 계가 큰 것으로 보고되어있다(27).
여주 첨가별 된장의 이소플라본 함량 변화는 Table 3과 같다. 여주를 첨가하지 않은 된장을 제외하고 모든 된장에 서 공통적으로 3종의 배당체(daidzin, glycitin, 및 genistin)와 3종의 비배당체(daidzein, glycitein, 및 genistein)가 검출되 었다. 발효 초기 이소플라본 함량은 각각 491.09 μg/g(10%), 652.22 μg/g(5%), 및 689.32 μg/g(0%)이 검출되었고 여주 첨가량이 많을수록 발효 초기 이소플라본 함량은 적게 나타 났다. 배당체와 비배당체에 따른 함량을 살펴보면 발효가 됨에 따라 daidzin, glycitin 및 genistin의 함량은 감소하였고 여주를 첨가하지 않은 된장은 발효 60일째 배당체 형태가 모두 검출되지 않았다. 한편 이와는 반대로 비배당체 형태 인 daidzein, glycitein, 및 genistein은 발효 후에 증가하였다. 여주 무첨가 된장은 발효 60일째 daidzein(251.45 μg/g), glycitein(42.15 μg/g), 그리고 genistein(181.31 μg/g) 함량이 여주를 첨가한 된장들보다 높은 것으로 나타났다. 2.5% 첨가 된장은 daidzein은 189.30 μg/g, glycitein은 41.10 μg/g, genistein은 152.04 μg/g이 검출되었고 5% 및 10% 여주 첨가 된장은 공통적으로 된장 발효 후에 glycitein이 검출되지 않았다. 한편 발효 후 총 이소플라본 함량은 감소하였고 여주를 첨가하지 않은 된장은 발효 후 474.91 μg/g이었고 여주 10% 첨가 된장은 219.49 μg/g으로 여주 함량이 높을수 록 총 이소플라본 함량은 낮게 나타나는 일관성 있는 결과 를 나타내었다(Table 3).
된장이나 청국장 그리고 유사 콩 발효식품들은 발효과정 중에 맛뿐만 아니라 이소플라본과 같은 기능성 물질들이 변화하게 된다(30). 특히 콩은 천연 항산화제로 알려져 있으 며 대부분의 이소플라본은 glycoside 접합체로 존재한다.
배당체 이소플라본 중 일부분은 섭취 시 직접 흡수되지 만 대부분 장내 세균의 β-glucosidase에 의해 가수분해 되어 비배당체 형태인 aglycone으로 전환된다(31). McCue 및 Shettt(32)는 콩 발효 중에는 생체 이용률이 높은 daidzein, glycitein, 및 genistein으로 전환되며 이는 항산화 활성 또한 우수하다고 보고하였다. Jo 등(30)도 전통된장 숙성 중 배당 체는 감소하고 비배당체는 증가한다 하였고 이는 본 연구와 도 유사하였다. 따라서 본 연구에서는 숙성 과정 중Bacillus subtilis가 생성하는 β-glucosidase 활성에 의해 배당체는 감 소하고 비배당체는 증가한 것으로 판단된다.
여주 첨가 된장의 phenolic acids 화합물의 변화는 Table 4에 나타내었다. 모든 된장에서 gallic acid, protocatechuic acid, p-hydrobenzoic acid, chlorgenic acid, vanillic acid, veratric acid 및 t-cinnamic acid 7 종의 phenolic acids 유도체 가 검출되었고, 발효 후 veratric acid를 제외하고 모두 증가 하는 경향을 보였다. 발효 전 된장의 주요 phenolic acids 유도체는 protocatechuic acid 및 p-hydrobenzoic acid로 각각 80.3 μg/g(0%), 115.88 μg/g(5%), 135.86 μg/g(10%) 및 97.43 μg/g(0%), 75.34 μg/g(5%), 64.05 μg/g(10%) 있었고, 발효 후 증가하여 각각 163.72 μg/g(0%), 180.32 μg/g(5%), 203.04 μg/g(10%) 및 114.66 μg/g(0%), 110.13 μg/g(5%) 및 97.97 μg/g(10%) 있었다. 한편 발효 후에는 gallic acid와 chlorgenic acid가 급격히 증가하여 각각 62.63 μg/g(0%), 94.15 μ g/g(5%), 113.56 μg/g(10%) 및 127.59 μg/g(0%), 142.15 μ g/g(5%), 169.71 μg/g(10%) 있었다(Table 4).
일반적으로 phenolic acid는 벤젠 핵에 페놀성 수산화기 (OH)와 카복실기(COOH)를 가지는 화합물이며 식용 가능 한 식물에 존재하고 생리활성이 뛰어난 것으로 알려져 있다 (16,33). 콩 발효식품의 주요 phenolics 화합물로 gallic, protocatechuic, p-cumaric, caffeic, chlorogenic, gentisic, p-hydroxylbenzoic, vanillic 및 ferulic acids로 보고하였고 (34), 여주의 phenolic acid 역시 gallic, protocatechuic, p-Hydroxylbenzoic, vanillic, caffeic, chlorogenic, p-cumaric 및 ferulic acids를 보고하였다(35). 특히, Cho 등(34)은 청국 장 발효 과정 중에 GA 함량이 지속적으로 증가함으로써 DPPH 라디칼 소거활성이 증가한다고 보고하였다.
여주 첨가 된장의 항산화 활성[DPPH, ABTS, hydroxyl (⋅OH) 라디칼 소거활성 및 FRAP 환원력]을 측정한 결과 는 Fig. 2에 나타내었고, 전체적으로 항산화 활성은 여주 첨가량이 증가할수록 활성이 높았고, 발효 전보다는 발효 후가 높았다.
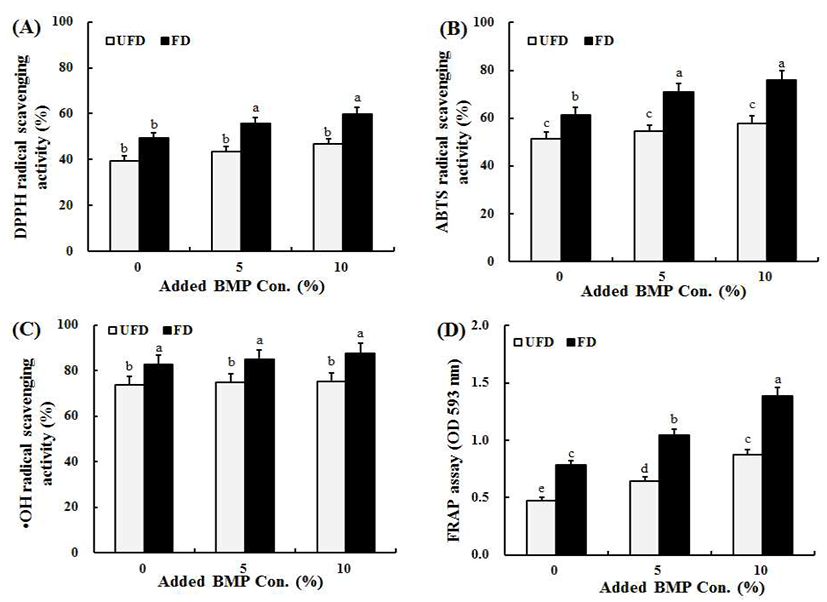
DPPH 라디칼 소거활성은 발효 후에 증가하는 경향을 보여, 여주를 첨가하지 않은 된장은 발효 전 22.56%에서 발효 후에는 37.61%로 증가하였다. 여주 첨가량이 많아질 수록 발효 전 DPPH 라디칼 소거활성은 조금씩 증가하였고 발효가 끝난 시점인 60일째 역시 증가하여 10% 여주 첨가 된장은 25%에서 64.17%로 가장 우수하였다(Fig. 2A).
ABTS 라디칼 소거활성은 동일한 농도에서 DPPH 보다 는 약 2배 이상 높은 활성을 나타내었고, 여주 첨가량에 따른 소거활성의 차이는 크게 없었다. 발효 초기부터 60일 까지의 소거활성은 0%의 경우 51.42%에서 61.31%로 증가 하였고 가장 높은 활성을 나타낸 10%의 경우에는 73.74% 에서 82.66%로 발효됨에 따라 소거활성 역시 증가함을 나 타내었다(Fig. 2B).
Hydroxyl(⋅OH) 라디칼 소거활성 또한 여주 첨가량과의 상관관계는 없는 것으로 나타났고, 발효 후에 증가하여 82.66%(0%), 84.88%(5%) 및 87.63%(10%)를 나타내었다 (Fig. 2C).
FRAP 환원력은 여주 첨가량이 증가할수록 숙성 초기 환원력도 비례하여 증가하였고 라디칼 소거활성과 유사하 게 발효 후에 환원력이 크게 증가하였다. 이때 10% 여주된 장의 경우 1.39의 가장 높은 환원력을 나타내었다(Fig. 2D).
된장의 우수한 라디칼 소거활성은 발효 과정 중에 저분 자 phenolic acid 화합물들과 비배당체 이소플라본으로의 증가가 원인인 것으로 판단되었다(36). 또한 Lee 등(37)은 증자콩에 존재하지 않았던 phenolic acid 함량이 된장 숙성 중에 증가하므로 항산화 활성이 증가한다고 보고하였고, Shon 등(38)은 청국장의 총 phenolics 함량이 0.27 mg/g일 때 DPPH 라디칼 소거활성은 87%를 나타낸다고 하였고 이는 phenolics 함량과 항산화 활성과의 관계가 밀접한 것으 로 판단된다. Cho 등(34) 역시 총 phenolics 함량이 증가함에 따라 항산화 활성도 증가함을 보고하였고 이는 본 연구 결과와도 경향이 유사하였다. 따라서 발효 미생물에 의해 생성된 phenolics 물질들과 비배당체 이소플라본 형태가 같이 공존할 경우 라디칼 소거활성과 FRAP 환원력이 상승 효과를 나타내는 것으로 판단된다.
α-Glucosidase 저해제는 식후 고혈당을 완화 시킬 수 있는 잠재적 능력을 보유하고 있다(39). 당뇨는 고혈당으로 인해 신장과 심혈관계 질환에 큰 손상을 준다는 점이 큰 특징이 다(40). 현재 당뇨의 지속적인 관리를 위하여 주로 α -glucosidase 및 α-amylase 저해제를 경구 투여하여 사용하 고 있으며 이들은 소장의 α-glucosidase를 경쟁적 저해를 하여 당 흡수율을 감소시키고 대부분 반응물질인 pNPG를 사용하여 평가한다고 보고되어있다(38).
따라서 본 연구의 α-glucosidase 저해활성을 측정한 결과 는 Fig. 3과 같았다. 전체적인 결과로는 DPPH 라디칼 소거 활성과 일관성 있는 결과를 나타내었다. 즉, 여주 첨가량이 많을수록 각각의 된장 발효 초기 저해율이 증가하는 것으로 나타났으며 발효 후에는 효소 저해활성도 전체적으로 증가 하는 것으로 나타났다. 여주를 첨가하지 않은 된장의 발효 초기 저해율은 0.86%로 거의 없는 것으로 나타났으나 발효 후에는 23.64%로 약간 증가하였다. 5%의 경우에는 27.74% 를 나타내었으며 10% 여주된장은 30.79%로 가장 우수한 저해율을 나타내었다(Fig. 3).
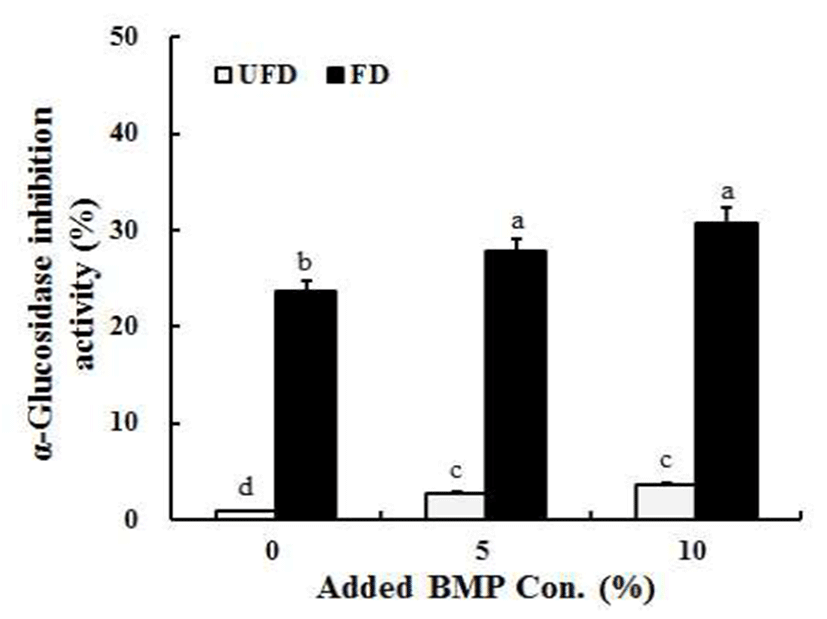
한편 Hwang 등(41)의 결과에 따르면 전통 된장 메탄올 추출물에서 33.5-44.3%의 저해율을 나타내었다고 하였고, Shukla 등(40) 역시 상업식 된장(20.66-25.55%)보다 전통 된장(26.50-36.86%)의 α-glucosidase 저해율이 우수하다고 보고하였다. 이러한 결과는 본 연구와도 유사한 것으로 판 단된다. 또한 이러한 콩 외에도 고구마에 함유된 phenolics 화합물들도 α-glucosidase 저해활성을 가진다는 연구 결과 도 있다(42). 따라서 본 연구의 여주 첨가 된장은 고혈당 개선뿐만 아니라 비만과 당뇨와 같은 질병을 치료 및 관리 하는데 효과가 있을 것으로 기대된다.
요 약
본 연구는 여주 분말 첨가 된장의 발효 중 이화학적 특성, phytochemical 화합물(isoflavones과 phenolic acids) 및 생리 활성 활성 변화를 측정하였다. 된장 발효 중 pH는 6.41-5.83 에서 5.81-5.24로 감소하였고, 반면에 산도는 0.42-0.65%에 서 1.28-1.48%로 증가하였다. 고초균과 효모 생균수, 염도 및 총 아미노산 함량은 발효 종기(60 일)에 증가하였다. 특히, 발효 후 10% 여주 분말 첨가 된장은 가바(GABA, 129.87 mg/100 g) 함량이 다른 된장 시료들과 비교하여 가 장 함량이 높았다. 발효 후 된장은 발효 전 된장 시료보다 생리활성이 높았다. 발효 후 phytochemicals 화합물 중 isoflavone-aglycones과 phenolic acids는 증가하였고, 반면 에 isoflavone-glycosides는 감소하였다. 게다가, 발효 후에 총 phenolics, isoflavone-aglycones과 phenolic acids 함량은 급격히 증가하였고, 이에 따라 항산화 활성과 α-glucosidase 저해활성이 증가하였다. 이들 결과로부터 여주 분말 첨가 로 항산화와 항당뇨 활성이 개선된 새로운 타입의 된장 제조가 가능할 것으로 판단되었다.










