서 론
느릅나무 (Ulmus sp.)는 장미목 느릅나무과에 속하며, 한국, 일본, 중국 등지에 분포하는 것으로 알려져 있다(1). 국내 자생하는 대표적인 느릅나무로는 당느릅나무(U. davidiana), 참느릅나무(U. parvifolia), 비술나무(U. pumila), 왕느릅나무(U. macrocarpa) 등이 있다(2). 느릅나무 껍질은 유백피라고 불리며, 항산화, 항균, 항암, 주름개선 등의 생 리활성이 연구되어 있다(3,4). 느릅나무 뿌리 껍질은 유근 피라고 불리며, 염증, 항부종, 항균 작용 등의 생리활성이 보고되었다(5). 한편, 왕느릅나무 수피에서 분리된 (+)- catechin, (-)-epicatechin, (+)-catechin 7-O-β-D-glycopyranoside, procyanidin B-1 등은 높은 항산화 활성을 나타낸다고 보고 되었으며(6), 당느릅나무에서 분리된 sesquiterpene인 torilin, 1-hydroxytorilin, 1-hydroxytorilin A는 항염증 활성을 보인 다(7). 또한, 느릅나무 속인U. wallichiana의 수피에서 분리 된다당류인naringenin-6-C-β-D-glucopyranoside, tetrahydroxydihydroflavonol- 6-C-β-D-glucopyranoside, trihydroxydihydroflavonol- 6-C-β-D-glucopyranoside는 조골세포의 분화를 유 도한다고 보고되었다(8).
활성산소종이라 불리는 ROS(reactive oxygen species)는 superoxide anion, hydrogen peroxide, hydroxyl radical 등이 있으며, 세포의 정상적인 대사과정 중에도 생성되지만, 인 체의 산화적 스트레스에 의해 발생되기도 한다(9). 또한, 과발현된 ROS는 생체내의 단백질, DNA 등을 손상시켜, 암, 당뇨, 동맥경화 등의 질병을 유발하는 것으로 알려져 있다(10). 이러한 이유로 식품 산업에서는 유해한 ROS를 제거하기 위하여 합성 항산화제인 butylated hydroxy toluene(BHT), butylated hydroxy anisole(BHA), propyl gallate(PG) 등을 꾸준히 사용하고 있으나, 이들 합성 항산화 제는 동물모델에서 많은 부작용을 일으킨다고 보고되었다 (11). 따라서 이러한 합성 항산화제보다 더 안전하고, 효과 적인 항산화 활성을 찾고자 하는 연구가 식품 산업 분야에 서 꾸준히 진행되고 있다.
최근 생활수준의 향상과 건강 추구의 식생활 문화로 인 하여 심신의 안정 및 건강에 도움을 주는 기능성 음료에 대한 관심이 높아지고 있다(12). 그 중에서 식물 유래 기능 성 음료는 고유의 phytochemical을 함유하고 있기 때문에 다양한 생리활성, 약리효능 등을 나타내고 있으며, 이러한 이유로 식물소재 및 약용 소재를 이용한 추출음료 및 침출 차의 연구가 활발하게 진행되고 있다(13,14). 특히, 최근에 는 한방소재인 엄나무, 오가피, 생강나무, 뽕나무 등을 이용 한 기능성 음료의 연구가 활발하게 진행되고 있으나 (15-18), 전통적인 한방소재인 유백피를 이용한 기능성 음 료에 관한 연구는 현재까지 진행되지 않았다.
따라서, 본 연구에서는 유백피를 기능성 음료로 사용하 고자, 온도 및 시간에 따른 유백피 수용성 추출물을 제조하 였으며, 추출된 유백피 수용성 추출물의 항산화 활성 및 이화학적 특성을 연구하였다. 또한, 유백피 수용성 추출물 의 항산화 활성에 영향을 미치는 주요 성분인 total phenolic 과 tannin 함량을 분석하고, 항산화 활성을 갖는 유백피 음 료를 제조하여 관능평가를 실시하였다.
재료 및 방법
2,2-Diphenyl-1-picrylhydrazyl(DPPH), 2,2′-azino-bis(3-ethylbenzothiazoline- 6-sulfonic acid)(ABTS), potassium persulfate, potassium ferricyanide, trichloroacetic acid, Iron(Ⅲ) chloride, hydrogen peroxide, peroxidase, Folin-Ciocalteu's phenol reagent, gallic acid, sodium carbonate, ascorbic acid(vitamin C) 등은 Sigma-Aldrich Co.(St. Louis, MO, USA)로부터 구입 하였으며, 그 외, 실험에 사용한 시약은 분석용으로 Sigma (Sigma-Aldrich Co.)로부터 구입하여 사용하였다.
본 연구에 사용한 유백피(bark of Ulmus pumila)는 강원도 정선에 소재한 정선약초백화점에서 구입 후 분쇄기 (HMF-3260S, Hanil Electric, Seoul, Korea)를 이용하여 20 mesh 이하로 분쇄 후 상온에서 보관하였다. 유백피 음료 제조 방법은 1 g의 유백피 시료에 100 mL의 4℃, room temperature(RT), 80℃의 증류수를 첨가하여, 실온에서 1분 및 5분간 교반 없이 정치, 침출 추출하였다. 각각의 추출물 은 filter paper(Whatman No. 3, Whatman, Maidstone, UK)로 여과한 후, 동결건조(Ilshin biobase Co., Ltd., Yangju, Korea) 하였으며, 각 추출물의 수율은 건조중량을 기준으로 환산 하여 계산하였다.
유백피 수용성 추출물의 pH는 액체형태의 유백피 수용 성 추출물(1% 추출물, w/v)과 Orion Star A211 pH meter (Thermo Fisher Scientific Company, Waltham, MA, USA)를 이용하여 측정하였으며, 색도는 색차계(Ultrascan VIS, Hunter lab, Reston, VA, USA)를 이용하여 3회 반복 측정하 였다. 색차계 측정 전 표준백판으로 보정한 후 사용하였으 며, L(lightness), a(redness), b(yellowness) 값으로 나타내었다.
DPPH(2,2-Diphenyl-1-picrylhydrazyl) 라디칼 소거능은 Cho 등(9)의 방법을 이용하여 측정하였다. 70% ethanol을 사용하여 용해시킨 시료 0.1 mL와 0.4 mM DPPH 용액 0.1 mL를 혼합한 뒤, 30분 동안 암소에서 반응하였다. Microplate reader(Molecular Devices, Sunnyvale, CA, USA) 의 515 nm에서 흡광도 값을 측정하였으며, DPPH 라디칼 소거능은 다음의 식을 이용하여 계산하였다.
ABTS(2,2′-azino-bis(3-ethyl- benzothiazoline-6-sulfonic acid) 라디칼 소거능은 Re 등(19)의 방법으로 측정하였다. 7 mM ABTS 용액과 2.45 mM potassium persulfate를 혼합하 여 빛을 차단한 상태로 12~16시간 동안 상온에서 반응시켜 ABTS 양이온을 형성시킨 후, 734 nm에서 흡광도 값이 0.70±0.02가 되도록 무수에탄올을 이용하여 조절하였다. 시료 50 μL와 150 μL의 희석된 ABTS 용액을 첨가하고 20분 동안 상온에서 반응시켜 microplate reader의 734 nm에 서 흡광도를 측정하였다. ABTS 라디칼 소거능은 아래의 식을 이용하여 계산하였다.
NO 라디칼 소거능은 Cho 등(20)의 방법을 응용하여 실험 하였다. 다양한 농도로 희석한 시료 0.5 mL와 1 mM sodium nitrite 용액 0.5 mL를 첨가 후, 0.1 N HCl을 이용하여 반응액 의 pH를 1.2로 보정한 다음 증류수를 가하여 최종부피를 5 mL로 하여 premix를 제조하였다. Premix를 37℃에서 1시 간 동안 반응시킨 후, 1 mL씩 취하여, 2% acetic acid 5 mL와 Griess 시약(A:B=1:1 A, 1% sulfanilic acid in 30% acetic acid; B, 1% naphthylamine in 30% acetic acid) 0.4 mL를 첨가하여 실온에서 15분간 반응시켰다. 반응이 완료 된 시료는 microplate를 이용하여 520 nm에서 흡광도를 측 정하고, 아래의 식을 이용하여 NO 라디칼 소거능을 계산하 였다.
Hydrogen peroxide 소거능은 Heo 등(21)의 방법을 응용 하여 측정하였다. 시료 30 μL, 0.1 M sodium phosphate buffer (pH 7.4) 100 μL, 2 mM hydrogen peroxide 15 μL 를 혼합 후, 35℃에서 5분간 반응하고, 1.25 mM ABTS 25 μL, peroxidase(1 U/mL) 25 μL를 첨가하였다. 최종 hydrogen peroxide 소거능은 microplate reader 410 nm에서 흡광도를 측정 후, 아래의 식을 이용하여 계산하였다.
Reducing power는 Cho 등(9)의 방법을 응용하여 측정하 였다. 시료 0.5 mL, 0.2 M sodium phosphate buffer 0.5 mL, 1% potassium ferricyanide 0.5 mL를 혼합하여 50℃에서 20 분간 반응시킨 후, 10% trichloroacetic acid 0.5 mL를 넣어주 고 12,000 rpm에서 10분 동안 원심분리 하였다. 원심분리 후, 1.0 mL 상등액과 0.1% Iron(Ⅲ) chloride 0.2 mL를 첨가하 여 상온에서 10분간 반응하고 microplate reader 700 nm에서 흡광도를 측정하였다. Reducing power의 환원력은 vitamin C 100 μg/mL 농도의 환원력을 100%로 계산하였다.
다양한 조건에서 추출된 유백피 추출물의 total phenolic 함량은 Kahkonen 등(22)의 방법에 따라 측정하였으며, Folin-Ciocalteu을 이용하였다. 각 시료 500 μL 에 1.0 M Folin-Ciocalteu's reagent 250 μL, 12.5%(w/v) sodium carbonate 용액 1.25 mL를 혼합하여 실온의 암소에서 40분간 방치 후, microplate reader 750 nm에서 흡광도를 측정하였다. Total phenolic 함량의 측정은 gallic acid를 표준물질로 이용 하였으며, 시료에 함유된 total phenolic 함량은 mg GAE/g sample로 나타내었다.
Total tannin content는 Gunaratne 등(23)의 방법을 응용하 여 측정하였다. 시료 400 μL와 sulfuric acid/methanol(3:7, v/v) 용액 1 mL, 1%(w/v) vanillin 용액 1 mL를 혼합하여 30°C에서 15분간 반응 후, microplate reader 500 nm에서 흡광도를 측정하였다. 총 tannin content는 catechin을 지표 성분으로 이용하였으며, 시료에 함유된 tannin content는 mg CE/g sample로 나타내었다.
관능평가는 대학생 남녀 27명을 대상으로 본 실험의 목 적과 평가방법 및 측정 항목에 대해 잘 인지하도록 충분히 설명한 후 진행되었다. 관능평가를 한 시료는 총 3가지이며, 유백피 음료를 제조하기 위하여 멸균한 유백피 시료 1.0 g을 티백제조용 그물망에 넣어 끝을 봉한 다음 냉수(4℃), RT, 끓인 생수(95±2℃) 100 mL에 넣고 정확히 5분 후 건져 내어 종이컵에 50 mL씩 대상자에게 주어졌다. 하나의 시료 를 평가한 후에는 제공된 생수로 입안을 헹구도록 하였으 며, 측정시간은 오전 10~11시 사이에 실시하였다. 평가항목 으로는 쓴맛, 단맛과 같은 맛에 관련된 항목과 색, 향 등 전반적인 기호도에 대하여 관능평가 하였다. 유백피 음료 의 관능평가는 5점 평점법을 이용하여 평가하였는데, 각 항목에서 상용화 된 현미 녹차(Dongsuh Foods Co., Seoul, Korea) 1 g을 끓인 생수 100 mL에 1분간 침출한 것을 2.5점 기준으로 하여, 특성의 강도가 약할수록 1점, 특성의 강도 가 강할수록 5점을 주었다.
결과 및 고찰
추출온도와 시간을 달리하여 추출한 유백피 수용성 추출 물의 수율 및 pH는 Table 1에 나타내었다. 다양한 유백피 수용성 추출물의 수율은 전체적으로 15.10~16.27%를 보였 으며, 각 온도별 및 시간에 따른 추출 수율의 차이는 거의 보이지 않았다. 이러한 결과는 Kim 등(1)이 보고한 유근피 수용성 추출물의 추출 수율 26.3~27.5% 보다 낮게 나타났 으며, Cho 등(24)이 보고한 유백피 30% 에탄올 추출물의 추출 수율인 9.89~10.54% 보다는 높게 나타났다. 이러한 결과는 유근피(느릅나무 뿌리 껍질)와 유백피(느릅나무 껍 질)의 차이에 의한 것 일수도 있지만, 두릅 순 및 두릅 잎의 추출과 같이 에탄올 추출물 보다는 수용성 추출물에서 더 높은 추출 수율을 나타내는 것으로 보인다(25). 유백피 수용 성 추출물의 pH는 5.77~5.94를 보였으며, 유백피 수용성 추출물의 추출 온도 및 추출 시간에 따른 pH의 차이는 크게 보이지 않았다. 한편, 유백피 수용성 추출물의 색도는 Table2에 나타내었다. 밝기를 나타내는 L 값이 49.81~55.36 으로 나타났으며, 4℃, 1분 추출물이 49.81로 가장 낮은 L 값을 보였고, 80℃, 1분 추출물이 55.36으로 가장 높은 L 값을 보였다. 적색도를 나타내는 a 값은 전체적으로 (-) 값을 나타내었으며, 시료의 추출조건에 따른 차이는 크게 보이 지 않았다. 하지만, 황색도를 나타내는 b 값의 경우, 추출조 건 및 추출시간에 따라 큰 차이를 보였는데, 4℃, 1분 추출물 에서 가장 낮은 2.93의 b 값을 보였으며, 80℃, 5분 추출물에 서 13.59로 가장 높은 b 값을 보였다. 이러한 연구결과는 차 제품을 제조할 때 가열할수록 황색도가 증가한다는 것을 나타내는데, Jeong 등(14)이 연구한 배암차즈기 차 제조의 연구결과와 일치하며, Park 등(26)이 연구한 녹차 제조의 연구결과와도 일치한다.
DPPH 라디칼 소거능은 자유 radical을 가지고 있는 보라 색의 화합물로서 항산화 활성을 갖는 성분에 의해 환원되면 보라색에서 탈색이 되어 가는 원리를 이용한 것이다(27). 전체적인 유백피 수용성 추출물의 DPPH 라디칼 소거능은 100 μg/mL의 농도로 처리하여 Fig. 1에 나타내었다. 각 온도 에 따른 유백피 수용성 추출물을 살펴보면, 80℃ 열수 추출 물의 DPPH 라디칼 소거능이 가장 우수하였고 4℃, RT 추출 물도 높은 DPPH 라디칼 소거능을 나타내었다. 1분 및 5분 의 시간에 따른 DPPH 라디칼 소거능의 차이는 크게 나타나 지 않았다. 한편, 비교대조군으로 사용한 ascorbic acid(100 μg/mL, 94.8%)의 DPPH 라디칼 소거능은 유백피 수용성 추출물보다(88.9~92.2%) 높게 나타났다. 이러한 연구결과 는 유백피 수용성 추출물을 열처리 하였을 때 DPPH 라디칼 소거능이 증가하는 것을 의미하는 것으로, Heo 등(28)이 보고한 참당귀 추출물에서 80℃ 열수 추출물이 RT 추출물 보다 높은 DPPH 라디칼 소거능을 보인다는 결과와 일치 한다.
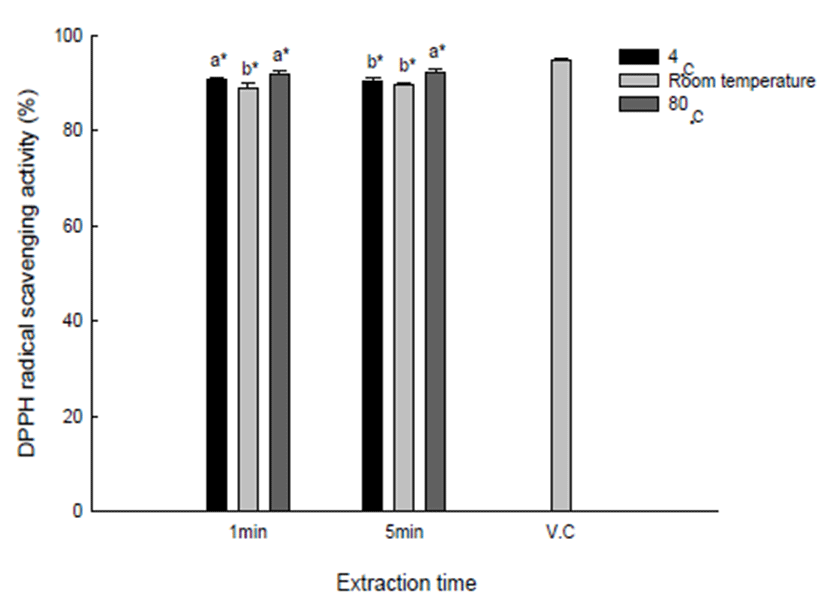
ABTS 라디칼 소거능의 측정원리는 청녹색의 양이온 ABTS 라디칼을 소거하는 능력을 측정하는 방법으로, 지용 성 및 수용성의 항산화 성분 모두 사용이 가능하다(29). Fig. 2에서는 유백피 수용성 추출물의 ABTS 라디칼 소거능 을 나타내었다. 유백피 수용성 추출물의 ABTS 라디칼 소거 능은 100 μg/mL의 농도로 처리하여 나타내었다. 각 온도별 및 시간별 유백피 수용성 추출물의 ABTS 라디칼 소거능은 크게 차이를 보이지 않았다. 유백피 수용성 추출물의 ABTS 라디칼 소거능을 비교대조군으로 사용한 vitamin C와 비교 하면 100 μg/mL 농도에서 vitamin C는 약 94%의 ABTS 라디칼 소거능을 보였으나, 유백피 수용성 추출물은 89.9~91.5%로 vitamin C보다 낮은 ABTS 라디칼 소거능을 보였다.
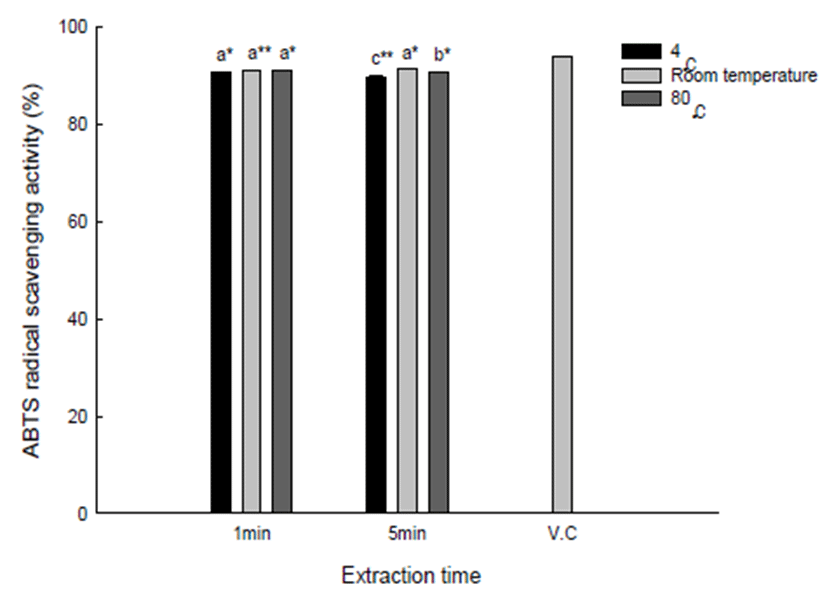
NO는 일반적으로 면역관련 시스템과 높은 연관성을 갖 지만, O2-와 반응하면 독성이 강한 산화제인 peroxynitrite (ONOO-)를 생성하게 된다. 이렇게 생성된 peroxynitrite는 인체내에서 강력한 산화제의 역할을 하게 되어 다양한 질병 의 원인이 되는 것으로 알려져 있다(30). 따라서, 본 연구에 서는 유백피 수용성 추출물의 항산화 활성 측정 방법으로 NO 라디칼 소거능을 측정하였으며, 그 결과는 Fig. 3에 보여준다. 4℃ 유백피 수용성 1분 추출물은 400 μg/mL 농도 에서 약 47%의 NO 라디칼 소거능을 보였는데, RT 및 80℃ 유백피 수용성 1분 추출물은 각각 58, 56%로 4℃ 유백피 수용성 추출물보다 높게 나타났다. 그러나, 추출시간 1분 및 5분에 따른 유백피 수용성 추출물의 NO 라디칼 소거능 차이가 있었지만 추출 온도에 비하여 크지 않았다. 한편, 비교대조군으로 사용한 vitamin C는 400 μg/mL 농도에서 약 17%의 NO 라디칼 소거능을 보이면서 본 연구에서 사용 한 유백피 수용성 추출물보다 낮은 NO 라디칼 소거능을 보였다. 본 연구에서 수행된 NO 라디칼 소거능을 다른 연구 결과들과 비교하면, Jee(31)는 상백피 열수 추출물 500 μ g/mL 농도에서 43.5%의 NO 라디칼 소거능을 보인다고 보고하였는데, 이는 유백피 수용성 추출물과 유사한 결과 를 보였다. 하지만, 유백피 수용성 추출물의 NO 라디칼 소거능은 Jang 등(32)이 보고한 리기다소나무 수피 열수 추출물(50 μg/mL, 46.6%) 보다는 낮게 나타났다.
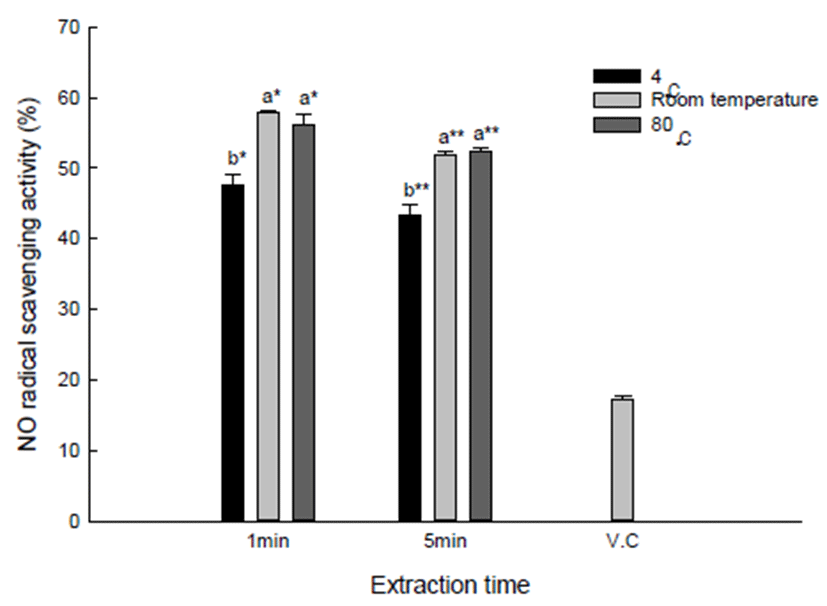
H2O2는 세포 내에서 금속이온(Cu2+, Fe2+등)과 반응하면 hydroxyl radical(OH)로 전환되는데, 이러한 과정에서 산화 적 스트레스를 유발한다(33). 유백피 수용성 추출물의 H2O2 라디칼 소거능은 200 μg/mL의 농도를 처리하여 Fig. 4에 나타내었다. 각 조건별 유백피 추출물을 살펴보면, 4℃, 1분 유백피 추출물에서 88.6%로 가장 높은 H2O2 라디칼 소거능 을 보였으며, 80℃, 5분 유백피 수용성 추출물에서 74.8%로 가장 낮은 H2O2 라디칼 소거능을 보였다. 하지만, 1분과 5분 추출물에 따른 H2O2 라디칼 소거능 차이는 크게 나타나 지 않았다. 이러한 결과는 Cha와 Cho(34)가 보고한 꾸지뽕 추출물에서 30℃ 추출물이 60℃ 추출물보다 높은 항산화 활성을 나타낸다는 결과와 유사하게, 낮은 온도에서 더 높 은 H2O2 라디칼 소거능을 보였다. 하지만, DPPH 및 NO 라디칼 소거능에서는 80℃로 추출한 유백피 수용성 추출물 에서 높은 라디칼 소거능을 보였는데, H2O2 라디칼 소거능 에서는 4℃ 유백피 수용성 추출물에서 가장 높은 활성을 나타내었다. 이러한 이유는 항산화 활성은 다양한 메커니 즘에 의해 나타내는데(20), 각 실험 방법에 따라 항산화 활성의 차이가 조금씩 나는 것으로 예상된다.
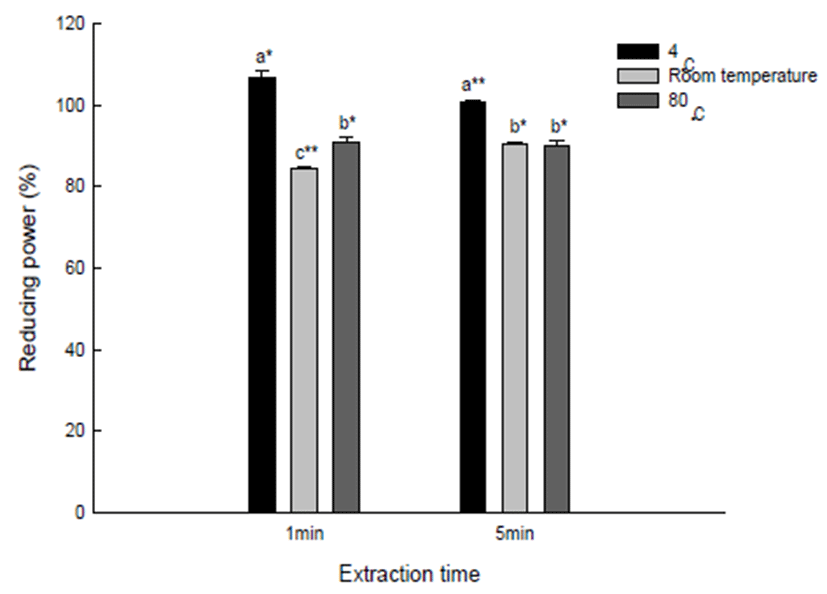
Reducing power는 ferric-ferricyanide(Fe3+)가 ferrous(Fe2+) 로 환원되는 능력을 측정하는 방법으로, 시료내에 존재하 는 reductone의 양을 측정한다(24). 유백피 수용성 추출물의 reducing power는 200 μg/mL의 농도를 처리하여 Fig. 5에 나타내었다. 4℃, 1분 추출물이 가장 높은 106.66%의 환원 력을 보였고, 80℃ 5분 추출물은 90.16%로 4℃ 유백피 수용 성 추출물보다 낮은 환원력을 보였다. 각 시간별 유백피 수용성 추출물의 환원력은 추출시간에 따른 차이를 보이기 는 했지만 크게 나타나지 않았다. 또한, reducing power 역시 H2O2 라디칼 소거능과 같이 온도가 높아질수록 환원력이 감소하였는데, 이러한 현상 역시 항산화 활성 측정 방법에 따른 차이일 것이라 예상된다.
식물에 함유되어 있는 phytochemical 성분들은 높은 항산 화 활성을 보이기 때문에 일반적으로 항산화 활성의 지표 성분으로 분석된다(24). 따라서, 본 연구에서도 유백피 수 용성 추출물의 항산화 성분들을 분석하기 위하여 total phenolic과 total tannin 함량을 측정하였다. 유백피 수용성 추출에 함유되어 있는 total phenolic 함량은 1분 추출물의 경우 4℃ 수용성 추출물이 462.78 mg GAE/g sample, RT 수용성 추출물이 506.11 mg GAE/g sample, 80℃수용성 추 출물이 512.44 mg GAE/g sample로 온도가 높아질수록 total phenolic 함량이 증가하였다(Table 3). 하지만, 5분 추출물의 경우 541.33~544.83 mg GAE/g sample로 온도에 따른 total phenolic의 함량차이는 크게 보이지 않았다. 한편, 총 탄닌 함량은 total phenolic 함량과 반대의 경향을 보였는데, 유백 피 수용성 1분 추출물은 4℃ 추출물이 96.57 mg CE/g sample, RT 추출물이 96.38 mg CE/g sample, 80℃ 추출물이 83.43 mg CE/g sample로 온도가 높아질수록 총 탄닌 함량이 감소하였다(Table 3). 또한, 5분 추출물 역시 온도가 높아질 수록 총 탄닌 함량은 91.62 mg CE/g sample에서 83.62 mg CE/g sample로 감소하였다. Total phenolic 함량과 총 탄닌 함량을 항산화 활성과 함께 분석하여 보면, DPPH 및 NO 라디칼 소거능의 경우 유백피 수용성 추출물의 추출 온도가 증가할수록 항산화 활성이 증가하였기 때문에 total phenolic 함량과 높은 연관성을 가지며, H2O2 라디칼 소거능 및 reducing power는 추출온도가 높아질수록 항산화 활성이 감소하였기 때문에 총 탄닌 함량과 높은 연관성을 가질 것으로 예상된다. 하지만, 본 연구에서는 4℃, RT, 80℃의 추출온도와 1분 및 5분의 제한적인 추출조건만을 설정 하였기 때문에 정확한 항산화 활성과 성분과의 연관성을 정확하게 분석하기는 어려울 것으로 사료된다. 따라서, 유 백피 수용성 추출물의 항산화 활성과 성분과의 정확한 연관 성을 분석하기 위해서는 추출온도 및 추출시간을 다양하게 설정하고, 항산화 성분을 분리 정제 후, 단일물질의 항산화 활성을 분석하기 위한 연구가 필요할 것으로 사료된다. 다 만 5분 이내의 짧은 침출 과정만으로도 항산화 활성이 높은 추출물을 제조 할 수 있었기에, 본 연구를 바탕으로 유백피 를 활용한 차 제품을 개발할 수 있을 것이라고 기대된다.
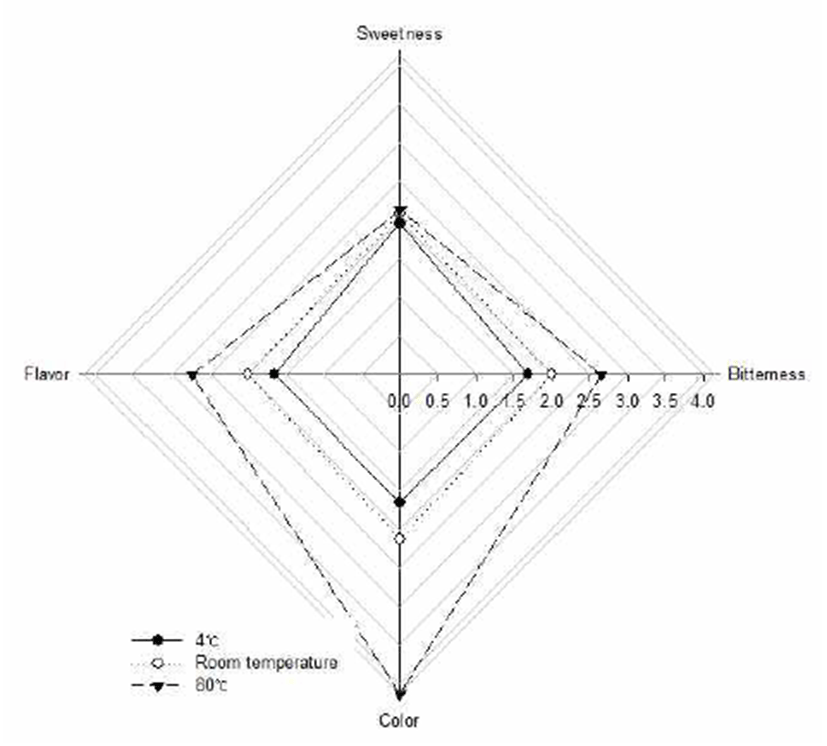
본 연구 결과를 차 제품 개발에 활용하기 위하여, 침출온 도를 달리한 유백피 수용성 추출물의 관능적 특성을 분석하 였고, 평가한 결과는 Fig. 6에 나타내었다. 4℃ 추출물과 RT 추출물 간의 유의적인 차이는 보이지 않았으나 모든 항목에서 추출 온도가 올라갈수록 높은 점수를 보였다. 8 0℃ 열수 추출물의 경우 쓴맛(2.7점), 향(2.7점), 색(4.1점)의 3가지 항목에서 유의적으로 가장 높은 점수를 보였고, 침출 온도에 따라 유의적인 차이는 없었지만 단맛 또한 80℃ 열수 추출물의 경우 가장 높은 점수를 보였다. 또한, 전반적 인 기호도를 조사한 결과 80℃ 열수 추출물이 74%로 가장 높았고, RT 추출물이 26%, 4℃ 추출물이 0%로 가장 낮았다. 관능적 특성 결과를 종합하여 볼 때 80℃유백피 열수 추출 물이 가장 우수한 경향을 보였다. 이 결과로부터 유백피 음료는 80℃ 열수 추출을 하였을 때가 향후 제품개발에도 바람직할 것으로 사료된다.
요 약
본 연구는 유백피를 기능성 음료로 사용하고자 유백피를 다양한 온도(4, RT, 80℃)및 시간(1, 5분)으로 수용성 추출물 을 제조하였으며, 추출된 유백피 수용성 추출물의 항산화 활성 및 total phenolic 및 tannin 함량을 분석하고, 유백피 음료의 관능평가를 실시하였다. 그 결과, 유백피 수용성 추출물의 pH는 추출온도 및 추출시간에 따라 크게 변하지 않았으나, 황색도를 나타내는 b 값의 경우 80℃ 5분 추출물 에서 가장 높게 나타났다. 한편, 다양한 유백피 추출물의 항산화 활성에서 DPPH 라디칼 소거능은 온도가 높아질수 록 항산화 활성이 증가하였으나, H2O2 라디칼 소거능 및 환원력은 4℃ 1분 추출물에서 가장 높게 나타났다. 이들 유백피 추출물에 함유된 total phenolic의 함량은 유백피 80℃수용성 추출물에서 가장 높았으며, total tannin content 는 4℃ 1분 추출물에서 가장 높게 나타났다. 또한, 각 온도에 서 5분간 추출한 유백피 음료를 관능평가한 결과 80℃ 열수 추출물의 기호도가 가장 높게 나타났다. 따라서, 본연구의 결과에 의하면 유백피 추출물은 phenolic 및 tannin compound 등을 다량 함유하고 있으며, 높은 항산화 능력을 나타내기 때문에 기능성 음료로의 개발 가능성이 충분할 것으로 생각된다.










