서 론
과도한 산화적 스트레스에 노출로 인한 현대인들은 각종 퇴행성 질환 및 습관성 질병에 건강과 일상생활을 위협 받고 있다. 과도하게 생성된 superoxide(O2-), nitric oxide (NO), nitrogen dioxide(NO2), hydroxyl(OH), peroxynitrite (NO3⁻) 등과 같은 활성산소종(reactive oxygen species, ROS) 은 세포구성성분인 지질, 단백질, 당, DNA 등에 비 선택적, 비가역적 파괴를 촉진하게 된다(1,2). 이러한 산화 적 스트 레스는 노화를 촉진시키고 암, 뇌질환, 심혈관계 질환, 피부 질환 등의 각종 질병의 원인이 된다(3,4). 생체내의 ROS나 자유라디칼을 제거하여 노화방지, 성인병 예방 등의 기능 을 하는 성분을 항산화 물질이라고 하며, butylated hydroxy anisol(BHA), butylated hydroxy toluene(BHT) 등의 합성 항 산화제가 개발되어 사용되었으나(5,6), 이들 합성항산화제 는 암, 지질대사 불균형 등의 부작용에 의하여 사용이 제한 되고 있는 실정이다(7).
현대인들은 생활수준의 향상으로 인한 식습관의 변화로 대사성 질환 중의 하나인 당뇨병이 증가하고 있으며, 향후 전 세계 당뇨인구의 급격한 증가와 발병연령도 점차 낮아져 더 많은 인구가 당뇨병으로 인해 고통 받을 것으로 예측된 다(8). 당뇨병 중, 제 1형은 췌장 베타세포의 병변에 따른 인슐린 결핍으로 인한 인슐린 의존성 당뇨, 제 2형은 인슐린 저항성으로 인한 인슐린 비의존성 당뇨로 정의된다(9,10). 또한 산화적 스트레스는 췌장 베타세포의 손상과 인슐린 분비감소를 유발하여 항산화 성분은 당뇨병과 밀접하게 관련되어 있는 것이 알려져 있다(11). 한편, α-glucosidase는 소장점막에 존재하는 당분해 효소로서 이를 저해하면 탄수 화물의 소화를 방해하여 소장에서의 흡수가 지연되므로 식후 급격한 혈당상승을 막아준다(12). 천연물로부터 α -glucosidase 저해제의 분리 및 동정에 관한 다수의 연구가 수행되었으며(13), 특히 뽕나무의 플라보노이드인 mortatarins D는 α-glucosidase의 우수한 저해제로 주목을 받고 있다 (14). 시판되는 α-glucosidase 저해제로는 acarbose 및 voglibose 가 있으나 이들을 장기 복용할 경우 각종 부작용(15,16)으로 인하여 보다 안전하며 효능이 우수한 천연 기능성 소재의 탐색이 필요한 실정이다.
삼나물(Aruncus dioicus var. kamtschaticus)은 장미과 (Rosaceae)의 다년초로서 어린순은 식용가능하며 울릉도에 서 자생하는 산채로서 전국 각처의 고산지역에 자생하고 맛과 식감이 독특하여 고급 산채로 생산량이 확대되고 있다 (17). 삼나물의 지상부는 항산화(18), 항암(18), 항균(19), 항염증(20) 및 항 혈전(21) 등의 효능을 나타내며, 소수의 monoterpene류 및 flavoniod류(18) 등의 성분이 보고되어져 있다. 본 연구에서는 삼나물 뿌리의 80% 메탄올 추출물 및 각 분획물에 대하여 항산화 및 항 당뇨 활성 평가를 위하여 DPPH, ABTS+ 라디칼 소거능 및 α-glucosidase 저해 활성을 평가 하여 우수한 활성을 확인하였으므로 이들 결과 를 보고하고자 한다.
재료 및 방법
본 실험에 시료로 사용한 삼나물 뿌리(Aruncus dioicus var. kamtschaticus)는 충남 청양군 운곡면에서 재배되어 2016년도 3월에 채취한 신선한 삼나물 뿌리를 사용하였다. 표본시료는 대구대학교의 식품공학과 천연물화학 실험실 에 보관하고 있다. 본 실험에서 사용된 gallic acid, 2,2'- azinobis-3-ethylbenzothiazoline-6-sulfonic acid(ABTS+), 1,1- diphenyl-2-picrylhydrazyl(DPPH), Saccharomyces cerevisiae 유래의 α-glucosidase, (+)-catechin 및 acarbose은 Sigma- Aldrich chemical Co.(St. Louis, MO, USA) 구입하여 사용하 였고, 그 외에 사용된 용매 및 시약은 모두 일급 이상의 등급을 사용하였다.
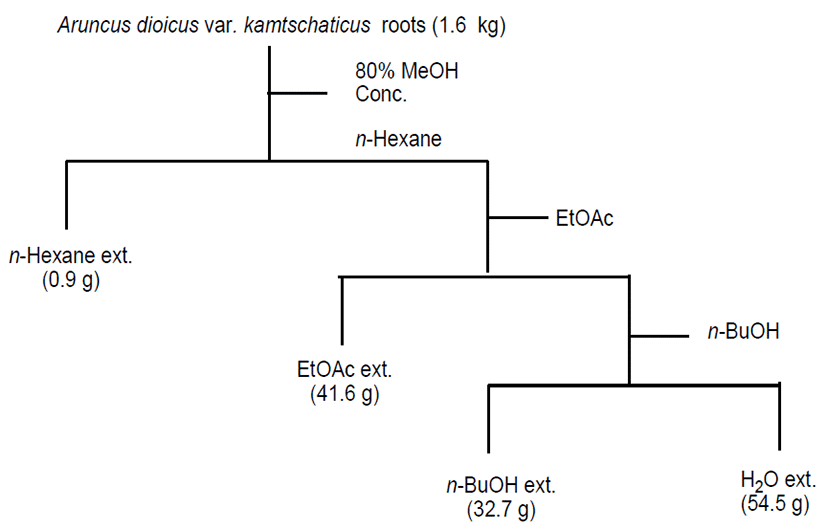
신선한 삼나물 뿌리 1.6 kg을 80% 메탄올로 침지 추출을 3회 반복하여 여과 한 후 농축하였다. 얻어진 삼나물 뿌리 80% 메탄올 추출물(41.6 g)을 물에 현탁하여 저극성 용매인 n-hexane으로 먼저 추출한 후 수층을 다시 ethyl acetate (EtOAc)와 n-butyl alcohol(n-BuOH)을 이용하여 각각 순차 적으로 5회 분획하여 추출하였다. 각 용매추출 분획을 감압 농축하여 건조 시킨 후 각각 n-hexane 가용분획(0.9 g), EtOAc 가용분획(41.6 g), n-BuOH 가용분획(32.7 g) 및 H2O 가용분획(54.5 g)을 각각 얻었으며 각 분획물을 대상으로 라디칼 소거능 및 α-glucosidase 저해능 평가를 수행하였다.
총 페놀성 화합물의 함량은 Folin-Denis 방법(22)에 따라 측정하였으며, 추출물 혹은 분획물을 1.0 mg/mL 농도로 조제한 후, 시료 50 μL와 Folin-Denis 시액 50 μL, 0.7M 탄산나트륨 포화용액 50 μL를 차례로 넣은 다음 이것을 잘 혼합하여 실온에서 60분 방치한 후 UV/VIS 분광광도계 로 750 nm에서 흡광도를 측정하였으며, 표준물질은 gallic acid를 이용하여 표준곡선을 작성하여 양을 환산하였다.
삼나물 뿌리의 80% 메탄올 추출물 및 분획물의 전자공여 능은 Blois 방법(23)에 따라 측정하였다. 각 시료용액에 120 μL에 0.45 mM의 DPPH 용액 60 μL을 넣고 교반한 후 15분 간 방치한 다음 517 nm에서 흡광도를 측정하였다. 전자공 여능은 시료용액의 첨가군과 무첨가군의 흡광도 차이를 백분율로 나타내었다.
삼나물 뿌리의 80% 메탄올 추출물 및 분획물에 대하여 ABTS+ radical 소거능을 Re(24)의 방법을 변형하여 다음과 같이 측정하였다. 7 mM ABTS+ 와 2.4 mM K2O8S2동량을 혼합 후 실온, 암소에서 12시간 방치하여 라디칼의 생성을 유도한 후 ABTS+ 라디칼 용액을 희석하여 734 nm에서 흡광도 값이 0.7~0.8 정도가 되도록 희석한 후 사용하였다. 희석한 ABTS+ 라디칼 용액 100 μL와 생약 추출액 100 μL을 혼합하여 실온에서 7분간 반응시킨 후 734 nm에서 흡광도 를 측정하였다. 이때 positive control로는 (+)-catechin을 사 용하였으며 결과는 시료를 처리하지 않은 군에 대한 백분율 로 나타내었다.
α-Glucosidase 저해능은 Eom(25) 등이 행한 방법을 변형 하여 효소-기질반응을 이용한 분광학적 방법으로 측정하였 다. 즉, 1 U/mL α-glucosidase 90 μL에 시료 혹은 0.1 M sodium phosphate buffer(pH 6.8) 10 μL를 첨가하여 혼합한 후 37℃에서 15분 동안 incubation 하였다. 반응 후 기질인 1 mM p-NPG 100 μL를 첨가한 후 5분간 반응시키고 405 nm에서 ELISA reader를 이용하여 흡광도를 측정함으로써 기질로부터 유리되어 나오는 p-nitrophenol을 측정하였다. 양성대조군으로는 α-glucosidase 저해제로 알려진 acarbose 를 사용하였으며 α-glucosidase 저해활성은 시료용액의 첨 가군과 무첨가군의 흡광도 감소율로 나타내었다.
결과 및 고찰
삼나물 뿌리 추출물 및 각 분획물의 총 페놀성 화합물의 함량을 Table 1에서와 같이 나타내었다. 먼저 EtOAc 분획물 은 1 g당 90.1±1.6 mg의 페놀성 화합물을 함유하는 것으로 나타났으며, 삼나물 뿌리 80% 메탄올 추출물은 1 g당 37.6±3.1 mg, n-BuOH 분획물이 1 g당 14.9±2.2 mg, H2O층 에서는 1 g당 7.1±1.8 mg의 페놀성 화합물의 함량이 확인되 었다. 또한 n-hexane 분획물이 5.7±2.5 mg의 상대적으로 낮은 총페놀 함량을 나타내는 것으로 확인되었다.
| Samples | Phenolic contents (mg/g)1) |
|---|---|
| 80% MeOH extract | 37.6±3.1 |
| n-Hexane layer | 5.7±2.5 |
| EtOAc layer | 90.1±1.6 |
| n-BuOH layer | 14.9±2.2 |
| H2O layer | 7.1±1.8 |
Table 2에서 나타낸 것처럼 삼나물 뿌리 80% 메탄올 추출 물 및 각 유기용매 분획에 대해서 DPPH 라디칼 소거능을 측정한 결과, 삼나물 뿌리 80% 메탄올 추출물 IC50값은 161.9±4.4 μg/mL 라디칼 소거능을 나타내었으며, 특히 EtOAc 분획물이 IC50값이 32.3±2.3 μg/mL의 가장 우수한 라디칼 소거능을 나타내었고, 이 결과는 positive control로 사용된 (+)-catechin의 IC50값인 73.0±3.4 μg/mL보다 우수한 활성을 나타냄을 확인하였다. n-BuOH 분획물 또한 IC50값 이 271.2±3.9 μg/mL의 라디칼 소거능을 나타내었으며, H2O 층과 n-hexane 분획물에서는 IC50값이 500 μg/mL 이상으로 상대적으로 낮은 라디칼 소거능을 나타내었다. 이상의 결 과는 삼나물 뿌리 추출물의 DPPH 라디칼 소거능은 Table 1 및 2에서 나타낸 것과 같이 EtOAc 분획층에서 페놀성 화합물의 함량이 상대적으로 높은 것을 확인할 수 있었으 며, DPPH 라디칼 소거능과 총 페놀 함량 사이에는 밀접한 상관관계가 있다는 보고(26)와도 일치하는 결과였다.
Table 3에서 나타낸 것처럼 삼나물 뿌리 80% 메탄올 추출 물 IC50값이 31.9±1.2 μg/mL의 ABTS+ 라디칼 소거능을 나 타냄을 확인하였으며, 각 분획물중에서도 EtOAc 분획의 IC50값이 18.9±2.1 μg/mL의 가장 우수한 라디칼 소거능을 나타내었으며, 이는 positive control인 (+)-catechin의 IC50값 인 34.9±2.1 μg/mL의 소거 활성에 상당하는 효능임을 확인 하였다. 또한 n-BuOH 분획층은 IC50값이 51.0±2.9 μg/mL 라디칼 소거능을 나타내었다. EtOAc 분획층의 100 μg/mL 에서 85.1%, 50 μg/mL의 농도에서 82.8%, 25 μg/mL의 농도 에서 60.9%의 라디칼 소거능을 나타내었다. 한편, H2O 분획 층과 n-hexane 분획에서는 IC50값이 200 μg/mL 이상으로 상대적으로 낮은 라디칼 소거 활성을 나타내었다. Table 1에서 나타낸 것처럼 총 페놀 함량이 상대적으로 높은 EtOAc 분획층에서 ABTS+ 라디칼 소거 활성이 우수한 화합 물의 존재가 시사되었다. 최근의 연구에서 삼나물 지상부 에 라디칼 소거활성을 나타내는 flavonoid류(18)의 보고는 있으나, 삼나물 뿌리의 라디칼 소거 활성 및 관련 성분에 대한 보고는 이번이 처음이며, 삼나물 뿌리 추출물의 EtOAc 분획물에 존재하는 활성 물질의 동정이 필요하다고 사료된다. Fig. 1
시판되는 대표적인 당뇨 치료제인 acarbose와 voglibose 는 장기간 복용 시 구토 및 설사를 비롯한 복부팽만감 등의 부작용으로 인하여 보다 안전한 천연물 유래의 소재 개발에 관한 연구가 활발하게 진행되어지고 있다(27). 본 연구의 결과, Table 4에서 나타낸 것처럼 삼나물 뿌리 80% 메탄올 추출물의 IC50값이 198.0±8.8 μg/mL의 활성을 나타내었고, 총 페놀 함량이 가장 높은 EtOAc 가용부의 IC50값이 57.8±7.8 μg/mL으로 가장 우수한 활성은 나타내었으며, 다 음으로n-BuOH 분획층의 IC50값은 251.7±10.1 μg/mL의 활 성을 나타났다. 이들 활성은 양성대조구인 acarbose의 IC50 값인 501.1±17.5 μg/mL과 비교할 때 EtOAc 가용분획의 활 성은 우수한 효능임을 확인하였다. 최근의 연구(28,29)에 의하면 단풍취(Ainsliaea acerifolia) 추출물의 EtOAc 가용 부의 IC50 값은 103.4 μg/mL, 오디(Morus alba) 와인의 polystyren 수지 칼럼 충진제를 활용한 80% 에탄올 용리액 의 IC50 값은 70.2 μg/mL의 α-glucosidase의 저해 활성을 나타내었다. 이들 활성과 비교하면 삼나물 뿌리의 EtOAc 가용부의 우수한 활성을 확인하였으며, 향후 활성물질의 동정을 통한 활성기작 연구가 필요하다고 사료된다.
요 약
삼나물 뿌리를 80% 메탄올로 침지 추출하여 얻어진 추출 물에 대해n-hexane, EtOAc 및n-BuOH의 유기용매를 활용 하여 순차 분획을 실시하였고, 얻어진 결과물에 대하여 DPPH, ABTS+ 라디칼 소거능 및 α-glucosidase 저해활성을 평가하였다. DPPH 라디칼 소거능은 총 페놀성 화합물의 함량이 상대적으로 높은 EtOAc 층에서 IC50값이 32.3±2.3 μg/mL으로 가장 우수한 DPPH 라디칼 소거능을 확인하였 고, 삼나물 뿌리 의 EtOAc 가용부에 다량 존재하는 페놀성 화합물과 라디칼 소거능과의 연관성을 시사하였다. 또한 ABTS+ 라디칼 소거능은 EtOAc 층의 IC50값이 18.9±2.1 μ g/mL의 우수한 라디칼 소거활성이 확인 하였고, 우수한 라디칼 소거 활성물질의 존재가 시사되었다. 또한, α -glucosidase 저해활성을 평가한 결과, 우수한 라디칼 소거 능을 나타낸 EtOAc 층의 IC50은 57.8±7.8 μg/mL의 저해활성 을 나타내었으며, 이는 positive control인 acarbose의 IC50값 인 501.1±17.5 μg/mL과 비교하여 우수한 활성이었으며, 추 출물 상태의 시료를 단일물질로 정제할 경우 더욱 강한 효능의 화합물이 존재할 가능성을 시사하였다. 향후 이들 활성물질 동정을 통한 활성 기작에 대한 연구가 필요하며 본 연구결과는 보다 우수한 라디칼 소거능 및 α-glucosidase 저해능을 가지는 새로운 기능성 소재 발굴을 위한 기초자료 로 활용 가능할 것으로 사료된다.










