ARTICLE
수확시기별 오렌지 5품종 부산물의 플라보노이드 함량과 항산화 활성
안현주*, 박경진, 김상숙
Flavonoids composition and antioxidant activity of by-products of five orange cultivars during maturation
Hyun Joo An*, Kyung Jin Park, Sang Suk Kim
Author Information & Copyright ▼
Citrus Research Institute, National Institute of Horticultural and Herbal Science, RDA, Jeju 63607, Korea
© The Korean Society of Food Preservation. This is an Open-Access article distributed under the terms of the Creative Commons Attribution Non-Commercial License (http://creativecommons.org/licenses/by-nc/3.0/) which permits unrestricted non-commercial use, distribution, and reproduction in any medium, provided the original work is properly cited.
Received: Oct 25, 2016; Revised: Nov 18, 2016; Accepted: Nov 22, 2016
Abstract
This study was conducted to investigate total flavonoid content, flavonoid composition, and free radical scavenging effects of by-products from five orange cultivars during the period September 2015 to February 2016. Total flavonoid content was highest in peel extracts from immature fruit harvested in September. Total flavonoid contents of all cultivars mostly decreased while ripening. Among the five cultivars, total flavonoid content was highest in Hamlin sweet orange (21.66 mg/g), followed by Sanguinello blood orange (20.39 mg/g), Shamouti orange (18.49 mg/g), Tarocco blood orange (18.46 mg/g), and Olinda Valencia orange (17.07 mg/g). With regard to flavonoid composition, all cultivar materials had high levels of narirutin and hesperidin, but naringin and neohesperidin were not detected in any of the materials. Nobiletin, as polymethoxyflavone, was detected within a 23~40 μg/mL range in the immature fruit of all cultivars. Among all cultivars, antioxidant activities were higher in peel extracts than in pulp extracts. DPPH radical scavenging activities of peel extracts ranged from 40% to 58% while the ABTS radical scavenging activity range was 90~94%. The results indicate that orange, by-products, especially peel of immature orange fruit, could have application as natural materials with antioxidative effects.
Keywords: antioxidant; by-product; flavonoid; maturation; orange
서 론
국내 감귤 생산량은 연간 60만톤 내외로 그 중 매년 10~16%가 가공용으로 사용되고 있다. 감귤류 가공공정으 로 생기는 껍질, 즙을 짜고 난 부산물 등 과일의 50%에 해당하는 부산물이 생기는데, 이들 부산물에도 다양한 생 리활성 성분들이 함유되어 있고 항산화 효과가 있다고 보고 되었으며(1), pinene, linalool 등의 휘발성 물질이 함유되어 있어 항균작용이 있다고 보고된 바 있다(2,3). 감귤 가공에 있어서 가장 많은 비중을 차지하고 있는 감귤은 오렌지이 다. 미국의 오렌지 주 생산지인 플로리다주의 감귤류 산업 은 오렌지 주스 생산으로 유명하며 한 해 1억 5천만 박스가 넘는 오렌지 주스가 생산되고 있다. 그러나 오렌지 주스 생산에 있어 오렌지 껍질 및 착즙 후 찌꺼기 등 70만 톤에 달하는 부산물이 생산되고 있으며, 이들은 일부분 가축사 료용으로 사용되거나 대부분은 폐기되고 있는 실정이다.
감귤류는 polyphenol류, vitamin류, limonoid류, synepheine 등의 다양한 화합물을 함유하고 있으며(4), rutin 및 deosmine 등의 일반적인 flavonoid류, hesperidin, naringin 등 citrus 과일 특유의 flavonoid류, 또한 채소나 과일에서는 보고되지 않는 감귤류 고유의 tangeretin, nobiletin 등의 flavonoid류를 함유하고있다(5). 특히감귤과피에는carotenoid류, bioflavonoid 류, pectin 및 terpene류가 풍부하게 함유되어 있으며(6,7), 이러한 성분들의 기능성에 대한 평가로서 항산화 작용, 순 환계 질병의 예방, 항염증, 항알레르기, 항균, 항바이러스, 혈중 지질 저하작용, 면역증강작용, 모세혈관 강화작용 등 이 보고된 바 있다(8,9).
따라서 본 연구에서는 오렌지 생과 및 가공용으로 주로 사용되는 주요 5가지 오렌지 품종의 과피 및 착즙을 하고 난 부산물의 플라보노이드 성분과 유리 라디칼 소거활성을 성숙시기별로 분석하여 오렌지 부산물의 천연물 유래 기능 성 소재로서의 활용 가능성을 검토하고자 수행하였다.
재료 및 방법
실험재료
본 실험에 사용된 오렌지(Citrus sinensis) 5품종(Tarocco blood, Sanguinello blood, Hamlin sweet, Shamouti, Olinda valencia)는 제주도 서귀포시 감귤연구소 유전자원 하우스 에서 재배된 과실을 2015년 9월부터 2016년 2월까지 한 달 간격으로 수확하여 사용하였다. 수확한 과실은 비상품 과들을 선별하고 흐르는 수돗물로 깨끗이 세척한 후, 물기 를 제거한 다음 과피와 과육을 분리하고, 과육은 착즙기를 이용하여 과즙을 제거하고 남은 부산물을 사용하였다. 분 리한 과피와 즙을 제거한 과육 부산물은 60℃ 건조기에서 12~48시간 건조시킨 후 분쇄하여 사용하였다.
메탄올 추출물 제조
각 품종별, 부위별 추출물은 건조 분말 20 g에 70% 메탄 올 1 L를 가하여 3시간씩 3회 추출 한 다음 추출액을 여과한 후 감압농축기를 이용하여 용매를 완전히 제거하였고 동결 건조하여 -20℃에 보관하면서 실험에 사용하였다.
총 플라보노이드 함량 측정
총 플라보노이드 함량은 Moreno 등의 방법(10)을 이용하 여 비색 정량하였다. 추출물 15 μL에 diethylene glycol 150 μL, 1 N NaOH 15 μL를 첨가하여 혼합한 후 상온에서 1시간 반응시키고 UV-Spectrophotometer(Molecular devices, SpectraMax M2, Sunnyvale, CA, USA)를 사용하여 420 nm 에서 흡광도를 측정하였다. 총 플라보노이드 함량은 quercetin(Sigma-Aldrich, St. Louis, MO, USA)을 표준물질 로 하여 검량선을 작성하였고 플라보노이드 함량은 건조 시료 중량 당 mg quercetin equivalent(QE/g dry weight)로 나타내었다.
High Performance Liquid Chromatography(HPLC) 분석
과피 추출물의 성분분석은 HPLC(Waters, model E2695 Separation module, Milford, MA, USA)를 통해 확인하였으 며(11-13), 모든 시약은 HPLC grade를 사용하였다. 이동상 용매인 acetonitrile과 acetic acid는 Merck(Darmstadt, Germany)에서 구입하여 사용하였으며, 분석에 사용된 표 준물질은 Sigma-Aldrich 사의 제품을 사용하였다. Waters 2489 UV visible detector, 분석 column은 YMC Pro C18 RS (250×4.6 mm; YMC Co., Kyoto, Japan)을 사용하였다. Column 온도는 40℃, 유속은 1 mL/min으로 유지하였고 UV 280 nm에서 검출하였으며, 이동상 용매는 0.1% acetic acid를 포함하는 증류수 (A)와 acetonitrile (B)를 이용하였 다. 이동상 용매 조건은 초기 20% B로 시작하여, 0~5 min 10~25% B, 5~30 min 25~40% B, 30~35 min 40~100% B, 35~43 min 100~10% B로 유지하는 조건으로 분석하였다. 분석 S/W는 Waters의 Empower system을 사용하였다.
DPPH 라디칼 소거활성 측정
항산화 활성은 변형된 Blois 등의 방법(14)을 이용하여 DPPH (1,1-diphenyl-2-picrylhydrazyl) free radical에 대한 전 자공여능(electron donating ability, EDA)을 측정하였다. 추 출물의 전자공여능 측정을 위해, 시료 20 μL에 0.2 mM DPPH 용액 180 μL를 넣고 10분간 반응시킨 후 UVSpectrophotometer를 사용하여 잔존하는 DPPH free radical 을 517 nm에서 측정하였다. DPPH radical 소거활성은 시료 용액의 첨가구와 무첨가구 사이의 흡광도 차이를 백분율로 나타내었다.
ABTS 라디칼 소거활성 측정
ABTS〔2,2’-azino-bis(3-ethylbenzothiazoline-6-sulfonic acid)〕radical 소거활성은 Pellegrini 등의 방법(15)에 따라 측정하였다. ABTS radical 소거활성은 7.4 mM ABTS와 2.6 mM potassium persulfate를 혼합 후 실온 암소에서 15시간 동안 방치하여 radical을 형성시킨 후 이 용액을 734 nm에서 흡광도 값이 0.70±0.02가 되도록 희석하였다. 희석된 ABTS 용액 180 μL에 추출물 20 μL를 가하여 실온에서 15분 동안 방치한 다음 734 nm에서 흡광도를 측정하였다. ABTS radical 소거활성은 시료 용액의 첨가구와 무첨가구 사이의 흡광도 차이를 백분율로 나타내었다.
통계분석
모든 실험은 3회 반복으로 이루어졌으며 실험결과는 SAS package(version 9.2, Cary, NC, USA)를 이용하여 평균 과 표준편차로 나타냈다. 각 실험군의 유의적 차이가 있는 항목은 Duncan’s multiple range test에 의하여 p<0.05 수준에 서 통계적 유의성을 검정하였다.
결과 및 고찰
총 플라보노이드 함량
식물에 널리 분포되어 있는 플라보노이드 성분 역시 항 산화능을 비롯한 여러 생리활성 기능이 최근 많은 연구에서 밝혀지고 있고(16-18), 이러한 플라보노이드 함량은 일반적 으로 시료의 품종, 성숙시기, 과일의 부위에 따라 차이를 나타낸다(19). 오렌지 5품종을 대상으로 미성숙기인 9월부 터 성숙기인 2월까지의 과일을 과피와 과육부분으로 나누 어 각 시료의 플라보노이드 함량을 조사한 결과는 Table 1과 같다. 성숙시기에 따른 총 플라보노이드 함량은 모든 시료에서 성숙이 진행된 과일 보다 미성숙 상태의 과일인 9월에 수확한 과일에 함량이 가장 높은 것으로 나타났으며, 성숙이 진행될수록 감소하는 경향을 보였다. Quercetin 등 량값으로 표시할 때 건조 시료 g 당 부위별로는 과피 추출물 에서의 함량은 17.07~21.66 mg으로 측정되었고, 과육 추출 물의 함량은 8.5~10.14 mg으로 측정되었다. 품종간에는 과 피 추출물의 경우 Hamlin(21.66 mg) > Sanguinello blood (20.39 mg) > Shamouti(18.49 mg), Tarocco blood(18.46 mg) > Olinda valencia(17.07 mg) 순으로 조사되었다. 과육 추출 물의 경우는 Hamlin(10.14 mg) > Olinda valencia(9.69 mg) > Sanguinello blood(9.25 mg) > Shamouti(8.87 mg) > Tarocco blood(8.5 mg) 순으로 과피 추출물과는 차이가 있음 을 알 수 있었다. Kubola 등(20)에 따르면 과일의 부위별 플라보노이드 함량은 과피 부분이 과육이나 씨 부위보다 3배 이상 높았다고 보고하였는데, 본 연구 결과에서도 5품 종 모두 과피 추출물이 과육 추출물에 비해 2배 이상 플라보 노이드 함량이 높음을 알 수 있었다.
Table 1.
otal flavonoid contents of peel extracts (A) and pulp extracts (B) from five orange cultivars harvested at different maturation stages (unit: mg QE/g dry weight)1)
(A)
| Cultivar |
September |
October |
November |
December |
January |
February |
| Tarocco blood |
18.46±2.3c2) |
12.86±0.6d |
15.08±3.6d |
11.55±4.7a |
9.68±0.7c |
9.17±0.4d |
| Sanguinello blood |
20.39±1.4b |
13.29±2.4cd |
11.87±1.9cd |
9.06±0.8b |
10.19±4.2b |
9.40±2.0d |
| Hamlin |
21.66±2.2a |
20.52±4.7a |
14.17±2.4a |
11.40±2.0a |
10.90±0.6a |
11.03±3.0b |
| Shamouti |
18.49±0.1c |
13.52±1.6c |
11.59±5.9c |
11.41±5.5a |
9.28±1.1d |
11.39±0.6a |
| Olinda valencia |
17.07±3.7d |
16.04±1.8b |
12.81±0.4b |
11.50±0.8a |
10.11±1.7b |
10.55±0.3c |
| (B) |
|
Cultivar
|
September
|
October
|
November
|
December
|
January
|
February
|
| Tarocco blood |
8.5±1.5e |
7.62±1.2c |
7.04±1.1c |
7.09±1.0d |
6.72±0.4d |
6.95±0.7d |
| Sanguinello blood |
9.25±0.7c |
8.27±0.6b |
7.45±0.3b |
7.50±0.9c |
6.73±0.3d |
7.82±0.4b |
| Hamlin |
10.14±0.2a |
9.14±1.7a |
8.30±2.7a |
8.14±1.1a |
7.24±0.3b |
8.22±0.6a |
| Shamouti |
8.87±0.9d |
8.03±2.1b |
6.95±0.4b |
7.75±1.6b |
6.9±0.6c |
6.88±0.3d |
| Olinda valencia |
9.69±2.0b |
8.98±0.7a |
8.27±1.0a |
7.98±1.6ab |
8.06±0.6a |
7.18±0.2c |
Download Excel Table
HPLC에 의한 플라보노이드 정성 분석
페놀계 화합물질 중 플라보노이드는 C6-C3-C6의 기본 골 격을 가지고 있다. 플라보노이드는 분자 구조에 의해 flavones, flavanones, flavonols, isoflavones, anthocyanidins and flavanols 6개 그룹으로 분류된다(21). 감귤에서 플라보 노이드 성분의 종류와 함량은 품종에 따라 다르고(22), 특히 감귤 과피에 많이 함유되어 있으며 대부분의 플라보노이드 화합물은 naringin 및 hesperidin으로 배당체 형태로 존재한 다(23). Tarocco blood, Sanguinello blood, Hamlin, Shamouti, Olinda valencia 오렌지 5품종 과피 추출물의 성숙시기별 플라보노이드 함량 변화는 Table 2와 같다. 5품종 모두 성숙 시기가 9월인 미숙과에 플라보노이드 함량이 가장 높음을 알 수 있었으며, 성숙이 진행될수록 함량이 큰 폭으로 감소 하였다. Flavanone류에서 narirutin의 경우 Hamlin이 171.24 μg/mL로 가장 많이 함유하고 있으며, 다음으로 Shamouti 135.13 μg/mL, Olinda valencia 77.83 μg/mL, Sanguinello blood 71.44 μg/mL, Tarocco blood 54.86 μg/mL 순으로 함유 되어 있었다. Hesperidin은 Hamlin 92.80 μg/mL, Tarocco blood 70.50 μg/mL, Sanguinello blood 69.36 μg/mL, Shamouti 63.79 μg/mL, Olinda valencia 41.95 μg/mL 순으로 확인되었다. 그러나, naringin 과 neohesperidin은 모든 시료 에서 검출이 되지 않았다. Elisa 등(24)은 glycoside 형태의 flavanone 중에서도 구조적인 차이로 두 개의 그룹으로 성 분을 분류할 수 있는데, neohesperidoside에 속하는 naringin 과 neohesperidin, 이 두 성분은 쓴맛에 관여하는 성분으로 주로 grapefruit, bitter orange에 있으며, rutinoside에 속하는 narirutin과 hesperidin은 맛에 영향을 미치지 않는 성분으로 주로 오렌지, 만다린, 레몬에 많이 함유되어 있다고 보고 하였는다. 본 실험의 결과에서도 쓴맛이 없는 일반 생식용 오렌지에서 naringin과 neohesperidin이 검출되지 않은 것은 이러한 보고와 유사한 결과로 판단되었다. Flavone류 중 다른 채소, 과일에는 거의 없고 감귤류에만 있는 polymethoxyflavone류는 9월 수확한 Hamlin 미성숙과에 nobiletin이 40.22 μg/mL로 가장 많이 함유되어 있었고, 다음 으로 Olinda valencia 36.47 μg/mL, Sanguinello blood 28.70 μg/mL, Tarocco blood 23.96 μg/mL, Shamouti 22.93 μg/mL 순으로 검출되었다. 9월 이후에는 큰 폭으로 함량이 감소하 였다.
Table 2.
Changes in flavonoid contents of peel extracts from five orange cultivars harvested at different maturation stages (unit: 'g/mL)
| Cultivar |
Date |
Flavone |
Flavanone |
Polymethoxylflavones |
| Rutin |
Narirutin |
Naringin |
Hesperidin |
Neohesperidin |
Nobiletin |
Tangeretin |
| Tarocco blood |
9/15 |
9.47 |
54.86 |
ND1) |
70.50 |
ND |
23.96 |
2.11 |
|
|
11/15 |
3.13 |
19.67 |
ND |
14.65 |
ND |
7.68 |
0.92 |
|
|
1/15 |
3.71 |
20.01 |
ND |
14.87 |
ND |
8.51 |
1.10 |
|
|
|
| Sanguinello blood |
9/15 |
11.32 |
71.44 |
0.29 |
69.36 |
ND |
28.70 |
4.13 |
|
|
11/15 |
3.46 |
31.35 |
ND |
18.28 |
ND |
13.86 |
1.85 |
|
|
1/15 |
5.47 |
19.06 |
ND |
16.38 |
ND |
6.32 |
ND |
|
|
|
| Hamlin sweet |
9/15 |
26.51 |
171.24 |
ND |
92.80 |
ND |
40.22 |
6.60 |
|
|
11/15 |
20.41 |
95.17 |
ND |
34.14 |
ND |
15.08 |
2.21 |
|
|
1/15 |
4.82 |
42.22 |
ND |
18.50 |
ND |
5.50 |
0.60 |
|
|
|
| Shamouti |
9/15 |
7.28 |
135.13 |
ND |
63.79 |
ND |
22.93 |
3.01 |
|
|
11/15 |
5.77 |
40.19 |
ND |
20.15 |
ND |
10.20 |
1.15 |
|
|
1/15 |
3.25 |
22.64 |
ND |
12.72 |
ND |
5.71 |
ND |
|
|
|
| Olinda valencia |
9/15 |
7.64 |
77.83 |
ND |
41.95 |
ND |
36.47 |
3.80 |
|
|
11/15 |
3.57 |
31.51 |
ND |
21.47 |
ND |
16.50 |
1.73 |
|
|
1/15 |
4.64 |
19.32 |
ND |
14.01 |
ND |
10.47 |
0.91 |
Download Excel Table
DPPH 라디칼 소거활성 측정
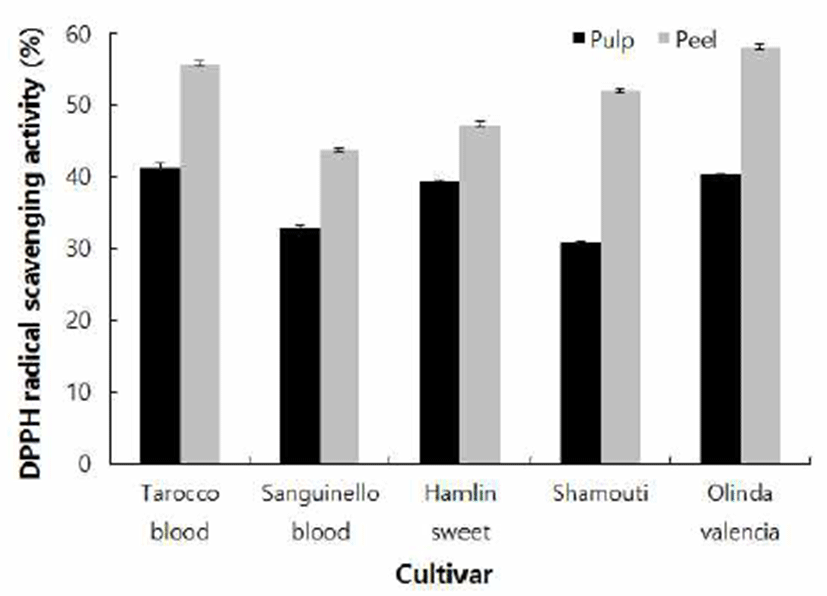
항산화 활성을 측정하는 방법에는 여러 가지가 있으나 DPPH 라디칼 소거활성은 비교적 간단하면서 대량으로 측 정이 가능한 항산화 측정법이다. DPPH는 라디칼 중 비교적 안정한 화합물로 황 함유 아미노산, ascorbic acid, 페놀성 화합물 등의 항산화 물질로부터 전자나 수소를 제공받아 DPPH-H로 환원되면서 자색이 탈색되는 원리를 이용하여 항산화 활성을 간단히 측정할 수 있는 동시에 식물체의 항산화 활성과도 연관성이 매우 높기 때문에 많이 이용되고 있는 방법이다(25). 9월 15일 수확한 과일의 과피 추출물과 과육 추출물의 DPPH 라디칼 소거 활성을 측정한 결과는 Fig. 1과 같다. 각 시료 1,000 μg/mL 농도 처리에 의한 DPPH 라디칼 소거활성을 비교해 본 결과 모든 품종에서 과육 추출물보다 과피 추출물의 DPPH 라디칼 소거활성이 우수 하였으며, 품종 중에 가장 높은 DPPH 라디칼 소거활성 값을 나타낸 것은 Olinda valencia 오렌지로 58.04%를 나타 냈으며, 그 다음으로Tarocco blood(55.76%), Shamouti(52.06%), Hamlin(47.30%), Sanguinello blood(43.78%) 순으로 나타났 다. Kim 등(18)은 자생식물과 생약자원을 대상으로 DPPH 라디칼 소거활성과 폴리페놀 및 플라보노이드와의 상관관 계를 보고 하였는데, 대부분의 시료들에서 폴리페놀, 플라 보노이드와 DPPH 라디칼 소거활성의 일관된 상관관계를 찾기 어렵다고 보고하였으며, Lee 등(26)은 11종 과일의 껍질을 대상으로 폴리페놀, 플라보노이드, 비타민 C 함량과 항산화능 측정법과의 상관관계를 분석한 결과 DPPH 라디 칼 소거활성은 비타민 C 함량에서 양의 상관관계를 나타냈 다고 보고하였는데, 본 연구의 결과에서도 플라보노이드 함량이 제일 낮았던 Olinda valencia 오렌지가 DPPH 라디칼 소거활성은 가장 높은 것으로 확인된 결과와 관련 있는 것으로 판단된다. 따라서, 폴리페놀 및 플라보노이드뿐만 아니라 오렌지에 포함되어 있는 여러 가지 항산화 성분의 DPPH 라디칼 소거활성에 관한 비교 연구가 수행되어야 할 것으로 판단된다.
Fig. 1.
DPPH radical scavenging activity of pulp and peel extracts of fruits harvested on 15th Sep.
Results are mean±SD of triplicate data.
Download Original Figure
ABTS 라디칼 소거활성 측정
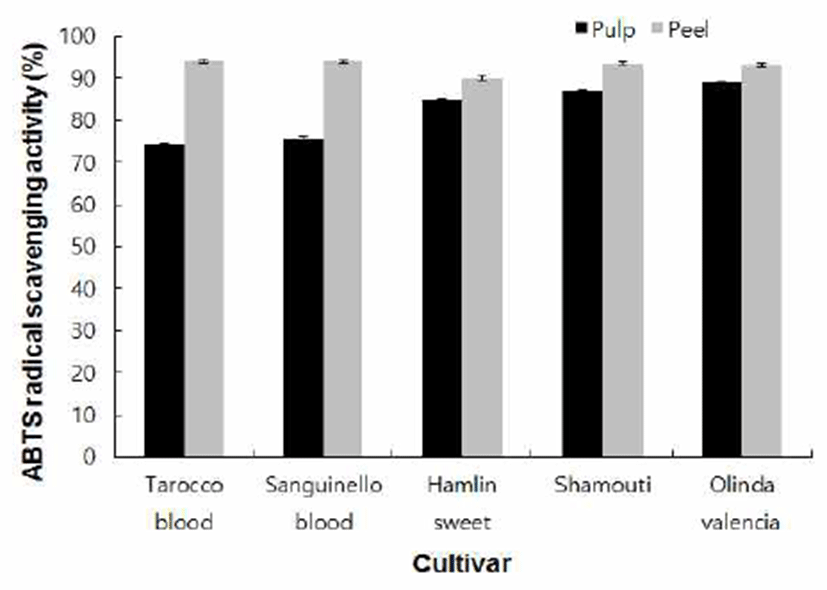
대부분의 페놀성 물질이 유리 라디칼을 효과적으로 제거 하지만 라디칼의 기질에 따라 선택적으로 작용하는 페놀성 물질이 존재하기 때문에 DPPH와 ABTS 라디칼 소거활성 을 측정하여 본 연구에 사용한 시료들의 항산화 활성을 비교하였다. 9월 15일 수확한 과일의 과피 추출물과 과육 추출물의 ABTS 라디칼 소거활성을 측정한 결과는 Fig. 2와 같다. 각 시료 1,000 μg/mL 농도 처리에 의한 ABTS 라디칼 소거활성을 비교해 본 결과 모든 품종에서 과육 추출물 보다 과피 추출물의 소거활성이 우수하였으며, 과육 추출 물은 74.3~88.85%의 소거활성을 보여주었고, 과피 추출물 은 90.07~94.22%로 모든 품종이 매우 높은 소거활성을 가 지고 있음을 알 수 있었다. 그러나 DPPH 라디칼 소거활성 의 결과와 비교해 보았을 때, ABTS 라디칼 소거활성은 전체적인 소거활성에서도 90% 이상의 높은 소거활성을 보여 DPPH 라디칼 소거활성과 차이가 나지만 품종 간에서 도 DPPH 라디칼 소거활성이 가장 높았던 Olinda valencia 오렌지의 ABTS 소거활성(93.08%)은 낮았고, DPPH 라디칼 소거활성이 가장 낮았던 Sanguinello blood 오렌지의 ABTS 소거활성(94.04%)은 높음을 보여 주어 두 측정법간에 역의 관계가 나타남을 알 수 있었고, 또한 총 플라보노이드 함량 이 높은 오렌지 품종의 ABTS 라디칼 소거활성이 높음을 확인하였다. 이러한 결과로 DPPH 라디칼 소거활성과 ABTS 라디칼 소거활성 간에 차이가 있음을 알 수 있었다.
Fig. 2.
ABTS radical scavenging activity of pulp and peel extracts of fruits harvested on 15th Sep.
Results are mean±SD of triplicate data.
Download Original Figure
요 약
오렌지 생과 및 가공용으로 주로 사용되는 주요 5가지 오렌지 품종의 과피 및 착즙을 하고 난 부산물의 플라보노 이드 성분과 유리 라디칼 소거활성을 성숙시기별로 분석하 여 오렌지 부산물의 천연물 유래 기능성 소재로써의 활용 가능성을 검토하고자 본 연구를 수행하였다. 성숙시기에 따른 총 플라보노이드 함량은 모든 시료에서 성숙이 진행된 과일 보다 미성숙 상태의 과일인 9월에 수확한 과일에 함량 이 가장 높은 것으로 나타났으며, 성숙이 진행될수록 감소 하는 경향을 보였다. 품종간에는 과피 추출물의 경우 Hamlin(21.66 mg/g) > Sanguinello blood(20.39 mg/g) > Shamouti(18.49 mg/g), Tarocco blood(18.46 mg/g) > Olinda valencia(17.07 mg/g) 순으로 조사되었다. 플라보노이드 성 분 변화에서는 모든 시료에 narirutin과 hesperidind의 함량 이 높았으며, naringin과 neohesperidin은 검출되지 않았다. PMF 성분 중에는 9월에 수확한 미성숙과의 과피 추출물에 nobiletin이 23~40 μg/mL 함유되어 있음을 확인할 수 있었 다. 유리 라디칼 소거활성에서는 모든 품종에서 과피 추출 물이 과육 추출물에 비해 우수하였고, 과피 추출물의 DPPH 라디칼 소거활성은 40~58%, ABTS 라디칼 소거활성에서는 90~94%의 소거능을 보였다.
감사의 글
본연구는농촌진흥청지원사업(과제번호: PJ010934032016) 의 지원을 받아 수행되었으며 이에 감사 드립니다.
References
Senevirathne M, Jeon YJ, Ha JH, Kim SH. Effective drying of citrus by-product by high speed drying A novel drying technique and their antioxidant activity. J Food Eng. 2009; 92:157-163


Benelli P, Riehl CAS, Smania Jr A, Smania EFA, Ferreira SRS. Bioactive extracts of orange (Citrus sinensis L. Osbeck) pomace obtained by SFE and low pressure techniques: Mathematical modeling and extract composition. J Supercrit Fluids. 2010; 55:132-141


Kim YS, Shin DH. Researches on the volatile antimicrobial compounds from edible plants and their food application. Korean J Food Sci Technol. 2003; 35:159-165.

Bravo L. Chemistry, dietary sources, metabolism, and nutritional significance. Nutr Rev. 1998; 56:317-333.

Cha JY, Kim SY, Jeong SJ, Cho YS. Effects of hesperetin and naringenin on lipid concentration in orotic acid treated mice. Korean J Life Sci. 1999; 9:389-394.

Kamiya S, Esaki S. Recent advances in the chemistry of the citrus flavonoids. Nippn Shokuhin Kogyo Gakkaishi. 1971; 18:38-48


Moresi M, Clementi F, Rossi J, Medici R, Vinti GL. Production of biomass untreated orange peel by Fusarium avenaceum. Appl Microbiol Biotechnol. 1987; 27:37-45.

Sohn JS, Kim MK. Effect of hesperidin and naringin on antioxidative capacity in the rat. Korean J Nutr. 1998; 31:687-696.

Yoshigai E, Machida T, Okuyama T, Mori M, Murase H, Yamanishi R, Okumura T, Ikeya Y, Nishino H, Nishizawa M. Citrus nobiletin suppresses inducible nitric oxide synthase gene expression in interleukin-1β -treated hepatocytes. Biochem Biophys Res Commun. 2013; 439:54-59


Moreno MIN, Isla MI, Sampietro AR, Vattuone MA. Comparison of the free radical-scavenging activity of propolis from several regions of Argentina. J Ethnopharmacol. 2000; 71:109-114


Park HS, Oh JH, Lee JH, Lee YJ. Minor effects of the Citrus flavonoids naringin, naringenin and quercetin, on the pharmacokinetics of doxorubicin in rats. Pharmazie. 2011; 66:424-429.

Sasaki K, Mito K, Ohara K, Yamamoto H, Yazaki K. Cloning and characterization of naringenin 8-prenyltransferase, a flavonoid-specific prenyltransferase of Sophora flavescens. Plant Physiol. 2008; 146:1075-1084


Zhang J, Chu CJ, Li XL, Yao S, Yan B, Ren HL, Xu NY, Liang ZT, Zhao ZZ. Isolation and identification of antioxidant compounds in Vaccinium bracteatum Thunb. by UHPLC-Q-TOF LC/MS and their kidney damage protection. J Funct Foods. 2014; 11:62-70


Blois MS. Antioxidant determination by the use of a stable free radical. Nature. 1958; 181:1199-1200


Re R, Pellegrini N, Proteggente A, Pannala A, Yang M, Rice-Evans C. Antioxidant activity applying an improved ABTS radical cation decolorization assay. Free Radic Biol Med. 1999; 26:1231-1237


Heim KE, Tagliaferro AR, Bobilya DJ. Flavonoid antioxidants Chemistry, metabolism, and structureactivity relationships. J Nutr Biochem. 2002; 13:572-584.

Jia Z, Tang M, Wu J. The determination of flavonoid contents in mulberry and their scavenging effects on superoxide radicals. Food Chem. 1999; 64:555-559.

Kim EJ, Choi JY, Yu MR, Kim MY, Lee SH, Lee BH. Total polyphenols, total flavonoid contents, and antioxidant activity of Korean natural and medicinal plants. Korean J Food Sci Technol. 2012; 44:337-342


Diaz-Mulab HM, Japata PJ, Guillen F, Martinez- Romero D, Castillo S, Serrano M, Valero D. Changes in hydrophilic and lipophilic antioxidant activity and related bioactive compounds during postharvest storage of yellow and purple plum cultivars. Postharvest Biol Technol. 2009; 51:354-363.

Kibola J, Siriamompun S. Phytochemicals and antioxidant activity of different fruit fractions (peel, pulp, aril, and seed) of Thai gac (Momordica cochinchinensis Spreng). Food Chem. 2011; 127:1138-1145.

Lee BH, Kim SY, Cho CH, Chung DK, Chun OK, Kim DO. Estimation of daily per capita intake of total phenolics, total flavonoids, and antioxidant capacities from fruit and vegetable juices in the Korean diet based on the Korea national health and nutrition examination survey 2008. Korean J Food Sci Technol. 2011; 43:475-482


Choi SY, Ko HC, Ko SY, Hwang JH, Park JG, Kang SH, Han SH, Yun SH, Kim SJ. Correlation between flavonoid content and the NO production inhibitory activity of peel extracts from various citrus fruits. Biol Pharm Bull. 2007; 30:772-778


Cha JY, Cho YS. Biofunctional activities of citrus flavonoids. J Korean Soc Agric Chem Biotechnol. 2001; 44:122-128.

Tripoli E, Guardia ML, Giammanco S, Majo DD, Giammanco M. Citrus flavonoids Molecular structure, biological activity and nutritional properties A review. Food Chem. 2007; 104:466-479


Katsube T, Tabata H, Ohta Y, Yamasaki Y, Anuurad E, Shiwaku K, Yamane Y. Screening for antioxidant activity in edible plant products comparison of low-density lipoprotein oxidation assay, DPPH radical scavenging assay, and Folin-Ciocalteu assay. J Agric Food Chem. 2004; 52:2391-2396


Lee MY, Yoo MS, Whang YJ, Jin YJ, Hong MH, Pyo YH. Vitamin C total polyphenol, flavonoid contents and antioxidant capacity of several fruit peels. Korean J Food Sci Technol. 2012; 44:540-544