서 론
생체 내에서 발생되는 활성산소종은 지질의 과산화, 단백질의 산화 등 산화적 세포 손상을 일으키며 특히, DNA의 손상은 돌연변이, 비정상적인 유전자 발현, 나아가 비정상적인 세포의 성장 분화를 유도하여 암 발생의 주된 원인으로 작용한다. 항산화제는 발암 원인 물질인 활성산소종을 제거하여 발암의 개시 단계를 효과적으로 차단시킴으로써 암을 예방할 수 있다(1). 이러한 활성산소를 억제하는 성분으로는 butylated hydroxy anisol(BHA), butylated hydroxy toluene(BHT) 등의 폐놀계 합성항산화제와 야채나 식물의 잎과 같은 식물성 원료에 많이 들어있는 ascorbic acid, tocopherol, phenolic compound, flavonoid 등의 천연항산화제가 있다(2).
염증(inflammation)이란 생체나 조직에 물리적 작용이나 화학적 물질, 세균감염 등의 어떠한 기질적인 변화를 가져오는 것에서 수복 재생하려는 일련의 과정이며 macrophage 나 mast cell 등의 백혈구에서 생성된 다양한 신호전달물질인 histamine, serotonine, bradykinin, prostaglandins(PGs), hydroxyeicosatetraenoic acid(HETE), leukotriene과 같은 혈관 활성 물질로 인해 혈관투과성이 증가하여 염증을 유발하게 된다. macrophage는 감염초기 생체방어에 중요한 역할을 하며 대표적인 염증 매개물인 nitric oxide(NO)과 cytokine 생성에 관여한다(3,4). 그람 음성세균(gram-negative bacteria)의 세포 외막에 존재하는 lipopolysaccharide(LPS)는 macrophage 또는 monocyte에서 interleukin-1α(IL-1α), interleukin-1β(IL-1β), interleukin-6(IL-6), interleukin-8(IL-8), tumor necrosis factor-α(TNF-α)와 같은 cytokine을 증가시키는 것으로 알려져 있다(5,6). 그 중에서도 TNF-α와 IL-1α는 초기 자극에 대한 염증 유발인자로서 분비되고, 다음으로 IL-6와 IL-8의 발현을 유도하여 염증 반응을 유발한다(7,8,9).
최근 신약 개발과 관련하여 천연자원의 기능에 관한 연구가 활발하게 진행되고 있으며, 이 중 지구상에서 다수종을 차지하고 있는 곤충의 기능에 대한 관심도 증대 되고있는 실정이다(10,11). 갈색거저리(T. Molitor , mealworm)는 딱정벌레목(Coleoptera)거저리과로서 한국을 비롯한 전세계에 분포하고 있다. 주로 애완동물의 먹이로 많이 사용되고 있으며 최근에는 갈색거저리가 대량 생산이 용이한 점과 단백질 등의 영양성분이 풍부한 점을 이용하여 미래의 식량자원으로서 가치도 연구 되고 있다(12). 보고된 연구로는 갈색거저리에서 분리한 항진균 단백질을 이용한 항균효과 검증(13) 과 건조 방법별 항산화 효과(14) 등이 있으며 동의보감 및 본초강목에는 간경화, 간암, 파상풍 등에 효과가 있는 것으로 알려져 있다. 하지만 효능에 대한 연구가 미비하여 다양한 방면에서 탐색이 필요하다, 그러므로 본 연구에서는 갈색거저리의 용매별 추출물에 대한 항산화, 항염증 효과를 검증하는 실험을 실시하였다.
재료 및 방법
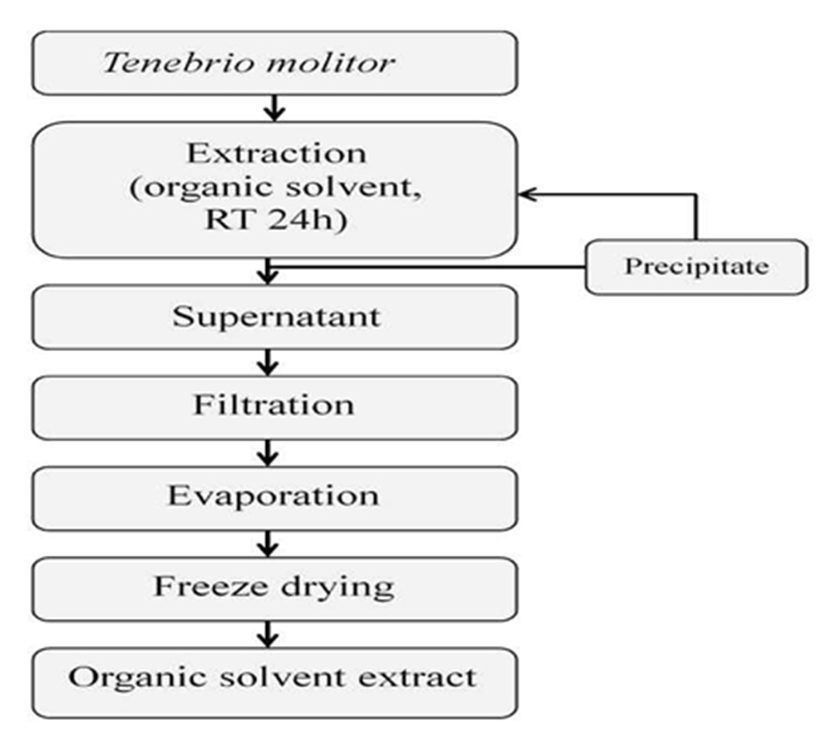
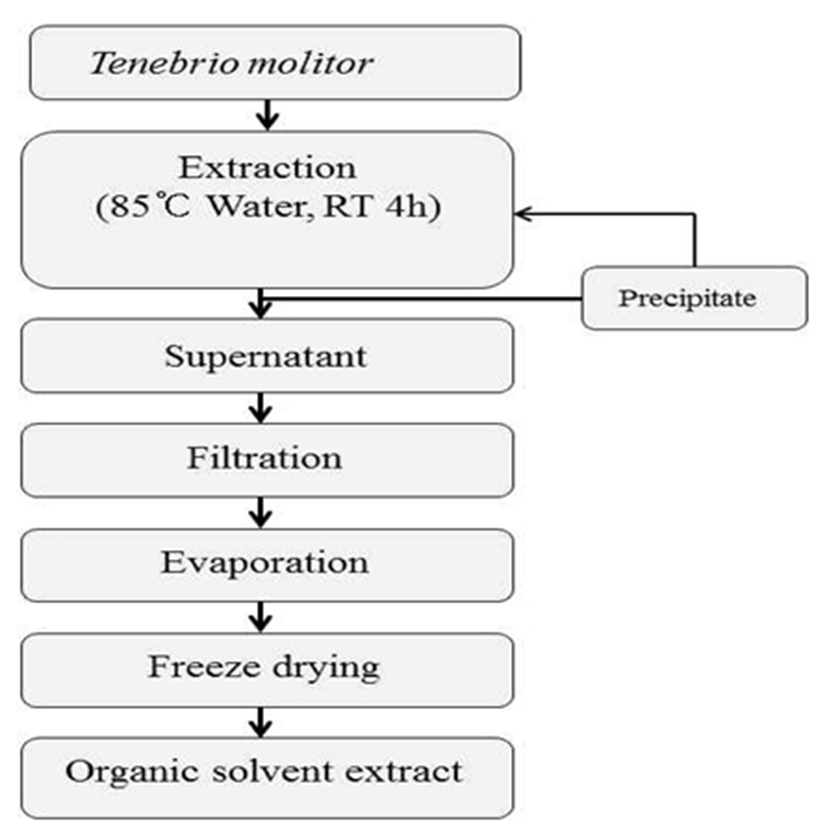
본 실험에 사용한 갈색거저리(T. Molitor)는 에스웜(Swarm, Gyeonggi, Korea)에서 구입하여 용매별로 추출 후 동결건조하여 사용하였다. 갈색거저리의 용매 추출은 Fig. 1, 2와 같이 추출하였다. 에탄올과 메탄올을 각각 50%, 70%, 100% 추출물은 중량의 10배의 양으로 실온에서 stirrer(250 rpm) 를 사용하여 24시간 추출하고 상등액을 분리하는 방법으로 3회 반복하였고, 열수 추출물은 85℃에서 4시간씩 3회 반복추출하였다. 추출물은 원심분리 및 여과, 농축 후 동결 건조하여 냉장실에 보관하면서 실험의 시료로 사용하였다.
항산화능 측정 실험에 사용된 시약인 2,2'-azino-bis (3-ethylbenzthiazolin e-6-sulphonic acid), 1-1-diphenyl-2-picryl-hydrazyl(DPPH), xanthine, xanthine oxidase, nitro blue tetrazolium(NBT) 등은 sigma chemical Co.(St, Louis, MO, USA)에서 구입하였다.
항염증측정실험에사용된시약인p-dimethylaminobenzaldehyde, sodium nitrite, griess reagent, ripa buffer, lipopolysaccharide, protease inhibitor 등은 sigma chemical Co., Ltd.(St. Louis, MO, USA)에서 구입하여 사용하였다. PGE2와 cytokine 측정을 위한 ELISA kit는 R&D systems Inc.에서 구입하였으며 iNOS, COX-2, 2차 antibody는 santa cruz(Biotech, CA, USA)에서 구입하였다.
세포 생존율 측정에 사용된 세포주는 macrophage cell (RAW 264.7)로 american type culture collection(Manassas, VA, USA)에서 구입하여 사용하였다. 세포 배양을 위한 dulbecco's modified eagle medium(DMEM), fetal bovine serum(FBS)은 LONZA Co.에서 구입하여 사용했으며, 0.25% trypsin-EDTA, 0.4% trypan blue stain은 gibco BRL Co.(Grand Island, NY, USA)에서 구입하여 사용하였고, 3-[4,5-dimethylthiazol-2-yl]-2,5-diphenyl-tetrazolium bromid(MTT)는 sigma chemical Co., Ltd.(St. Louis, MO, USA)에서 구입하여 사용하였다.
본 실험에 사용된 기기는 UV/VIS spectrophotometer (Hitachi, Tokyo, Japan), polarization microscope(Olympus BX 51, Tokyo, Japan), western imaging system(CAS-400SM, Davinch-K, Seoul, Korea), rotary vacuum evaporator (EYELA, Tokyo, Japan), centrifμge(Hitachi, Tokyo, Japan), freeze drier(Ilshin, Gimpo, Korea), microscope (Olympus, Tokyo, Japan), CO2 incubator(Hanbaek Scientific Co., Bucheon, Korea), pH meter(Metrohm, Herisau Switzerland), BOD Incubator(Hanbaek Scientific Co., Bucheon, Korea), autoclave(Hanbaek Scientific Co., Bucheon, Korea), ELISA reader(Molecular Devices, California, USA)를 사용하였다.
실험 방법
전자공여능(EDA, electron donating ability)은 Blois(15)의 방법을 변형하여 측정하였다. 각 시료용액과 0.2 mM의 1,1-diphenyl-2-picrylhydrazyl(DPPH)를 1:1 비율로 넣고 교반한 후 흡광도 517 nm에서 측정하였다. 전자공여능은 시료용액의 첨가군과 무첨가군의 흡광도 감소율로 나타내었다.

ABTS+ radical을 이용한 항산화력 측정은 ABTS+· decolorization assay 방법(16) 에 의하여 측정하였다. 7 mM 2,2-azino-bis(3-ethyl-benthiazoline-6-sul fonic acid)와 2.4 mM potassium persulfate를 혼합하여 실온에서 24시간 동안 방치하여 ABTS+·을 형성시킨후 ethanol로 희석하여 ABTS+· 100 μL에 시료 100 μL를 더하여 1분 동안 방치한 후 흡광도 734 nm에서 측정하였다.

Superoxide anion radical 소거능은 nitroblue tetrazolium (NBT) 환원방법(17)에 의해 측정하였다. 각 시료용액 0.1 mL와 0.1 M potassium phosphate buffer(pH 7.5) 0.6 mL xanthine(0.4 mL)과 NBT(0.24 mM)을 녹인 기질액 1 mL를 첨가하고 xanthine oxidase(0.049 U/mL) 1 mL를 가하여 37℃에서 20분간 반응시킨 후 1 N HCl을 1 mL 가하여 반응을 종료시킨 다음, 반응액 중에 생성된 superoxide anion radical 의 양을 흡광도 560 nm에서 측정하였다.

본 실험에 이용한 RAW 264.7 세포의 배양은 10% FBS과 1% penicillin/streptomycin(100 U/mL)을 첨가한 DMEM 배지를 사용하였으며, 37℃, 5% CO2 incubator에 적응시켜 계대 배양하였다.
세포 독성 측정은 Carmichael(18)의 방법에 따라 측정하였다. 각 세포주 RAW 264.7은 96 well plate에 5×104 cells/well이 되게 0.18 mL 분주하고, 시료를 농도 별로 조제하여 0.02 mL 첨가한 후 37℃, 5% CO2incubator에서 24시간 배양하였다. 여기에 5 mg/mL 농도로 제조한 MTT 용액 0.02 mL 첨가하여 4시간 배양한 후 배양액을 제거하고 각 well당 DMSO 0.15 mL를 가하여 실온에서 30분간 반응시킨 뒤 ELISA reader로 540 nm에서 흡광도를 측정하였다. 세포 독성 측정은 시료용액의 첨가군와 무첨가군의 흡광도 감소율로 나타내었다.

Nitric oxide(NO) 측정은 cell의 supernatant에서 NO의 양을 nitrite and nitrate로서 측정을 하였다(19). Nitrite에 대한 nitrate로 환원된 후의 안전한 형태인 griess reagent(Sigma, Darmstadt, Germany)를 사용하였으며, 6 well plate에 2×106 개의 cell을 confluence가 80%일 때, PBS로 2번 washing 한 후 무혈청 배지를 사용하여 12시간 이상 배양시킨 다음 lipopolysacchride(LPS) 10 μg/mL을 control 군을 뺀 모든 well 에 다 넣어서 자극시켰다. 2시간 후에 시료를 농도별로 처리하여 실험하였다. NO 생성량은 24시간 후에 supernatant를 모아 griess regent로 10분간 반응시킨 후에 540 nm에서 흡광도를 측정하였다.
cell을 차가운 PBS로 2회 세척 후 RIPA buffer 10 mL에 complate mini 1 tab을 가한 것으로 용해해서 4℃ 12,000 rpm에서 15분간 원심 분리 하였다. 원심 분리하여 얻은 상층액은 bradford assay로 정량하여 25 μL의 단백질을 10% 의 SDS-PAGE 에서 전기 영동하여 분리하였다. 분리된 단백을 PVDF membrane에 옮긴 다음 실온에서 30분 동안 blocking buffer(5% skim milk in TBST)에서 incubation 시켰다. 1차 항체를 희석하여 3시간 동안 반응한 다음, 다시 10분 간격으로 TBST로 3회 washing 하고 membrane을 HRP 가 중합된 각각의 2차 항체를 1:1,000로 희석하여 60분 동안 반응시켰다. 3회 washing 한 뒤 davinch-k western imaging system 기기를 이용하여 밴드 확인 및 정량 하였다.
100 mm dish에 cell seeding을 하고 24시간 동안 배양한 후 샘플을 농도별로 처리하여 cell의 종류에 따라 24~48시간 동안 유지시켰다. 상등액을 제거한 후 trizol lysis buffer 각각의 dish 에 1 mL씩 분주하여 세포를 lysis 한 후 상온에서 5분 동안 방치하였다. Trizol buffer를 mL 당 chloroform 200 μL~500 μL를 첨가하여 약 15초 동안 강하게 vortexing 해주고 다시 상온에서 5분간 방치하였다. 원심분리기를 이용하여 4℃에서 12,000~15,000 rpm으로 15분간 실시하고 상등액 400 μL를 새 tube로 옮겨서 isopropyl alcohol 400 μL와 1:1로 조심스럽게 섞어준 뒤 상온에서 5~10분간 두었다. 앞의 과정과 동일하게 원심분리를 하고 tube의 바닥에 있는 RNA pellet을 확인한 후 상층액을 제거하였다. 70% ethanol로 RNA pellet을 washing 해주고 남은 ethanol을 날린 후 RNase free water에 RNA pellet을 녹여주었다. cDNA로의 역전사와 증폭은 TOPscript™ RT DryMIX(Enzynomics, Daejeon, Korea)를 이용하여 시행하였다.
SYBR Green PCR Mastet Mix(applied biosystems, UK)를 사용하여 cDNA와 TOPreal™ qPCR 2X PreMIX(Enzynomics, Daejeon, Korea), primer(Table 1)를 넣고 ABI step one plus(Applied biosystem, CA, USA) 기기를 이용하여 실시간 정량 분석을 하고 stepone Software(Applied biosystem, CA, USA)를 사용하여 95℃에서 2분간 denature시킨 후 95℃에서 10초, 60℃에서 15초, 72℃에서 20초간 반응하는 온도순환조건을 40회 반복한 결과를 분석하였다.
| Gene | Primer | Sequencs(5’→3’) |
|---|---|---|
| iNOS | Forward | ACA TCG ACC CGT CCA CAG TAT |
| Reverse | CAGAGG GGT AGG CTT GTC TC | |
| COX-2 | Forward | TCC CTA AAG GAA AAG TGG GAC |
| Reverse | GAG CGC ATT AAC CTC AGG ACC |
결과 및 고찰
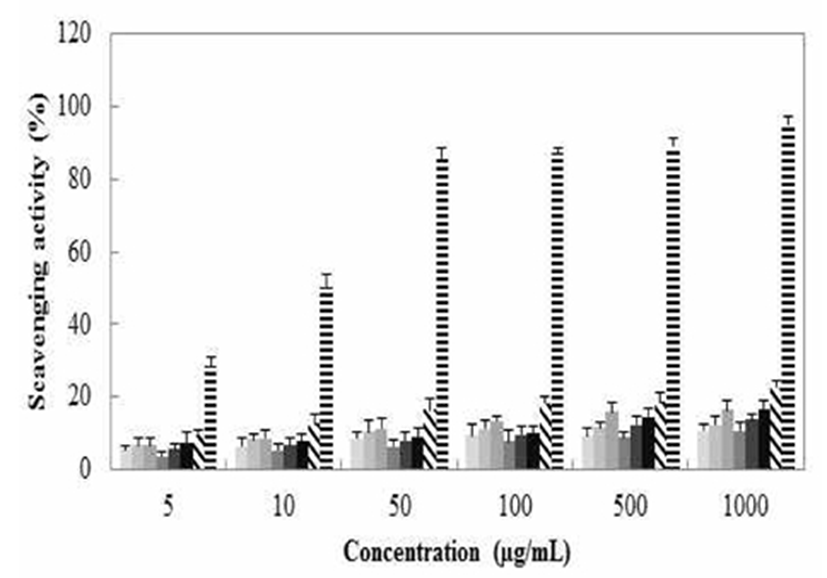
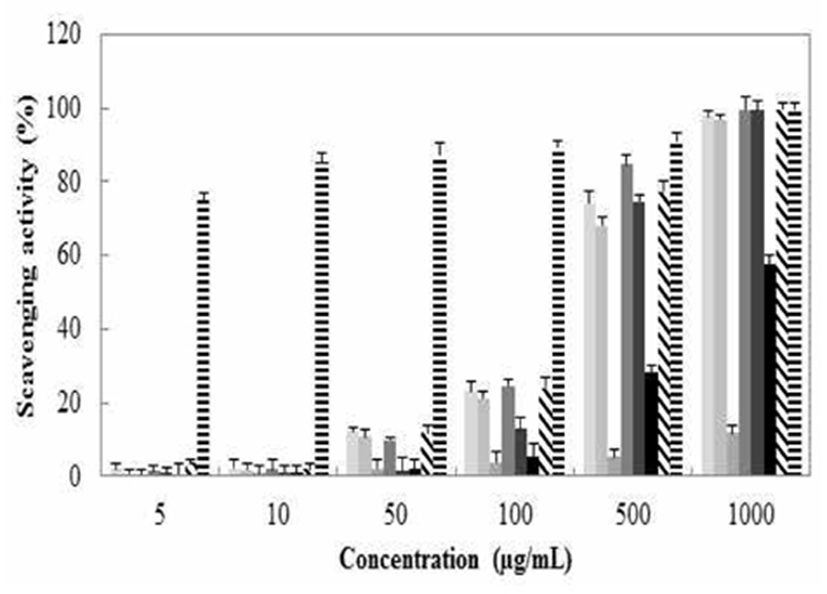
1,1-diphenyl-2-picrylhydrazyl(DPPH)는 짙은 자색을 띄는 그 자체가 안정한 free radical로서 517 nm에서 특징적인 광흡수를 나타내는 화합물이다. 또한 glutathion, cystein과 같은 함황아미노산과 L-ascorbic acid 및 BHA 등에 의해 환원되어 탈색되므로 여러 소재에서 항산화물질을 확인하는데 많이 사용되고 있다. 이 라디컬은 알코올 등의 유기용매에서 매우 안정하며, 특히 여러가지 항산화 기작 중 proton-radical scavaenger에 의하여 탈색되기 때문에 항산화 활성을 육안으로 쉽게 관찰할 수 있는 장점이 있다. 반면에 indole, uric acid, flavonoid, polyphenol 등에도 민감하여 비교적 넓은 스펙트럼을 보이는 단점도 있다. 갈색거저리의 전자공여능은 Fig. 3와 같이 나타내었다. 최고 농도인 1,000 μg/mL에서 T. Molitor water extract(TDW)의 경우 22.5%로 나타났고 T. Molitor methanol extract(TM100)은 16.5%, T. Molitor ethanol extract(TE100)은 16.2%의 저해율을 나타내었다.
 TE50, T. Molitor extracted with 50% Ethanol;
TE50, T. Molitor extracted with 50% Ethanol;  TE70, T. Molitor extracted with 70% Ethanol;
TE70, T. Molitor extracted with 70% Ethanol;  TE100, T. Molitor extracted with 100% Ethanol;
TE100, T. Molitor extracted with 100% Ethanol;  TM50, T. Molitor extracted with 50% Methanol;
TM50, T. Molitor extracted with 50% Methanol;  TM70, T. Molitor extracted with 70% Methanol;
TM70, T. Molitor extracted with 70% Methanol;  TM100, T. Molitor extracted with 100% Methanol;
TM100, T. Molitor extracted with 100% Methanol;  TDW, T. Molitor extracted with Water;
TDW, T. Molitor extracted with Water;  BHA, Butylated hydroxyl anisole.
BHA, Butylated hydroxyl anisole.
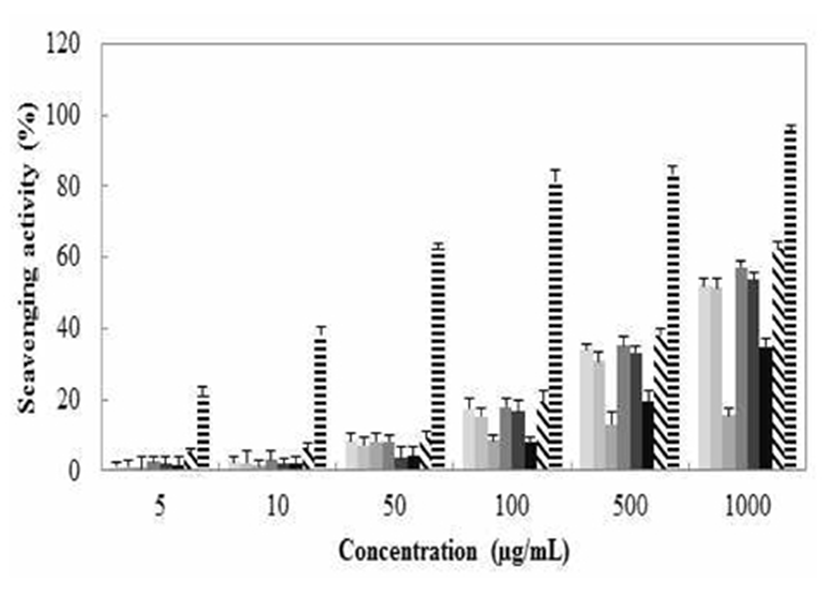
2,2'-azino-bis-3-ethylbenzothiazoline-6-sulphonic acid(ABTS)는 DPPH와 비슷한 원리로 항산화 활성을 측정할 수 있는 방법으로서 실험 전 potassium persulfate와 미리 하루 정도 반응시켜 청록색의 라디칼을 생성해야 한다. 시료를 첨가하면 연한 하늘색으로 변하는 것을 측정하는 방법이며 hydrogen donating antioxidant와 chain breaking antioxidant 모두를 측정할 수 있다. 갈색거저리의 ABTS+ radical scavenging activity는 Fig. 4에 나타내었다. 최고 농도인 1,000 μg/mL에서 물추출의 경우 99.7%로 나타났고 메탄올 50% 추출은 99.8%, 메탄올 70% 추출은 99.5%의 저해율을 보여주었다. 이는 대조군인 BHA의 99.9%의 전자공여능과 유사한 수준으로 물과 메탄올 50%, 70% 추출물의 높은 항산화능을 확인할 수 있었다.
 TE50, T. Molitor extracted with 50% Ethanol;
TE50, T. Molitor extracted with 50% Ethanol;  TE70, T. Molitor extracted with 70% Ethanol;
TE70, T. Molitor extracted with 70% Ethanol;  TE100, T. Molitor extracted with 100% Ethanol;
TE100, T. Molitor extracted with 100% Ethanol;  TM50, T. Molitor extracted with 50% Methanol;
TM50, T. Molitor extracted with 50% Methanol;  TM70, T. Molitor extracted with 70% Methanol;
TM70, T. Molitor extracted with 70% Methanol;  TM100, T. Molitor extracted with 100% Methanol;
TM100, T. Molitor extracted with 100% Methanol;  TDW, T. Molitor extracted with Water;
TDW, T. Molitor extracted with Water;  BHA, Butylated hydroxyl anisole.
BHA, Butylated hydroxyl anisole.
Superoxide anion radical은 호기성 세포의 효소 및 비효소적 단계에서 생성되는 독성이 매우 강한 radical로서 노화와 관련된 산화반응의 개시단계에 관여하고 있다. 또한 superoxide anion radical은 hydrogen peroxide, hydroxyl radical, singlet oxygen 등과 같은 다른 활성산소종의 생성에 관여하여 지질, 단백질, DNA 등에 산화적 손상을 유도하는 것으로 알려져 있다(20,21). Superoxide anion radical은 NBT 와 반응하여 청색을 띠게 되는데 시료 중에 항산화 물질이 존재하면 superoxide anion radical-NBT complex 형성을 방해하여 청색이 탈색되고(22) 페놀성 화합물들이 superoxide anion radical을 소거한다는 보고도 있다(23). 최고농도 1,000 μg/mL에서 물추출물이 62.4%, 메탄올 50%가 57.1%, 메탄올 70%가 53.5%로 에탄올추출물보다 상대적으로 좋은 활성을 보였다. 갈색거저리의 superoxide anion radical 저해활성은 Fig. 5에 나타내었다.
 TE50, T. Molitor extracted with 50% Ethanol;
TE50, T. Molitor extracted with 50% Ethanol;  TE70, T. Molitor extracted with 70% Ethanol;
TE70, T. Molitor extracted with 70% Ethanol;  TE100, T. Molitor extracted with 100% Ethanol;
TE100, T. Molitor extracted with 100% Ethanol;  TM50, T. Molitor extracted with 50% Methanol;
TM50, T. Molitor extracted with 50% Methanol;  TM70, T. Molitor extracted with 70% Methanol;
TM70, T. Molitor extracted with 70% Methanol;  TM100, T. Molitor extracted with 100% Methanol;
TM100, T. Molitor extracted with 100% Methanol;  TDW, T. Molitor extracted with Water;
TDW, T. Molitor extracted with Water;  BHA, Butylated hydroxyl anisole.
BHA, Butylated hydroxyl anisole.
갈색거저리 추출물에 의한 macrophage cell의 세포 생존율을 MTT assay를 통해 확인한 결과를 Fig. 6에 나타내었다. 추출 용매별, 농도별로 측정한 결과 농도 10, 25, 50, 100 μg/mL에서 모두 95% 이상의 생존율을 보였고 nitric oxide 측정 및 western blot, real-time PCR은 위 4개의 구간으로 설정하여 실험을 진행하였다.
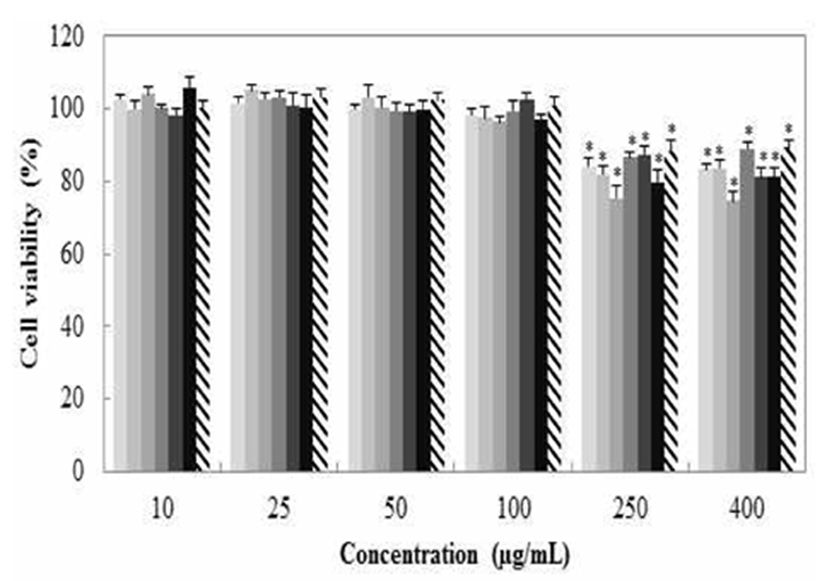
 TE50, T. Molitor extracted with 50% Ethanol;
TE50, T. Molitor extracted with 50% Ethanol;  TE70, T. Molitor extracted with 70% Ethanol;
TE70, T. Molitor extracted with 70% Ethanol;  TE100, T. Molitor extracted with 100% Ethanol;
TE100, T. Molitor extracted with 100% Ethanol;  TM50, T. Molitor extracted with 50% Methanol;
TM50, T. Molitor extracted with 50% Methanol;  TM70, T. Molitor extracted with 70% Methanol;
TM70, T. Molitor extracted with 70% Methanol;  TM100, T. Molitor extracted with 100% Methanol;
TM100, T. Molitor extracted with 100% Methanol;  TDW, T. Molitor extracted with Water.
TDW, T. Molitor extracted with Water.
Macrophage cell인 RAW 264.7에서 갈색거저리의 nitric oxide(NO)의 억제 정도를 측정하기 위해 용매별, 농도별로 샘플을 처리하여 NO의 양을 측정한 결과 Fig. 7와 같이 나타내었다. 모든 용매에서 농도 의존적으로 감소하는 결과를 보였고 최고 농도 100 μg/mL에서 TM50은 23.5%, TDW는 25.8%의 저해효과를 보였다.
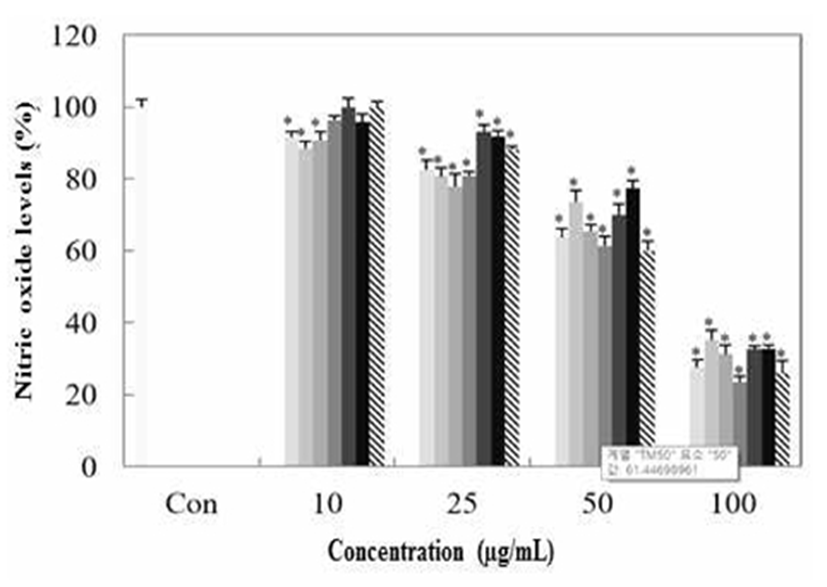
 TE50, T. Molitor extracted with 50% Ethanol;
TE50, T. Molitor extracted with 50% Ethanol;  TE70, T. Molitor extracted with 70% Ethanol;
TE70, T. Molitor extracted with 70% Ethanol;  TE100, T. Molitor extracted with 100% Ethanol;
TE100, T. Molitor extracted with 100% Ethanol;  TM50, T. Molitor extracted with 50% Methanol;
TM50, T. Molitor extracted with 50% Methanol;  TM70, T. Molitor extracted with 70% Methanol;
TM70, T. Molitor extracted with 70% Methanol;  TM100, T. Molitor extracted with 100% Methanol;
TM100, T. Molitor extracted with 100% Methanol;  TDW, T. Molitor extracted with Water.
TDW, T. Molitor extracted with Water.
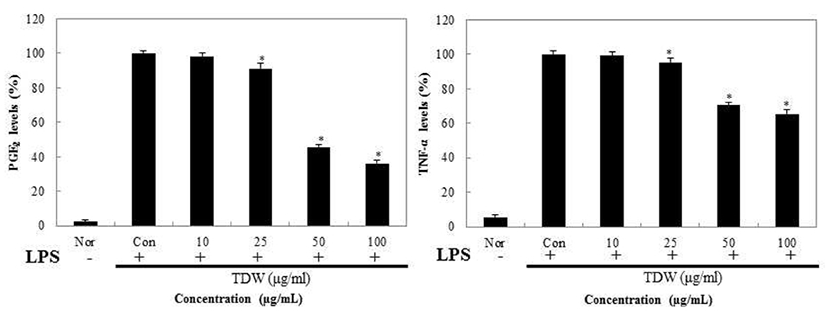
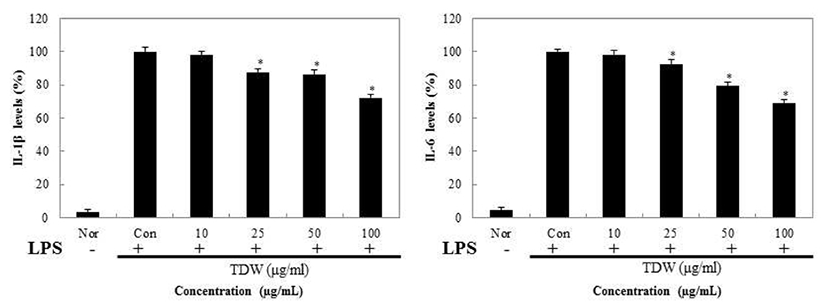
Macrophage cell인 RAW 264.7에서 갈색거저리의 prostaglandin E2(PGE2)와 pro-inflammatory cytokine의 형성을 억제하는지 확인하기 위해 TNF-α, IL-1β, IL-6 그리고 PGE2를 ELISA kit를 통해 측정하였고 그 결과를 Fig. 8,9에 나타내었다. RAW 264.7을 이용한 NO실험결과 TDW가 가장 염증억제가 우수함을 확인하였고, 이에 따라서 TDW만 실험을 진행 하였다. TDW를 처리한 결과 PGE2의 경우 농도 100 μg/mL에서 36.2%의 저해율을 보여주었고 TNF-α 는 65.3%, IL-1β는 72.3%, IL-6는 69.2%의 억제 활성을 확인하였다.
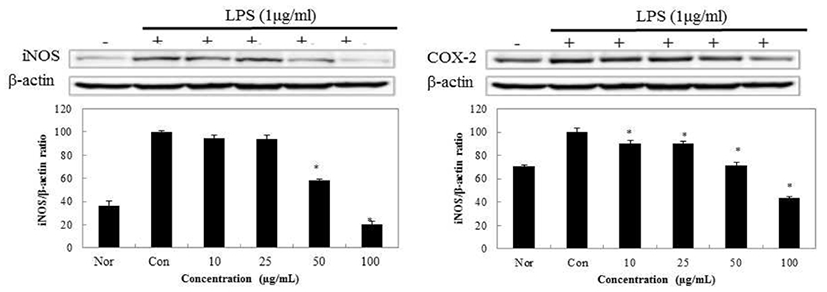
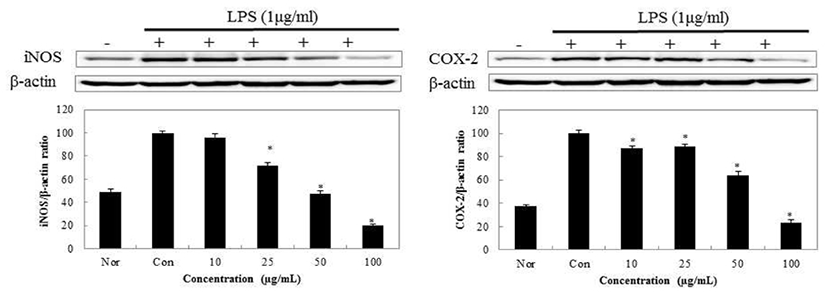
갈색거저리에 의한 NO의 저해 기전을 보기 위해 iNOS의 단백질 발현을 보았고, PGE2의 저해 경로를 보기 위해 COX-2의 발현을 측정한 결과 Fig. 10,11과 같이 나타내었다. TM50의 iNOS 발현 억제를 보았을때 100 μg/mL의 농도에서 20.3%를 나타내었고 COX-2의 발현 억제율은 42.5% 로 측정되었다. 반면에 동일한 농도의 TDW의 경우 iNOS 발현율이 19.7%, COX-2의 발현율은 23.2%로 TM50보다 TDW의 추출이 억제 정도가 좋게 나타났다.
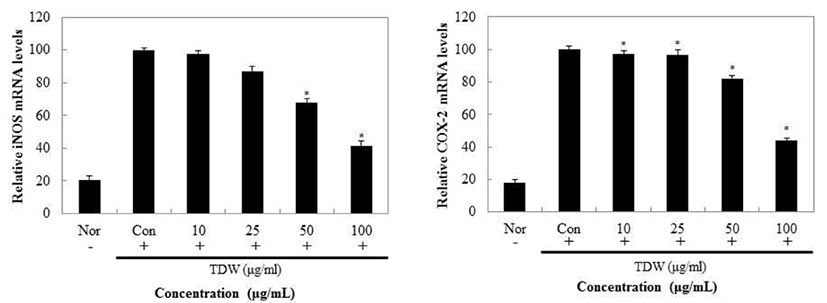
TDW에 의한 NO의 저해 기전을 보기 위해 iNOS의 발현을 확인하고, PGE2의 저해 경로를 보기 위해 COX-2의 발현을 mRNA 수준에서 측정한 결과 Fig. 12와 같이 나타내었다. TDW의 iNOS와 COX-2 발현 억제 효과는 농도의존적으로 감소하는 효과를 보였고 최고 농도인 100 μg/mL에서는 약 60%의 억제효과를 확인할 수 있었다. 미래의 대체 식량자원으로 주목받고 있는 갈색거저리는 식량자원 으로서의 역할 뿐만 아니라 약품, 화장품등에서의 사용에 높은 가능성을 가지고 있다. 갈색거저리 추출물은 전자공여능, ABTS+ radical scavenging, Superoxide anion radical 저해활성등의 항산화에 효능이 있는 것으로 나타났으며, Nitric oxide 저해활성, PGE2와 cytokine 저해활성, iNOS 및 COX-2 발현 억제등 항염증 소재로서도 효능을 나타내었다.
이러한 결과를 종합 해 볼 때, 갈색거저리는 항산화, 항염증뿐만 아니라 다른 다양한 분야에서도 연구해볼만한 가치와 가능성을 가진다고 사료된다.
요 약
본 연구의 목적은 갈색거저리의 추출물에 따른 약리활성에 대한 검증 및 효능 평가이다. 갈색거저리의 항산화, 항염증에 대하여 효과를 확인 하였다. 염증 반응은 자극이 가해지면 histamin, serotonin, prostaglandin과 같은 혈관 활성물질에 의해 혈관 투과성이 증대되어 염증을 유발하고 cytokine, free radical, lysosomal enzyme 등 다양한 매개 인자가 관여한다. 자극에 의한 macrophage cell의 염증반응은 tumor necrosis factor-α(TNF-α), interleukin-6(IL-6), interleukin-1β(IL-1β)와 같은 pro-inflammatory cytokine의 발현이 유도되고, inducible nitric oxide synthase(iNOS)와 cyclooxygenase-2 (COX-2)에 영향을 받는 유전자의 발현을 자극하게 되어 nitric oxide(NO) 및 PGE2등의 염증 인자가 생성된다. 이에 따라 갈색거지리 추출물의 항염증에 대한 연구를 위해 이에 영향을 주는 인자인 iNOS, COX-2, PGE2, MAPKs의 단백질 발현억제 작용을 확인 하였다. 그 결과 TDW 처리군에서 iNOS 발현율이 19.7%, COX-2의 발현율은 23.2%의 값을 나타내었고, PGE2의 저해 경로를 보기 위해 COX-2의 발현을 mRNA 수준에서 측정한 결과 최고 농도인 100 μg/mL에서는 약 60%의 억제효과를 확인할 수 있었다. 결론적으로 TDW는 염증 생성 기전에 작용하여 이 활성을 억제하는데 있어서 효과를 줄 수 있으며 지속적으로 연구해볼 가치가 있다고 사료된다.