서 론
녹차는 차나무(Camella sinensis L.)에서 어린잎을 채취하여 가공한 것으로 전 세계적으로 많이 음용되고 있는 기호식품중의 하나로 다양한 생리활성 효과도 있는 것으로 알려져 있다(1). 녹차의 성분은 채엽 시기(2), 품종(3), 재배환경(4) 등에 따라 차이가 난다고 알려져 있으며 특히 녹차에 함유되어있는 카테킨 화합물의 양이나 질은 pH, 온도, 효소처리 등의 추출조건이나 방법에 따라서 크게 좌우된다고 보고되고 있다(5). 차는 당, 유기산, 질소화합물, polyphenol, 섬유질, 비타민 및 무기질로 구성되어 있고 이들 중 polyphenol류를 상당량 함유하고 있다(6). 차에 함유된 주요 polyphenol류는 flavonoid와 이의 유도체인데 카테킨 화합물은 flavonoid 유도체의 단량체인 flavan 3-ol을 칭한다(7). 녹차의 주요 카테킨 화합물은 (-)-Epicatechin(EC), (-)- Epigallocatechin(EGC), (-)-Epicatechingallate(ECG), (-)- Epigallocatechingallate(EGCG) 등이다(8). 이러한 녹차의 카테킨 화합물은 항산화 작용, 항균작용, 항암작용, 콜레스테롤 저하 등의 작용과 카페인에 의한 중추신경 흥분, 이뇨, 강심, 수렴, 해열 등의 작용이 있는 것으로 보고되고 있다(9-14). 우리나라 음료 시장은 소득수준이 향상되면서 2000년대 이후 건강 지향적인 관심도의 증가, 문화상품으로서의 인식 등으로 웰빙 식품에 대한 소비가 확대되고 있으며 특히, 20, 30대 여성들을 중심으로 건강뿐만 아니라 미용에 대한 관심도 동시에 높아지고 있는 실정이다. 특히 2008년 3월 건강기능성식품에 관한 정의를 법률로 개정, 공포하여 건강기능성식품을 손쉽게 접할 수 있게 되었고 녹차와 오가피차 등 다이어트 및 기타 기능성을 강조한 식물소재를 이용한 대용차 및 건강기능성 식품이 급성장하고 있는 추세이다(15). 이러한 녹차의 추출물을 보다 고순도로 이용하고자 녹차로부터 카테킨을 정제하기 위해 크로마토그래피법 및 활성탄과 같은 흡착제를 이용하여 녹차추출물로부터 카테킨 성분을 분배 추출 및 분리하는 연구가 보고되어있다(16). 그러나 이와 같은 방법은 추출 및 정제과정이 복잡하고 시간이 많이 걸리거나 가격이 비싸다는 단점을 가지고 있어서 경제적이면서도 비교적 단순한 공정의 카테킨 성분을 추출하고 분리, 정제하는 공정의 개발이 요구되고 있다. 한편 chloroform과 ethyl acetate등과 같은 유기용매를 이용하여 고순도로 카테킨을 정제하는 것에 대하여 보고(17)된 연구에 의하면 녹차 추출물을 유기용매로 정제시 녹차 건고물기준 함량이 46~47%로 증가하여 고순도 녹차 추출물의 제조에 효과적이라고 보고되었다. 그러나 chloroform과 ethyl acetate등의 유기용매는 대용량 단위의 식품제조에 사용하기에는 건강 및 공정상 위험요소가 많을 뿐 아니라 생산비용도 증가할 것으로 사료되어 본 연구에서는 chloroform과 ethyl acetate의 용매를 이용한 방법을 참고하여 식품으로서 안전하고 비교적 생산비용을 절감할 수 있는 방안으로 에탄올만 이용하여 식품가공 및 건강기능성 식품산업에 효과적으로 적용하고자 하였다. 본 연구에서는 녹차 추출물의 유용성분인 카테킨화합물과 카페인을 발효주정을 이용하여 식품으로서의 안전성 확보와 더불어 비교적 단순한 공정으로 카테킨 성분을 보다 고순도로 추출하고자 에탄올 용매비 및 추출온도에 따른 성분을 반응표면분석을 통하여 최적 조건을 탐색하였다.
재료 및 방법
본 실험에서 사용된 녹차는 농업회사 법인 J사(Korea)에서 2015년 10월에 제조된 녹차 분쇄 잎을 제공받아 사용하였다. 녹차 성분 분석을 위한 표준품 (-)-Epicatechin(EC), (-)-Epigallocatechin(EGC), (-)-Epicatechingallate(ECG), (-)- Epigallocatechingallate(EGCG) 및 카페인은 Sigma Chemical Co.(St. Louis, MO, USA) 제품을 사용하였고 Acetonitrile, Water 등 용매는 HPLC용으로 Burdick&Jackson(Morris Plains, NJ, USA)제품을 사용하였다. 추출용 에탄올은 95% 식음용 발효주정(Ethanol Supplies World Co., Ltd., Jeonju, Korea)을 사용하였다.
본 연구에서 에탄올 재추출 조건의 예비 설정에 필요한 녹차의 추출 방법은 Kim(17)의 방법을 참고하였으며 추출, 여과 및 농축 등 설비와 최종 제품 제조에 투입되는 생산비용 등의 경제성을 고려하여 적용 가능한 전처리 추출 조건을 설정하였다. 즉 Fig. 1에 나타낸 바와 같이 녹차 100 g에 50% 에탄올을 1,500 g을 가한 후 70℃에서 3시간동안 추출한 액을 Whatman filter paper(Filter number 2, GE Healthcare, Buckinghamshire, UK) 여과 후 회전농축기(EYELA N-1000, Sunileyera, Seongnam, Korea)로 감압건조한 건고물을 시료로 사용하였다. 이 녹차 추출 건고물 5 g에 50, 95, 99% 에탄올 농도, 시료대 용매비를 3, 10, 20 mL/g 및 온도 -5, 20℃에서 재추출하여 여과된 재추출물을 HPLC 분석을 통해 추출조건 최적화 실험의 기본조건으로 활용하였다.

에탄올을 이용한 녹차의 카테킨 성분의 최적 재추출 조건을 알아내기 위해 반응표면분석법(response surface methodology, RSM)을 사용하였으며 예비실험의 결과를 바탕으로 중심합성계획(central composite design)을 실시하였다. 에탄올 재추출 공정의 독립변수(Xn)는 에탄올 용매비(mL/g)(X1)와 추출 온도(℃)(X2)에 대한 실험 범위를 선정하여 5단계(-2, -1, 0, 1, 2)로 나누어 Table 1에 나타내었고 중심합성계획에 따른 실험구는 Table 2에 나타내었다. 이들 독립변수에 의해 영향을 받는 종속 변수(Yn)는 건고물 수율(Y1)과 건강기능식품의 기준 및 규격(18)에 고시된 녹차 추출물의 규격에 근거하여 카테킨류 즉, EGC(Y2), EC(Y3), EGCG(Y4), ECG(Y5) 함량과 카페인 함량(Y6)으로 설정하였으며 3회 반복 측정한 후 각각 회귀분석을 실시하였다. 반응표면분석은 SAS software(Version 9.2, SAS institute Inc., Cary, NC, USA)를 이용하여 회귀분석에 의한 최적조건을 예측하였으며 회귀분석 결과 임계점이 최대점 혹은 최소점이 아니고 안장점일 경우에는 능선분석을 통하여 최적점을 구하였으며, 본 실험에 사용된 회귀식은 다음과 같다.
Y=b0+b1X1+b2X2+b11X12+b12X1X2+b22X22
추출특성의 모니터링과 예측된 모델식을 이용하여 3차원 반응표면분석으로 최적 조건 범위를 해석하였다.
| Symbol | Independent variable | Coded level | ||||
| -2 | -1 | 0 | 1 | 2 | ||
| X1 | Ratio of solvent to sample content (mL/g) | 1 | 4 | 7 | 10 | 13 |
| X2 | Extraction temperature (℃) | -20 | -10 | 0 | 10 | 20 |
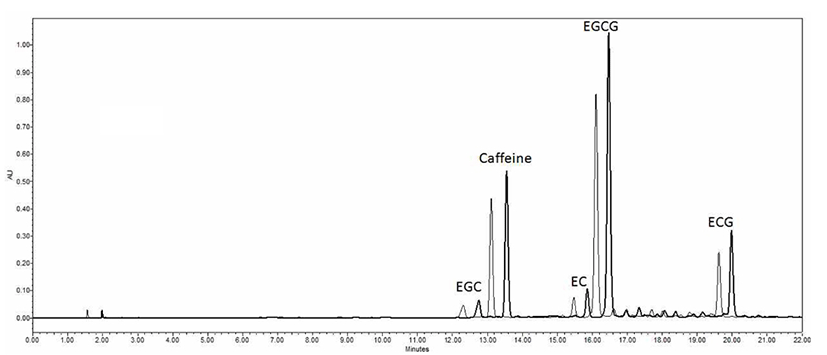
카테킨류 및 카페인은 Choung과 Lee의 방법(19)을 변형하여 분석하였다. 녹차의 카테킨 및 카페인 분석은 HPLC (Waters Co., Ltd., Miliford, MA, USA)를 이용하여 분석하였고 분석 조건은 Table 3에 나타내었다. 에탄올 재추출 전 녹차 추출물의 카테킨 함량은 30.91%, 카페인 함량은 4.5%인 것을 시료로 사용하였다. 각 시험구의 분석결과는 표준물질의 retention time과 비교하여 3번 반복 측정하였고 표준시료의 peak 면적에 의해 산출된 백분율(%)함량 값을 기준으로 평균과 표준편차로 나타내었다.
결과 및 고찰
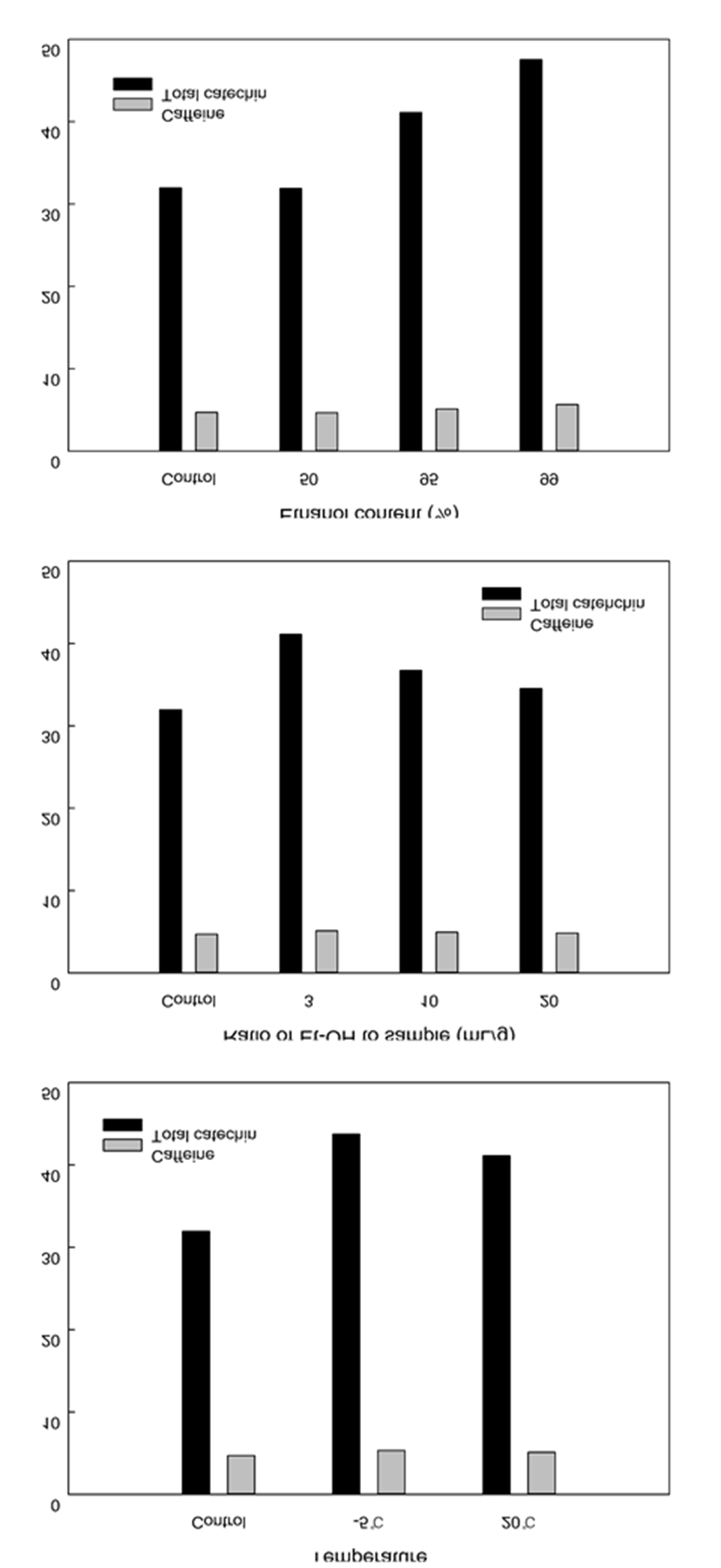
에탄올 재추출조건의 최적화를 위한 예비 설정에 필요한 실험으로 재추출 농도와 시료대 용매비, 온도에 대한 추출특성을 확인하였고 이 결과에 따른 예비 실험 조건을 바탕으로 중심합성계획을 실시하였다(Fig. 2). 총 카테킨 함량은 에탄올 농도가 높아질수록 증가하는 경향을 보였는데 50% 에탄올 재추출은 31.2%로 에탄올 재추출전 녹차추출물의 총 카테킨 함량 30.91%와 차이가 거의 없었고, 99% 에탄올로 재추출시 총카테킨 함량은 47.38%(건고물 기준)로 가장 높았고 95% 에탄올의 경우 40.62%로 나타났다. 99% 에탄올의 경우 식품용으로 사용이 불가능하고 95% 이하의 농도에서는 재추출에 대한 효과가 미미하여 적용가능한 95% 에탄올로 고정하여 실험을 진행하였다. 에탄올 사용 용매비에 따른 총카테킨 함량은 시료대 용매비가 3, 10, 20 mL/g으로 증가할수록 총카테킨 함량이 41.21, 36.79, 34.43%로 감소하였으며 카페인 함량도 유사한 경향을 나타내었다. 에탄올 재추출시 온도에 따른 총카테킨 함량은 95% 에탄올로 재추출시 온도가 낮을 때 카테킨 및 카페인 함량이 더 높음을 확인하였다. 추출시간에 대한 카테킨 및 카페인 함량 변화는 거의 없어 효과가 없었다(data not shown). 따라서 에탄올 재추출 농도 95%, 재추출 시간은 10분으로 고정하고 시료대 용매비와 재추출 온도를 독립변수로 하여 중심합성계획법에 의해 추출조건 최적화를 실시하였다.
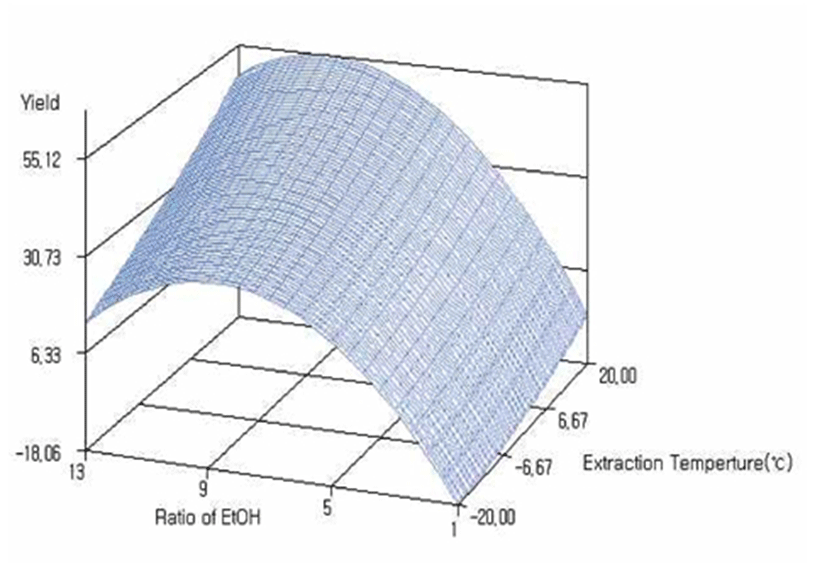
각 추출조건에 따른 녹차추출물의 수율은 에탄올 용매비가 1 mL/g, 온도 0℃일 때 고형분 수율은 8.94%로 가장 낮았고 에탄올 용매비가 7 mL/g, 온도 20℃일 때 고형분 수율은 51.91%로 가장 높게 나타났다(Table 4). 반응표면 분석을 한 결과는 Fig. 3에 나타낸 바와 같고 에탄올 용매비와 추출 온도에 유의적이었다(p<0.001). 추출온도의 경우 용매비가 증가함에 따라 수율도 증가하였고 용매비는 9~12 mL/g에서 최대값을 나타내었다. 반응표면 분석 결과 일차적, 이차적 영향 모두 99.9%의 신뢰 수준 이상으로 유의하였고 전체 회귀모델의 R2 값이 0.9808로 p<0.001 수준에서 유의성이 인정되었다(Table 5). 에탄올 사용 비율 이차항의 계수는 곡선형태로 p<0.001으로 유의성이 인정되었으며, 음의 값으로 본 실험의 에탄올 용매비 범위 내에서 증가하다 감소하는 형태를 보였다(Fig. 3, Table 5). 예측된 정상점은 안장점으로 시료에 대한 에탄올 용매비 9.38 mL/g, 추출온도 28.04℃일 때 최대값 55.15%로 예측되었다.
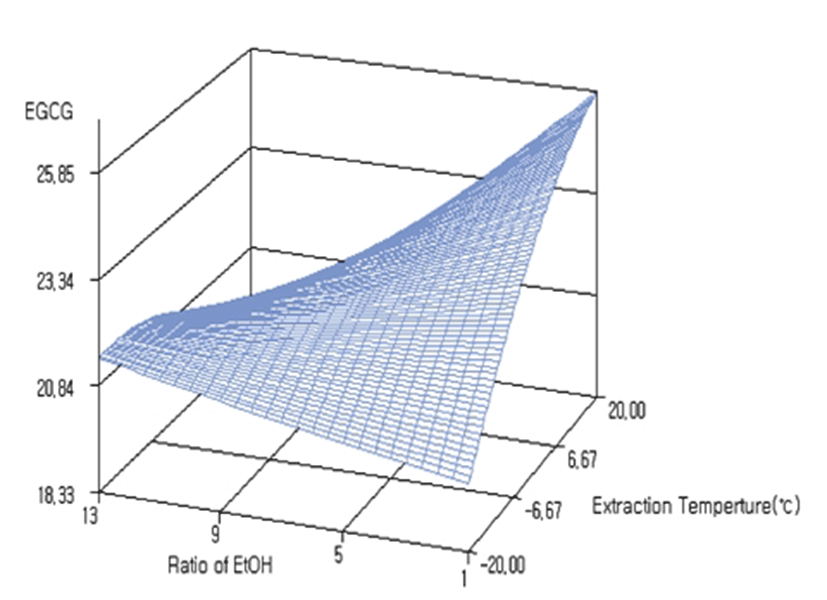
녹차의 높은 항산화 능력은 차의 성분 중 10~30%를 차지하고 있는 카테킨들이 대표적인 생리활성 물질로 알려져 있으며 항산화력은 EGC>EGCG>ECG>EC순으로 나타난다고 보고되었다(20). 그 중 EGCG는 녹차카테킨 성분 중 가장 많은 양을 차지하고 있고 가장 강력한 항암 작용을 한다고 보고된 바 있다(21). 이에 본 실험에서 독립변수 조건에 의한 각 성분 함량의 영향을 알아보고자 녹차 카테킨의 EGC, EC, EGCG, ECG의 함량과 성분의 합하여 나타낸 총 카테킨 함량의 반응표면분석을 수행하였다. 중심합성계획법에 따른 추출조건별 녹차추출물의 에탄올 재추출 결과 총 카테킨 함량은 에탄올 재추출 전 32%에서 에탄올 재추출 후 카테킨 함량이 약 41~46%까지 올라갔으며 에탄올 재추출전과 재추출후의 카테킨 함량의 HPLC 분석 결과를 Fig. 4에 나타내었다. 동일한 농도에서 HPLC 분석시 재추출 후의 카테킨 함량의 peak도 증가한 것을 확인할 수 있었다. 녹차의 에탄올 재추출에 대한 카테킨 성분 및 총카테킨 함량의 반응표면 분석결과는 Fig. 5에 나타내었으며 카테킨의 각각 성분은 총카테킨 함량의 반응표면 분석결과와 유사하여 하나의 그림으로 나타내었다. 시료대 용매비는 추출온도가 낮을때는 함량 변화가 적었으나 추출온도가 높을 때는 함량 변화가 유의적이었다. 추출온도가 일정할 때 에탄올 용매비가 적어질 수 록 카테킨 함량이 증가하는 경향성을 보였다. 또한 에탄올 재추출 온도가 낮아질수록 카테킨 함량이 증가하는 경향성을 나타내었다. Pinelo 등(22)의 보고에 의하면 polyphenol은 에탄올에서 추출이 잘되고 온도와 용매비가 증가할수록 total polyphenol 함량은 증가한다고 보고되었는데 본 실험에서는 추출물을 에탄올로 재추출했을 때는 오히려 온도가 낮아질수록 카테킨 함량이 더 높게 나타나 Pinelo 등(22)의 보고와 다른 결과를 나타내었다. 그리고 polyphenol의 하나인 (+)-카테킨은 온도와 에탄올 농도가 증가할수록 용해도가 증가하는데 이와 같은 결과는 대기압상태의 물/에탄올 혼합물에서는 극성정도가 온도에 영향을 받고 온도가 낮아질수록 극성정도는 작아지고, 에탄올 농도는 증가할수록 극성정도가 작아져 용해도가 증가한다고 보고되었다(23,24). 한편, Lourdes 등(25)의 의하면 D-glucose는 에탄올/물 혼합물에서 에탄올 농도가 낮아질수록 용해도가 증가하며 특히 물에서 용해도가 가장 높고 온도가 높을수록 용해도가 증가한다고 보고되었고, 아미노산도 에탄올에 비해 극성이 큰 물에서 용해도가 높다고 보고된 바 있다(26). 다시 말해, 본 실험에서 95% 에탄올로 재추출시 온도에 따른 함량 결과는 0℃ 이하에서 상대적 극성정도에 따른 에탄올의 용해 영향력 증가, 물 가용성분의 용해도 감소의 2가지 요인이 상호보완적으로 작용한 것으로 판단된다. EGC, EGCG와 총 카테킨 함량은 에탄올 용매비 4 mL/g에서 온도 10℃일 때, EC와 ECG는 에탄올 용매비 1 mL/g에 온도 0℃일 때 가장 높은 값을 나타내었다(Table 6). 녹차의 카테킨류와 총 카테킨의 분석 결과는 Table 4에 나타내었으며 R2값은 0.90이상이었고 1% 이내의 유의성이 인정되었다(Table 5). 특히, 총카테킨 함량의 R2는 0.9778로 가장 높은 수준의 유의성이 인정되었다. EGC, EC, EGCG, ECG 및 총 카테킨 함량의 분산분석 결과 일차, 이차 및 상호작용도 유의적으로 나타났다. 녹차 추출물의 에탄올 재추출에서 EGC는 용매비 1.60 mL/g, 온도 16.52℃에서 최대 함량 13.82%로, EC는 용매비 1.45 mL/g, 온도 15.14℃에서 최대 함량 4.08%, EGCG는 용매비 1.75 mL/g, 온도 17.69℃에서 최대 함량 24.98%, ECG는 용매비 1.77 mL/g, 온도 17.81℃에서 최대 함량 6.26%로 예측되었다. 총 카테킨 최대 함량은 49.14%로 예측되었으며, 이때의 추출 조건은 용매비 용매비 1.68 mL/g, 온도 17.19℃로 나타났다.
Y=b0+b1X1+b2X2+b11X12+b12X1X2+b22X2
1)X1, ratio of solvent to sample content (mL/g); X2, Extraction temperature (℃).
2)Epigallocatechin (EGC), Epicathchin (EC), Epigallocatechingallate (EGCG), Epicatechingallate (ECG).
3)*Significant at 0.1% level; **Significant at 0.05% level; ***Significant at 0.01% level.
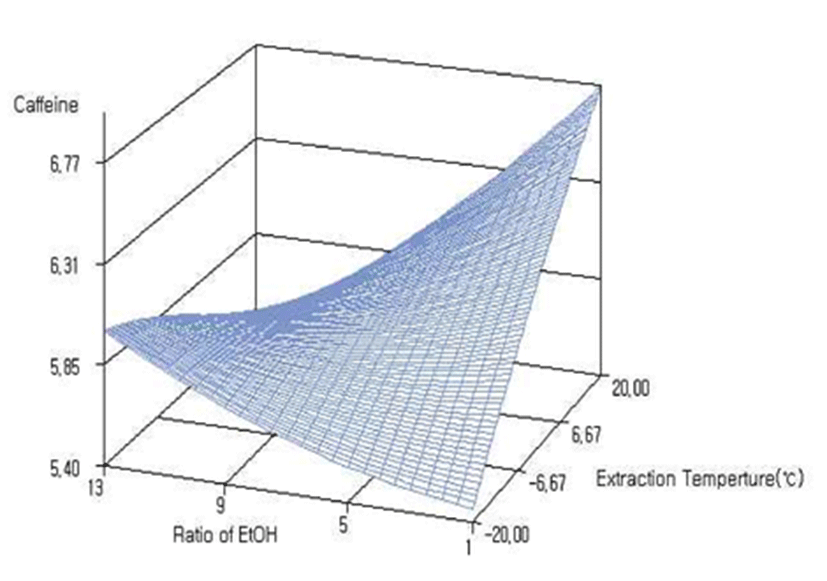
본 실험에서 카페인 함량은 에탄올 용매비 4 mL/g에 온도 10℃일 때 카페인 함량 6.24%로 가장 높았고, 에탄올 용매비 11.75 mL/g, 온도 20.73℃에서 추출했을 때 카페인 함량이 5.49%로 가장 낮았다(Table 6). 녹차추출물의 에탄올 재추출에 대한 카페인 함량은 Table 5에 나타낸 바와 같이 반응표면 분석 및 분산분석 결과 R2는 0.8770로 p<0.01의 유의성이 인정되었다. 일차 및 이차적 영향은 p<0.05수준으로 유의성이 인정되었고 에탄올 용매비 및 온도에 대한 상호작용도 유의적으로 나타났다(Table 3). 에탄올 재추출에 대한 카페인함량의 반응표면 분석 결과는 Fig. 6에 나타낸 바와 같으며 추출온도에 대한 카페인 함량은 용매비가 낮을때 온도가 증가할수록 카페인 함량이 증가하였고, 용매비가 높을때 온도가 증가할수록 카페인 함량은 낮게 나타났다.
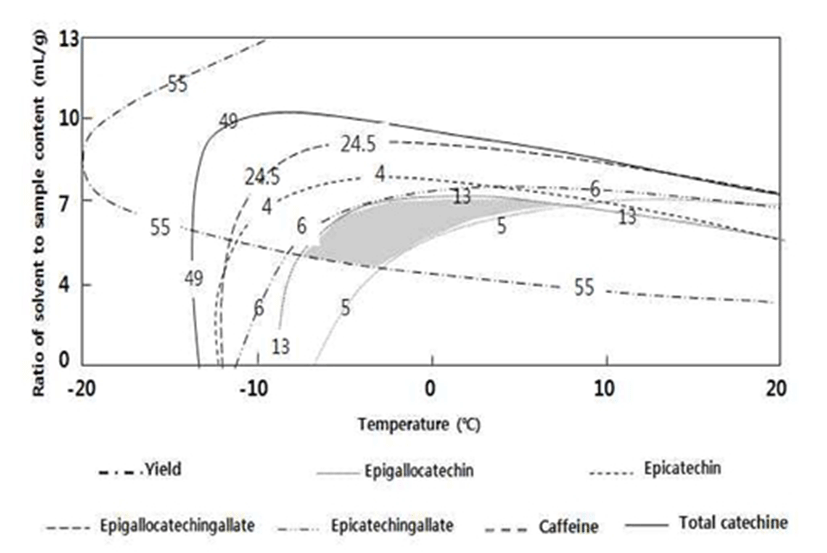
녹차추출물의 카테킨 성분의 최적 추출조건 설정을 위해 추출조건에 따른 EGC, EC, EGCG, ECG, 총 카테킨 함량 및 카페인의 contour map을 superimposing하여 예측한 최적 추출조건은 에탄올 용매비 6 mL/g에 0℃이며 Table 7과 Fig. 7에 나타내었다. 예측값과 동일 조건에서 추출 실험을 한 결과 실제 실험 시 고형분 수율 35.02% EGC 13.31%, EC 3.97%, EGCG 19.11%, ECG 4.29%, 총 카테킨 함량 40.68% 및 카페인은 5.30%을 나타내었다(Table 8). 에탄올 추출 전 녹차 추출물 성분 함량에 대비 실측값의 녹차 추출물 성분 함량 수율은 평균적으로 약 44.42%였다. Kwon 등(16)에 의하면 녹차 추출물의 카테킨 성분을 활성탄을 이용하여 추출하였는데 흡착제를 통한 추출시 카테킨 성분 손실이 있으며 공정상 고온에서 평균 흡착 시간이 6~8시간에 걸쳐 함량을 높일 수 있다고 보고되었는데 고온 및 장시간 공정 조건을 고려하면 에탄올 추출에 의한 것이 비교적 단순한 공정으로 단시간 처리 가능하고 에탄올 가용성 부분과 불용성 부분 모두를 활용 가능하다는 점에서 보다 고순도의 카테킨 성분 추출을 효과적이고 경제적인 공정으로 활용될 수 있을 것이라고 사료된다.
| Extraction conditions | Optimum ranges |
| Ratio of solvent to sample content (mL/g) | 4.5~7.5 |
| Extraction temperature (℃) | -8~8 |
요 약
녹차 추출물의 에탄올을 이용한 카테킨 성분의 고순도 및 고효율 추출을 위한 추출조건을 반응표면분석법을 사용하여 최적화하였다. 고형분 수율은 에탄올 사용 비율 및 온도 조건 모두 유의적으로 영향을 받았다(p<0.001). 녹차의 카테킨 성분 함량 및 총 카테킨 함량 모두 1%이내의 유의성이 인정되었고 온도보다 에탄올 사용 비율 조건이 추출결과에 더 영향을 미친다. 카페인 함량은 에탄올 사용 비율에 유의적으로 영향을 받았다. 반응표면 분석 결과 카페인을 제외한 종속변수의 R2값은 0.90 이상으로 1% 이내의 유의성이 인정되었다. 예측된 조건은 에탄올 사용 비율이 6 mL/g, 온도가 0℃에서 고형분 수율 33.01%, EGC 12.56%, EC 3.78%, EGCG 22.43%, ECG 5.39%로 총 카테킨 함량은 40.17%이며 카페인 함량은 5.87%로 예측되었다. 예측된 조건에서 실제 추출시 고형분 수율은 35.02%, EGC 13.31%, EC 3.97%, EGCG 19.11%, ECG 4.29%로 총 카테킨 함량은 40.68%이며 카페인 함량은 5.30%로 분석되었다.










