서 론
아마인(Linum usitatissimum)은 고대부터 재배되어진 오 랜 역사를 지닌 작물로서 기원전 6,000년경 티그리스강과 유프라테스강 유역의 고대농업사회에서 재배되었다(1). 전 통적으로 아마인에서 추출한 아마인유는 주로 페인트의 희석제나 리놀륨으로 이용되었고, 아마인유의 부산물은 사 료 등으로 이용되었으며, 고대의 그리스나 로마에서는 일 찍이 식품의 재료로 이용하였다. 최근에는 건강을 위해 아 마인이나 압착 아마인이 빵이나 시리얼, 음료로 이용되어 지고 있으며, 주요 경작지는 캐나다가 지배적이고, 중국, 인도, 미국 등의 지역에서도 재배되고 있다(2,3)
최근 아마씨는 미국과 캐나다에서 건강증진 식품으로 많은 각광을 받고 있다. 아마씨의 다양한 건강증진 효능에 대한 유효 활성물질로는 페놀성 화합물인 리그난류가 대표 적인 물질이며 항산화 활성에 관여하는 것으로 알려져 있 다. 특히 아마인의 경우 secoisolariciresinol diglucoside (SDG)이 대표적인 리그난으로서(4) 항산화 활성뿐만 아니 라 항암, 당뇨병 및 동맥경화 예방에도 효과가 있다고 알려 지고 있다(5,6,7). 또한, 아마인의 대표적인 페놀산으로는 trans-ferulic(46%), trans-sinapic(36%), ρ-coumaric(7.5%), trans-caffeic(6.5%) 등이 알려져 있다(8). 아마인의 아미노 산 중 glutamine의 경우 immune system에 도움을 주며(9), arginine은 심장질환 예방에 효과가 있어(10) 유지의 추출 후 생기는 아마인박(linseed cake)의 활용이 기대된다.
현재 우리나라의 대표적인 유지자원은 참깨와 들깨로서, 이를 이용한 참기름과 들기름은 독특한 향미 외에도 토코페 롤과 리그난류의 산화방지제를 함유하고 있는 유용한 기능 식품이다. 또한 oleic acid와 linoleic acid 같은 불포화지방산 을 다량 함유하고 있어 영양학적으로도 우수한 유지로서, 마가린 및 쇼트닝 등의 조리유에도 이용되고 있다(11,12).
이에 본 연구에서는 아마인과 기존 유지작물의 일반성분 및 유용성분을 분석하였으며, 추출유의 지방산 조성 및 토 코페롤 함량 등 영양학적 가치와 경제성을 고려한 아마인의 산업적 가치를 비교, 검토하고자 하였다.
재료 및 방법
본 실험에 사용된 아마인은 경상북도 농업기술원 생물자 원연구소에서 제공받았으며(2011년), 참깨 및 들깨는 안동 시에서 재배된 것을 구입하였다. 각각의 유지는 n-Hexane 을 이용하여 상온에서 2시간 동안 교반 추출하였으며, 추출 후 회전식 감압농축기를 이용하여 37℃에서 감압농축하였 다. 농축된 시료는 -20℃에서 보관하여 실험에 이용하였다.
일반성분은 AOAC법에 준하여 분석하였다. 수분은 10 5℃ 상압건조법, 회분은 회화법, 지질은 Soxhlet 추출법, 단백질은 Kjeldahl법을 이용하였고, 조섬유는 Henneberg- Stohmann법을 개량한 AOAC법으로 측정하였다. 당질 함량 은 100 g 중에서 수분, 단백질, 지질, 조섬유, 회분 함량을 감한 값으로 하였다.
지질을 제거한 시료 약 0.5 g을 취한 후 6 N HCl 20 mL을 가하여 110℃에서 12시간 가수분해 시켰다. 가수분해 시료 0.2 mL에 100 mM phenyl isothiocyanate(in acetonitrile) 0.1 mL 와 1 M triethylamine(in acetonitrile) 0.1 mL를 혼합한 후 1시간 정도 상온에서 반응시키고 시료의 추출을 위하여 0.4 mL hexane 용액을 첨가한 후 용액이 분리되도록 10분간 방치한 후 분석시료로 이용하였다(13). 사용한 기기는 ACE 5 C18 column(250×4.6 mm)을 장착한 LC-20A Prominence HPLC system(Waters 2695, waters Co., Miliford, MA, USA) 을 이용하였고 column 온도는 25℃로 유지 하였다. 용매 조성은 A용매는 10 mM sodium phosphate buffer(pH 7.0)이 고 B용매는 acetonitrile를 사용 하였으며, 용매의 흐름 속도 는 1.0 mL/min로 하여 A/B=95/5 → 65/35 (v/v)의 용매 구배 로 40분간 분리 하였다. 검출기는 UV detecter (SPD-20A, waters Co., Miliford, MA, USA)로 254 nm에서 측정하였다.
시료의 지방산 조성은 gas chromatography(GC)에 의한 정량법에 따라 실시하였다(14,15). 추출한 지질의 지방산 조성은 정제된 지질을 각각 0.1 g씩 취하여 0.5 N NaOHmethanol 용액으로 가수분해 하여, BF3-methanol로 methyl ester화 시킨 다음 GC(Hewlett packard 6890, USA)로 분석하 였다. GC에서 분리된 각 지방산 methyl ester의 면적과 총면 적에 대한 각 peak면적을 이용하여 각 지방산들의 조성비를 백분율로 표시(%) 하였다. GC분석 조건은 Table 1과 같으 며, 표준품으로는 SupelcoTM 37 component FAME Mix를 사용하였다.
토코페롤의 함량 측정은 Yen 등(16)의 방법을 변형하여 실험하였다(17). 시료유 0.5 g을 2.5 mL의 methanol에 추출 한 후, 원심분리 하여 상등액을 채취한 뒤 유기용매를 완전 히 제거하였다. 유기용매가 제거된 시료에 2.5 mL의 CH3CN:MeOH(85:15)용매를 이용하여 시료를 녹인 후, 원 심분리 하여 상등액을 토코페롤 측정 시료로 사용하였다. 사용한 기기는 ACE 5 C18 column(4.6 mm×250 mm)을 장착 한 LC-20A Prominence HPLC system(Waters 2695, waters Co., Miliford, MA, USA)을 이용하였고 column온도는 25℃ 로 유지 하였다. 용매 조성은 CH3CN:MeOH(85:15)로 20분 간 분리 하였다. 검출기는 UV detecter(SPD-20A, waters Co., Miliford, MA, USA)로 298 nm에서 측정하였다.
시료의 총 페놀 함량은 Satue 등(18)의 방법에 따라 추출 한 후 Folin-ciocalteu 법(19)을 변형하여 함량을 측정하였다. 즉, 먼저 시료를 각각 2 g씩 취하여 n-Hexane 5 mL에 녹인 후 80% methanol 10 mL를 가하여 페놀성 물질을 3회 반복 추출하였다. 이 추출물에 n-hexane 10 mL를 가하여 잔존하 는 유지성분을 제거한 후 무수황산나트륨을 이용하여 수분 을 제거하였다. 각각의 분리된 80% methanol 층을 감압농축 기를 이용하여 용매를 완전히 제거하였다. 용매가 제거된 각각의 추출물들은 에탄올에 녹여 총 페놀 함량 측정 시료 로 사용하였다. 총 페놀 함량은 시험관에 시료를 0.5 mL 채취하고 1 N Folin-ciocalteu 시약을 0.5 mL를 첨가하여 3분 후 2% sodium carbonate anhydrous 포화용액 10 mL를 첨가하여 1시간 동안 반응시켰다. UV/Visible spectrophotomer (SpectraMax M2, Molecular Devices, Hercules, USA)를 이용 하여 750 nm에서 여과 된 반응물의 흡광도를 측정하여 총 페놀 함량을 구하였다. 표준물질로는 tannic acid (Sigma-Aldrich Co., St. Louis, MO, USA)를 사용하였다.
시료의 전자 공여능은 Lee 등(20)의 방법을 변형하여 항 산화물질에 의한 2,2-diphenyl-β-picrylhydrazyl(DPPH) 라 디컬 소거 효과를 측정하였다. 시험관에 2.7 mL의 0.15 mM DPPH 용액과 농도별로 조제한 시료 0.8 mL를 넣고 실온에 서 15분 방치한 후 525 nm에서 UV/Visible spectrophotomer (SpectraMax M2, Molecular Devices, Hercules, USA)로 흡광 도를 측정하였다. 대조구로는 메탄올을 사용하였으며, 그 값은 다음 식에 의하여 계산하였다.
결과 및 고찰
각각의 아마인을 분쇄하여 일반성분을 조사한 결과는 Table 2와 같다. 수분과 탄수화물은 37% 정도를 차지하고 있으며 조지방은 참깨나 채종유 원료 등의 40%이상의 유지 함량에는 못 미치나 대두의 20%보다는 높은 35%내외인 35.33%와 36.16%인 것으로 나타나 유지 자원의 활용이 가 능하리라 사료된다. 또한 단백질은 25.60%와 22.59%로 두 시료간에 큰 차이는 없었으며, 회분의 경우 2.50%와 3.54% 으로 갈색 아마인이 다소 높은 함량을 나타내었다.
아마인의 단백질은 관상동맥질환, 신장질환 및 암 등에 효과가 있다고 알려져 있으며(21) 이러한 아마인의 아미노 산 조성을 분석한 결과 황색과 갈색 아마인의 아미노산 조성 차이는 없었으며, 주요 구성 아미노산은 glutamine, glycine, arginine 등이었으나 cystine, methionine 등의 함량 은 매우 낮게 나타났으며(Table 3), 필수 아미노산 함량은 전체 아미노산의 31% 수준으로 이는 참깨박의 31.5%와 유사한 함량을 나타내었다(22). Chung 등(23)의 연구에 따 르면 아마인의 주요 아미노산은 arginine, glutamine, asparagine으로유사한 결과를 보였다. Czarnecki와Krichevsky (24), Park과 Leipa(25)의 연구에 따르면 lysine/arginine ratio 에 따라 고콜레스테롤혈증 및 동맥경화증에 영향을 준다고 알려져 있으며, 아마인의 비율이 0.37로서 콩 및 카놀라의 0.88보다 낮아 더 좋은 효과를 나타낸다고 보고하였고 본 연구 결과 황색 및 갈색 아마인 모두 0.35수준으로 나타났 다.
추출한 각각의 아마인 유지의 지방산 조성은 포화지방산 과 불포화지방산의 비율 및 조성 지방산의 함량 측면에서 큰 차이를 나타내었다(Table. 4). 황색 아마인의 경우 포화 지방산이 10%, 불포화지방산은 90%로서 갈색 아마인의 포화지방산 14%, 불포화지방산 86%와 비교할 때 황색 아 마인유의 불포화도가 상대적으로 높은 경향을 나타내었다. 총 지질의 지방산 함량은 황색 아마인의 경우 linolenic acid 가 56.6% 로 가장 높은 함량을 나타내었으며, 갈색 아마인 은 oleic acid가 39.2% 로 많은 함량을 나타내었고, linoleic acid의 경우 두 종류 모두 15% 정도의 유사한 함량을 나타내 었다. 아마인은 일반적으로 linolenic acid함량이 47~52% 수준으로 보고되고 있지만(26) 황색과 갈색 아마인의 지방 산 조성에 대한 연구는 전무한 실정으로 본 연구의 지방산 조성 분석 결과에서 큰 차이를 나타내었다. 일반 식용유지 인 참기름은 oleic acid와 linoleic acid가 각각 41.1%와 43.8% 로 나타났으며, 들기름은 oleic acid와 linolenic acid가 각각 15.2%와 62.8% 수준으로 분석되었다. 따라서 다가 불포화 지방산의 산화로 악영향을 받기 쉬운 점을 고려할 때(27) linolenic acid의 함량이 높은 황색 아마인 보다는 oleic acid 의 함량이 높은 갈색 아마인이 비교적 안정성이 있는 식물 유지로서 가공적성이 우수할 것으로 사료되며, 이러한 유 지의 산화 안정성을 고려해 1990년대에 개발된 linola라는 아마인의 경우 ɑ-linolenic acid의 함량을 2% 이하로 낮추고, γ-linolenic acid와 linoleic acid의 함량을 65~75%로 높여 산화 안정성이 높은 것으로 보고되었다(28).
각각의 추출된 유지들의 γ-토코페롤과 ɑ-토코페롤의 함 량을 비교분석한 결과는 Table 5에 나타내었다. 토코페롤은 고도 불포화지방산의 산화를 억제하는 기능을 가지고 있어 유지의 안정화에 있어 토코페롤의 함량은 중요한 요소이 며, 본 연구 결과 γ-토코페롤은 황색 아마인과 갈색 아마인 이 각각 20.59, 17.94 mg/100 g으로 대조구로 시험한 참깨의 13.82 mg/100 g보다는 높았지만 들깨의 30.10 mg/100 g보단 낮은 함량을 보였으며, ɑ-토코페롤의 경우 들깨에서 1.42 mg/100 g의 함량을 나타내었지만 다른 유지에서는 검출되 지 않았다. Oomah 등(29)의 연구에서는 아마인씨의 토코페 롤 함량이 9.3 mg/100 g로서 이중 96~98%가 γ-토코페롤이라고 보고하였다. 본 연구에서는 황색 아마인과 갈색 아마 인씨에서 각각 7.3, 6.5 mg/100 g 로서 다소 차이는 있었지만 이는 추출 방법의 차이로서 압착과 열을 가하게 되면 기름 유출과 토코페롤 등의 유용물질의 추출이 향상되는데, 기 름 추출율과 지용성 비타민 추출율이 비례하기 때문인 것으 로 사료된다(30). 이러한 공정은 유지의 열에 의한 열화로 인하여 산화안정성은 낮아질 것으로 생각된다.
| Tocopherols | Content (mg/100 g) | |||
|---|---|---|---|---|
| Yellowflaxseed oil | Brownflaxseed oil | Sesame oil | Perilla oil | |
| γ-Tocopherol | 20.59 | 17.94 | 13.82 | 30.10 |
| ɑ-Tocopherol | ND1) | ND | ND | 1.42 |
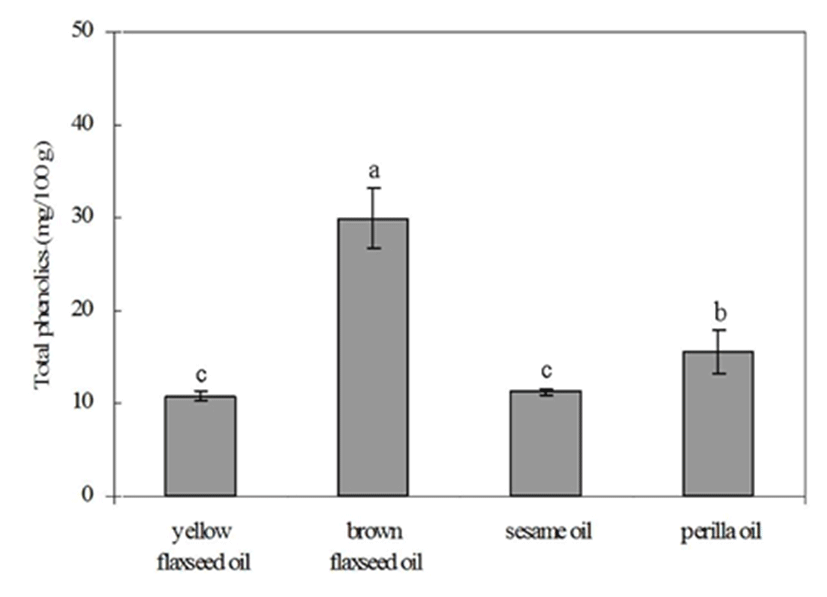
황색 아마인, 갈색 아마인, 참깨 및 들깨에서 추출한 지질 의 총 폴리페놀 함량을 측정한 결과 각각 10.78±0.46, 29.88±3.25, 11.28±0.35 및 15.52±2.24 mg/100 g으로 갈색 아마인이 가장 높은 총 폴리페놀 함량을 나타내었다(Fig. 1). 갈색 아마인은 황색 아마인보다 약 3배, 참깨보다 약 2.6배를 나타냈으며, 들깨보다는 약 2배 정도 높은 총 폴리 페놀 함량을 나타내었다. 따라서 갈색 아마인의 총 폴리페 놀 함량이 가장 높게 나타난 결과로 보아서 갈색 아마인의 추출 유지가 산화 안정성이 가장 클 것으로 판단된다. 또한 식품의 건강증진효능에 대한 원인물질로서 페놀성 화합물 의 가치가 높게 평가 되므로 이러한 기능성 측면에서도 갈색 아마인의 가치가 높이 평가 될 것으로 판단된다. Kim 등(31)은 이들 페놀성 화합물은 정제 및 탈색 등의 공정에 따라 현저한 변화를 일으키며 가열 온도의 증가에 따라 더욱 높아진다고 보고하였다.
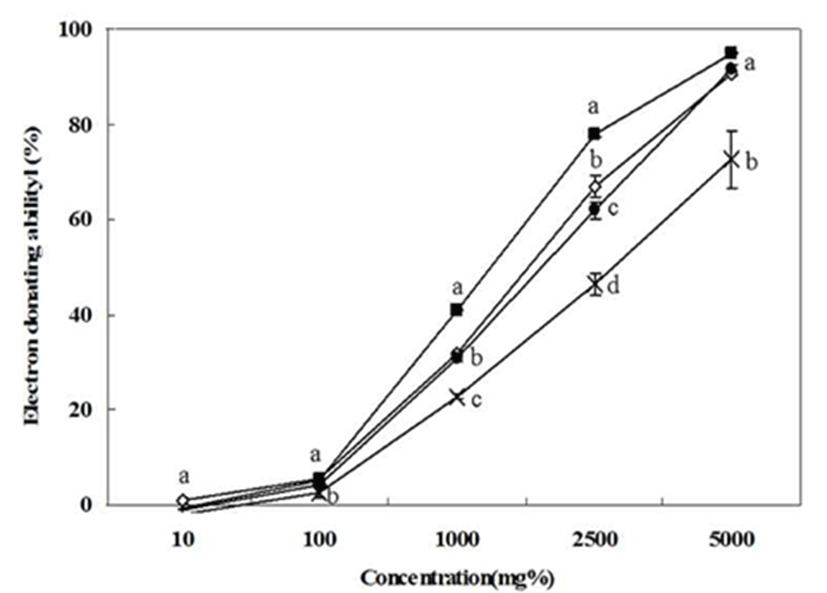
각 추출유의 전자 공여능을 2,2-diphenyl-β-picrylhydrazyl (DPPH) 라디칼의 소거 정도에 따라 비교하여 측정한 것을 Fig. 2로 나타내었다. 10~5,000 mg% 범위의 농도에 따른 전자 공여능의 변화를 살펴본 결과 10 mg%에서는 시료간 의 유의적인 차이를 나타내지 않았지만, 100 mg%의 농도에 서부터 시료간의 차이를 나타내었다. 1,000 mg% 농도의 경우 갈색 아마인이 40.96±0.14%로서 유의적으로 높은 값 을 나타내었고 황색 아마인과 들깨가 각각 31.74±0.77, 30.81±0.58%로서 유사하게 나타났으며, 참깨가 22.78± 0.47%로서 가장 낮은 활성을 나타났다. 2,500 mg%의 농도 의 경우에도 갈색 아마인과 황색 아마인이 각각 77.81±0.61, 66.90±2.12%로서 다른 유지 작물에 비해 높은 활성을 보였 으며, 이러한 결과는 토코페롤 함량과 폴리페놀 함량과 유 사한 경향을 보여 식물유지 자원으로서의 가치가 우수한 것으로 생각 된다.
요 약
황색 아마인과 갈색 아마인의 일반성분 분석과 아미노산 조성, 지방산 조성, 토코페롤 함량, 총 폴리페놀 함량 및 전자 공여능을 측정하여 각 유지들의 특성을 비교하였다. 일반성분의 경우 수분과 탄수화물은 37% 정도를 차지하고 있으며 조지방은 35%내외로 대두의 20%보다는 높은 함량 을 나타내었다. 아마노산 조성은 황색과 갈색 아마인의 차이는 없었으며 주요 구성 아미노산은 glutamine, glycine, arginine 등이었고, 지방산 조성의 경우는 두 아마인의 지방 산 조성에 차이가 있으며 황색과 갈색 아마인의 linolenic acid와 oleic acid의 함량은 각각 56.60, 31.38 과 18.24, 39.16 으로 나타나 갈색 아마인이 황색 아마인보단 산화 안정성이 우수할 것으로 생각된다. γ-토코페롤의 경우는 황색 아마인 이 20.59 mg/100 g으로 갈색 아마인보단 높았지만 들깨의 30.10 mg/100 g에는 미치지 못했다. 총 폴리페놀은 황색 및 갈색 아마인이 각각 10.78, 29.88 mg/100 g으로 갈색 아마인이 높은 함량을 나타냈으며, 전자 공여능 또한 2,500 mg%의 농도에서 갈색 아마인이 77.81%으로 가장 좋은 활 성을 나타냈다. 따라서, 황색 아마인과 비교하여 갈색 아마 인이 유지의 산화안정성 및 저장성이 우수할 것으로 생각되 며, 기존 참기름 및 들기름과 비교하여서도 영양학적인 측 면과 산업적인 가치가 높다고 할 수 있다.










