Article
활성산소종의 조절을 통한 음료 ‘별의별간’의 급성간독성 보호효과
장보윤1,
오준석2,
한지혜1,
김다은1,
홍재희2,
김성연1
,*

Protective effect of STAR of STAR series on CCl4 induced acutehepatotoxicity by regulation of reactive oxygen species
Bo Yoon Chang1,
Jun Seok Oh2,
Ji Hye Han1,
Da Eun Kim1,
Jae Heoi Hong2,
Sung Yeon Kim1
,*

Author Information & Copyright ▼
1Institute of Pharmaceutical Research and Development, College of Pharmacy, Wonkwang University, Iksan 54538, Korea
2Dongbu Eastern Herbal Medicine Agricultural Association Corporation, Sunchun 58019, Korea
*Corresponding author. E-mail:sungykim@wonkwang.ac.krPhone:82-63-850-6806, Fax:82-63-850-7309
Korean Journal of Food Preservation. This is an Open-Access article distributed under the terms of the Creative Commons Attribution Non-Commercial License (http://creativecommons.org/licenses/by-nc/3.0/) which permits unrestricted non-commercial use, distribution, and reproduction in any medium, provided the original work is properly cited.
Received: Feb 29, 2016; Revised: Mar 28, 2016; Accepted: Apr 04, 2016
Abstract
STAR of STAR (SS 01-04) is a series of drinks that consist of various extracts obtained from Coriolus versicolor,Artemisia capillaris Thunb., Hovenia dulcis, Acanthopanax sessiliflorus, Lycium chinense, Citrus reticulata, Saururus chinensis, Pueraria lobata, Pyrus pyrifolia, and Oenanthe javanica. A purpose of this study was to investigate the hepatoprotective effect of SS 01-04. Antioxidant activity of the drinks was evaluated by conducting a hydroxyl radical-scavenging assay. Cytotoxicity and hepatoprotective potential were determined using HepG2 cells in vitro, while protective effects against acute hepatotoxicity was evaluated in vivo. The antioxidant activity of the SS 01-04 at concentration of 100 and 250 mg/mL was similar to that of 50 μM vitamin C. tert-Butyl hydroperoxide (tBHP)-induced production of reactive oxygen species (ROS) was blocked by SS 01, 03 and 04 in a dose-dependent manner. Treatment with SS 04 significantly lowered the serum levels of alanine aminotransferase and aspartate aminotransferase in an animal model of carbon tetrachloride (CCl4)-induced hepatotoxicity (p<0.05). In addition, SS04 increased glutathione level while decreased malondialdehyde level in the liver considerably (p<0.05). It also inhibited the CCl4-induced increase in the levels of triglyceride and cholesterol in serum and the liver. These findings indicated that SS 01-04 possessed antioxidant activity and protect against ROS. In particular, SS 04 is potentially highly beneficial in treating liver damage as it scavenges reactive free radicals and boosts the endogenous antioxidant system.
Keywords: Herb mtixure; Antioxidant; Hepatoprotection; Star of Star
서 론
활성산소(reactive oxygen species, ROS)는 면역활동과 같은 자연적인 원인, 과로, 과식, 흡연과 같은 습관적인 원인, 배기가스, 중금속, 방사선과 같은 환경적인 원인에 의해 발생되어 체세포나 조직을 손상 및 파괴시키게 되는데 이러한 활성산소의 공격을 산화적 스트레스라고 한다(1,2,3). 산 화적 스트레스는 DNA 분절과 단백질의 불활성화 및 세포 생체막의 구성성분인 불포화지방산을 공격하여 과산화 반 응을 일으켜 생체기능을 저하시킨다. 이는 노화를 유발할 뿐만 아니라 류마티스성 관절염, 당뇨병, 심장병, 동맥경화, 암 등과 같은 여러 질환의 원인으로 잘 알려져 있다(2,4). 인체의 가장 큰 장기인 간 또한 항상성을 유지하지 못하 고 산화적 스트레스가 유발되면 불포화지방산이 풍부한 세포막은 free radical에 의해 지질과산화의 표적이 되어 세포소기관들이 정상적인 구조 및 기능을 잃게 되며, 국소 적인 손상은 물론 알데하이드와 같은 지질과산화 분해 산물 이 생성부위에서 멀리 떨어진 부위로 이동하여 세포 손상시켜 지방간, 간염, 간경화, 간암을 포함하는 간질환이 유발된 다(5,6). 간질환의 치료방법은 식이요법과 약물 요법이 있 으며 약물 요법으로 사용되는 것은 우로소데옥시콜린산 (ursodeoxycholic acid), 글루타치온(glutathione), 인터페론 (interferon), 말로틸레이트(malotilate) 등의 간세포 재생 촉 진제 및 간 기능 보조제등이 사용되어 지고 있으나 일부 합성약물에서의 위장장애 및 신장질환 등의 부작용이 보고 되고 있다(7,8,9). 그에 따라 마리아 엉겅퀴 활성성분인 silymarin과 같은 천연물 유래 간질환 치료 및 보호제에 대한 연구가 활발하게 진행되고 있다(4,9,10).
우리나라를 비롯한 동양권에서는 예로부터 다양한 종류의 질병 치료를 위해 천연물이 활용되어져 왔다. 천연물 제제들은 오랜 기간의 경험을 근거로 생리활성 효능이 검증 되어 있고, 낮은 부작용으로 널리 사용되어지고 있다(11). 천연물 제제는 단일물질이 아닌 여러 가지 천연물로 구성되 기 때문에 다양한 성분의 복합적인 효과로 광범위한 효능을 나타낼 수 있으며, 배합비와 추출 방법에 따라 효능이 달라 질 수 있다(12,13,14).
본 연구에서는 현재 민간 및 한방에서 간보호 및 간기능개선을 위해 사용되는 운지(15), 헛개열매(16), 인진(17), 오가피(18), 구기자(19), 진피(20), 삼백초(21), 갈근(22), 아 로니아(23), 미나리(24) 등의 천연물을 주성분으로 하는 복 합 처방제의 간 보호능을 확인하여, 천연물 복합제 기반 간보호제 개발에 필요한 기초 자료를 제공하고자 한다
재료 및 방법
시 약
세포 배양에 사용된 Dulbeco's modified eagle medium,fetal bovine serum, streptomycin penicillin 등의 시약들은 Gibco(San Francisco, CA, USA)사에서 구입하였다. 1,1- diphenylpicryl-2-hydrazyl(DPPH), 3'-(4,5-dimethylthiazol- 2-yl)-2,5-diphenyltetrazolium bromide(MTT) silymarin 등은 sigma(St. Louis, MO, USA)사에서 구입하였다.
세포주 및 배양
천연물 복합제의 세포 독성을 측정하기 위하여 사람의간세포 유래 HepG2세포를 ATCC에서 구입하여 사용하였 다. HepG2세포는 DMEM배지에 10 % FBS, 1% 페니실린, 1% 스트렙토마이신 및 20 μg/mL L-글루타민을 첨가한 배 양액을 사용하여 배양하였고, 37℃ 습윤한 CO2 배양기(5% CO2 , 95% air)에서 배양하였다.
동물의 사육
본 연구에서는 오리엔트(주)로부터 입수한 6주령의 자성SD 랫트를 사용하였다. 1 주간의 적응기를 둔 후 체중범위에 따른 무작위법에 의하여 군 분리를 실시한 후 사용하였 다. 실험에 사용된 동물들은 인수 및 순화기간 동안 이상증 상이 관찰되지 않았다. 순화 및 실험 기간 동안 사육 환경은 온도 23±2℃, 상대습도 55±5%, 조명시간 12시간 및 조도 150~300 Lux 로 설정하고, 살균 처리된 실험동물용 고형사 료(Orient, Jeonju, Korea)와 물은 자유섭취 조건으로 하였 다. 실험동물은 꼬리에 개별인식 처리 후 각각의 동물을 관찰하는데 방해가 되지 않는 범위에서 폴리카보네이트 케이지에 사육하였다.
시험물질인 SS04는 정제 증류수로 희석하여 100, 300mg/kg, 양성대조군인 silymarin은 50 mg/kg으로 제조하여 kg당 10 mL을 투여액량으로 1일 1회 4일간 경구투여 하였 다. 급성 간 손상 유발을 위해 4일째 시험 약물 투여 한 시간 뒤, CCl4 를 0.75 mL/kg로 경구투여 하였다. CCl4 투여 24시간 뒤, 에테르 마취하여 복부대동맥 채혈 및 간 적출을 수행하였다. 채취한 혈액은 1시간 방치한 후 원심분리하여 혈청을 분리하고, 분석 시까지 -70℃에서 보관하였다. 실험 동물의 구입과 사육에 모든 과정은 원광대학교 동물실험윤 리위원회의 승인을 받고(WK15-12), 규정에 따라 실행하였다.
시료의 추출
본 실험에 사용한 운지, 헛개열매, 인진, 오가피, 구기자,진피, 삼백초, 갈근, 미나리, 아로니아는 영동약초영농조합 법인에서 2015년 3월에 구입하였다. 본 실험에 사용한 10종 의 천연물은 동부생약의 홍재희 대표가 검증 후 실험에 사용하였으며, 동부생약의 표본실에 보관하고 있다 (DB-15-025). 추출은 시료 중량의 10배 양을 가하여 120℃ 에서 7시간 추출하였다(G008, Daewoo Converge, Seoul, Korea). 복합 처방제는 여과 농축하여 건조 하였고 실험 전까지 냉장실에 보관하였다. 천연물의 혼합비율은 운지버 섯, 황금 및 인진의 간보호능에 관한 보고(15,16,17)를 근거로 간기능의 개선의 효능이 탁월하고 다른 부가적인 효능이 있는 운지버섯, 황금, 인진을 주처방으로 설정하고, 이에 간기능이나 지질 개선능에 사용되어온 오가피, 구기자, 진 피, 삼백초, 갈근, 아로니아, 미나리을 추가 혼합하여 간보 호 기능의 최적 처방을 찾고자 하였다(19,20,21,22,23,24). 본 실험에 사용된 복합 처방제는 총 4종으로 Star of Star(SS) 01은 운지, 헛개열매, 인진, 오가피, 구기자, 진피, 삼백초를 18.8:18.8:15:3.1:1.9: 1.9:1의 비율로 혼합 후 열수추출 하였 으며, SS02, 03, 04는 SS01에 갈근, 아로니아, 미나리를 7.5 비율로 추가 혼합하여 각각 열수추출 하였다. 각각의 추출 수율은 27.0, 22.4, 28.4, 27.1%였다.
항산화능 측정
SS01~04의 항산화 효과를 확인하기 위하여, 진한 보라색을 띄는 diphenylpicrylhydrazyl이 diphenylpicrylhydrazine 으로 환원되어 옅은 노란색에 가까워지는 DPPH(Diphenylpicrylhydrazine) assay를 수행하였다. 시료와 0.1 mM DPPH용액을 1:1로 혼합하고 1시간 뒤, 520 nm의 파장 에서 흡광계를 이용하여 항산화능을 측정하였다. 흡광도를 다음의 식으로 %로 환산 하였다(25).
간세포 보호 및 활성 산소종 활성 측정
HepG2 세포(1×104cells/well)를 CO2 배양기 내에서 24시간 배양한 후, 4종류의 SS(10, 30, 100 μg/mL)를 전처리하였 다. SS 처리 4시간 후 간독성 유발물질인t-BHP을 50 μM의 농도로 처리하고 24시간 동안 CO2 배양기에서 배양하였으 며, 세포생존율은 MTT법을 활용하여 측정하였다. 양성 대 조약물로는 curcumin 20 μM을 사용하였다.
동일 조건에서 배양된 세포를 PBS로 세척한 후, 10 μM2',7'-dichlofluorescein diacetate(DCFDA)를 포함하는 Hank’s balanced salt 용액에서 30분 동안 반응시킨 후 세포 의 형광광도(SpectramaxGemini XS, Molecular Devices, Sunnyvale, CA, U.S.A.)를 측정하였다. 양성 대조약물로는 curcumin 20 μM을 사용하였다.
혈청alanineaminotransferase(ALT)와aspartateaminotransferase(AST) 측정
ALT와 AST를 Reitman and Frankel법으로 측정하였다(26). 분리된 혈청은 각각의 기질액과 37℃에서 30분과 60분 동안 반응 하고, 2,4-DNPH 500 mL를 첨가하여 실온에서 20분방치 하였다. 0.4 N NaOH 5 mL를 넣어 30분간 반응 후, 520 nm에서 흡광도를 측정하였다.
간 Glutathione 함량 측정
Glutathione은 Griffith법으로 측정하였다(27). 실험 종료후, 랫트의 간을 적출하고 간 조직 2 g에 EDTA 2 mM이 함유 된 1 M HClO4 용액을 5 mL 가하고 Polytron(IKAWERKE, Wilmington, USA) 으로분쇄하여homogenate를제조 하였다. Homogenate 를 5,000 rpm에서 5분간 원심분리한 후 상등액을 취한 뒤 phosphate 완충액을 이용하여 glutathione 농도가 표준 검량선 농도범위 내에 들도록 희석한 후, 총 glutathione 정량을 위한 검체로 사용하였다. Microcuvette 에 0.3 mM NADPH 용액 0.7 mL, 6 mM DTNB 용액 0.1 mL과 검체 또는 glutathione 표준액 0.2 mL을 가해서 섞은 후 상온에서 4분간 방치하였다. 여기에 glutathione reductase(50 unit/mL)을 섞어준 후 412 nm에서 약 1분간 흡광도의 변화를 측정하여 기울기 변화를 구하였다.
Malondialdehyde 측정
Malondialdehyde(MDA)는 thiobarbituric acid 반응을 이용한 Draper법으로 측정하였다(28). Tetraethoxypropane을 표준액으로 사용하였으며, 간 균질액에 SDS(8.1%, 0.2 mL), thiobarbituric acid(0.67% 1.5 mL), acetic acid(pH 3.5, 1.5 mL)와 물 0.6 mL를 넣고 95℃에서 1시간 동안 반응 후, 얼음에서 식히고, n-buthanol 5 mL를 혼합하였다. 4,000 rpm에 서 10분간 원심분리하고 상층액을 532 nm에서 측정하였다.
중성지방 및 콜레스테롤 함량 측정
혈청 중성지방 및 총콜레스테롤의 농도는 자동분석장치(SPOTCHEM EZ, AP-4430, ARKRAY)을 이용하여 측정하 였다. 간조직의 지질은 Folch등 의 방법에 따라 간조직 무게의 10에 해당하는 용매(chloroform:methanol=2:1)을 가 하여 지질을 추출하였다. 추출한 지질은 다시 chloroform용 액에 녹여 혈청에서 분석한 동일한 방법으로 총 콜레스테롤 과 중성지방 함량을 측정하였다.
통계분석
시험에 얻어진 결과는 평균±표준편차로 표기하였으며,Graphpad Prism v5.0 프로그램을 활용하여 student t-test를 수행하여 유의성을 검증하였다. 통계적인 유의성은 p값이 0.05 이하인 경우를 기준으로 판정하였다.
결과 및 고찰
별의별간(SS01~04)의 항산화능 측정
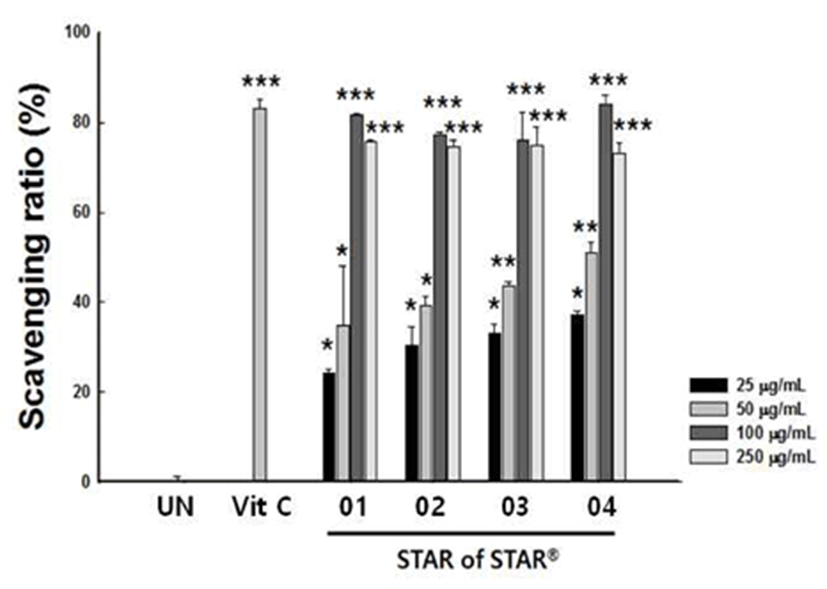
항산화 물질의 가장 특징적인 기작은 라디칼과 반응하는것으로 소거 작용은 활성라디칼에 전자를 공여하여 항산화 효과나 인체에서 노화를 억제하는 척도로 이용되고 있다 (25). SS01~04의 항산화능 평가를 위해 DPPH를 이용한 라디칼 소거 활성을 측정 하였다. SS01~04 모두 25~100 μg/mL까지 농도 의존적인 항산화 활성을 나타내며 100 μg/mL 이상의 농도에서 50 μM vitamin C와 유사한 항산화 효과를 나타내었다(Fig. 1).
Fig. 1.
Antioxidant acitivity of Star of Star01-04.
The value were presented as means±SD.*p<0.05, **p<0.01, ***p<0.001 significantly different from the UN (untreated) group.
Download Original Figure
별의별간(SS01~04)의 ROS 생성 억제효과
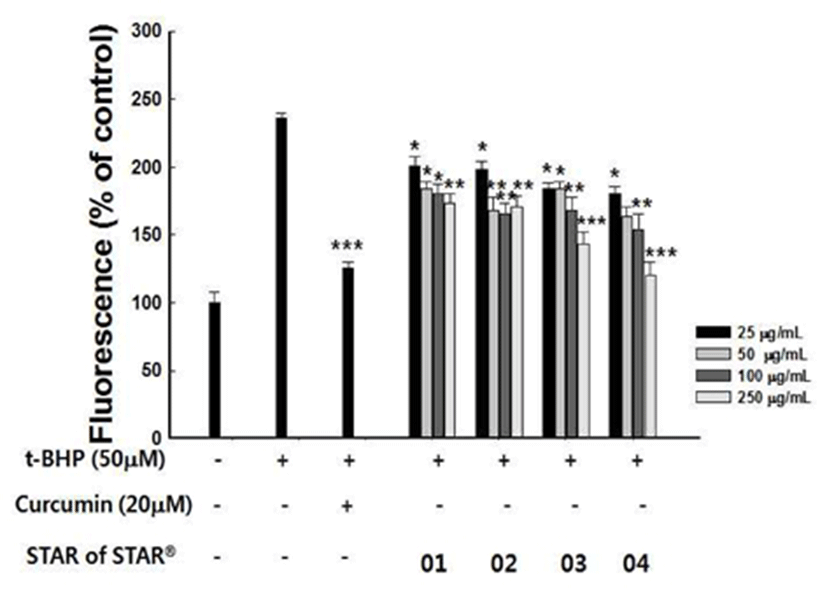
ROS는 free radical 및 O2 , O2- , H2O2 , ·OH등 다양한 형태 의 활성화된 산소로, 생명체의 항상성 유지기작을 통해 조 절된다. 하지만 노화 및 산화 스트레스로 조절능이 불안정 화되면 ROS의 양이 많아져 세포막지질의 산화, 세포단백 질의 변성을 유발 하고 결국 노화의 촉진 및 각종 성인병을 발병시켜 인간의 수명을 단축시키는 것으로 알려져 있다 (2,30,31). 세포내에서 산화 스트레스에 의해 발생하는 ROS 생성에 대한 SS01~04의 억제활성을 알아보기 위해 HepG2 세포에 t-BHP로 산화적 스트레스를 유도한 뒤 DCFH-DA 를 이용하여 ROS의 양에 따른 형광의 발생 정도를 측정하 였다. DCFH는 세포내 ROS에 의해 산화되어 DCF로 전환 되며, ROS의 생성이 많을수록 측정되는 형광량이 증가 한 다(30). 실험 결과 50 μM t-BHP을 노출시킨 대조군에서는 ROS의 생성이 242.5%로 유의적인 증가를 나타내었다(Fig. 2). 그러나 SS 01~04가 전처리된 모든 세포에서 ROS의 생성이 농도 의존적으로 감소하였으며, 특히 SS04의 250 μg/mL처리 농도에서는 125%로 유의적인 감소를 나타내었 으며, 양성대조군으로 사용한 curcumin 50 μM과 유사한 산화 스트레스에 의한 ROS 생성량 감소를 나타냈다.
Fig. 2.
Effect of Star of Star 01-04 on the intracellular reactive oxygen species production induced by ter t-butyl hydroperoxide.
The value were presented as means±SD.*p<0.05, **p<0.01, ***p<0.001 significantly different from the only t-BHP treated group.
Download Original Figure
별의별간(SS01~04)의 간세포 안전성 및 산화적 손상에 대한 간세포 보호 효과
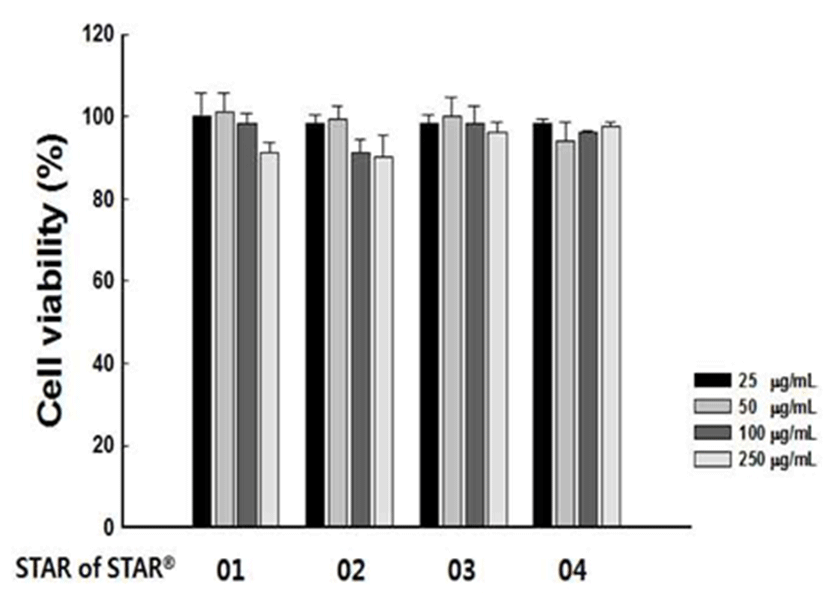
HepG2세포에 SS01~04의 농도를 각각 25, 50, 100, 250μg/mL로 처리하고 24시간 배양한 다음 MTT로 세포 생존율 을 측정한 결과, 아무런 처치도 하지 않은 대조군의 세포 생존율을 100%로 환산하였을 때 세포 생존율은 92.05~99.33%로 측정됨에 따라 4종류의 SS는 250 μg/mL농도까지 간세포에 유의적인 세포독성은 없음을 확인하였다(Fig. 3).
간세포내에서 t-BHP는 cytochrom P450에 의해 peroxyl및 alkoxyl radical 등과 같은 독성물질로 대사된다. 대사과 정을 통해생성된 free radical은 세포막을 구성하는 불포화 지방산과 반응을 통해 결과적으로 간세포의 자연사나 세포 괴사를 유발한다(29,30).
Fig. 3.
Cytotoxicity of Star of Star01-04 in Hep G2 cells.
The value were presented as means±SD.
Download Original Figure
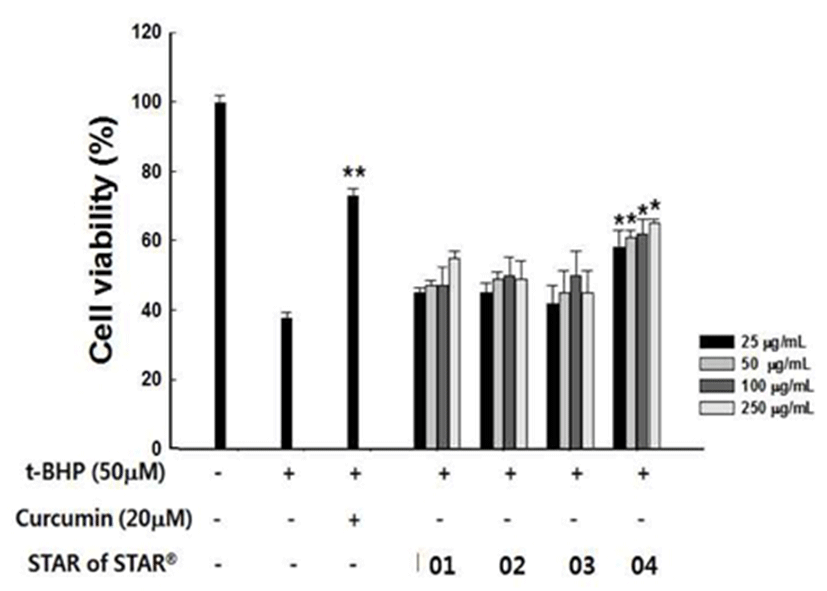
SS01~04가 간세포 생존율에 영향을 미치지 않는 것이확인됨에 따라 t-BHP로 산화적 스트레스를 유도한 후 SS01~04의 농도별(25, 50, 100, 200 μg/mL) 산화적 손상에 대한 간세포 보호 효과를 확인해 보았다. 50 μM t-BHP을 세포에 노출시킨 결과 SS01~04을 처리하지 않은 대조군에 서는 세포 생존율이 36.5%로 유의적인 감소를 나타내었다 (Fig. 4). 양성대조군으로는 curcumin을 처리하여 사용하였 고 그 생존율은 76.9% 으로 관찰되었다. SS01~04가 전처리 된 세포에서 생존율이 증가하였으며, 특히 SS04는 농도 의존적인 세포 생존율 증가를 나타내었다. SS04, 250 μg/mL 처리 농도에서는 69.2%의 세포 생존율을 보여t-BHP로 유 도된 산화 스트레스에 대해 세포 보호효과가 있는 것으로 판단되었다.
간독성 유발 동물에서 별의별간(SS04)의 간보호 효과
CCl4 는 간독성을 유발시킴으로써 지방변성, 섬유화, 간세포 괴사 및 발암성 등의 간독성 기전 관련 연구나 다른 약물의 효능연구에 많이 사용되고 있다(4,9,32). CCl4 에 의 해 유도되는 독성 발현 기전은 CYP450에 의하여 대사되어 높은 반응성을 갖는 trichloromethyl free radical이 생성됨으 로서 시작된다. 또한 trichloromethyl free radical은 oxygen 과 반응하여 더욱 강력한 반응물질인 trichloromethyl peroxyl radical을 생성하는데, membrane에 존재하는 불포 화지방산 사슬의 methylene bridge를 공격함으로써 지질과 산화를 일으킬 뿐 아니라 미트콘드리아, 내형질세망, 세포 막 등의 투과율에 영향을 미쳐 치명적인 세포 손상을 유발 한다. SS01~04중 높은 항산화 효능 및 간세포보호 효과를 나타내는 SS04의 CCl4 로 간독성이 유발된 동물에 대한 간 보호효과를 검증하고자 하였다. SS04 농도는 OECD guideline에 따라 안전성 실험을 수행하여 2,000 mg/kg까지 의 안전성 확인 후, 인체적용농도(HED)를 고려하여 100, 300 mg/kg으로 본시험을 수행하였다.
Fig. 4.
Protective effect of Star of Star 01-04 against tert-butyl hydroperoxide-induced cytotoxicity.
The value were presented as means±SD. *p<0.05 significantly different from the only t-BHP treated group.
Download Original Figure
혈중의 ALT 및 AST 활성 변화
CCl4 는 간세포의 괴사와 조직의 파괴를 유도하여 몇 시간 내에 간독성의 발현이 시작되며, 12~24시간 후 혈중 ALT와 AST의 현저한 증가를 나타낸다(32,33). 본 연구에 서도 CCl4 군은 ALT는 173.8±14.5, AST는 232.4±10.2 (unit/mL)로 유의적 증가를 나타내었다. SS04 투여군의 ALT 농도는 CCl4 군 대비 100, 300 mg/kg 용량에서 각각 123.5±24.0, 146.7±40.3(unit/mL)으로 유의하게 감소하였 다. 혈중 AST 농도는 CCl4 군 대비 100, 300 mg/kg 용량에서 각각 204.3±8.3, 184.3±20.3(unit/mL)로 유의하게 감소하였 다(Table 1). SS04의 투여는 CCl4 투여로 높아진 ALT 및 AST를 유의하게 감소시켰으며 간 기능 개선 효과가 있는 것으로 사료된다.
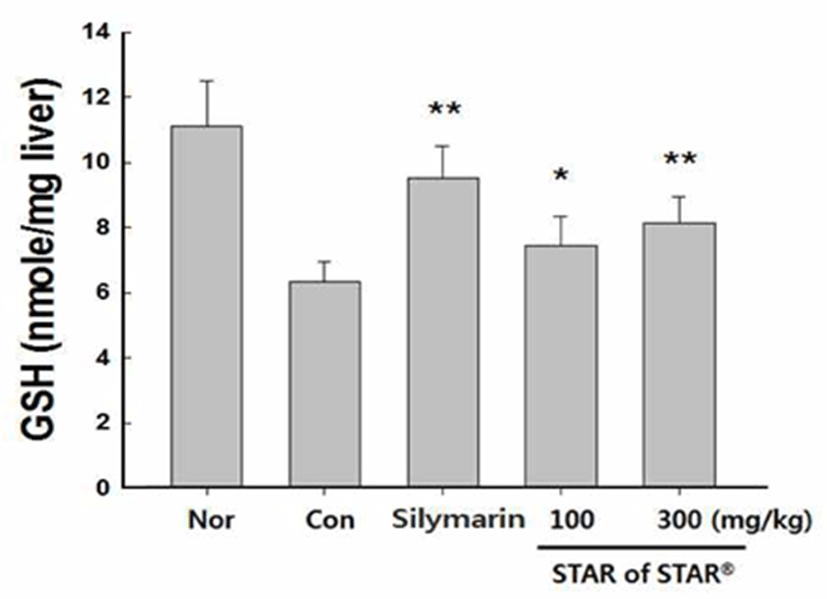
간 조직중 GSH 함량 변화
GSH는 중요한 항산화물질로 활성산소종 및 다양한 독성물질의공격으로부터 인체를보호한다. Glutathione peroxidase (GPX) 및 glutathione S-transferase(GST)의 기질로 이용되면 서 반응성이 큰 유독한 대사물질을 제거하는데 중요한 역할 을 하는 것으로 알려져 있다(2). 대표적인 GSH 작용의 예로, hydroxyl radical과 singlet oxygen을 제거하는 역할을 하며 지질 과산화(lipid peroxidation)의 환원에도 관여 한다. 유독물질의 제거과정에서 생성된 산화형 glutathione(GSSG)는 glutathione reductase(GR)에 의해서 GSH로 전환되어 항산 화 작용을 회복한다(2,34).
Table 1.
Effect of Star of Star 04 on serum alanineaminotransferase and aspartate aminotransferase levels in a rat model of carbon tetrachloride-induced hepatotoxicity
| Group |
ALT(unit/mL) |
AST(unit/mL) |
| Normal |
25.9±4.91) |
43.4±5.3 |
| Control |
+CCl4 |
173.8±14.5 |
232.4±10.2 |
| Silymarin |
100.6±6.9**2) |
152.3±15.9** |
| Star of |
100mg/kg |
123.5±24.0* |
204.3±8.3 |
| Star®_04 |
300mg/kg |
146.7±40.3* |
184.3±20.3* |
Download Excel Table
실험결과 CCl4 투여군의 GSH는 6.2±0.7(nmole/mg liver)으로 정상군 대비 유의적 감소를 나타내었다(Fig. 5). 양성 대조군으로 사용된 silymarin 투여군의 GSH 함량은 9.4±0.4(nmole/mg liver)로 CCl4 군 대비 51.6% 증가 나타내 었으며, 100, 300 mg/kg 용량이 투여된 SS04은 각각 7.4±1.0, 8.2±0.8(nmole/mg liver)으로 CCl4 군 대비 각각 19.4, 32.2%로 농도의존적인 증가를 나타내었다.
Fig. 5.
Effect of Star of Star 04 on glutathione depletion caused by carbon tetrachlor ide -induced hepatic toxicity.
The value were presented as means±SD.*p<0.05, **p<0.01 significantly different from the control group.
Download Original Figure
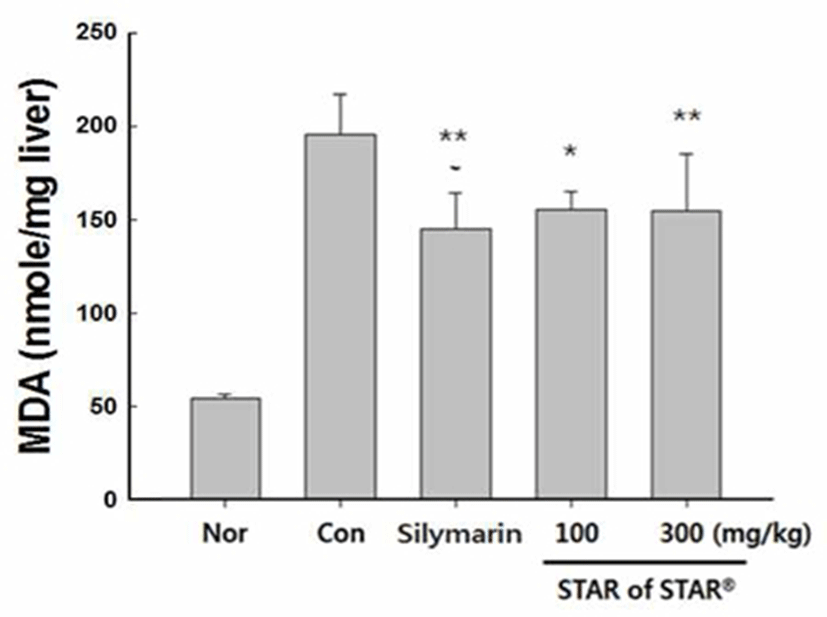
간 조직중 지질과산화 측정
지질과산화는 free radical에 의해 지질성분인 불포화지방산의 methylene기로부터 수소원자가 탈취됨에 따라 개 시되는데, 이때 주로 관여하는 free radical은 hydroxy group 이며 수소탈취에 의해 생긴 alkyl radical은 다시 산소와 결합하여 peroxyl radical을 형성한다. Peroxyl radical은 다 시 다른 불포화지방산으로부터 수소를 탈취함으로써 일종 의 chain recation이 진행된다. 이때 연쇄 반응의 부산물로 MDA(malondialdehyde)가 생성되며 지질과산화물의 지표 로 사용되어진다(28,34). CCl4를 투여한 그룹의 MDA의 발 현량은 193.3±21.3(nmole/mL)로 정상군과 비교해 253% 유 의적 증가를 관찰할 수 있었으나, 양성 대조군으로 사용된 silymarin 투여군은 CCl4군 대비 25% 감소하였다. SS04의 100, 300 mg/kg 용량에서 각각 20.5%, 20.7%로 유의적 감소 를 나타났다(Fig. 6).
Fig. 6.
Effect of Star of Star 04 on malondialdehyde induced by carbon tetrachlor ide.
The value were presented as means±SD.*p<0.05, **p<0.01 significantly different from the control group.
Download Original Figure
혈중 및 간조직 내 지질 함량
CCl4 의 투여는 내형질세망의 불포화지방산을 산화시켜과산화지질을 형성함으로써 그 기능을 감퇴시키고 중성지 질의 축적을 유발한다(35). CCl4 를 투여한 그룹의 혈중 및 간조직내 중성지방의 함량은 정상군 대비 각각 188.6%, 192% 증가되었다. 양성대조군으로 사용한 silymarin 투여 군은 CCl4 군에 의해 증가된 중성지방의 양은 혈액과 간에서 각각 27.9%, 35.4% 감소하였다(Table 2). SS04의 100, 300 mg/kg 용량에서 CCl4 군 대비 혈청내 중성지방의 함량은 각각 6.5%, 8.9%로 유의적 감소를 나타내었으며, 간조직내 중성지방의 함량도 각각 25.3%, 24.0%로 농도의존적인 유 의적 감소를 나타내었다.
혈청 중 총 cholesterol 함량 측정은 체내 지질 대사 이상의지표로서 중요하며 관상 동맥 질환, 지방대사 이상, 췌장, 간장 질환 등의 경우 농도가 증가하는 것으로 알려져 있다. CCl4 를 투여한 그룹의 혈중 및 간조직내 콜레스테롤의 함량은 정상군 대비 각각 37.6%, 256.0% 증가되었다. 양성 대조군으로 사용한 silymarin 투여군은 CCl4 군 대비 각각 22.9%, 25.9% 감소하였다. SS04의 100, 300 mg/kg 용량에서 도 CCl4 군 대비 혈청내 콜레스테롤의 함량은 12.3%, 15.17% 로 농도의존적인 감소를 나타내었다. 간조직내 콜 레스테롤의 함량은 각각 20.7%, 21.0%로 유의적 감소를 나타내었다. SS04는 CCl4 에 의해 증가된 중성지방 및 콜레스테롤의 함량을 혈청과 조직내에서 모두 유의적으로 감소 시켰다.
Table 2.
Effect of Star of Star 04 on serum and hepatictr iglyceride and cholesterol levels in a rat model of carbon tetrachlor ide-induced hepatotoxicity
| Group |
Triglycerides |
Cholesterol |
| Serum (mg/dL) |
Hepatic (mg/gliver) |
Serum (mg/dL) |
Hepatic (mg/gliver) |
| Normal |
53.0±1.01) |
2.7±0.1 |
65.3±4.9 |
54.2±2.0 |
| Control |
+CCl4 |
153.0±12.0 |
7.9±0.5 |
89.9±5.3 |
193.0±21.3 |
| Silymarin |
110.3±1.0*2) |
)5.1±1.0* |
69.3±2.0* |
143.0±19.3* |
| Star of |
100mg/kg |
143.0±20.3 |
5.9±0.3** |
78.9±1.2* |
153.0±30.1** |
| Star®_04 |
300mg/kg |
139.3±13.0* |
*6.0±1.0** |
76.3±4.3** |
152.3±10.2** |
Download Excel Table
요 약
본 연구는 4종의 별의별간(SS) 음료의 간보호 소재로서의 이용 가능성을 조사하고자 항산화능 평가, t-BHP 와 CCl4 로 산화적 손상 및 급성 간독성 유도한in vitro, in vivo 모델을 활용하여 간보호능을 평가하였다.
실험결과, 별의별간 01~04는 50 μM vitamin C 와 유사한항산화 효과를 나타내었다. HepG2 세포에 t-BHP로 산화 스트레스를 유도한 뒤 나타나는 세포독성에 대해 별의별간 01 및 04에서 농도 의존적인 세포 보호효과를 보였으며, ROS 생성 억제에서 별의별간 01, 03, 04에서 농도의존적인 억제를 나타내었다. 미나리가 혼합된 별의별간 04에 대한 급성 간손상in vivo 모델을 활용하여 간보호능 검증 결과, 별의별간 04는 CCl4 로 증가된 혈중 ALT, AST의 유의적 감소, 간 조직중 증가된 MDA 함량 감소 및 감소된 GSH의 유의적 증가를 나타내었다. 또한, 혈청 및 간 조직에서 증가 된 중성지방과 콜레스테롤을 유의적으로 감소시켰다. 이러 한 결과를 종합하며, 별의별간 04는in vitro 및in vivo 모델 에서 산화적 손상에 대해 간보호 효과를 나타내었다.
감사의 글
본 연구는 산업통상자원부와 한국산업기술진흥원의 지역특화산업육성(R&D) 기술개발사업으로 수행된 연구결과입니다.
References
Yeon SH, Ham H, Sung JH, Kim YH, Namkoong SG, Jeong HS, Lee JS. 2013; Antioxidant activities of hot water extract from cornus walteri wanger against oxidative stress induced by tert-butyl hydroperoxide in HepG2 Cells.. J Korean Soc Food Sci Nutr. 42 p. 1525-1532


Mourao M, Dinguirard N, Franco GR, Yoshino TP. 2009; Role of the endogenous antioxidant system in the protection of Schistosoma mansoni primary sporocysts against exogenous oxidative stress.. PLoS Negl Trop Dis. 17 p. 550-562


de Andrade KQ, Moura FA, Dos S, de Arajo OR, de Farias Santos JC, Goulart MO. 2015; Oxidative stress and inflammation in hepatic diseases: therapeutic possibilities of N-Acetylcysteine.. Int J Mol Sci. 37 p. 30269-30308


Korenaga M, Hidaka I, Nishina S, Sakai A, Shinozaki A, Gondo T, Furutani T, Kawano H, Sakaida I, Hino K. 2011; A glycyrrhizin-containing preparation reduces hepatic steatosis induced by hepatitis C virus protein and iron in mice.. Liver Int. 31 p. 552-560


Chon JW, Kweon HY, Jo YY, Yeo JH, Lee HS. 2012; Protective effects of extracts of Protaetia brevitarsis on carbon tetrachloride-induced hepatotoxicity in the mice.. J Seric Entomol Sci. 50 p. 93-100


Park SM, Ki SH, Han NR, Cho IJ, Ku SK, Kim SC, Zhao RJ, Kim YW. 2015; Tacrine, an oral acetylcholinesterase inhibitor, induced hepatic oxidative damage, which was blocked by liquiritigenin through GSK3-beta inhibition.. Biol Pharm Bull. 38 p. 184-192



Stamatinos K, Pierris N. 2013; Serenoa repens extract additionally to quinolones in the treatment of chronic bacterial prostatitis. The preliminary results of a long term observational study.. Arch Ital Urol Androl. 84 p. 190-196


Gulan Z X, Jian Y, Yonghong W, Zhanzhuang T. 2015; Effect of nourishing “Yin” removing “Fire” chinese herbal mixture on hypothalamic mammalian target of rapamycin expression during onset of puberty in female rats.. Evid Based Complement Alternat Med. 2015 p. 157846.

Bansky D, Barolet R. 1990; Chinese herbal medicine formulas and strategies..Eastland PressSeattle, WA, USA p. 7-8.

Lee SG, Jeong HJ, Lee EJ, Kim JB, Choi SW. 2011; Antioxidant and anti-inflammatory activities of ethanol extracts from medicinal herb mixtures.. Korean J Food Sci Technol. 43 p. 200-205


Ko JB. 2005; Effects of liquid culture of Coriolus versicolor on lipid metabolism and enzyme activities in rats fed cholesterol diet.. J Life Sci. 15 p. 790-795


Choi JY, Kim JH, Kim G, Kim CK, Choi MS. 2014; Effect of fermented Hovenia dulcis Thunb fruit water extract on biomarker for liver injury and body weight changes in rats given oral administration of ethanol.. Korean J Food Preserv. 21 p. 412-420


Yu KH, Lee SY, Yang HM, Ham YA, Lee SU, Chae SW, Lee YJ. 2013; Effects of the Artemisia capillaris Extract on the Hepatotoxicity in Ethanol-induced Rats.. J Korean Soc Food Sci Nutr. 42 p. 1560-1566


Par YS. 2010; Antioxidant efeects and improvement of lipid metabolism of acathopanacis cortes water extract in rats fed high fat diet.. J East Asian Soc Dietary Life. 20 p. 37-45.

Yoon JS, Cha YJ, Kim JS. 2008; The effects of lycii fructus and lycii folium on the liver in ovariectomized rat.. Korean J Microscopy. 38 p. 353-361.

Ko BS, Jang JS, Hong SM, Kim DW, Sung SR, Prak HR, Lee JE, Jeon WK, Park SM. 2006; Effect of new remedies mainly comprised of hovenia dulcis thunb on alcohol degradation and liver protection in sprague dawley male rats.. J Korean Soc Food Sci Nutr. 35 p. 828-834.

Ha BJ, Ha JM, Lee SH, Lee JY, Park SY. 2003; Protective effects of saururus chinensis baill extracts on liver cell.. J Food Hyg Safety. 18 p. 177-182.

Lee E, Shin CO. 2007; Effects of galgeun (Pueraria radix) extracts on plasma and liver lipid composition, liver function and antioxidative capacity in rats fed high oxidized Fat.. Korean J Plant Res. 20 p. 475-480.

Jeong YY, Lee YJ, Lee KM, Kim JY. 2009; The effects of Oenanthe javanica Extracts on hepatic gat accumulation and plasma biochemical profiles in a nonalcoholic fatty liver disease model.. J Korean Soc Appl Biol Chem. 52 p. 632-367


Rertman S, Frankel S. 1957; A colorimetric method for the determination of serum glutamic oxalacetic and glutamic pyruvic transaminases.. Am J Clin Pathol. 28 p. 56-63


Griffith OW, Meister A. 1979; Potent and specific inhibition of glutathione synthesis by buthionine sulfoximine (S-n-butyl homocysteine sulfoximine).. The Journal of biological chemistry. 254 p. 7558-7560


E Al-Sayed, Esmat A. 2016; Hepatoprotective and antioxidant effect of ellagitannins and galloyl esters isolated from Melaleuca styphelioides on carbon tetrachloride-induced hepatotoxicity in HepG2 cells.. Pharm Biol. 5 p. 1-9


Jin YX, Yoo YS, Han EK, Kang IJ, Chung CK. 2008; Artemisia capillaris and Paecilomyces japonica stimulate lipid metabolism and reduce hepatotoxicity induced by carbon tetrachloride in rats.. J Korean Soc Food Sci Nutr. 37 p. 548-554