서 론
최근 우리나라는 서구화에 따른 식습관의 변화로 고단백, 고지방 등 동물성 식품의 섭취가 증가하는 추세이며 이로 인하여 각종 암이나 성인병 등 과거에는 흔하지 않았 던 질병으로 인한 사망률이 증가하고, 심장병, 당뇨, 고혈압 등의 만성 질환이 사회문제로 대두되고 있다. 이것으로 인 하여 건강에 대한 관심은 매우 높아지고 있어서 최근에는 건강에 도움이 되는 천연물에 대한 연구들이 활발히 진행되 고 있다(1,2).
페놀 화합물은 암, 당뇨, 심혈관계 질환, 신경변성 질환,그 외에 다양한 질병을 예방하는데 유익한 역할을 하며, 천연항산화제로써 중요한 인자가 된다(3). 천연 폴리페놀 화합물에는 flavonoid, chlorogenic acid, arbutin, lignan, lignin, tannin 등이 있으며 항암 물질로써 만성질환을 예방 하는데 도움을 준다(4). 페놀 화합물과 더불어 플라보노이 드는 다양한 식물류 등에 존재하며 황색 색소를 가지는 성분으로 페닐기 2개가 C3 사슬을 매개로 하여 탄소 골격구조를 갖는 페닐화합물을 말한다. 플라보노이드계 화합물은 항균작용, 항암작용, 항염증작용, 항알레르기 등 다양한 생 리활성 기능이 인체 내에서 모든 질병의 원인이 되는 산화 작용을 억제하는 효과를 가진 것으로 알려져 있다(5).
또한, 일반적으로 식물성 추출물은 추출 부위, 방법, 조건및 추출용매 등에 따라 유효물질의 함량 및 패턴이 다르며, 항산화 활성, 지질대사 등 이화학적 특성에 변화를 준다(6). 따라서 추출용매의 선별은 기능성 물질의 추출에 매우 중요 하게 작용할 수 있으며 methanol, ethanol, water 등 다양한 추출용매를 이용하여 항산화성 물질을 효율적으로 찾고자 하는 연구가 진행되고 있다(7).
한편, 대극속(Euphorbia L.)에 속하는 비단풀(Euphorbia humifusa)은 땅빈대라고도 불리며 1년생 초본으로 전국의 전야나 노변에 야생하며 백색의 유액을 함유하고 있고, 줄 기는 보통 뿌리의 상단에서 2가지로 갈러져 지면을 따라 옆으로 뻗으며 붉은 빛을 나타내는 식물로서 잎의 길이는 5~10 mm, 너비 4~6 mm의 긴 타원형의 모양을 가지고 있다 (8). 또한 비단풀의 주요 성분은 flavonoid, gallic acid, tannin 등을 함유하고 있으며 항산화 약리활성으로는 발병성 구균 과 나균에 대한 항균활성과 포도상 구균, diphteria균, 대장 균 및 녹농균에 대해 살균작용을 나타내며(9) 그 외에도 항암작용과 해독작용, 항균작용, 진정작용 등이 뛰어나서 여러종류의 암, 염증, 천식, 당뇨병, 심장병, 신장질환, 악성 두통, 정신불안증 등의 효과적인 것으로 알려져 있다(10). 비단풀에 관한 연구로는 비단풀의 물 추출물의 항산화력 및 항암활성(10), 식중독 세균에 대한 항균활성(8), 세포보 호 효과(11) 등이 보고되고 있으나 대부분이 물 추출물을 이용해 추출된 것을 사용하였고 다른 추출방법이나 용매를 이용해 추출된 비단풀을 이용한 연구는 거의 없어 이를 유용하게 사용하기 위한 다양한 추출조건 및 효능에 대한 과학적인 근거 제시가 필요하다.
따라서 본 연구에서는 비단풀의 이용가치를 높이기 위하여 추출용매에 따른 항산화 활성과 생리활성의 검증을 통해 천연항산화 소재 및 생리활성물질 개발 가능성을 확인 및 기초자료로 활용하고자 하였다.
재료 및 방법
본 실험에서 사용된 건조 비단풀(Euphorbia humifusa)은2014년 경북영천에서 재배된 것을 구입하여 사용하였으며, 분쇄기를 사용하여 잎과 뿌리를 함께 분쇄(20 mesh)한 분말 을 –50℃에 보관하면서 실험에 사용하였다.
건조비단풀의 추출방법은 분쇄시료 100 g에 8배의 각각의 다른 용매인 물, 70% 에탄올, 80% 메탄올을 가한 후환류냉각추출의 방법으로 추출물을 제조하였다. 환류냉각 추출은 분쇄시료와 용매를 넣은 용기에 냉각관을 부착하여 물 60℃, 70%에탄올 60℃, 80% 메탄올 60℃의 맨틀 상에서 3시간씩 3회 반복 추출하였다. 각각의 추출물은 Whatman No. 1 여과지로 여과한 다음 rotary vacuum evaporator(rotary vacuum evaporator N-N series, EYELA, Tokyo, Japan)로 감압농축한 후에 동결건조(freeze dryer, FD SFDSM12, Samwon, Busan, Korea)하여 분말 시료를 제조하였으며 -5 0℃에 보관하면서 실험에 사용하였다. 추출물 각각의 수율 은 추출액을 동결건조 시켜 건물 중량을 구한 다음 추출액 조제에 사용한 원료 건물량에 대한 백분율로 나타내었다.
폴리페놀 함량은 Dewanto 등(12)의 방법에 따라 시료100 μL에 2% sodium carbonate 2 mL과 50% Folin-ciocalteu reagent 100 μL을 가한 후 720 nm에서 흡광도를 측정하였으 며, gallic acid의 검량선에 의하여 함량을 산출하였다. 플라 보노이드 함량은 Abdel-Hameed (13)의 방법에 따라 시료 100 mL에 5% sodium nitrite 0.15 mL을 가한 후 25℃에서 6분간 방치한 다음 10% aluminium chloride 0.3 mL를 가하 여 25℃에서 5분간 방치하였다. 다음 1N NaOH 1mL를 가하 고 vortex상에서 가한 후 510 nm에서 흡광도를 측정하였으 며 rutin hydrate의 검량선에 의하여 함량을 산출하였다.
Vanillin-sulfuric acid법 (14)에 따라 시료 200 μL에 1.2%vanillin 용액 500 μL와 20% sulfuric acid 500 μL를 혼합하여 20 분간 방치한 후 500 nm에서 흡광도를 측적하였으며 (+)-catechin의 검량선에 의하여 함량을 산출하였다.
DPPH radical 소거활성은 Blois MS(15)의 방법에 의하여실험하였다. 시료 0.2 mL에 0.4 mM DPPH (1,1-diphenyl- 2-picryl-hydrazyl) 용액 0.8 mL를 가하여 10분간 방치한 다 음 525 nm에서 분광광도계(UV-1650PC, Shimadzu, Kyoto, Japan)를 이용하여 흡광도의 변화를 측정하였으며, electron donating ability(%)=100-[(O.D of sample/O.D. of control) ×100]에 의하여 활성도를 산출하였다. Re 등(16)의 방법에 따라 7.4 mM ABTS[2,2’-azino-bis(3-ethylbenzothiazoline -6-sulfonic acid) diammonium salt]와 2.6 mM potassium persulfate를 혼합하여 실온․암소에서 24시간 동안 방치하 여 radical을 형성시킨 다음 실험 직전에 ABTS 용액을 732 nm에서 흡광도가 0.70±0.03이 되도록 phosphate buffer saline(PBS, pH 7.4)로 희석하여 사용하였다. 희석된 용액 950 μL에 추출물 50 μL를 가하여 암소에서 10분간 반응시 킨 후 732 nm에서 흡광도를 측정하였으며 계산식, ABTS+ radical scavenging ability(%)=100-[(OD of sample/OD of control)×100]에 의하여 활성을 산출하였다.
Saeedeh와 Asna(17)의 방법에 따라 시료 1 mL에 0.2 Mphosphate buffer(pH 6.6) 2.5 mL와 1% potassium ferricyanide 용액 2.5 mL를 가한 후 50℃에서 30분간 반응시켰다. 다음 에 10% trichloroacetic acid 용액 2.5 mL를 가한 후 1,650×g 에서 10분간 원심분리 하였으며, 상징액 2.5 mL에 증류수 2.5 mL와 0.1% FeCl3 용액 0.5 mL를 가한 후 700 nm에서 흡광도를 측정하였다.
Kim 등(18)의 방법에 따라 추출물 0.05 mL, 1 uint/mLα-glucosidase 0.05 mL와 200 mM potassium phosphatebuffer (pH 7.0) 0.05 mL를 잘 혼합하여 37℃에서 10분간 전처리하 였다. 다음에 3 mM ρNPG(ρ-nitrophenyl α-D-glucopyranoside) 0.1 mL를 첨가하여37℃에서 10분간 반응시킨 후 0.1 M Na2CO3 0.75 mL로 반응을 정지시켜 405 nm에서 흡광도를 측정하였다. 이때, 활성 비교를 위하여 acarbose를 사용하였 다. 저해활성은 α-Glucosidase inhibition(%)=[1-(CAbs-SAbs)/ (CAbs-BAbs)]×100: “CAbs,대조구흡광도 SAbs, 시료흡광도 BAbs, 시료 무첨가구의 흡광도”에 의하여 산출하였다.
3-hydroxy-3-methylglutaryl coenzyme A(HMG CoA)reductase 저해활성은 Kleinsek 등(19)의 방법을 변형하여 측정하였다. 추출물 40 μL, dimethyl sulfoxide 40 μL와 0.5 μM phosphate buffer(pH 7.0) 200 μL에 20 mM dithiothreitol 200 μL, 0.3 mM β-NADPH 200 μL를 넣고 혼합하였다. 다음 37℃에서 3분간 preincubation을 한 다음 0.3 mM HMG CoA 200 μL를 첨가하여 37℃에서 5분간 반응시킨 후 340 nm에서 흡광도 변화를 측정하였으며, 저해활성은 계산식, HMG CoA reductase inhibitory activity(%)=[1-(CAbs- SAbs)/(CAbs-BAbs)]×100: “CAbs, 대조구 흡광도; SAbs, 시료 흡 광도; BAbs, 시료 무첨가구의 흡광도”에 의하여 산출하였다.
Stirpe와 Corte(20)의 방법에 따라 추출물 0.1 mL와 0.1M potassium phosphate buffer(pH 7.5) 0.6 mL에 2 mM xanthine 기질액 0.2 mL를 첨가하고 xanthine oxidase(0.2 U/mL) 0.1 mL를 가하였다. 다음에 37℃에서 15분간 반응시 킨 후 1 N HCl 1 mL를 가하여 반응을 종결시킨 다음, 반응액 중에 생성된 uric acid의 양을 292 nm에서 흡광도를 측정하 였으며 계산식, xanthine oxidase inhibition activity(%)= 100-[(O.D of sample/O.D of control)×100]에 의하여 산출하였다.
결과 및 고찰
건조 비단풀로부터 생리활성물질과 같은 유효성분을 가장 효율적으로 추출하기 위해 물, 에탄올, 메탄올 용매를 사용하였으며수율, 폴리페놀, 플라보노이드및proanthocyanidin 함량은 Table 1과 같다. 수율은 메탄올 추출물, 에탄올 추출 물, 물 추출물에서 각각 21.88%, 21.09% 및 20.63% 순으로 나타내었다. 천연물 중에는 catechins, pectin, caffein, flavonoids, tocopherol과 같은 식물성 phenolic compounds는 수용성 또는 지용성으로 구분되어 있어 추출되는 용매에 따라 추출되는 성분들이 달라지기 때문에 추출 수율에 있어 서도 많은 차이를 보이나(21,22) 본 연구에서는 용매간의 추출 수율이 크게 차이나지 않았다.
항산화 물질 중 polyphenolic 화합물들은 우수한 항산화력을 가지고 있으며, flavonoids는 주로 anthocyanidins, flavonols, flavones, cathechins 및 flavanones 등으로 구성되 어 있으며, 그 구조에 따라 특정 flavonoid는 항산화 및 항균 성 등 다양한 생리활성을 갖고 있는 것으로 보고되고 있다 (23). 추출용매에 따른 비단풀 추출물의 폴리페놀 함량은 메탄올, 에탄올, 물 추출물에서 g당 각각 293.25 mg/g, 261.27 mg/g 및 197.28 mg/g으로 나타났으며, 플라보노이드 함량은 메탄올 추출물, 에탄올 추출물, 물 추출물이 g당 각각 21.05 mg, 19.40 mg, 17.09 mg으로 메탄올 추출물에서 가장 높은 함량을 보였으며 이는 폴리페놀 함량과 비슷한 경향을 나타내었다.
생리활성의 바이오플라보노이드(bioflavonoids)의 한 부류인 프로안토시아니딘(proanthocyanidin)은 축합된 탄닌물질로 알려져있으며, 이들 물질은 생체 내에서 유리기 소 거능과 관련된 산화환원 반응을 통해 항산화작용을 나타낸 다(24). 프로안토시아니딘 함량은 g 당 물 추출물이 8.42 mg, 메탄올 추출물이 5.70 mg, 에탄올 추출물이 5.39 mg으 로 물 추출물에서 높은 함량을 나타내었으며 폴리페놀 및 플라보노이드 함량과는 상반되는 경향을 나타내었다.
Kim 등(25)은 산사 씨 메탄올 추출물에서 폴리페놀이함량이 가장 높게 나타났다고 보고하였으며 본 연구결과와 일치하였다. 추출용매에 따른 페놀화합물 함량의 유의적인 차이를 나타내었고 폴리페놀이 유기용매와 반응하기 적합 한 hydroxyl group이 포함된 입체구조 화합물이므로 비단풀 의 경우 메탄올 추출 시 수율 및 페놀화합물 등의 유용성분 의 추출함량을 증대시킬 수 있는 것으로 판단된다.
추출용매별 비단풀 추출물의 DPPH 및 ABTS+ 라디칼소거활성과 환원력을 측정한 결과는 Table 2와 같다. DPPH 라디칼 소거활성의 경우 0.5 mg/mL의 농도에서 메탄올 추 출물이 91.72%, 에탄올 추출물이 85.23%, 물 추출물이 71.83%로 나타났으며, 합성 산화방지제인 BHT(Butylated hydroxytoluene)와 비교한 결과 0.5 mg/mL의 농도에서 29.90%로 나타나 전체적으로 비단물 추출물이 높은 라디칼 소거활성을 보였다. ABTS+ 라디칼 소거활성의 경우 0.5 mg/mL의 농도에서 양성대조구인 BHT(99.65%)보다 낮은 활성을 나타내었으나 메탄올 추출물이 84.83%로 라디칼 소거활성에서는 메탄올 추출물이 높은 활성을 보였다. Kim 등(26)의 연구에 따르면 비단풀 추출물의 free radical 소거 활성(FSC50)을 비교한 결과 ethyl acetate 분획물과 aglycon 분획물의 소거활성의 차이를 가짐을 알 수 있었으며 비단풀 추출물의 항산화활성은 quercetin과 kaempferol에 의한 작 용이라 보고하였다. 또한 Park 등(27)은 울금 메탄올 추출물 이 물 추출물에 비해 높은 라디칼 소거 활성을 보였고 이는 유기용매에 의해 추출되는 저분자 화합물 중 주류를 이루는 페놀성 화합물 및 플라보노이드와 유의적인 상관관계를 나타내는 것으로 보고하였다.
추출용매를 달리한 비단풀 추출물의 환원력을 측정한결과, 각 용매사이에서 유의적인 차이를 나타내었으며 에 탄올 추출물에서 0.96으로 가장 높은 환원력을 나타냈고, 물 추출물은 0.65로 가장 낮은 환원력 수치를 보였다. 또한 양성 대조구인 BHT는 0.99로 나타나 비단풀 추출물에서 다소 낮게 나타났으나 전체적으로 높게 측정되어 항산화 효과가 우수함을 알 수 있었다. Wang 등(28)의 보고에 따르 면 DPPH 라디칼 소거능과 총 페놀성 화합물의 함량은 밀접 한 상관관계가 있으며, 본 연구 결과 또한 비단풀의 총 폴리 페놀 함량에 따라 DPPH 라디칼 소거 활성에 높아지고 있어 상관관계 성립을 예측할 수 있었다. 또한 Lee 등(29)은 와송 부위별 추출물의 환원력 측정결과는 페놀화합물 함량이 높은 에탄올 추출물이 물 추출물보다 높은 활성을 보였다고 보고하였는데 이는 본 실험과도 유사하였다.
추출용매를 달리한 비단풀 추출물의 α-glucosidase,HMG-CoA reductase 및 xanthine oxidase 저해활성을 측정 한 결과는 Fig. 1과 같다. 0.1 mg/mL의 농도에서 α -glucosidase 저해활성을 평가하였으며, 양성 대조군으로는 제2형 당뇨치료제로 쓰이는 acrobose와 비교하였다. 그 결 과 물 추출물에서는 13.49%, 에탄올 추출물에서는 69.07%, 메탄올 추출물에서는 88.82%로 메탄올 추출물에서 높은 저해 활성을 나타내었다. 또한 양성 대조군인 acarbose(50 mg%)에 비하여 α-glucosidase 저해활성이 더 우수한 것으로 나타났다. Sim 등(30)의 연구에 따르면 고사리 물 추출물은 모든 농도에서 10% 미만의 낮은 저해 활성을 나타내었으나 50% 에탄올 추출물에서는 30.04%로 물 추출물보다 월등히 높은 저해 효과를 보고하였으며 본 연구와 동일한 경향을 나타내었다.
한편, HMG-CoA reductase는 콜레스테롤 생합성 과정에서 중요한 조절 효소로서, 이 효소의 저해는 세포 내에서 콜레스테롤 합성을 억제한다고 알려져, HMG-CoA reductase 저해제는 혈중 콜레스테롤 특히 LDL 콜레스테롤 을 가장 효과적으로 낮출 수 있는 hypo cholesterolemic 약제 로 널리 사용되고 있다(31). HMG-CoA reductase 저해율은 시료를 넣지 않은 대조군의 효소 활성에 대한 저해 정도를 백분율로 환산하여 검토하였는데, 0.1 mg/mL의 농도에서 비단풀 물 추출물이 81.98%, 메탄올 추출물이 80.81%, 에탄 올 추출물이 77.41%의 순으로 나타났으며 전체적으로 높은 저해활성을 나타내었다. 양성대조구는 콜레스테롤 저하 등 의 다양한 생리활성을 가지는 caffeoylquinic acid류의 chlorogenic acid 및 cynarin을 사용하였으며(32), 전체적으로 대조구보다 비단풀 추출물의 HMG-CoA reductase 저해 활성이 높게 나타났다. Bui 등(33)의 연구에 따르면 비단풀 은 pyrrolidinonoids, sesquiterpenoids, triterpenoids 등의 다 양한 phenolic 성분들을 함유하고 있으며 비단풀 추출물로부터 분획하여 얻은 물질들은 soluble epoxide hydrolase 억 제제의 효능을 가지며 다양한 항염증, 항고혈압 등의 효과 를 가짐을 시사하고 있다. 따라서 본 연구 결과에서 전반적 으로 비단풀 추출물의 높은 HMG-CoA 저해활성은 비단풀 에 함유되어 있는 여러 유효성분이 콜레스테롤 저하 및 심혈관계 질환에 영향을 미칠 것으로 판단된다.
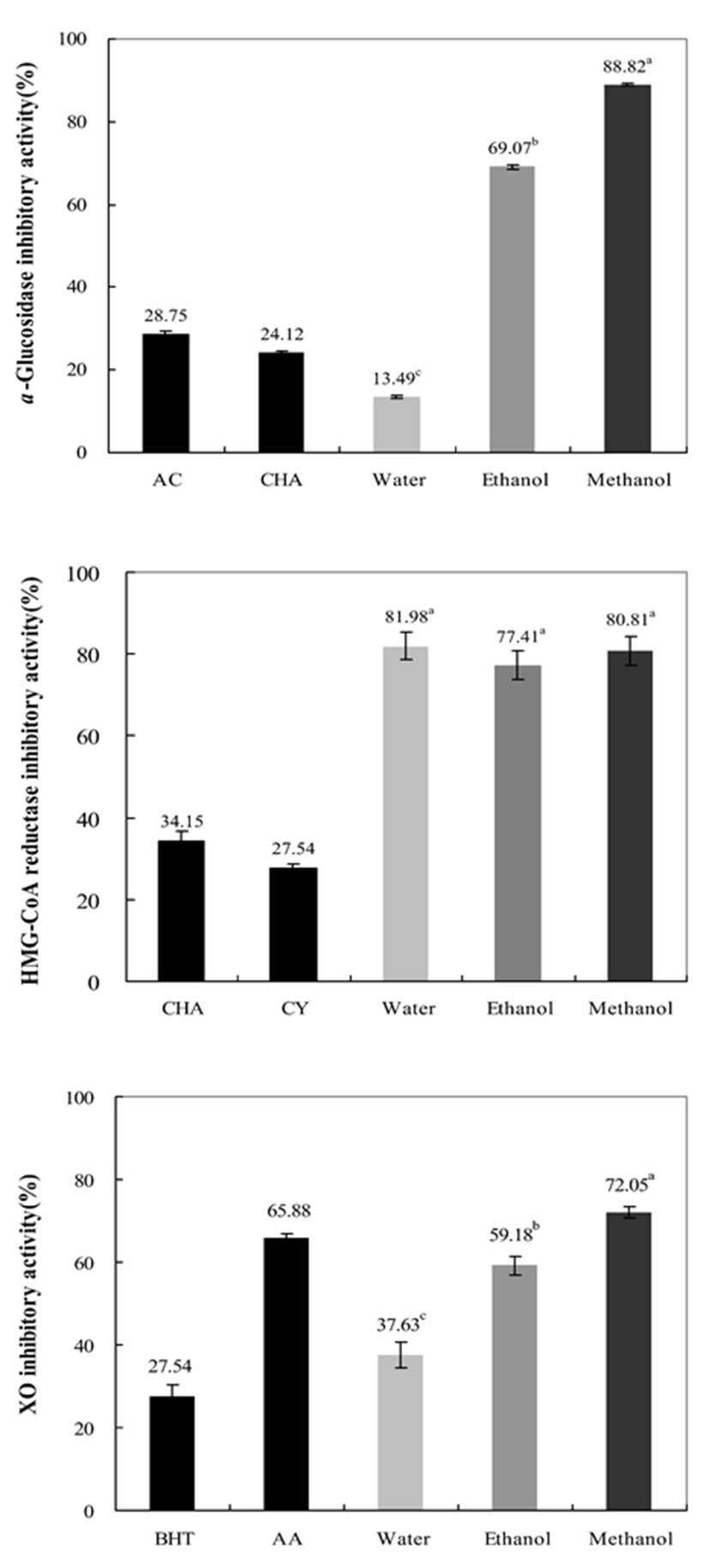
Xanthine oxidase(XO)은 xanthine 또는 hypoxanthine으로부터 uric acid를 형성하여 혈장내에서 과량 존재하게 되면 골절에 축적되어 심한 통증을 동반하는 통풍(gout)과 신장 에 침착되어 신장 질환을 유발하는 효소이다. 따라서 XO 저해활성은 free radical의 생성을 억제하므로 항산화, 항노 화 및 항암 등의 효과를 기대할 수 있는 생물학적 중요한 효소라고 할 수 있다(34). 0.1 mg/mL의 농도에서 XO 저해활 성은 메탄올 추출물이 72.05%로 가장 높았고 에탄올 추출 물이 59.18%, 물 추출물이 37.63%의 순으로 나타났으며, 메탄올 추출물의 경우 양성대조군인 BHT(27.54%, 50 mg%)와 ascorbic acid(65.88%, 50 mg%) 보다 높은 저해활성 을 보였다. 이는 XO 저해활성 실험에서 폴리페놀류가 저해 효과가 높다는 Stirpe 등(35)의 보고와 같이 높은 페놀 함량 을 나타낸 비단풀 메탄올 추출물에서 높은 저해효과가 나타 났으며 전체적으로 비단풀 추출물은 통풍의 예방이나 생약 치료제로써의 개발 및 이용이 가능할 것으로 판단된다.
추출용매를 달리한 비단풀 추출물의 페놀화합물과 생리활성 간의 상관관계를 분석한 결과는 Table 3과 같다. 전체 적으로 상관 계수 값(Pearson's correlation coefficient, r)이 0.9 이상으로 모든 항목에서 높은 유의적인 양의 상관관계 (p<0.05)가 있는 것으로 나타났다. 폴리페놀 함량이 높을수 록 DPPH 및 ABTS+ 라디칼 소거활성과 α-glucosidase 및 xanthine oxidase(XO) 저해활성이 높았으며 상관계수는 각 각 1.000, 0.999, 0.997, 0.999로 양의 상관관계를 보였다 (p<0.05). 플라보노이드 함량이 높아질수록 ABTS+ 라디칼 상관관계를 나타내었다(p<0.05). 이상의 결과로 폴리페놀과 플라보노이드 함량은 항산화 활성에 대한 상관성이 높 은 것을 알 수 있었다. 페놀성 물질은 항산화 활성을 포함한 다양한 생리적 효능을 나타내는 것으로 보고되며 이에 따라 항산화활성과 페놀성 성분간의 높은 상관관계에 관한 연구 들은 다소 보고된 바 있다(36).
요 약
비단풀의 이용가치를 향상시키기 위해 추출용매에 따른효율적인 추출방법을 제시하기 위하여 물, 에탄올, 메탄올 세 가지 용매별로 환류냉각 추출한 건조 비단풀 추출물의 항산화 특성을 비교 분석하였다. 수율은 메탄올, 에탄올 및 물 추출물이 각각 21.88%, 21.09% 및 20.63% 순으로 메탄올 추출물이 가장 높은 수율을 나타내었다. 메탄올 추 출물의 폴리페놀과 플라보노이드 함량은 g당 각각 273.25 mg/g, 20.05 mg/g으로 가장 높게 나타났으나 프로안토시아 니딘은 에탄올 추출물이 8.42 mg/g으로 다소 높은 경향을 나타내었다. DPPH 및 ABTS radical 소거활성은 메탄올 추 출물에서 높은 활성을 나타내었으나 환원력에서는 에탄올 추출물이 높은 활성을 보였다. 비단풀 추출물의 다양한 생 리활성 검z증을 위하여 효소실험을 실시하였으며 HMGCoA 저해활성의 경우, 양성대조군과 비교하였을 때 전체 적으로 높은 저해활성을 나타내어 콜레스테롤 개선 효과에 대한 가능성을 확인하였으며 물 추출물이 조금 더 높은 저해활성을 나타내었다. α-Glucosidase 및 xanthine oxidase 저해활성의 경우 비단풀 메탄올 추출물이 다른 용매 추출물 에 비하여 높은 저해활성을 보였다. 이러한 결과를 종합해 볼 때 비단풀 메탄올 추출물은 우수한 항산화 및 생리활성 을 나타내어 향후 천연 항산화제 및 기능성 소재로써의 활용 가치가 높을 것으로 판단된다.










