서 론
삼채(Allium hookeri)는 히말라야 산맥 해발 1,400~4,200미터 지역의 초 고랭지역이나 숲 또는 습지에서 자생하는 다년생초로, 마늘, 파, 양파, 부추 등과 같은 백합과 (Liliaceae)에 속한다(1). 미얀마와 인도에서는 삼채를 국민 채소로 애용할 뿐만 아니라 염증질환과 암 등의 민간요법으로 오랫동안 사용하여 왔으며, 중국에서도 식용과 약용으 로 이용하고 있다(2). 단맛, 쓴맛, 매운맛이 난다고 하여 삼채(三菜), 또는 인삼 맛이 난다고 하여 삼채(蔘菜)라고 불린다. 삼채는 0.5~1 m 정도의 높이까지 자라고 뿌리, 뇌 두, 잎, 꽃대, 꽃으로 구성되어 있으며, 주로 뿌리와 잎을 식용으로 섭취한다. 삼채는 마늘에 비해 6배 많은 식이 유황 화합물을 함유하고 있으며, 또한 양파에 비해 높은 함량의 섬유소, 단백질, 폴리페놀 등을 함유하고 있다고 보고되고 있다(1). 미얀마 의학사전에는 다량의 식이유황이 포함되 어 있어 그 효능이 식이유황에서 기인된 것이라고 추측하고 있는데(3), 식이유황은 다수의 연구를 토대로 항암, 항염증, 항균효과 등이 보고되어 있다(4). 대체로 식이유황은Allium 속 식물과 사포닌이 다량으로 함유되어 있는 인삼, 도라지, 더덕 등에 많이 포함되어 있어, 삼채 또한Allium속 식물로 다량함유되어다양한생리활성을나타낼것으로생각된다(5).
국내에는 2006년 삼채가 건강기능성 물질이 많이 함유된작물로 소개된 이후 그 성분과 효능에 관심이 집중되어 미얀마로부터의 수입이 꾸준히 증가하고 있다. 2010년에 경남 하동 지역에 삼채 재배가 처음 도입된 이후 현재 농가 의 신소득 작물로서 인식됨으로써 전국 각 지역에서의 재배 량이 증가하고 있는 추세이며(6), 이에 따른 삼채에 대한 연구도 활발히 진행되고 있다. 현재까지 보고된 삼채에 관 한 연구는 삼채뿌리의 항염증 효과, 노지 및 시설재배 삼채 뿌리 및 잎의 이화학적 성분 및 DPPH 라디칼 소거능, 삼채 뿌리를 첨가한 김치의 품질특성 등(2,3,7,8)이 있으며, 또한 선행연구를 통해 다량의 유리아미노산과 조사포닌이 함유 되어 있음을 확인하였다(5). 하지만 아직까지 국내산 삼채 에 대한 다양한 생리활성에 관한 연구는 여전히 부족한 실정이며, 더욱이 삼채 재배지 즉, 수입산 및 국내산 삼채에 대한 식품학적 및 기능적 특성 비교에 대한 연구보고는 전무하다. 따라서 본 연구에서는 국내 및 원산지인 미얀마 에서 재배된 삼채뿌리의 항산화, 항당뇨 및 항치매 활성 등을 비교, 분석하여 기능성 식품소재로의 가치를 확인함 과 동시에 국내산 삼채의 우수성을 확인하고자 하였다.
재료 및 방법
본 실험에 사용된 삼채뿌리 중 국내산은 경상남도 하동군에서 재배된 뿌리를 구입하였고, 미얀마산은 미얀마 샨 (Shan)주에서 재배된 뿌리를 구입하여 사용하였다. 구입한 시료는 이물질 제거 및 수세 하여 동결건조 후 -40℃에 보관 하여 사용하였다.
삼채뿌리의 기능성 측정을 위한 추출물은 삼각플라스크에 동결건조 시료 40 g과 80% methanol 200 mL을 넣어 잘 섞은 다음 60℃ shaking water bath(KMC-8480SF, Vision Scientific Co., Seoul, Korea)에서 100 rpm으로 5시간 동안 추출하고, 이를 4℃, 8000 rpm에서 20분간 원심분리한 다음 Whatman No. 1(Maidstone, England)로 여과하였다. 고형분 을 모아 다시 80% methanol 200 mL를 넣어 위의 방법으로 반복 추출 하였다. 얻어진 추출액을 감압농축(R-124, Buchi, Flawil, Swizerland)하고, 각각의 농축된 추출물은 동결건조 (FD-1, Eyela, Tokyo, Japan)하여 일정량의 농도로 만들어 실험에 사용하였다.
총 폴리페놀 함량은 Folin-Denis법(9)에 준하여 측정하였다. 즉, 추출물을 증류수에 녹인 다음 시험관에 0.2 mL씩취하고 여기에 Folin-ciocalteu’s phenol reagent 0.2 mL 첨가 하여 잘 혼합하였다. 이를 실온에 3분간 방치한 뒤, 10% Na2CO3 0.4 mL를 가하여 혼합하고 증류수 4 mL를 첨가하 였다. 실온에 1시간 방치한 다음 725 nm에서 흡광도를 측정 하였다. 이 때 총 폴리페놀 화합물은 gallic acid(Sigma, St. Louis, MO, USA)를 이용하여 작성한 표준곡선으로부터 함량을 구하였다.
총 플라보노이드 함량은 Moreno 등(10)의 방법에 준하여측정하였다. 추출물을 증류수에 녹인 다음 시험관에 0.5 mL 취하고 10% aluminum nitrate와 1 M potassium acetate를 각각 0.1 mL씩 넣고, 80% ethanol을 4.3 mL를 가하여 혼합하 였다. 실온에서 40분간 방치한 후 415 nm에서 흡광도를 측정하였다. 이 때 총 플라보노이드 함량은 quercetin(Sigma St. Louis, MO, USA)을 이용하여 작성한 표준곡선으로부터 환산하여 측정하였다.
삼채뿌리 추출물의 항산화 활성을 확인하기 위해 DPPH및 ABTS 라디칼 소거능, Fe2+ 킬레이팅 효과 그리고 환원력 을 측정하였으며, 이에 대한 IC50(half maximal inhibition concentration)을 구하여 나타나내었다.
삼채뿌리 추출물의 DPPH 라디칼 소거능은 Blois(11)의방법에준하여측정하였다. 안정한유리라디칼인1,1-diphenyl- 2-picryl hydrazyl(DPPH, Sigma)에 대한 시료 용액과의 전자 공여 효과로써 이 반응에 의해 DPPH 라디칼이 감소하는 정도를 spectrophotometer(U-2900, Hitachi, Tokyo, Japan)를 이용하여 측정하였다. 각 추출물을 농도별로 제조하여 시 험관에 0.5 mL 취하고, 0.1 mM DPPH 용액 1 mL를 가하여 10초간 vortex mixing 하였다. 이를 실온에서 30분간 반응시 켜 520 nm에서 흡광도를 측정하였다.
ABTS[2,2’-Azino-bis(3-ethylbenzothiazoline-6-sulfonicacid)] 소거활성은 Re 등(12)의 방법을 일부 수정하여 실험 하였다. ABTS 7 mM과 potassium persulfate 2.45 mM을 증류수에 용해하여 12~16시간 동안 암소에 방치하여 ABTS cation 라디칼(ABTS·+)을 형성시켰다. 이 용액을 80% ethanol을 이용하여 734 nm에서 0.700±0.002의 흡광도 값을 갖도록 희석하였다. 증류수에 농도별로 희석한 추출 물 50 μL를 시험관에 가한 다음 희석된 ABTS·+ 용액 1 mL를 첨가하고 실온에서 6분간 반응시켜 734 nm에서 흡광 도를 측정하였다.
삼채뿌리의 Fe2+ 킬레이팅 활성은 Dinis 등(13)의 방법을변형하여 측정하였다. 추출물을 증류수에 녹여 농도별로 1 mL 취한 뒤, 2 mM FeCl2 와 5 mM Ferrozine[3-(2- pyridyl)-5,6-diphenyl-1,2,4-triazine-4,4″-disulfonic acid]을 각각 25 μL 첨가하고 혼합하였다. 이를 실온에 10분간 방치 한 다음 562 nm에서 흡광도를 측정하였다.
환원력은 Mau 등(14)의 방법에 준하여 측정하였다. 추출물을 증류수에 녹인 다음 250 μL 취하고, 0.2 M sodium phosphate buffer(pH 6.6)와 1% potassium ferricyanide[KFe (CN)6] 각각 250 μL를 첨가하여 50℃ 수욕에서 20분간 반응 시킨 후, 10% trichloroacetic acid 250 μL를 첨가하였다. 위 반응액을 25℃, 1000 rpm에서 10분간 원심분리 하여 얻은 상등액 500 μL에 증류수 500 μL와 0.1% ferric chloride (FeCl3·6H2O) 100 μL를 첨가하여 혼합하였다. 이후 반응액 의 흡광도를 microplate reader(EPOCH, BioTek Instument Inc, Winooski, VT, USA)를 이용하여 700 nm에서 측정하였다.
α-Glucosidase 저해활성은 Phan 등(15)의 방법에 따라 측정하였다. 즉 각 농도별 sample 50 μL를 0.2 U/mL 50 μL, 200 mM potassium phosphate buffer(pH 6.8) 50 μL와 혼합하 여 37℃에서 15분간 배양한 후 3 mM ρNPG(ρ-nitrophenyl-α -D-glucopyranoside, Sigma) 100 μL를 가하여 37℃에서 10분 간 반응시켰다. 이후 반응액에 0.1 M NaOH 50 μL로 반응을 정지시키고 405 nm에서 흡광도를 측정하였다. Sample 무첨 가구는 negative control로 사용하였고, 기질 무첨가구는 blank로 사용하였다. 비교를 위해 acarbose(Sigma)를 positive control로 사용하였으며, 효소활성의 저해정도는 다음식의 의해 산출되었다.
ABSsample: Absorbance of the experimental sample
ABSblank: Absorbance of the blank
ABScontrol: Absorbance of the negative control
삼채뿌리의 acethylcholinesterase(AChE) 저해활성은Ellman 등(16)의 방법을 응용하여 측정하였다. 200 mM phosphate buffer에 녹인 sample 200 μL, DTNB 80 μL, 0.2 unit/mL acethylcholinesterase 10 μL를 micro well plate에 넣고 혼합한 뒤, 25℃에서 5분간 incubation 하였다. 배양 후 acetylcholine iodide 15 μL를 넣고 다시 25℃에서 5분간 incubation 한 뒤, 405 nm에서 흡광도를 측정하였다. Control 은 sample 대신 동량의 phosphate buffer를 사용하였으며, 효소활성의 저해정도는 다음 식에 의하여 산출하였다.
ABSsample: Absorbance of the experimental sample
ABScontrol: Absorbance of the control
결과 및 고찰
폴리페놀계 물질은 식물체에 널리 분포되어 있으며 한분자 내에 2개 이상의 phenolic hydroxyl(-OH)기를 가지는 방향족 화합물을 총칭하며, 산화-환원반응에서 기질로 작 용한다. 폴리페놀화합물의 종류로는 phenolic acid, flavonoids, lignans, stilbenes 등이 있으며, 항산화활성을 비롯하여 심혈관계 질환예방, 항암, 항염증, 항고혈압 활성 을 가진다(17). 삼채뿌리의 총 폴리페놀 및 플라보노이드 함량을 측정한 결과는 Table 1과 같다. 총 폴리페놀함량은 국내산 삼채뿌리 5.27 mg GAE/g, 미얀마산 삼채뿌리 4.80 mg GAE/g으로 국내산 삼채뿌리가 유의적으로 높은 함량 을 나타내어 재배지에 따라 함량이 차이를 보이는 것을 알 수 있었다. 총 플라보노이드 함량 또한 국내산 삼채뿌리 0.35 mg QE/g, 미얀마산 삼채뿌리 0.24 mg QE/g으로 유의 적인 차이를 보여 대부분의 식물에서 폴리페놀함량이 높을 경우 플라보노이드함량 또한 높다는 보고와 동일하게 나타 났다(18). 이상의 결과에서 국내산 삼채뿌리가 미얀마산 삼채뿌리보다 더 높은 총 폴리페놀 및 플라보노이드함량을 보여 항산화 활성이 더 뛰어날 것으로 추측된다.
| Sample1) | Total polyphenols (mgGAE/g extract powder) | Total flavonoids (mgQE/g extract powder) |
|---|---|---|
| KR | 5.27±0.132)*3) | 0.35±0.01* |
| MR | 4.80±0.11 | 0.24±0.02 |
삼채뿌리의 항산화 활성을 측정하기 위하여 DPPH 라디칼 소거능, ABTS 라디칼 소거능, Fe2+ 킬레이팅 활성, 환원 력을 조사하였고, 라디칼 및 킬레이팅 화합물의 농도를 50% 감소시키거나 0.5의 흡광도를 가지는데 필요한 시료의 농도인 IC50을 측정한 결과는 Fig. 1과 같다. DPPH 라디칼 소거능의 IC50 값은 국내산 삼채뿌리 6.53 mg/mL, 미얀마산 삼채뿌리 5.31 mg/mL로 미얀마산 삼채뿌리의 DPPH 라디칼 소거효과가 더 뛰어난 것으로 나타났다. ABTS 라디칼 소거능의 IC50 값은 국내산 삼채뿌리 14.75 mg/mL, 미얀마 산 삼채뿌리 16.93 mg/mL로 국내산 삼채뿌리의 소거활성 이 더 뛰어나 DPPH 라디칼 소거능의 결과와는 다른 경향을 나타내었다. 이는 두 측정방법에 이용되는 라디칼의 종류 가 각각 다르고, 기질과 항산화물질과의 결합정도의 차이 로 인해 라디칼의 소거능력에서도 차이가 생기는 것으로 판단된다. 세이지로부터 추출된 10종류의 폴리페놀 화합물 중 rosmarinic acid, 6-O-(E)- feruloyl-(α and β)-glucopyranoside, (-)-isolariciresinol 3α-O-β-D-glucopyranoside, luteolin-7-O- β-glucopyranoside 만이 DPPH 라디칼과 결합하여 높은 소거능을 보인 반면, ABTS 라디칼은 10종류의 폴리페놀 화합물과 모두 결합하였으나 그 소거능은 매우 약하게 나타 났다(19). 따라서 국내산 삼채뿌리에는 ABTS 라디칼과 결 합력이 강한 폴리페놀 화합물의 함량이 높을 것으로 추측되 며, 향후 이에 대한 추가 연구가 필요할 것으로 판단된다.
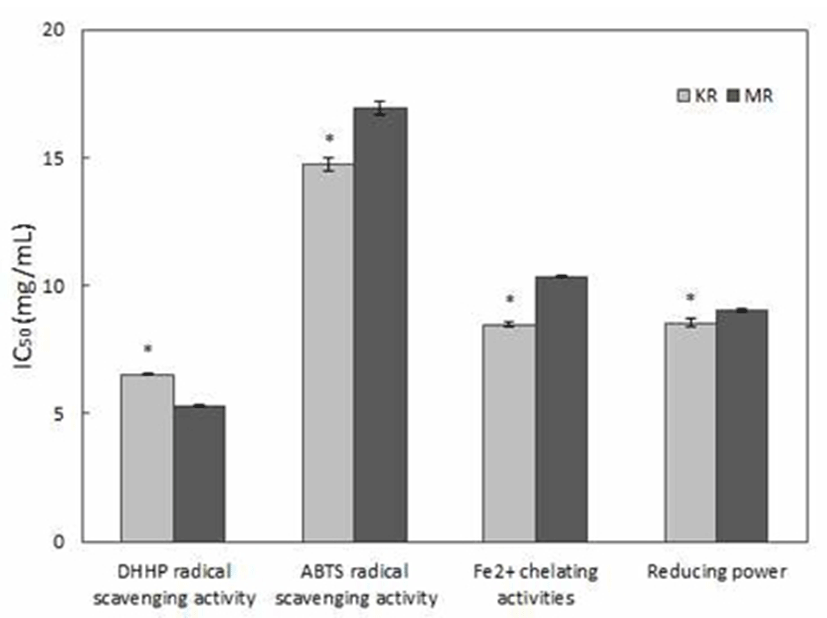
Fe2+ 킬레이팅 활성은 ferrozine을 이용하여 Fe2+이온과complex를 형성해 붉은색을 나타내지만, 킬레이팅 효과를 가지는 물질에 의해 붉은색이 탈색되는 정도를 측정하여 나타낸다. 삼채뿌리의 Fe2+ 킬레이팅 활성의 IC50값은 국내 산 삼채뿌리 8.47 mg/mL, 미얀마산 삼채뿌리 10.36 mg/mL 으로 국내산 삼채뿌리가 더 높은 소거능을 보였다. 환원력 은 활성산소와 유리기에 전자를 공여하는 능력으로, 환원 력이 높을수록 녹색에 가깝게 발색되며 높은 흡광도를 나타 낼수록 항산화 활성이 높다(20). 삼채뿌리의 환원력의 IC50 값을 측정한 결과, 국내산 삼채뿌리는 8.53 mg/mL, 미얀마 산 삼채뿌리는 9.03 mg/mL으로 국내산 삼채뿌리가 더 높은 환원력을 보였다.
일반적으로 폴리페놀과 항산화 활성과의 상관관계에 대한 연구결과를 살펴보면, 폴리페놀과 DPPH 라디칼과의 상관관계에 대해 Kwon 등(21)은 총 페놀함량이 높은 분획 물에서 가장 높은 DPPH 라디칼 소거능을 보였고, Kang 등(22)은 환원력이 클수록 DPPH 라디칼 소거능이 높다고 하여 페놀화합물이 DPPH 라디칼 소거능과 밀접한 상관관 계를 가진다고 보고하였다. 또한 ABTS 라디칼도 폴리페놀 및 플라보노이드의 함량이 많을수록 우수하다고 알려져 있다. 이는 페놀성 화합물이 반응 중 alkyl 라디칼 또는 alkylperoxy 라디칼에 수소를 공여해 라디칼을 제거하여 산화를 억제하기 때문이다(23). Pasko 등(24)과 Dlamini 등 (25)은 폴리페놀함량이 많을수록 높은 환원력을 보인다고 보고하였다. 따라서 이상의 결과에서 국내산 삼채뿌리가 ABTS 라디칼과 Fe2+ 킬레이팅 활성 및 환원력이 미얀마산 삼채뿌리에 비해 높게 나타난 것은 높은 폴리페놀 함량 (Table 1)에 기인한 것으로 판단된다. 반면 미얀마산 삼채뿌 리가 국내산 삼채에 비해 DPPH 라디칼의 소거능이 다소 우수한 것으로 나타나 미얀마산 삼채뿌리에는 DPPH 라디 칼과 결합력이 강한 폴리페놀 화합물의 함량이 높을 것으로 추측된다.
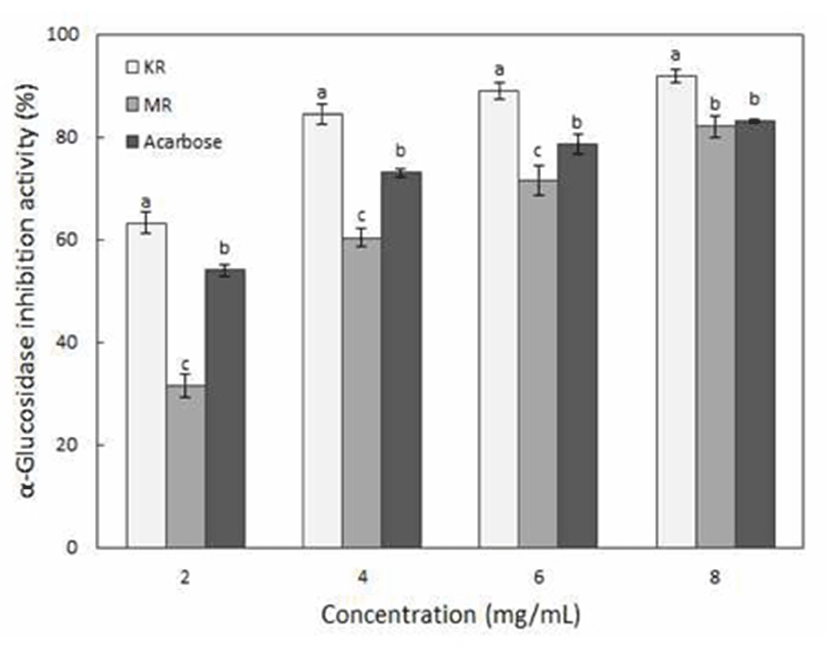
장내 α-glucosidase는 소장점막의 미세융모막에 존재하는 효소로서 다당류의 탄수화물을 단당류로 분해하는 탄수 화물의 소화에 필수적인 효소이다. 탄수화물은 amylase에 의해 올리고당으로 분해되고 α-glucosidase에 의해 포도당 으로 분해되는데, α-glucosidase inhibitor는 α-glucosidase에 결합함으로써 단당류인 포도당이 분해·흡수되는 것을 방해 하여 식후 혈당을 조절한다(26). 삼채뿌리의 항당뇨 활성을 분석한 결과(Fig. 2), 삼채뿌리 추출물에 대한 α-glucosidase 억제효과는 농도가 높아질수록 증가하는 경향을 보였고, 국내산 삼채뿌리의 억제효과가 유의적으로 높은 활성을 나타내었다. 2 mg/mL 농도에서 국내산 삼채뿌리는 63.13%, 미얀마산 삼채뿌리는 31.50%의 억제효과를 나타내었으며, 8 mg/mL 농도에서 국내산 삼채뿌리와 미얀마산 삼채뿌리 각각 93.75%, 86.89%로 높은 억제효과를 나타내었다. 또한 현재 α-glucosidase inhibitor로 시판되고 있는 acarbose의 저 해효과와 비교한 결과, 국내산 삼채뿌리는 모든 농도에서 acarbose에 비해 유의적으로 높은 억제활성을 나타내었다. 반면 미얀마산 삼채뿌리는 6 mg/mL이하의 농도에서 acarbose에 비해 낮은 저해활성을, 8 mg/mL 이상에서 acarbose와 유사한 저해활성을 나타내었다. Acarbose는 뛰 어난 혈당강하효과를 보이지만 장기간 복용할 경우 복부팽 만감, 설사 등 소화기계 부작용이 따르고, 염증성 장 질환이 나 간기능장애가 있을 경우 주의를 요하는 약물이다 (27,28). Jeong 등(29)은 약용식물 추출물의 α-glucosidase 저해활성, 총 폴리페놀, 총 플라보노이드 함량과의 상관관계를 분석한 결과, α-glucosidase 저해활성은 총 폴리페놀 함량(r=0.792, p<0.01) 및 총 플라보노이드 함량(r=0.588, p<0.01)과 양의 상관계수를 보인다고 보고하였다. 이는 본 연구에서 총 폴리페놀함량이 높은 국내산 삼채뿌리의 저해 활성이 더 높게 나타난 실험결과와 일치하였으며, 따라서 α-glucosidase를 저해하는 mechanism에 폴리페놀과 플라보 노이드가 관여하는 것으로 판단된다. 이상의 결과에서 천 연소재인 삼채뿌리 특히 국내산 삼채뿌리는 높은 α -glucosidase 저해활성으로 가지는 것으로 나타나 식후 혈당 조절제로서의 활용가능성이 뛰어날 것으로 판단된다.
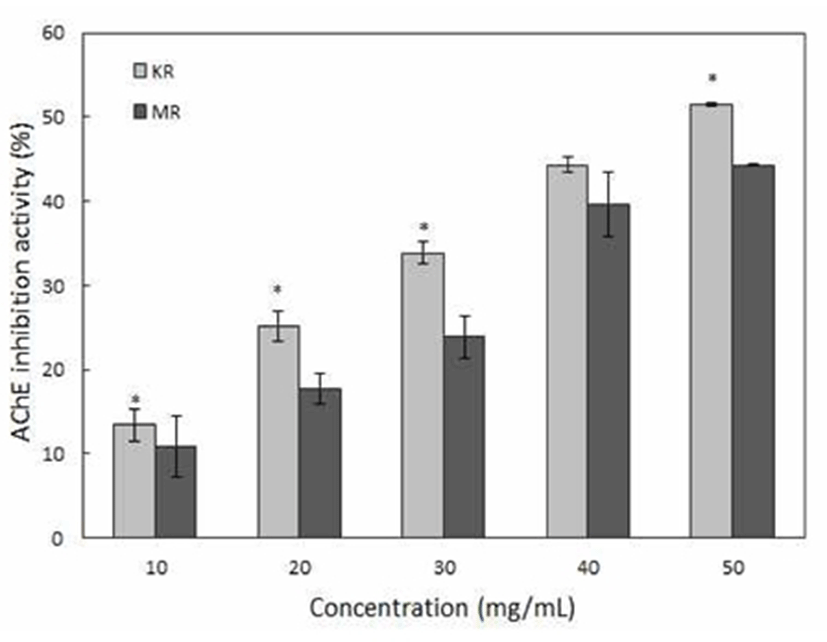
Acetylcholine은 신경조직에 존재하며 시냅스에서 신경자극을 전달하는 화학물질로 신경말단에서 분비된다. 체내 의신경전달이원활하게이루어지기위해서는acetylcholineesterase (AChE)의 활성이 중요하다. 알츠하이머환자의 경우 AChE 에 의해 acetylcholine의 양이 정상인에 비해 50% 감소되어 인지기능이저하된다고알려져있다(30). AChE는acetylcholine 을 acetate와 choline으로 가수분해 시키는 작용을 하며, 현 재는 이러한 AChE를 억제하여 acetylcholine의 양을 증가시 키는 방법을 바탕으로 인지기능을 호전시키고 치매치료에 사용하고 있다(31,32). 따라서 치매의 예방 및 치료개선 효 과를 확인하기 위해 삼채뿌리로 AChE 활성 억제정도를 측정한 결과(Fig. 3), 삼채뿌리의 농도가 증가할수록 높은 저해율을 나타냈으며, 추출물의 모든 농도에서 국내산 삼 채뿌리의 저해활성도가 미얀마산 삼채뿌리보다 더 높게 나타났다. 10 mg/mL 농도에서 국내산 삼채뿌리의 저해활 성도는 13.45%, 미얀마산 삼채뿌리 10.89%로 나타났으며, 50 mg/mL 농도에서는 국내산 삼채뿌리 51.44%, 미얀마산 삼채뿌리 44.33%의 저해활성효과를 보였다. 다수의 연구(33,34,35)에서 alkaloids 또는 flavonoid가 AChE 활성을 억제 하는 효과가 있다고 보고하고 있으며, Jeong 등(36)은 대표 적 파속식물인 마늘의 황 화합물이 AChE 활성을 저해한다 고 보고하였다. 따라서 국내산 삼채뿌리의 우수한 AChE 억제효과는 국내산 삼채뿌리의 높은 flavonoid 함량뿐만 아니라 황(S) 및 조사포닌의 높은 함량에 기인한 것으로 판단된다(4).
요 약
본 연구는 선행 연구된 삼채뿌리의 뛰어난 영양성을 토대로 기능성 식품소재로의 이용가능성을 확인하고 활용도 를 높이고자 국내산 및 미얀마산 삼채뿌리의 항산화 및 생리활성을 측정하였다. 삼채뿌리의 총 폴리페놀과 총 플 라보노이드 함량은 국내산 삼채뿌리가 각각 5.27 mgGAE/g, 0.35 mgQE/g, 미얀마산 삼채뿌리가 각각 4.80 mgGAE/g, 0.24 mgQE/g으로 국내산 삼채뿌리가 더 높은 함량을 나타 냈다. 삼채뿌리의 항산화력을 측정한 결과 DPPH 라디칼 소거능은 미얀마산이 더 높은 활성을 보였지만, ABTS 라디 칼 소거능과 Fe2+ 킬레이팅 활성, 환원력은 국내산이 더 높은 활성을 보였다. α-Glucosidase 저해활성은 국내산의 저해활성이 미얀마산 삼채뿌리의 저해활성보다 더 높았으 며 대조구인 acarbose에 비해서도 우수한 저해활성을 보였 다. Acetylcholinesterase 저해 활성을 측정한 결과, 50 mg/mL 농도에서 국내산 삼채뿌리가 51.44%로 44.33%의 저해활성을 보인 미얀마산 삼채뿌리보다 더 높은 저해활성 을 보였다. 본 연구를 통해 삼채뿌리 특히 국내산 삼채뿌리 는 높은 항산화 활성, α-glucosidase 및 acetylcholinesterase 저해 활성을 보여 혈당조절제, 치매예방 및 개선제로써의 활용가능성이 큰 것으로 확인되었으며, 이로써 기능성 식 품소재로의 활용이 증가될 것으로 판단된다. 하지만 향후 국내산 삼채의 우수성을 검증하기 위하여 여러 지역에서 재배된 삼채의 기능성 분석이 필요할 것으로 판단된다.










