서 론
국민경제가 향상되고 소득수준이 높아짐에 따라 우리나라의 식문화가 서구의 식생활 패턴이 변화되면서 뇌 혈관질환, 고지혈증, 고혈압 및 당뇨병 등의 순환계 질환과 암으로 인한 사망이 증가되고 있다. 이렇게 증가하는 성인병과 노화 등을 예방 또는 치료식품 자원으로 식물체 추출성분에 대한 관심이 고조되고 대한 기능성식품산업과 의약산업에서 실용화를 위한 많은 관심을 가지고 있다(1). 특히 천연 약용식물은 일부 성분들이 체내에서 유해 활성산소를 감소시키는 생리활성을 가지고 있는 것으로 보고되고 있어, 이로부터 인체에 안전하고 질병을 예방할 수 있는 생리활성을 가진 물질을 탐색하려는 연구가 활발히 이루어지고 있다(2).
침엽수의 대표적인 수종의 하나인 소나무는 중국, 일본, 우리나라 전역에서 자생하며, 해송은 중국, 일본, 우리나라 서해안과 동해안에 걸쳐 분포하고, 리기다소나무는 북아메리카 및 대서양 연안 등지에서 자라며 우리나라에도 널리 퍼져 있는 수종 중의 하나이다(3). 소나무 잎은 약으로도 많이 쓰이는데, 솔잎에는 약리성 물질인 옥시팔티민이라는 성분이 존재하고, 비타민과 클로로필이 풍부하며, 플라보노이드, 안토시안, 카로틴, 수지 등이 함유되어 있다. 솔잎은 중풍을 예방하고 간질환, 위장질환, 신경계 질환 등에 치료 효과와 동맥경화증, 고혈압, 당뇨병과 같은 노화 관련 질환을 예방하는 효능이 있는 것으로 알려져 있다(4-10). 또한 건조한 솔잎 분말이 항노화 작용을 하는 것으로 보고되었고(11,12), 솔잎 분말이 항암작용 상승효과(13), 돌연변이 억제효과(14)를 지니고 있음이 보고된 바 있다. 그 외에 솔잎차는 각종 성인병 예방에 이용하기도 한다(15). 동송근은 한방서적인 신약본초에 의하면 황토에서 생장하는 소나무의 동쪽으로 뻗은 뿌리를 지칭하며, 동의보감 본초에서는 곡식대신 소나무 뿌리만 먹어도 살수 있다고 기록하고 있다. 또한 인산의학 저널(16)에서는 동송근은 관절염, 통풍, 중풍 등을 다스리는 한약재라고 소개하고 있다. 현재 솔잎에 대해 연구한 문헌은 많지만 기존에 한약재로 판매되어 활용되고 있는 소나무 뿌리(동송근)에 대한 생리활성 연구는 거의 없는 실정이다.
따라서 본 연구에서는 소나무 뿌리로부터 phenolic compounds를 추출하여 항산화효과, 통풍억제 및 당분해 억제효과 등 생리활성을 검정하고, 기능성 식품소재로 활용가능성을 알아보고자 하였다.
재료 및 방법
생리활성 측정을 위한 시료 추출은 동송근 분말 1 g을 증류수 200 mL에 침지하여 추출물이 100 mL가 될 때까지 가열한 후 냉각하여 24시간 동안 교반 추출하였으며, ethanol 추출은 추출율이 가장 높았던 80% ethanol을 사용하여, 동송근 분말 1 g에 80% ethanol 100 mL를 첨가하여 24시간 동안 shaking incubator에서 교반 추출하였다. 각 추출물은 Whatman No. 1 filter paper로 여과한 후 필요에 따라 rotary vacuum evaporator(Eyela NE, Tokyo, Japan)에서 농축하여 시료로 사용하였다.
추출물 1 mL에 95 % ethanol 1 mL와 증류수 5 mL를 첨가하고 1 N Folin-ciocalteu reagent 0.5 mL를 잘 섞어 5분간 방치한 후 Na2CO3 1 mL를 가하여 흡광도 725 nm에서 1시간 이내에 측정하여 gallic acid를 이용한 표준곡선으로부터 양을 환산하였다(17).
DPPH radical에 대한 소거효과는 Blois의 방법(18)에 준하여 측정하였다. 각 시료 1 mL에 60 μM DPPH(1,1-diphenyl- 2-picrylhydrazyl) 3 mL를 넣고 vortex한 후 실온에서 15분간 반응시켜 517 nm에서 흡광도를 측정하였다. 전자공여능(%)은 1-(반응구의 흡광도/대조구의 흡광도)×100으로 나타내었다.
ABTS(2,2-azino-bis-3-ethylbenzothiazoline-6-sulfonic acid) radical 소거효과 측정은 Pellegrin등의 방법(19)에 의해 측정하였다. 7 mM ABTS 5 mL와 140 mM K2S2O8 88 μL를 혼합하여 암실에서 14~16시간 반응시켜 radical을 생성시킨 후, 이를 absolute ethanol과 약 1:88 비율로 섞어 734 nm에서 대조구의 흡광도 값이 0.7±0.002가 되도록 조절한 ABTS solution을 사용하였다. 시료 50 μL와 ABTS solution 1 mL를 혼합하여 30초간 vortex한 후 2.5분간 반응시키고 734 nm에서 흡광도를 측정하였다. ABTS radical 소거효과(%)는 1-(반응구의 흡광도/대조구의 흡광도)×100으로 나타내었다.
PF는 Andarwulan과 Shetty의 방법(20)으로 측정하였다. β-carotene 10 mg을 chloroform 50 mL에 녹인 용액 1 mL를 evaporator용 수기에 넣고 40℃ water bath에서 chloroform을 증류시킨 후 linoleic acid 20 μL, tween 40 184 μL, H2O2 50 mL를 첨가하여 emulsion을 제조하였다. 시료 100 μL에 emulsion 5 mL를 혼합해 50℃에서 30분간 반응시켜 냉각시킨 후, 470 nm에서 흡광도를 측정하여 다음의 식에 의해 PF값을 계산하였다. PF는 반응구의 흡광도/대조구의 비로 나타내었다.
TBARs는 Burge와 Aust의 방법(21)에 의해 측정하였다. 1% linoleic acid와 1% tween 40으로 emulsion을 제조하고, 시료 0.2 mL와 emulsion 0.8 mL를 혼합한 후 50℃ water bath에서 10시간 이상 반응시켰다. 반응 후 반응액 1 mL에 TBA reagent 4 mL를 가하고 15분간 중탕한 다음 10분간 냉각시켜 15분간 1,000 rpm으로 원심분리 하였다. 원심분리 한 액을 실온에서 10분간 방치 한 후 상층액을 취해 532 nm에서 흡광도를 측정하였으며, TBARs 값은 흡광도 수치×0.0154로 1 mL 반응혼합물에 대해서 생성된 1,1,3,3- tetraethoxypropane (TEP)의 μM로 계산한 후 다음의 식으로 TBARs에 대한 저해율을 계산하였다. 저해율(%)은 1-(반응구의 TBARs μM/대조구의 TBARs μM)×100으로 나타내었다.
Xanthine oxidase(XOase) 저해효과 측정은 Stirpe와 Della Corte의 방법(22)에 준하여 측정하였다. 즉, 반응구는 0.1 M potassium phosphate buffer(pH 7.5)에 녹인 기질액 2 mM xanthine 3 mL에 효소액(0.05 U/0.1 mL) 0.1 mL과 시료 0.3 mL를 넣고 대조구에는 시료 대신 증류수를 0.3 mL 첨가하여 37℃에서 5분간 반응시키고 종료시약 20% TCA 1 mL를 가한 후 반응액을 원심분리하여 단백질을 제거하고 생성된 uric acid를 흡광도 292 nm에서 측정하여, 저해율(%)은 1-(반응구의 uric acid μg/대조구의 uric acid μg)×100으로 나타내었다.
α-Glucosidase 저해효과 측정은 Tibbot과 Skadsen의 방법(23)에 준하여 측정하였다. 50 mM sodium succinate buffer (pH 4.2)에 ρ-nitrophenol-α-D-glucopyranoside(PNPG)를 용해시켜 1 mg/mL 농도로 기질을 만들고, 기질 1 mL와 효소액 0.1 mL를 혼합하여 반응구에는 시료 0.1 mL, 대조구에는 증류수 0.1 mL를 넣어 37℃에서 30분간 반응시킨 후 발색시약 1 N NaOH 0.1 mL를 첨가하였다. 이때 생성된 ρ-nitrophenol을 표준곡선에 대입하여 양을 환산하고, 저해율(%)은 1-(반응구의 ρ-nitrophenol μg/대조구의 ρ-nitrophenol μg)×100으로 나타내었다.
결과 및 고찰
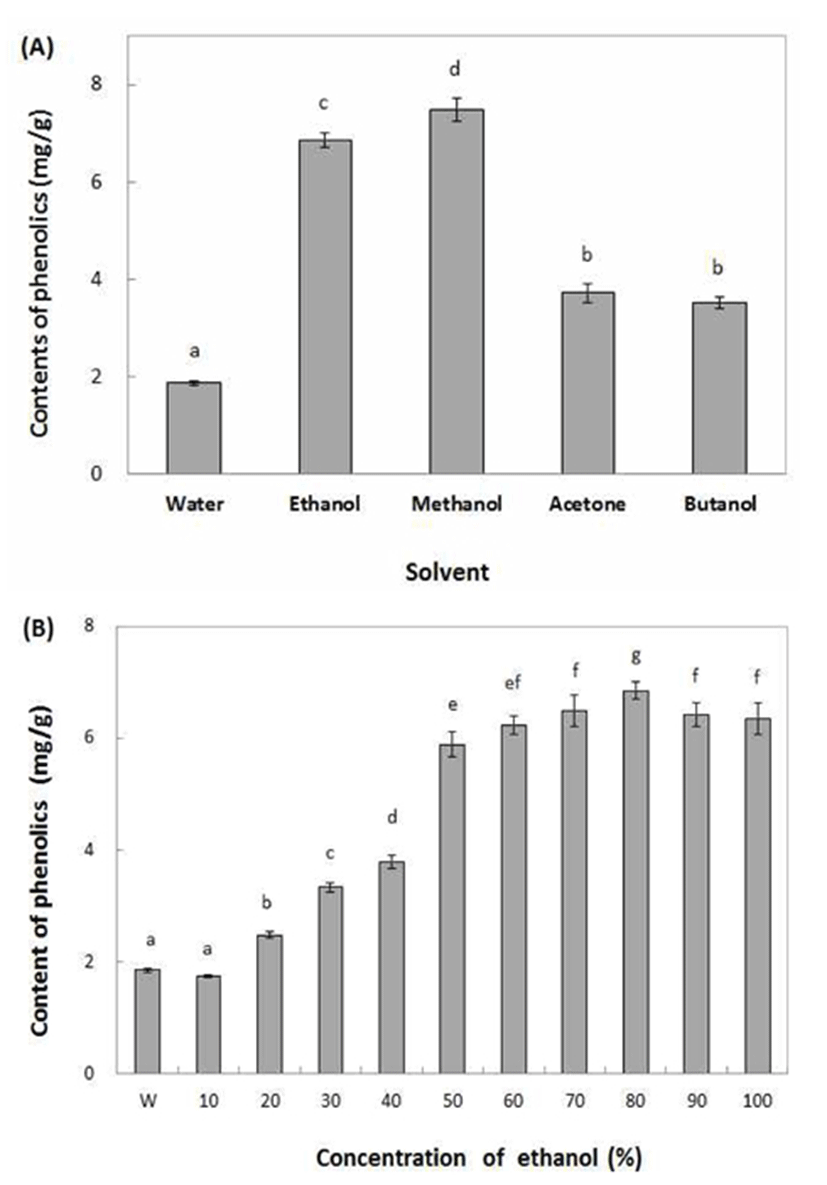
식물체에 존재하는 phenolic 화합물은 식물의 방어기작으로 생산되는 2차 대사산물의 한 종류이며, 분자구조 내에 존재하는 phenolic hydroxyl기에 의해 단백질 등 거대 분자들과 결합하는 특성을 나타내어 다양한 생리 기능을 가진다고 보고되어 있다(24). 따라서 동송근으로부터 생리활성에 관여하는 phenolic 화합물을 추출하기 위하여 추출용매를 달리하여 phenolic 화합물의 용출량을 알아보았다. 그 결과 Fig. 1-A에서와 같이 알코올류를 추출 하였을 때 다른 추출 용매에 비해 상대적으로 phenolic 화합물의 용출양이 높은 것을 알 수 있었으며, ethanol과 methanol을 용매로 하였을 때 각각 7.48, 6.85 mg/g의 함량을 나타내었으며, 용매에 따른 함량 차이는 비교적 높게 나타났다. 유기용매로 추출하는 것이 물을 용매로 하여 추출하였을 때 보다 높은 추출율을 나타내어 동송근의 phenolic 화합물이 극성용매에서 용해도가 높은 것으로 확인되어 유기용매에서 phenolic 화합물의 추출수율이 높다는 신의 결과(25)와 유사하였다. 동송근 추출물의 추출 조건을 확립하기 위하여 다양한 농도의 ethanol을 추출용매로 하여 동송근의 phenolic 화합물의 용출량을 측정한 결과 Fig. 1-B에서와 같이 동송근 물 추출물의 phenolic 화합물 함량보다 ethanol 추출물의 함량이 매우 높았으며, 에탄올 농도별로는 80% ethanol 추출물에서 6.85 mg/g으로 가장 높은 함량을 나타내었다. 위의 결과에 따라 생리기능성 탐색을 위하여 동송근 추출물을 기능성식품에 적용하고자 추출 용매를 물과 인체에 유해하지 않으며 phenolic 화합물의 용해도가 높은 ethanol을 이용하여 물 추출물과 80% ethanol을 이용하여 추출 한 후 시료로 사용하기로 하였다.
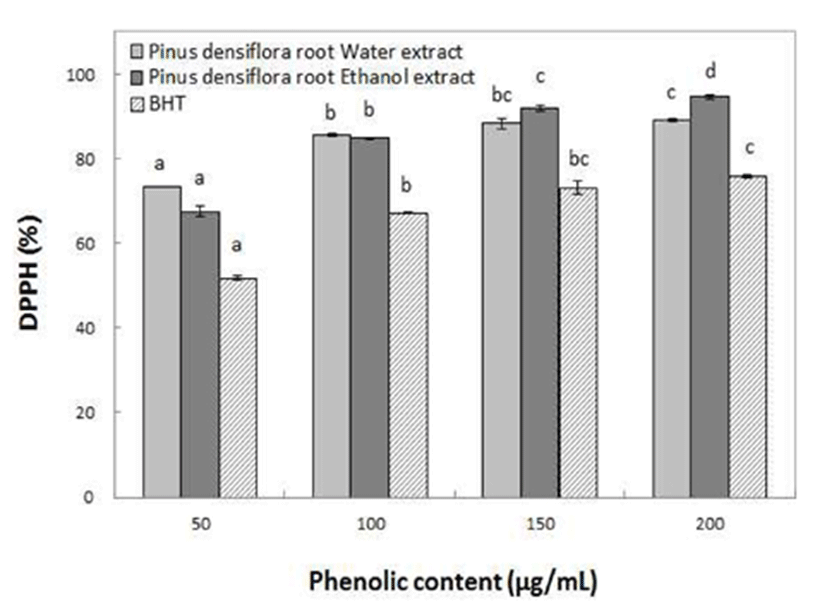
전자공여능 측정에 사용된 1-1-diphenyl-2-picrylhydrazyl (DPPH)는 phenolic 화합물과 같은 전자공여체와 반응하게 되면 phenoxy radical을 생성하게 되며, 안정한 분자가 된다. 또한 공여된 전자는 비가역적으로 결합하여 결합된 수에 비례하여 DPPH의 진보라색깔이 점점 옅어지게 된다(26). 동송근 추출물을 이용하여 전자공여능을 측정한 결과 Fig. 2에서와 같이 50~200 μg/mL의 phenolic 화합물 농도 범위에서 물추출물의 경우 73.44~89.19%의 전자공여능을, ethanol 추출물에서 67.58~94.40%의 전자공여능을 나타내었다. 또한 첨가되는 phenolics의 함량이 증가할수록 전자공여능도 높아져 농도의존적 양상을 나타내는 것으로 확인되었다. Cho 등(2)은 진달래 꽃 추출물의 항산화 측정 결과, 열수 추출물과 ethanol 추출물에서 각각 83.2, 89.7%의 전자공여능을 나타낸다고 보고한 것과 비교하면 동송근 추출물의 전자공여능이 약간 더 우수함을 알 수 있었다. 또한 Ju 등(27)은 한약재 중 감국, 결명자, 당귀, 배초향, 산사육, 엉겅퀴, 오가피 등의 열수추출물 250 μg/mL 농도에서 50% 이하의 낮은 DPPH radical 소거효과를 나타내었다고 보고한 것과 비교하면, 본 연구에 사용된 동송근의 경우 50 μg/mL 낮은 농도에서도 매우 우수한 DPPH radical 소거효과를 나타내는 것으로 확인되었다.
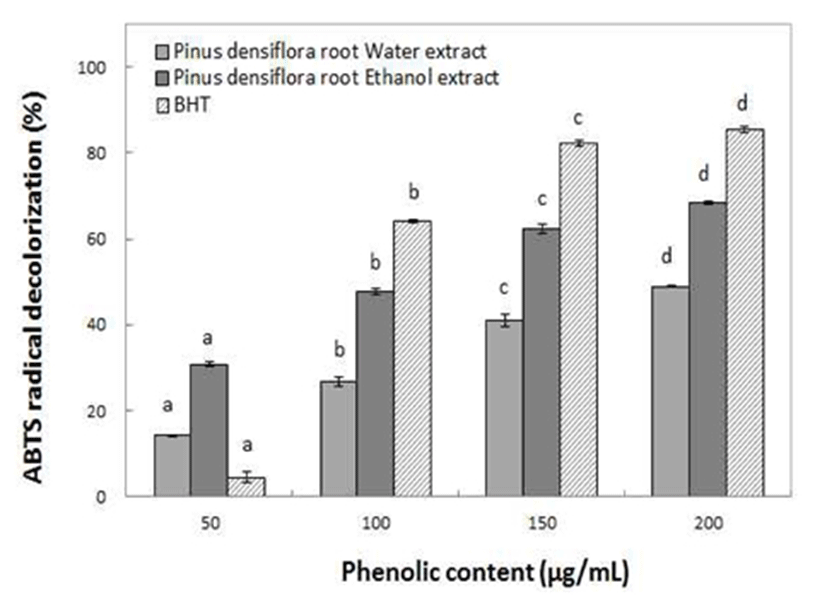
추출물들의 상대적인 항산화 측정은 hydrogen-donating antioxidant와 chain breacking antioxidant 모두를 측정할 수 있으며, ABTS radical 소거효과는 친수성 및 lipophilic 물질의 항산화 활성을 확인할 수 있다(19). 항산화 물질이 potassium persulfate와의 반응에 의해 생성된 ABTS+ free radical을 제거하여 radical의 청록색을 탈색시키는 원리를 이용하여 항산화 효과를 측정한 결과 Fig. 3에서와 같이 동송근은 물 추출물보다 ethanol 추출물에서 상대적으로 더 높은 활성을 나타내어 친수성 및 lipophilic 물질에 대한 항산화력이 우수한 것을 알 수 있었다. 또한 항산화력은 30.70~68.40%로 첨가되는 phenolics에 농도의존적으로 증가하는 양상을 나타내었다. 이는 와송 추출물의 ABTS radical 저해율이 1,000 μg/mL의 첨가 농도에서 70% 정도라는 보고(28)보다 우수한 결과였다. 따라서 동송근 추출물의 친수성 및 lipophilic 물질에 대한 항산화 효과는 비교적 우수한 것으로 판단할 수 있었다.
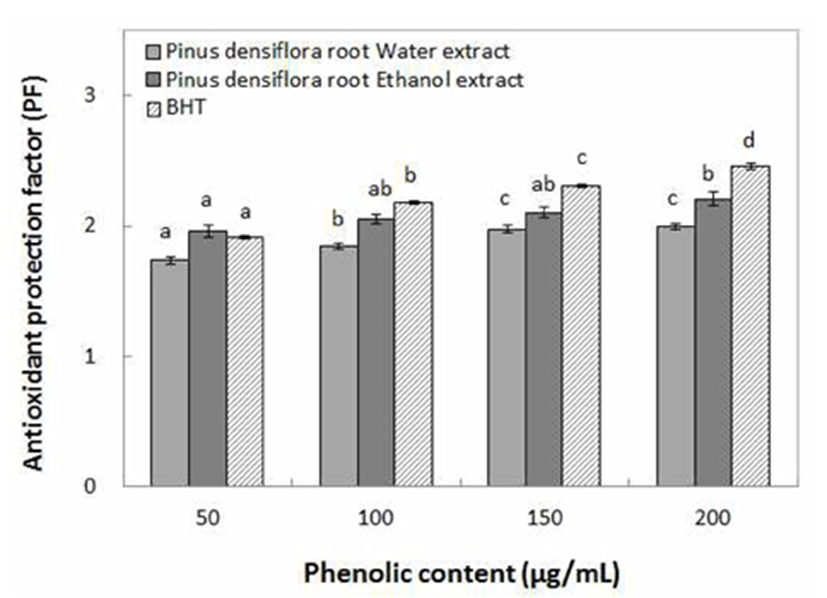
지질 산화과정의 중간산물인 free peroxyl radical은 β-carotene에 존재하는 이중결합 부위를 공격하여 불활성 화합물을 형성하게 되고, 이들 불활성 화합물들은 free radical에 의해 일어나는 연쇄반응을 중단시켜 산화가 발생하게 된다(29). 산화가 진행되면서 지용성물질인 β-carotene의 오렌지색의 색소가 decolorization되고 동송근 추출물의 antioxidant protection factor의 차이를 측정한 결과 Fig. 4에서와 같이 물 추출물의 경우 1.74~2.00 PF를, ethanol 추출물에서는 1.96~2.19 PF의 항산화능을 나타내었다. Andarwulan과 Shetty(20)는 지용성물질에 대한 산화정도를 PF 측정으로 나타내었고 항산화력을 나타내는 기준이 1.2 PF 이상이라고 기술하였으며, Cha 등(30)은 오디 추출물의 antioxidant protection factor가 ethanol 추출물에서 1.25 PF라고 보고하였고, 최 등(31)이 자색고구마 에탄올 추출물의 PF가 1.2라는 연구 결과 비교하였을 때, 본 연구에 사용된 동송근 추출물이 지용성물질에 대한 항산화력도 매우 우수하다고 판단되었다.
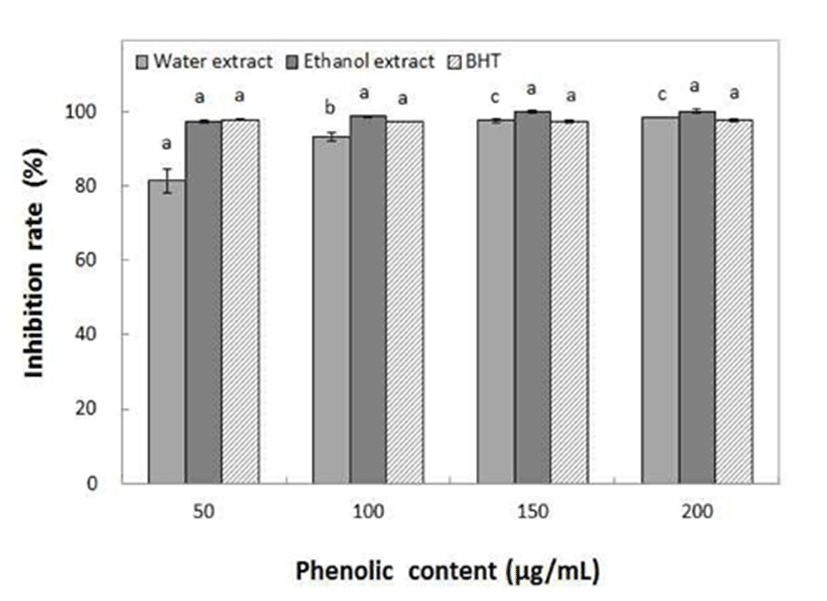
Ethanol 농도별 동송근 추출물의 thiobarbituric acid reactive substance를 측정한 결과 Fig. 5에서와 같이 물 추출물보다 ethanol 추출물에서 상대적으로 더 높은 활성을 나타내었으며, ethanol 추출물에서는 50 μg/mL의 저 농도에서도 97.40%의 높은 저해력을 나타내어 지용성 물질에 대한 항산화력도 매우 높다는 것을 확인할 수 있었다. TBARs 활성은 물 추출물보다 ethanol 추출물에서 효과가 더 우수하였으며, 첨가되는 phenolics 함량의 농도가 증가함에 따라 항산화 활성이 높아지는 농도의존형 상관관계를 나타내었다.
Chae 등(32)이 채진목 열매 추출물의 TBARs억제 효과가 phenolic 200 μg/mL의 농도에서 73.3%였다고 보고한 것과 김 등(33)이 유근피 추출물의 phenolic 50 μg/mL의 첨가 농도에서 84.2%의 높은 항산화 효과를 나타내었다고 보고한 것과 비교하면, 동송근 추출물의 항산화력이 더 우수하였다.
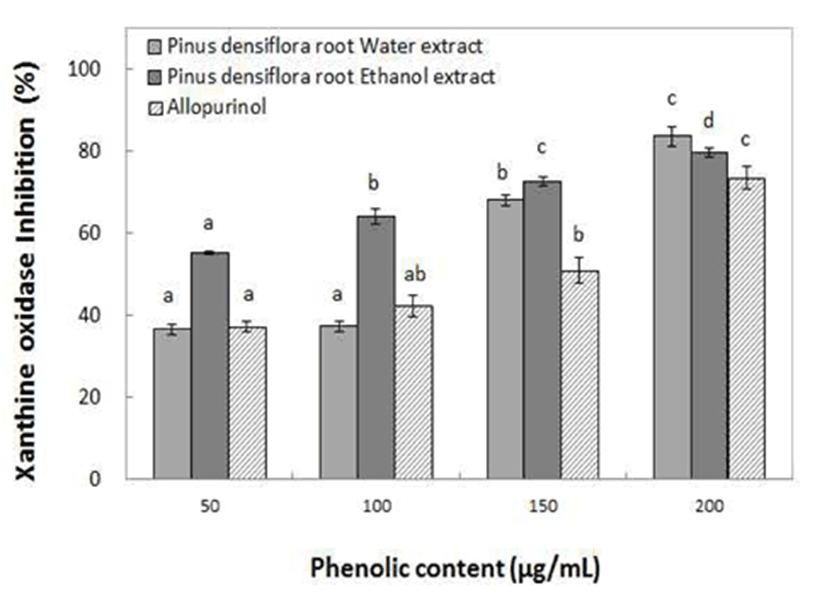
Xanthine oxidase(XOase)는 purine 대사에 관여하는 효소로서 xanthine 또는 hypoxanthine으로부터 요산을 생성하고, 생성된 요산은 관절에 축적되어 심한 통증과 부종을 일으키는 관절염인 통풍을 유발하는 효소로 알려져 왔다(34). 동송근 추출물의 xanthin oxidase 저해 활성을 측정한 결과 Fig. 6에서와 같이 ethanol 추출물이 물 추출물에 비해 저해율이 비교적 높게 나타났으며 물 추출물에서 36.66~83.65%의 저해율을 나타내었고, ethanol 추출물에서 55.05~79.64%의 XOase 저해율을 나타내어, 통풍 억제약제인 allopurinol보다 더 우수한 XOase 저해효과를 나타내었다. Kim 등(35)은 유근피 추출물의 phenolic 화합물이 200 μg/mL의 phenolics 농도에서 48.1%의 XOase 억제력을 나타내었다고 보고한 것에 비해 동송근의 통풍억제력이 더 우수하여 통풍 치료제로서 활용이 가능할 것으로 판단되었다.
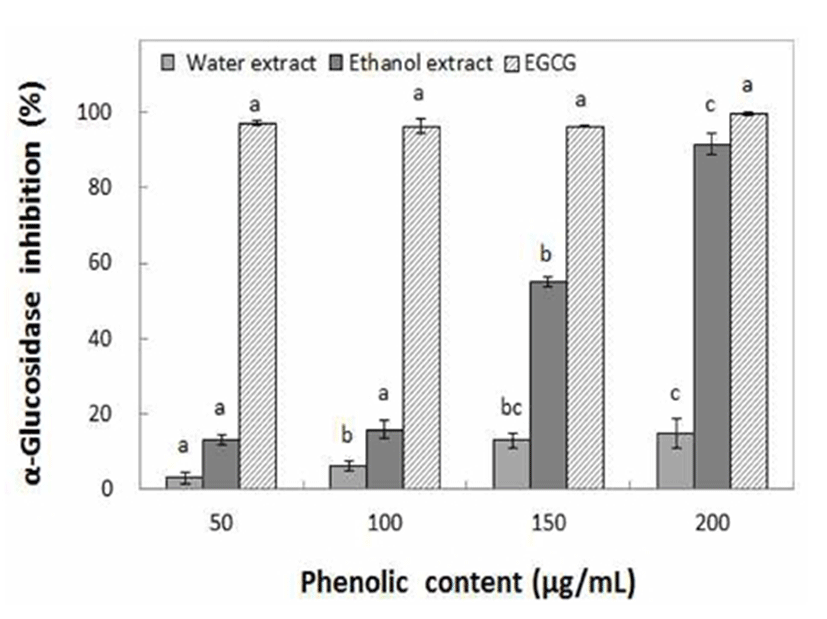
동송근 추출물의 효모기원 α-glucosidase 활성저해 효과를 측정한 결과, Fig. 7에서와 같이 물 추출물에서는 2.99~14.77%의 매우 낮은 효소억제 효과를 나타내었으며, ethanol 추출물에서는 13.17~91.62%로 첨가되는 phenolic 화합물의 농도에 따라 억제효과는 큰 격차를 나타내었다. α-Glucosidase의 억제효과를 나타내기 위해서는 ethanol 추출물 150 μg/mL 이상의 농도로 처리하여야 억제효과를 기대할 수 있을 것으로 나타났다. Kim 등(36)은 산사추출물의 α-glucosidase 저해활성이 60% ethanol 추출물보다 물 추출물에서 높은 저해활성을 나타낸다고 보고한것과 같은 양상을 나타내었으며, Lee 등(37)은 phenol성 물질인 proanthocyanidin이 α-amylase 및 α-glucosidase의 활성을 저해한다고 보고하였다. 이와 같이 동송근 추출물의 phenolic 화합물도 이러한 탄수화물 분해 효소의 활성을 억제하는 것으로 확인되었다.
따라서 위의 연구결과를 종합하면 동송근 추출물은 항산화 효과나 통풍 치료 및 항당뇨 효과를 활용하는 제품에 적용할 수 있을 것이라 판단하였다.
요 약
소나무 뿌리로부터 phenolic compounds를 추출 후 생리활성을 검정하여 기능성 소재로 활용가능성을 살펴보았다. 동송근에 함유된 페놀성 물질은 물과 80% ethanol을 용매로 하여 24시간 이상 추출하였을 때 각각 1.86 mg/g, 6.85mg/g 함량을 나타내었다. 추출물의 phenolic 농도를 50~200 μg/mL로 조절하여 DPPH를 측정한 결과, 물 추출물과 ethanol 추출물 100 μg/mL phenolics 농도에서 각각 86%, 85%였고, ABTS radical decolorization은 물 추출물과 ethanol 추출물에서 각각 48%, 68%였다. Antioxidant protection factor는 50 μg/mL phenolics 농도에서 물 추출물과 ethanol 추출물에서 각각 1.74 PF와 1.96 PF로 측정되었으며, TBARs값은 100 μg/mL phenolics농도에서 물 추출물이 93%, ethanol 추출물에서 98%를 나타내었다. Xanthine oxidase 저해능은 물 추출물과 ethanol 추출물에서 각각 84%, 80%로 측정되었으며, α-glucosidase 저해능은 ethanol 추출물에서만 92%의 높은 효능을 보였다. 이러한 결과로 보아 동송근 추출물이 항산화활성 또는 기능성 식품소재로서 활용이 가능할 것으로 판단되었다.










