ARTICLE
커피 볶음 정도에 따른 생화학적 성분 및 생리활성의 변화
남상해, 강수지*
Changes of biochemical components and physiological activities of coffee beans according to different roasting conditions
Sanghae Nam, Suji Kang*
Author Information & Copyright ▼
Division of Food Science, Gyeongnam National University of Science and Technology, Jinju 660-758, Korea
© The Korean Society of Food Preservation. . This is an Open-Access article distributed under the terms of the Creative Commons Attribution Non-Commercial License (http://creativecommons.org/licenses/by-nc/3.0/) which permits unrestricted non-commercial use, distribution, and reproduction in any medium, provided the original work is properly cited.
Received: Jan 6, 2015; Revised: Mar 9, 2015; Accepted: Mar 11, 2015
Abstract
Four different kinds of coffee beans (CS, Colombia supremo; EY, Ethiopia yirgacheffee; IM, Indonesia mandheling; and IMM, India monsooned malabar) were roasted at 200 and 250°C for 10, 15, and 20 min. To determine the optimum roasting conditions, various components of the coffee beans such as pyrazines produced during the roasting, and their antioxidant and antidiabetic effects were analyzed. The different roasting condition did not affect on the concentration of caffeine. However, the amount of 5-caffeoylquinic acid and the total phenolics decreased significantly, at a greater temperature and a longer roasting time. The greatest amount of pyrazines was produced from the IMM however, the amount of pyrazines decreased rapidly at 250°C according to increasing in roasting time. The DPPH free radical scavenging activity was mostly 80% more effective than that of BHT and α-tocopherol activities at the same concentration. In the case of the FRAP assay, the reducing power of the coffee slightly decreased at a greater temperature pand longer time. While the inhibitory effect on α-glucosidase was negligible, the activity decreased by more than 80% when the coffee beans were roasted at 250°C for 20 min. The inhibitory effect on α-amylase showed similar results. Taken together, the optimum roasting conditions were determined to be 200°C and 15 min, which provided the best physiological activity and nutty and chocolatey aromas from the pyrazine of coffee.
Keywords: coffee beans; roasting; antioxidant activity; antidiabetic activity; pyrazine
서 론
커피는 쓴 맛과 신 맛, 떫은 맛, 구수한 맛 등이 조화된 기호식품으로 원두를 물로 추출하여 음용하는 음료이다 (1). 커피의 맛과 향은 로스팅 과정을 거쳐서 형성되며, 로스 팅 시간과 온도에 따라서 커피 고유의 향과 풍미가 다양하 게 생성된다(2). 로스팅 된 커피에서의 가용 성분에는 caramel화 된 당 10~17%, chlorogenic acid 약 4.5%, organic acid 약 2%, 환원당 1~2%, 단백질 1~2%, 회분 약 3%, caffeine 1~2%, trigonelline 약 1% 그리고 휘발성 물질 약 0.35%가 있다. 커피는 식물 중 가장 풍부한 휘발성 향기성 분을 함유하고 있으며, 현재까지 확인된 향기성분만 800가 지 정도 보고된 바 있다. 로스팅 과정을 거치면서 Maillard reaction, caramel화 등 여러 반응으로 향기성분이 발생되는 데 furfural 유도체, maltol, pyrazine 유도체 등이 비효소적 갈색화반응의 생성물이다. 이러한 성분들은 원두의 배합부 터 로스팅 시간과 온도에 따라서 다른 양상으로 향기성분들 이 생성된다(3,4).
커피원두의 항산화효과에 관한 연구로는 배전시간에 따 른 커피추출물의 항산화효과(5), 추출시간에 따른 더치커 피 추출액의 페놀성분과 항산화효과(6), 커피생두 분말을 첨가한 식빵의 항산화성(7) 등이 연구되어 있다. 그 외에도 항균효과(5), 저장조건에 따른 품질연구(8), 향기성분 변화 (9,10), 가공법에 따른 관능 특성(11), 주요 화학성분 연구 (12) 등이 보고되어 있다. 가공된 식품 안에서 발견되는 다수의 pyrazine류는 천연에서 존재하는 경우는 아주 드물 며 인위적으로 가공하는 동안 환원당과 아미노산과의 열분 해에 의해서 2차적으로 생성된 것으로 커피의 주요 향미 성분이다(13). Roasted barley, roasted coffee, roasted peanut, bread, potato chip과 같은 볶거나 굽는 과정 중에 생성되는 pyrazine 화합물은 여러 가지 식품의 향기에 주요성분들로 밝혀져 있으며, nut-like flavor, toasted flavor, earthy flavor와 같은 특유한 향기를 가지고 있다(14,15).
이와 같이 커피에 관한 여러 가지 연구 결과가 있으나 본 연구에서는 커피의 로스팅 정도에 따른 생리활성과 향기 성분 중 고소한 향, 구운 향을 내는 pyrazine 화합물의 생성 을 비교 및 분석하여 가장 적합한 로스팅 조건을 연구하고 자 한다.
재료 및 방법
실험재료 및 로스팅
본 연구에서 사용한 커피는 국내 수입상에서 4종의 커피 원두(CS, Colombia supremo; EY, Ethiopia yirgacheffee G2; IM, Indonesia mandheling G1; IMM, India monsooned malabar AA)를 구입하였다. 커피 원두는 열풍로스터 (Genecafe CBR-101A, Genesis Co., Korea)를 사용하여 20 0°C와 250°C에서 각각 10, 15, 20분 로스팅하였다.
카페인 및 5-caffeoylquinic acid
커피 생두 또는 로스팅한 커피는 분쇄하였으며 각각의 커피분말 200 mg에 90°C의 증류수를 2 mL을 가하여 60°C water bath에서 2시간 환류시킨 후 추출하였다. 상등액을 0.45 μm membrane filter로 여과하여 Bradbury와 Weers의 방법(16)에 따라 HPLC로서 동시분석하였다. Analytical column은 Waters μBondapak™ C18(3.9×300 mm, 125Å, Waters, Milford, MA, USA)를 사용하였고 column 온도는 40°C로 하였다. Elution solvent는 10 mM HCl : Methanol=90 : 10으로 분석하였다. 유속은 0.5 mL/min, 시료 주입량은 10 μL, UV 검출기의 파장은 275 nm(caffeine)와 325 nm(5-caffeoylquinic acid)이었다. 표준용액은 100, 50, 25, 12.5, 6.25, 3.125, 1.5625 ppm으로 만들어 검량곡선을 작성 한 다음 시료에 대하여 각각의 함량을 계산하였다.
총 페놀 함량
커피 추출물 총 페놀 함량은 Folin-Denis법(17)에 따라 실험하였다. 커피 분말 200 mg에 methanol 2 mL을 가한 후 60°C water bath에서 6시간 방치하고 원심분리(5,000 rpm, 10 min) 후 0.45 μm membrane filter로 여과하여 시료로 사용하였다. 시료 0.5 mL에 25% Na2CO3 용액 0.5 mL을 첨가하여 3분간 정치시킨 후 2 N Folin-Ciocalteu’s phenol 시약 0.25 mL를 첨가하여 혼합한 후 30°C incubator에서 1시간 동안 발색시킨 후 원심분리(5,000 rpm, 10 min) 한 뒤 microplate reader (EL800, BioTek, Winooski, PA, USA)를 이용하여 750 nm에서 흡광도를 측정하였다. Total phenolics 함량은 gallic acid를 이용하여 작성한 표준곡선에 의해 산출 된 계산식을 사용하여 mg/g으로 표시하였다.
Pyrazine 함량
Pyrazine류 분석은 Caprioli 등의 방법(18)을 변형하여 사 용하였다. 생두와 로스팅 온도와 시간이 다른 각각의 커피 원두 분말 15 g을 에스프레소 머신(Grand Doge, BFC Co., Italy)으로 추출하여 5 mL씩 headspace용 vial에 담고 마개로 완전 밀봉하였다. 커피 추출물이 담긴 vial을 headspace SPME(solid phase micro extraction)법으로 60°C heating block에서 가열하여 커피 추출액에서 휘발되는 향기성분을 SPME fiber에 30분간 흡착시킨 후 GC(HP 7890A, Agilent technologies, Palo Alto, CA, USA), MSD(HP 5975C, Agilent technologies)로 분석하였다. SPME fiber는 polydimethylsiloxane/ divinylbenzene(PDMS/DBV) fiber(Supelco Inc., Bellefonte, PA, USA)를 사용하였고 분석 column은 HP-5MS(0.25 μm×0.25 mm×30 m, Agilent technologies)를 사용하였다.
DPPH 라디칼 소거활성
DPPH free radical scavenging 활성 측정은 Heo 등의 방법 (19)을 변형하여 실험하였다. 96 well plate에 농도별(1000, 500, 100, 10, 1 및 0.1 μg/mL)로 희석한 커피 추출물 200 μL와 사용 직전에 만든 0.2 mM DPPH를 100 μL 넣고 혼합하 여 실온에서 30분 동안 반응시킨 후, microplate reader (EL800, BioTek, Winooski, PA, USA)를 사용하여 517 nm에 서 흡광도를 측정하였다. 각 시료 추출물의 DPPH 라디칼 소거 활성은 실험구와 음성대조구의 흡광도를 구하여 백분 율(%)로 표시 하였다. 양성대조군으로 BHT와 α-tocopherol 의 소거활성과 비교하였다.
ABTS 라디칼 소거능
ABTS radical을 이용한 항산화력 측정은 ABTS cation decolorization assay 방법(20)을 수정하여 실시하였다. 7 mM ABTS 용액과 2.45 mM potassium persulfate을 최종농 도로 혼합하여 실온인 암소에서 24시간 방치하여 ABTS radical(ABTS+)을 만들고, ABTS radical은 732 nm에서 흡광 도 값이 0.7±0.02가 되도록 PBS(phosphate buffer saline, pH 7.4) buffer로 희석하여 ABTS 용액으로 사용하였다. 96 well plate에 ABTS 용액 200 μL와 농도별로 희석한 시료 100 μL를 섞고 1분 후 732 nm에서 흡광도를 측정하였다. 각 시료 추출물의 ABTS 라디칼 소거 활성은 실험구와 음성대 조구의 흡광도를 구하여 백분율(%)로 표시 하였다. 양성대 조군으로 BHT와 α-tocopherol의 소거활성과 비교하였다.
Ferric reducing antioxidant power(FRAP)
FRAP에 의한 항산화력의 측정은 Benzie와 Strain의 방법 (21)에 따라 측정하였다. Reaction solution은 300 mM acetate buffer(pH 3.6), 40 mM HCl에 녹인 10 mM TPTZ 및 20 mM iron(III) chloride를 10:1:1로 실험직전에 만들어 사용하였다. 96 well plate에 반응액 200 μL와 농도별로 희석 된 시료 50 μL를 혼합한 후 37°C에서 15분간 반응시킨 후, 590 nm에서 흡광도를 측정하였으며, 대조군으로 trolox의 환원력과 비교하였다.
α-Glucosidase 저해 활성
α-Glucosidase 저해활성은 nitrophenol 분석법(22)을 응용 하여 측정하였다. 0.2 unit/mL의 α-glucosidase 효소액 50 μL, 12 mM p-nitrophenyl-α-D-glucopyranoside 100 μL, sample 50 μL 및 0.1 M potassium phosphate buffer(pH 6.8) 50 μL와 혼합하여 37°C에서 20분간 pre-incubation한 후 0.1 M NaOH 100 μL를 가하여 반응을 정지시키고 405 nm에서 흡광도를 측정하였다. 이 때 활성 비교를 위해 제2형 당뇨치 료제에 쓰이는 acarbose를 사용하였으며, 실험구와 음성대 조구의 흡광도를 구하여 백분율(%)로 표시하였다.
α-Amylase 저해 활성
α-Amylase 저해활성은 환원당 분석법(23)을 응용하여 효 소원으로 사람의 타액 amylase를 사용하고 기질로서 0.5% starch를 이용하여 효소활성을 측정하였다. 효소액 50 μL, sample 50 μL, 0.5% starch 100 μL, 0.1 M potassium phosphate buffer(pH 6.8) 50 μL와 혼합하여 37°C에서 20분간 preincubation한 후 DNS 발색시약(48 mM 3,5-dinitrosalicylic acid and 30 % sodium potassium tartarate in 0.5 M NaOH) 250 μL를 넣고 100°C에서 10분간 끓여 발색시킨 후 충분히 냉각시킨다. 이 반응액에 1.5 mL의 물을 가하고 잘 교반한 후 540 nm에서 흡광도를 측정하였다. 대조군은 acarbose를 사용하였으며, 실험구와 음성대조구의 흡광도를 구하여 백 분율(%)로 표시하였다.
Statistical analysis
분석결과의 통계처리는 SAS(Statistical Analysis System, 9.0, SAS Institute, Cary, NC, USA) software를 이용하였으 며, 통계적 유의성 검정을 위해 분산분석(ANOVA)과 Duncan's multiple range test를 실시하였다.
결과 및 고찰
카페인 함량
품종별 커피의 로스팅 정도에 따른 caffeine 함량은 크게 변화하지는 않았다. Table 1에 나타낸 바와 같이 caffeine 함량은 로스팅이 강해질수록 약간씩 감소하는 경향이었다. 즉 생두의 caffeine 함량에 비하여 가장 강한 로스팅 조건 (250°C, 20 min)에서 CS는 약 28%, EY는 10.1%, IM은 9.9% 및 IMM은 7.5%정도 줄어들었다. 이러한 결과는 Kim과 Park(12)이 매우 강한 로스팅 공정이 아닌 경우 카페인의 손실은 매우 적으며, 로스팅 정도에 따라 거의 변화를 보이 지 않는다는 보고와 일치하였다.
Table 1.
Changes in the caffeine and 5-caffeoylquinic acid contents of the different types of coffee bean according to the roasting condition
| Roasting conditions |
Content of caffeine (mg/g) |
Content of 5-caffeoylquinic acid (mg/g) |
| CS1) |
EY |
IM |
IMM |
CS |
EY |
IM |
IMM |
| Raw |
11.71±0.472) |
9.58±0.65 |
11.91±0.60 |
13.90±0.70 |
37.68±2.48 |
36.70±1.12 |
34.74±0.39 |
46.64±0.87 |
| 200°C |
10 min |
11.68±0.57 |
9.08±0.42 |
11.77±0.52 |
13.40±0.30 |
14.56±0.99 |
15.36±0.41 |
13.05±1.02 |
15.45±0.13 |
| 15 min |
11.00±0.26 |
8.45±0.48 |
11.34±0.68 |
13.01±0.25 |
10.87±0.18 |
11.66±2.25 |
11.49±2.26 |
13.68±0.21 |
| 20 min |
9.82±0.22 |
8.01±0.24 |
10.81±0.64 |
12.98±0.16 |
9.58±0.23 |
9.04±0.17 |
9.15±0.17 |
9.89±0.04 |
| 250°C |
10 min |
11.68±0.79 |
8.78±0.47 |
11.17±0.39 |
13.48±0.41 |
7.39±0.31 |
7.97±0.87 |
7.91±0.18 |
8.00±0.10 |
| 15 min |
9.01±1.18 |
8.68±0.20 |
10.85±0.75 |
13.22±0.11 |
6.10±1.00 |
6.47±0.05 |
5.69±0.22 |
7.19±0.08 |
| 20 min |
8.42±0.52 |
8.61±0.48 |
10.84±0.22 |
12.99±0.21 |
4.50±0.41 |
5.05±0.11 |
5.22±0.29 |
5.13±0.24 |
Download Excel Table
5-Caffeoylquinic acid 함량
5-Caffeoylquinic acid는 quinic acid에 caffeic acid가 ester 결합된 성분으로 3개의 이성질체인 caffeoylquinic acids (CQA), dicaffeoylquinic acids(diCQA), feruoylquinic acids (FQA) 등을 가진 물질이며(24), 본 연구에서는 커피 로스팅 정도에 따른 5-caffeoylquinic acid를 분석하였으며 그 결과 를 Table 1에 나타내었다. 5-Caffeoylquinic acid는 로스팅 강도가 강해질수록 급격히 감소하는 경향을 보였으며, 생 두에 비하여 가장 강한 로스팅 조건(250°C, 20 min)에서 CS는 약 82.1%, EY는 86.2%, IM은 85.0% 및 IMM은 89.0% 감소하였다. Suh 등(9)의 연구에서도 본 연구결과와 유사한 경향으로 에티오피아 및 브라질산 원두를 강하게 로스팅하 였을 때 5-caffeoylquinic acid이 크게 감소하였다고 보고하 였다.
총 페놀화합물 함량
페놀성 화합물에 존재하는 phenolic hydroxyl(OH)기는 단백질 등과 결합하는 성질을 가지고 있으며, 항산화, 항암 및 항균 효과 등의 생리활성을 가지는 것으로 알려져 있다 (25-27). 각 품종별 커피의 로스팅 시간에 따른 추출물에 대한 총 페놀화합물의 함량은 Table 2에 나타내었다. 커피 의 품종 간에는 IM에서 121.71±4.35 mg/g으로 가장 많이 함유하고 있었으나. 로스팅이 강해질수록 크게 감소하였 다. 즉, 생두의 총 페놀 함량에 비하여 200°C에서는 손실이 7.2%이하로 적었으나, 250°C에서는 품종별로 26.6~42.1% 로 크게 감소하였다. Kim과 Han(5)은 로스팅이 진행되면서 총 페놀화합물 함량이 다소 감소한다고 보고하였다. Farah 와 Donangelo(28)도 로스팅 중에 총 페놀화합물이 다소 증 가하다가 최종적으로는 감소하는 경향을 나타내었다고 보 고하여 본 연구결과와 유사하였다.
Table 2.
Changes in the total phenolics contents of the different types of coffee beans according to the roasting condition
| Roasting conditions |
Content of total phenolics (mg/g) |
| CS1) |
EY |
IM |
IMM |
| Raw |
111.33±1.31A2) |
120.02±1.33A |
121.71±4.35A |
116.87±2.94A |
| 200°C |
10 min |
109.15±9.31A |
119.27±2.56A |
120.58±4.31A |
100.52±4.89C |
| 15 min |
108.49±10.32A |
118.38±3.67A |
118.12±7.46A |
109.96±1.29AB |
| 20 min |
107.78±3.85A |
115.49±2.66A |
118.11±3.62A |
108.20±3.35B |
| 250°C |
10 min |
110.56±3.69A |
115.09±5.91A |
108.87±4.05B |
108.19±6.79B |
| 15 min |
92.61±1.00B |
89.58±0.95B |
90.27±0.38C |
83.38±4.48D |
| 20 min |
81.76±6.64C |
78.83±3.72C |
82.74±4.37C |
67.66±1.27E |
Download Excel Table
Pyrazine 화합물의 생성
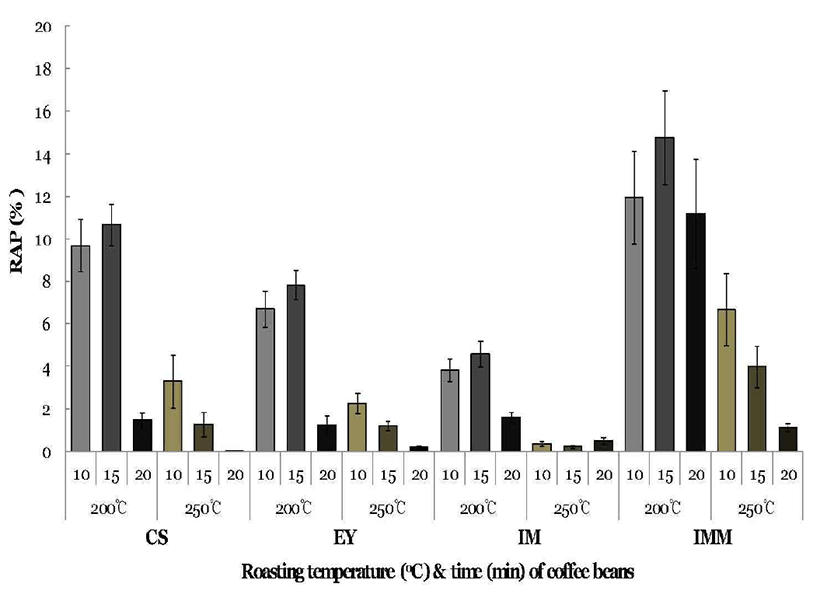
Pyrazine은 식품의 볶음 과정에서 발생되는 향기성분 중 에 하나로서 구운 향, 고소한 향, 토스트 향, 초콜릿 향 등의 냄새를 내는 성분으로 커피의 좋은 향의 본질이라고 할 수 있다. 각 커피 품종별 로스팅 정도에 따라 추출한 에스프 레소의 향기성분 중 pyrazine 화합물의 생성을 Fig. 1에 나타 내었다. Pyrazine 화합물은 전체 향기성분의 함량에 대한 상대적 pyrazine 함량(RAP, relative amount of pyrazine, %) 으로 나타내었다. 4종의 커피에서 생성된 pyrazine 화합물 은 CS, EY, IM 및 IMM에서 각각 0.01~10.69%, 0.2~7.84%, 0.5~4.56% 및 1.12~14.77%로 IMM에서 가장 많이 생성되 었다. 이것은 CS, EY 및 IM은 아라비카 종인 것에 비해 IMM은 로부스타 종이 섞인 켄트종이며, 생두를 인위적으 로 숙성시켰기 때문에 풍부한 향이 나는 것으로 생각된다. 모든 품종에서 생두일 때에는 pyrazine 화합물이 거의 생성 되지 않았으나, 로스팅이 시작되면서 생성되기 시작하였 다. 결과적으로 200°C에서는 10분 보다 15분 로스팅 하였을 때 증가하였으나 20분 로스팅 했을 때에는 감소하기 시작 하였다. 250°C에서는 10분간 로스팅하였을 때가 가장 많이 생성되었으며 시간이 경과할수록 급격히 줄어들었다. 이는 pyrazine 화합물은 휘발성 방향족 화합물이기 때문에 로스 팅 온도가 높아지고 시간이 길어지면서 대부분이 휘산되어 감소한 것이라고 생각되었다. Ku 등(29)은 로스팅의 온도와 시간이 증가하면서 2-methylpyrazine, 2,3-dimethy- lpyrazine, 2,5-dimethylpyrazine, 2,3,5-trimethylpyrazine, 2,3,5,6-tetramethylpyrazine이 대체적으로 증가하다가 감소하는 경향을 나타낸다고 보고하여 본 연구와 유사한 결과를 나타내었으 며, Lee 등(2)은 210~230°C에서 210~250초 동안 로스팅 하 였을 때 로스팅이 강해질수록 pyrazine이 감소하였다고 보 고하여 본 연구 결과와 유사하였다.
Fig. 1.
Pyrazine compounds in the espresso from each type of coffee bean according to the roasting conditions.
RAP, relative amount of pyrazine against the total volatile compounds; CS, Colombia supremo; EY, Ethiopia yirgacheffee G2; IM, Indonesia mandheling G1; IMM, India monsooned malabar AA. The values represent the mean±SD (n=3).
Download Original Figure
항산화활성
항산화물질은 인체 내에서 활성산소에 의하여 산화적 스트레스를 감소시켜 노화를 억제시키고 항암 등 생리활성 기능이 입증되면서 식품 자체보다 식품 속의 항산화 관련 물질에 대한 관심이 더 많이 집중되고 있다(30,31). 커피의 로스팅 조건에 따른 항산화능을 DPPH, ABTS 및 FRAP 방법으로 측정하였다(Table 3).
Table 3.
Antioxidant activities of the different types of coffee beans according to the roasting condition via DPPH, ABTS, and FRAP assays
| Tested methods |
Antioxidant activities (%) treated with concentration of 100 µg/mL |
| Raw |
200°C |
250°C |
BHT |
α-Tocopherol |
Trolox |
| 10min |
15min |
20min |
10min |
15min |
20min |
| DPPH (%) |
CS1) |
85.70±0.37AB2) |
85.82±0.76A |
85.33±0.00AB |
85.09±0.21B |
83.37±0.21C |
82.40±0.00D |
81.66±0.00E |
83.86±0.37 |
83.50±0.00 |
|
| EY |
84.60±0.00A |
84.60±0.37A |
84.96±0.00A |
84.72±0.21A |
82.89±0.21B |
82.89±0.21B |
80.93±0.00C |
| IM |
84.72±0.21A |
84.84±0.21A |
84.72±0.21A |
84.23±0.00B |
82.03±0.37C |
81.17±0.21D |
80.81±0.42D |
| IMM |
80.32±0.21A |
80.20±0.37A |
80.68±0.42A |
79.85±0.21A |
78.97±1.69AB |
77.38±1.81B |
75.43±0.00C |
| ABTS (%) |
CS |
61.05±0.71A |
59.86±0.41B |
59.30±0.33BC |
58.99±0.08C |
56.61±0.03BC |
55.21±0.37E |
53.99±0.68F |
62.65±0.03 |
60.50±0.36 |
| EY |
60.99±0.43A |
60.21±0.20B |
59.48±0.36C |
59.24±0.27C |
56.70±0.57D |
55.45±0.30E |
53.57±0.25F |
| IM |
60.76±0.63A |
59.20±0.32AB |
58.37±0.41B |
58.07±0.19B |
56.01±0.85C |
54.88±0.46C |
51.10±2.02D |
| IMM |
53.11±0.30A |
53.66±0.08A |
53.04±0.38A |
52.75±0.22A |
50.34±0.47B |
49.63±0.80B |
47.31±0.72C |
| FRAP (%) |
CS |
80.88±0.27A |
80.22±0.11B |
80.06±0.06B |
79.62±0.23C |
77.78±0.25D |
73.99±0.13E |
73.58±0.29E |
|
82.35±0.09 |
| EY |
82.04±0.11A |
80.74±0.20B |
80.22±0.04C |
80.01±0.05C |
78.11±0.57D |
74.66±0.36E |
73.82±0.38F |
| IM |
81.43±0.18A |
79.60±0.16B |
79.28±0.14B |
78.53±0.33C |
75.86±0.31D |
74.58±0.22C |
73.93±0.16F |
| IMM |
80.53±0.20A |
78.77±0.26B |
78.31±0.16BC |
77.83±0.05C |
75.35±0.91D |
72.75±0.44E |
72.03±0.29E |
Download Excel Table
DPPH 라디칼 소거활성은 0.1 mg/mL 처리하였을 때 20 0°C에서 로스팅 하였을 경우 79.85±0.21~85.82±0.76%로 비교적 높게 나타났으며, 250°C에서는 75.43±0.00~83.37 ±0.21%로 활성이 약간 낮았으나 같은 농도의 BHT (83.86± 0.37%)와 α-tocopherol(83.50±0.0%)와 거의 유사하게 높은 활성을 나타내었다. Kim과 Han(5)은 0, 5, 8, 10분 로스팅한 커피의 추출물에서는 유의적 차이 없이 높은 항산화성을 나타내었고, 20분에서 free radical 소거 효과가 크게 감소하 였으며, 25분에서 가장 낮은 항산화성을 나타내었다고 보 고하여 본 연구에서의 결과와 유사하였다.
ABTS cation radical 소거활성도 200°C에서 로스팅 하였 을 경우 52.75±0.22~60.21±0.20%로 비교적 높게 나타났으 며, 250°C에서는 47.31±0.72~56.70±0.57%로 활성이 약간 낮았으나 같은 농도의 BHT(62.65±0.03)와 α-tocopherol (60.50±0.36%)의 75~90% 정도의 높은 활성을 나타내었다. Pérez 등(32)은 커피 생두에서의 활성이 프렌치 또는 이탈 리안 방법으로 로스팅 하였을 때 보다 높은 활성을 보였다 고 하였다. 이는 프렌치와 이탈리안 로스팅이 가장 강한 로스팅 방법이기 때문에 항산화성이 낮아진 것으로 판단되 었다.
FRAP assay에서 커피 추출물(CS, EY, IM 및 IMM)의 환원력은 각각 73.58±0.29~80.22±0.11, 73.32±0.38~80.74± 0.20, 73.93±0.16~79.60±0.16 및 72.023±0.29~78.77±0.26% 의 환원력을 나타내어 trolox의 환원력(82.35±0.09%)에 비 해 낮으나 비교적 높은 활성을 나타내었다. 커피의 로스팅 정도가 강해질수록 활성이 약간 감소하는 것은 커피 생두에 존재하는 폴리페놀 성분이 로스팅 과정에서 분해가 되었기 때문으로 여겨진다. Kim과 Park(12)은 로스팅 시간에 따라 갈색도와 항산화성이 정비례관계를 보이다가 14분이 지나 면 오히려 항산화성이 다소 감소한다는 보고를 보여 본 연구와 유사한 결과를 나타내었다.
α-Glucosidase 및 α-Amylase 저해활성
α-Glucosidase는 소장의 융모막에 존재하는 소화 효소로 서 단당류로 가수분해하여 식후 혈당치의 급격한 상승을 일으킨다. 따라서 α-glucosidase 저해제는 제2형 당뇨의 치 료제 개발에 유용하다. α-Amylase 또한 당질을 분해하여 단당류로 전환시키는 효소로 이러한 효소의 활성 저해는 당질가수분해와 흡수과정을 지연시킴으로 식후 당 농도를 제한한다(33-35). 식후 소장에서 당 흡수를 지연시킴으로서 급격한 혈당상승을 막아주는 당뇨약에 acarbose 등이 있으 며, acarbose는 췌장과 타액선의 α-amylase와 장관의 α -glucosidase를 억제한다(36). 각 품종별 커피의 로스팅 조건 에 따른 커피 열수 추출물에 대한 α-glucosidase, α-amylase 저해 활성은 Table 4에 나타내었다.
Table 4.
α-Glucosidase and α-amylase inhibition activities of the different types of coffee beans according to the roasting conditions
| Roasting conditions |
α-Glucosidase inhibition activity (%) treated with concentration of 200 µg/mL |
| CS1) |
EY |
IM |
IMM |
Acarbose |
| Raw |
43.60±1.97ABa2) |
44.50±1.43Aa |
40.97±1.15Ba |
36.00±1.12Ca |
45.72±0.73 |
| 200°C |
10 min |
42.09±0.10ABab |
42.37±0.24Aab |
40.44±0.86Ba |
30.45±1.55Cb |
|
| 15 min |
40.21±0.42Ab |
41.05±0.30Aab |
38.08±0.64Bb |
25.05±0.42Cc |
| 20 min |
37.31±0.46Bc |
40.11±1.34Ab |
36.60±0.43Bb |
18.21±0.85Cd |
| 250°C |
10 min |
34.15±0.00Ad |
35.77±0.87Ac |
29.48±0.83Bc |
14.64±2.53Ce |
|
| 15 min |
15.40±1.12Ae |
15.65±0.73Ad |
14.42±0.85Ad |
1.47±1.53Bf |
| 20 min |
7.83±3.05Af |
9.29±4.88Ae |
6.85±1.27Ae |
0.98±0.73Bf |
| α-Amylase inhibition activity (%) treated with concentration of 200 µg/mL |
| Raw |
54.00±0.35Ca |
59.48±1.86Aa |
56.54±1.12Ba |
49.89±0.68Da |
55.81±1.85 |
| 200°C |
10 min |
52.41±0.65Ba |
55.49±1.34Ab |
51.92±0.45Cb |
47.85±1.67Cb |
|
| 15 min |
50.72±0.42Bb |
51.42±0.15Ac |
50.92±0.24Cc |
45.44±0.34Cc |
| 20 min |
48.32±0.38Ac |
49.10±1.62Ac |
48.19±1.20Bd |
43.04±0.58Bd |
| 250°C |
10 min |
46.91±0.36Bc |
48.91±0.42Ac |
47.64±0.74Cd |
42.08±0.27Cd |
|
| 15 min |
36.86±1.18Ad |
36.44±2.62Ad |
36.29±1.01Ad |
32.01±0.62Be |
| 20 min |
30.71±1.90ABe |
32.74±2.70Ae |
33.26±0.81Ae |
27.81±0.22Bf |
Download Excel Table
α-Glucosidase 저해 활성은 acarbose가 0.2 mg/mL의 농도 에서 45.72±0.73%의 활성을 나타내었고 같은 농도에서 커 피 추출물(CS, EY, IM 및 IMM)의 활성은 각각 7.83± 3.05~43.60±1.97%, 9.29±4.88~44.50±1.43%, 6.85±1.27~ 40.97 ±1.15% 및 0.98±0.73~36.00±1.12%로 acarbose와 비교하였 을 때 활성이 다소 낮으나 생두와 200°C에서 로스팅 된 원두에서는 상당한 항당뇨활성을 보였으나 로스팅이 강해 질수록 급격히 활성이 저하되었다.
α-Amylase 저해 활성에서는 acarbose 0.2 mg/mL의 농도 에서 55.81±1.85%의 활성을 나타내었으며 같은 농도에서 커피 추출물(CS, EY, IM 및 IMM)의 활성은 각각 30.71 ±1.90~54.00±0.35%, 32.74±2.70~59.48±1.86%, 33.26 ±0.81~56.54±1.12% 및 27.81±0.22~49.89±0.68%로 이 또 한 생두와 200°C에서 로스팅 한 원두에서 우수한 활성을 나타내었으나 로스팅이 강해질수록 활성이 저하되었다. Anderson 등(37)은 녹차와 우롱차, 홍차에서 모두 차에 함유 된 카페인이 카테킨과 같은 폴리페놀 성분과 더해졌을 때 인슐린 활성이 강화되었다고 보고하였다. 이는 커피에서도 카페인이 클로로겐산 등의 폴리페놀 성분과 더해져 항당뇨 활성을 나타낼 수 있을 것으로 사료되었다.
요 약
4종류의 커피 원두(CS, Colombia superimo; EY, Ethiopia yirgacheffee; IM, Indonesia mandheling; IMM, India monsooned malabar AA)를 생두(raw coffee bean)와 각각 다른 온도(200, 250°C)와 시간(10, 15, 20 min)으로 로스팅하 였으며, 최적의 로스팅 조건을 찾기 위하여 로스팅 중에 변화되는 pyrazine을 비롯한 몇 가지 성분과 항산화, 항당뇨 효과를 조사하였다. Caffeine 함량은 로스팅 정도에 따라 크게 차이를 보이지 않았으나, 5-caffeoylquinic acid와 total phenolic compounds는 대체로 로스팅이 강해질수록 크게 감소하였다. Pyrazine 화합물은 IMM에서 가장 많이 생성되 었으며, 250°C에서는 시간이 경과할수록 급격히 줄어들었 다. DPPH 라디칼 소거활성은 같은 처리농도에서의 BHT와 α-tocopherol의 활성에 비하여 대부분 80% 이상의 효과를 나타내었다. 한편 FRAP assay에서는 로스팅 정도가 강해질 수록 활성이 약간 감소하였다. α-Glucosidase 저해활성은 유의할 만한 수준이었으나, 250°C에서 20분 roasting할 경우 에는 활성이 80% 이상 줄어들었으며, α-amylase 저해활성 도 유사한 경향이었다. 이러한 결과로 로스팅 정도에 따른 생리활성과 커피의 고소한 향과 초콜릿 향을 내는 pyrazine 화합물의 생성을 종합적으로 보았을 때, 200°C에서 15분 정도 로스팅하는 것이 가장 최적의 조건인 것으로 판단하였 다. 따라서 이러한 결과는 커피산업에서 로스팅 조건을 달 리한 원두커피의 향과 생리활성이 높은 커피를 생산하는데 활용될 수 있을 것이라 기대된다.
감사의 글
이 논문은 2013년도 경남과학기술대학교 기성회 연구비 지원에 의하여 연구되었음.
REFERENCES
Kim HK, Hwang SY, Yoon SB, Chun DS, Kong SK, Kang KO. A study of the characteristics of different coffee beans by roasting and extracting condition. Korean J Food Nutr. 2007; 20:14-19.

Lee MJ, Kim SE, Kim JH, Lee SW, Yeum DM. A study of coffee bean characteristics and coffee flavour in relation to roasting. Korean J Food Nutr. 2013; 42:255-261


Moon JW, Cho JS. Change in flavor characteristics and shelf-life of roasted coffee in different packaging conditions during storage. Korean J Food Sci Technol. 1999; 31:441-447.

Baik HJ, Ko YS. Studies on the aroma components of roasted and ground coffee. Korean J Food Sci Technol. 1996; 28:15-18.

Kim JY, Han YS. Influence of roasting time on antibacterial and antioxidative effects of coffee extract. Korean J Food Sci Technol. 2009; 25:496-505.

Hwang SH, Kim KS, Kang HJ, Kim MJ. Phenolic compound contents and antioxidative effects on dutch coffee by extraction time. Korean J Public Health Research. 2013; 39:21-29.

Park JY. Antioxidant activities and quality characteristics of pan bread with green coffee bean powder. MS Thesis. Sejong University Korea. 2013; p. 26-42.

Park SS, Lee DH, Kim KI. A study on the quality of roast coffee bean according to methods of storage. Korean J Soc Coffee Industry. 2012; 1:31-36.

Suh YS, Lee SH, Shang Y, Yoon Jr, Lee WJ. Change in antioxidant activities and flavor patterns of Coffea arabica beans during roasting. Korean J Food Preserv. 2014; 21:224-230


Kim KH, Kim AH, Lee JK, Chun MS, Noh BS. Analysis of flavor pattern of various coffee beans using electronic nose. Korean J Food Sci Technol. 2014; 46:1-6


Choi YM, Yoon HH. Sensory characteristics of espresso coffee according to green coffee processing. Korean J Food Cookery Sci. 2011; 27:773-781


Kim KJ, Park SK. Changes in major chemical constituents of green coffee beans during the roasting. Korean J Food Sci Technol. 2006; 38:153-158.

Holscher W. Comparison of some aroma impact compounds in roasted coffee and coffee surrogates. R. Soc. Chem. 1996; 197:239-244.

Lee JH, Kim SS. Changes in methyl pyrazines of cocoa beans during microwave roasting. Korean J Food Sci Technol. 2000; 32:654-658.

Cheigh HS, Nam JH, Kim TJ, Kwon TW. Studies on Soong-Neung flavor. Korean J Food Sci Technol. 1975; 7:15-21.

Bradbury A, Weers M. Non-volatile compounds analysis in coffee. Kaft Eur Anal Method. 1995; :5-17.

Folin O, Denis W. On phosphotungstic phosphomolybdic compounds as color reagent. J Biological Chem. 1912; 12:239-249.

Giovanni C, Manuela C, Gloria C, Filippo M, Luigi O, Massimo R, Gianni S, Veronica S, Giacomo T, Sauro V. Optimization of espresso machine parameters through the analysis of coffee odorants by HS-SPME -GC/MS. J Food Chem. 2012; 135:1127-1133.

Heo JC, Lee DY, Son MS, Yun CY, Hwang JS, Kang SW, Kim TH, Lee SH. Effects of mole crickets (Gryllotalpa orientalis) extracts on anti-oxidant and anti-inflammatory activities. J Life Sci. 2008; 18:509-514


Re R, Pellegrini N, Proteggente A, Pannala A, Yang M, Rice-Evans C. Antioxidant activity applying an improved ABTS radical cation decolorization assay. Free Radic Biol Med. 1999; 26:1231-1237


Benzie IFF, Strain JJ. The ferric reducing ability of plasma (FRAP) as a measure of “antioxidant power” : The FRAP assay. Anal Biochem. 1996; 239:70-76


Matsui T, Ueda T, Oki T, Sugita K, Terahara N, Matsumoto K. a-Glucosidase inhibitory action of natural acylated anthocyanins 1 Survey of natural pigments with potent inhibitory activity. J Agr Food Chem. 2001; 49:1948-1951.

Gao H, Kawabata J. a-Glucosidase inhibition of 6-hydroxyflavones Part 3 Synthesis and evaluation of 2,3,4-trihydroxybenzoyl-containingflavonoid analogs and 6-aminoflavones as a-glucosidase inbibitors. Bioorg Med Chem. 2005; 13:1661-1671.

Clifford MN, Wight J. The measurement of feruloylquinic acids and caffeoylquinic acids in coffee beans. J Sci Food Agric. 1976; 27:73-84.

Halliwell B, Aeschbach R, Loliger J, Aruoma OI. The characterization of antioxidants. Food Chem Toxicol. 1995; 33:601-617.

Imai J, Ide N, Nagae S, Moriguchi T, Matsuura H, Itakura Y. Antioxidant and radical scavenging effects of aged garlic extract and its constituents. Plant Med. 1994; 60:417-420


Rice-Evans CA, Miller NJ, Paganga G. Antioxidant properties of phenolic compounds. Trends Plant Sci. 1997; 2:152-159.

Farah A, Donangelo CM. Phenolic compound in coffee. Braz J Plant Physiol. 2006; 18:23-26


Ku Madihah KY, Zaibunnisa AH, Norashikin S, Rozita O, Misnawi J. Optimization of roasting conditions for high-quality Arabica coffee. International Food Res J. 2013; 20:1623-1627.

Kalt W. Effects of production and processing factors on major fruit and vegetable antioxidant. J Food Sci. 2005; 70:11-19


Perron NR, Brumaghim JL. A review of the antioxidant mechanisms of polyphenol compounds related to iron binding. Cell Biochem Biophys. 2009; 53:75-100


Perez Hernandez LM, Chavez Quiroz K, Medina Juarez LA, Meza NG. Phenolic characterization, melanoidins and antioxidant activity of some commercial coffee from Coffea arabica and Coffea canephora. J Mexican Chemical Soc. 2012; 56:430-435.

Kwon JW, Lee HK, Park HJ, Kwon TO, Choi HR, Song JY. Screening of biological activities to different ethanol extracts of Rubus coreanus Miq. Korean J Medicinal Crop Sci. 2011; 19:325-333


Baron AD. Postprandial hyperglycemia and a -glucosidase inhibitors. Diabetes Res Clin Pract. 1998; 40:51-55.

Shinde J, Taldone T, Barletta M, Kunaparaju N, Hu B, Kumar S, Placido J, William ZS. a-Glucosidase inhibitory activity of Syaygium cumini (Linn) Skeels seed kernel in vitro and in Goto-Kakizaki (GK) rats. Carbohyd Res. 2008; 343:1278-1281.

Lee MH, Lee JS, Yang HC. a-Amylase inhibitory activity of flower and leaf extracts from buckwheat (Fagopyrum esculentum). J Korean Soc Food Sci Nutr. 2008; 37:42-47


Anderson RA, Polansky MM. Tea enhances insulin activity. J Agric Food Chem. 2002; 50:7182-7186