ARTICLE
송이줄기 첨가에 따른 Muscat Bailey A 포도의 발효 중 발효액 및 포도주의 생리활성 물질 함량
정세현, 장은하*, 허윤영, 정성민, 남종철, 고상욱, 최인명
Phenolic compounds of must and wine supplemented with Muscat Bailey A grape fruit stem
Se-Hyun Jeong, Eun-Ha Chang*, Youn-Young Hur, Sung-Min Jeong, Jong-Chul Nam, Sang-Wook Koh, In-Myung Choi
Author Information & Copyright ▼
Fruit Research Division, National Institute of Horticultural and Herbal Science, RDA, Suwon 440-310, Korea
© The Korean Society of Food Preservation. This is an Open-Access article distributed under the terms of the Creative Commons Attribution Non-Commercial License (http://creativecommons.org/licenses/by-nc/3.0/) which permits unrestricted non-commercial use, distribution, and reproduction in any medium, provided the original work is properly cited.
Received: Aug 19, 2014; Revised: Nov 11, 2014; Accepted: Nov 14, 2014
Abstract
This study investigated the phenolic compounds of must and wine supplemented with different concentrations (0% (no added stems), 1%, 2%, 3%, and 5%) of fruit stems during winemaking using Muscat Bailey A (MBA) grapes. The red color, and total anthocyanin, total polyphenol, and tannin contents of the must and wine significantly (p<0.05) increased with increasing added amounts of grape fruit stems, while the volatile acid content decreased with increasing added amounts of grape fruit stems. Catechin (8.16~23.08 mg/L), gallic acid (2.32~3.28 mg/L), trans-resveratrol (1.38~3.27 mg/L), and ferulic acid (1.51~1.59 mg/L) were detected in the must and wine via HPLC. The bioactive substance contents increased with increasing added amounts of grape fruit stems, except for ferulic acid. The DPPH IC50 activity was higher in the wine (12 mg/L) with 5% grape fruit stems than in ascorbic acid (67 mg/L). These results suggest that the fruit stems of MBA grapes can be used as functional materials for winemaking.
Keywords: grape; polyphenol; resveratrol; stem; wine
서 론
페놀 화합물은 식물계에 널리 분포하고, 서로 다른 농도 로 많은 식품에서 발견된다(1). 포도에서는 과육, 과피 및 종자에 존재하고, 포도의 색, 풍미, 쓴맛, 수렴성 등과 같은 관능 특성에 기여하기 때문에 포도 및 포도 제품의 가장 중요한 품질 변수 중 하나로 간주된다(2).
페놀 화합물의 함량 및 조성은 포도 품종, 포도 숙기, 날씨, 포도 재배 방법 및 포도 재배 지역에 따라 다르다(2). 포도주 제조 과정에서 사용하는 여러 가지 처리 방법은 과일에 자연적으로 존재하는 페놀 성분에 비해 최종 페놀 성분에 영향을 미친다. 특히 적포도 및 적포도 제품은 페놀 화합물이 풍부하다. 페놀 화합물은 포도 제품의 개발에 중 요한 역할을 할뿐만 아니라 건강에 미치는 유익한 영향으로 관심을 모으고 있다(3). 이들은 항산화 성질을 가지고 있고 (4), 세포의 산화적 손상을 방지 할 수 있다(5). 폴리페놀의 항산화 활성은 일중항 산소와 결합해 수소를 공여하는 환원 제로서 역할을 하거나(6), 킬레이트로서 역할을 할 수 있는 능력에 의한 것이다(3).
포도주 제조에서 신선하게 수집된 포도는 먼저 송이줄기 를 제거하고 포도액(must)을 얻기 위해 압착하는데 이 단계 에서 포도 찌꺼기가(주로 과피와 종자) 축적된다. 포도의 송이줄기는 포도 폐기물의 높은 부분을 차지하며, 처리된 원료 물질의 3~6%를 차지한다. 포도의 유용성분이 알려지 면서 많은 연구가 포도 줄기 성분, 특히 polyphenol, flavonoid, stilbenoids 및 proantocyanidins에 초점을 맞추고 있으며, 줄기 추출물의 항산화활성에 대한 연구들이 평가 되었다(7). Resveratrol(3,5,4’-trihydroxystilbene)은 다양한 식물에서 발견되는 폴리페놀계의 phytoalexin 중의 하나로 서, 자외선조사, 금속이온 등의 비생물학적, 또는 세균 및 곰팡이 등의 감염을 포함하는 생물학적 병충해로부터 자신 을 보호하기 위하여 합성되는 것으로 알려져 있다(8,9). Resveratrol은 mulberry, 땅콩, 포도를 포함한 최소 72종 이 상의 식물체에서 발견되는데, 신선한 포도 껍질에는 g당 약 50~100 μg의 resveratrol이 포함되어 있으며 포도 재배 품종, 지리적 상황 및 곰팡이 감염에 노출된 정도에 따라 달라지는 것으로 알려져 있다(10).
특히, 이전의 연구(11)에서 국내 육성 신품종 포도의 부 위별 생리활성물질 함량을 분석한 결과 포도에서 catechin, resveratrol과 같은 폴리페놀 성분은 가식부위보다 비가식 부위에서 월등히 높은 함량을 나타내었고, Muscat Bailey A(MBA) 품종은 송이줄기에서trans-resveratrol 함량이 394 ~436 μg/g으로 캠벨얼리 포도 품종의 33~38 μg/g에 비해 훨씬 높게 검출되었다.
본 연구는 MBA품종의 송이줄기에 resveratrol 함량이 풍 부하다는 선행연구 결과를 바탕으로 포도주 제조 시 송이줄 기 첨가가 포도주의 폴리페놀 성분을 향상시키는지 알아보 고자 실험을 수행하였다.
재료 및 방법
포도주 제조
포도주 제조에 사용된 MBA 포도는 2013년 국립원예특 작과학원 시험포장에서 재배되었으며, 양조용으로 사용하 기 위해 포도의 과방을 10 are 당 약 1.5 t으로 착과시켜 적정 수확 시기에 수확하여 포도주 제조에 사용하였다. 초 기 당도 20°Brix인 포도는 송이줄기를 제거하고 파쇄 된 포도 5 kg에 제거된 송이줄기를 농도별(1, 2, 3, 5%/kg)로 세절하여(1~2 cm) 다시 첨가하거나 첨가하지 않은(대조구) 후 잡균의 번식을 억제하고 포도즙(must)의 산패를 막기 위해 메타중아황산칼륨(potassium metabisulfite, K2S2O5, Junsei, Japan)을 100 mg/kg으로 처리하였다. 효모는 메타중 아황산칼륨 처리 후5시간뒤시판건조효모인Saccharomyces cerevisiae(Fermivin 7013, DSM food specialties, Netherlands) 를 사용하여 포도 무게의 0.02% (w/w)를 첨가하고 25°C로 발효시켰다. 효모 접종 후 원활한 발효를 위해 하루 2회씩 표면 위에 떠오르는 과피와 과육을 고루 저어 주었으며, 발효 10일 후 발효액을 압착하고, 2차 발효를 위해 압착한 발효액을 유리용기에 넣어 잔당발효를 실시한 뒤 약 15일 경과 후 1차 여과하였다. 발효액과 포도주의 분석을 위한 시료 채취는 발효액의 경우 발효 중 이틀이나 삼일 간격으 로 발효액을 취한 다음 원심분리 후 실험에 사용하였고, 포도주는 1차 여과를 실시한 후 실험을 위한 시료로 사용하 였다. 모든 시료는 3반복으로 실험을 실시한 후 통계처리를 통해 유의성 검정을 하였다.
pH, 총산, 당도, 알코올 및 휘발산 함량
pH는 pH meter(115PD, ISTEK, Seoul, Korea)로 측정하였 고, MBA 발효액 및 포도주의 총산함량은 시료 5 mL에 증류수 20 mL를 넣은 후 0.1 N NaOH로 pH 8.2까지 적정하 여 주석산(tartaric acid)으로 환산하였다. 당도(°Brix)는 포 도 발효액 및 포도주 원액을 당도계(Pocket refractometer PAL-1, ATAGO, Tokyo, Japan)로 측정하였다.
알코올 농도는 포도주 원액 100 mL에 증류수 30 mL를 넣고 증류장치에서 가열한 후 증류액을 80 mL 받고 증류수 로 100 mL로 정용한 후 15°C에서 주정계를 이용하여 측정 하였다(12).
휘발산 함량은 알코올 농도 측정에 사용한 증류액 30 mL를 취한 후, 0.01 N NaOH로 pH 8.2까지 적정하여 초산으 로 환산하였다(12).
적색도, 총안토시아닌 및 총폴리페놀 측정
발효액 및 포도주의 적색도는 원액 시료를 원심분리한 후 2 mm quartz cell에 담아 520 nm에서 흡광도를 측정하였 다. 총안토시아닌 및 총폴리페놀 함량은 시료 원액을 증류 수로 5배 희석한 후 희석액 1 mL에 0.2 M sodium acetate(pH 1.0) 9 mL를 넣어 반응시킨 후 총안토시아닌은 520 nm, 총폴리페놀은 280 nm에서 동시에 흡광도를 측정하였다 (13). 함량을 계산하기 위해 사용한 standard는 총안토시아 닌은 malvidin-3-glycoside, 총폴리페놀은 gallic acid를 표준 용액으로 사용하여 검량선을 작성한 후 환산하여 나타내었 다.
탄닌 함량
탄닌 함량은 Folin-Ciocalteu의 방법(14)에 따라 Folin- Ciocalteu reagent가 발효액 및 포도주의 폴리페놀 화합물에 의해 환원된 결과 청색으로 발색하는 원리로 측정하였다. 시료 원액을 원심분리한 후 상등액 0.2 mL에 증류수 10 mL를 가하고 Folin-Ciocalteu 시약 1 mL와 15% 탄산나트륨 3 mL를 첨가한 후 증류수를 이용해 최종 20 mL로 정용하였 다. 2시간 동안 실온에 방치한 후 765 nm에서 흡광도를 측정하고 tannic acid를 표준용액으로 사용하여 검량선을 작성한 후 환산하여 탄닌 함량을 나타내었다.
생리활성 성분 분석
포도 발효액 및 포도주의 폴리페놀 성분을 분석하기 위 해 사용한 기기는 HP-1100 Series liquid chromatograph (Agilent Technologies, Palo, Alto, CA, USA)를 사용하였으 며, 분석조건으로 컬럼은 Zorbax Eclipse XDB-C18 column (25 cm×4.6 mm i.d., 3.5 μm, Agilent, MD, USA)을 사용하였 다. 용매는 gradient조건 하에서 용매 A는 5% acetic acid in distilled water, 용매 B는 99.9% acetonitrile을 사용하여 시료 주입량 10 μL를 1.0 mL/min의 유동속도로 40분간 분석하였다. 용매의 조건은 gallic acid, catechin 및 epicatechin 분석은 0~11분까지 280 nm에서 A:B(10%: 90%)의 용매를, ferulic acid 분석은 18~23분까지 320 nm에 서 A:B(20%:80%)의 용매를, trans-resveratrol 분석은 25~ 29분까지 320 nm에서 A:B(30%:70%)의 용매 조건을 주었 으며 40분 분석 후 다음 분석을 위해 이동상의 용매를 5분 동안 A:B(10%:90%)의 용매로 흘러준 후 다음 분석을 수행 하였다.
DPPH radical 소거활성 측정
DPPH(1,1-Diphenyl-2-picrylhydrazyl) radical에 대한 소 거활성은 Blois(15)의 방법을 변형하여 실험하였다. 0.4 mM DPPH radical 용액을 흡광도 1로 맞춘 5 mL 용액에 희석된 포도주 시료 0.2 mL를 넣고 vortex로 균일하게 혼합한 다음, 실온암소에서30분간방치한후UV-visible spectrophotometer (DU 730, Beckman Coulter, Fullerton, CA, USA)로 517 nm 에서 DPPH radical 용액을 50% 감소시키는 흡광도 수치를 측정하였다. DPPH radical 소거활성 계산은 송이줄기를 농 도별로 첨가한 포도주의 총폴리페놀 함량을 이용하여 DPPH radical 용액을 50% 감소시키는 총폴리페놀 농도로 서 DPPH IC50(mg/L)으로 표시하였고, 각 시료를 3회 반복 실시하여 평균값으로 나타내었다. 포도주 시료의 항산화효 과는 ascorbic acid(Sigma, St. Louis, MO, USA)가 DPPH radical 용액을 50% 감소시키는 농도와 비교하여 나타내었다.
통계처리
본 실험결과 통계처리는 SPSS 프로그램(18.0, SPSS Inc., Chicago, IL, USA)을 이용하여 one-way ANOVA로 분석한 후, 처리간의 유의성은 p<0.05 수준에서 Duncan’s multiple range test로 검정하였다.
결과 및 고찰
MBA 발효액 및 포도주의 당도 및 총산 함량
MBA 포도에 송이줄기를 농도별로 첨가해 발효 중 발효 액의 품질 및 포도주의 품질을 측정한 결과는 Table 1과 2에 나타내었다. MBA 포도의 초기당도는 20°Brix였으며 발효가 진행될수록 당이 알코올로 전환되어 발효 완료시 발효액의 잔당은 약 6.20°Brix를 나타내었다. 그러나 굴절 당도계로 발효액이나 포도주의 당함량을 측정 시 알코올의 간섭을 받기 때문에 실제 당함량은 °Brix 당도로 표시된 것보다 훨씬 낮은 값을 나타낸다. 따라서 잔당을 확인하기 위해서는 HPLC로 측정하는 것이 정확한 방법이다. 송이줄 기 첨가가 발효에 영향을 미치지 않았으며, 발효 완료 후 당도도 처리별 유의적인 차이를 보이지 않았다. MBA 발효 액의 총산함량은 초기에는 0.61%에서 발효 중 acetic acid나 lactic acid 등의 산 함량 증가에 의해 총산함량이 증가하다 가(16) 발효 8일부터 감소하기 시작하여 발효 완료 시 0.75 ~0.78%의 함량을 나타내었고, 포도주에서도 처리별 유의 적인 차이 없이 0.71~0.77%의 함량을 나타내었다.
Table 1.
Sugar, total acid, and pH dur ing the fermentation of must supplemented with Muscat Bailey A grape fruit stem
| Sample(%) |
Fermentation time (day) |
| 0 |
1 |
4 |
6 |
8 |
10 |
| Sugar (°Brix) |
0% |
20.00±0.00 |
20.55±0.351)b2) |
17.85±0.78a |
10.50±0.71a |
7.50±0.14a |
6.25±0.21a |
| 1% |
20.55±0.07b |
18.10±0.14a |
10.35±0.49a |
7.40±0.14a |
6.25±0.07a |
| 2% |
20.45±0.21ab |
18.10±0.14a |
11.05±0.35a |
7.75±0.21b |
6.30±0.14a |
| 3% |
20.00±0.42a |
18.10±0.28a |
10.55±0.21a |
7.45±0.07a |
6.40±0.14a |
| 5% |
20.15±0.21ab |
17.85±0.07a |
10.65±0.21a |
7.45±0.07a |
6.20±0.00a |
| Total acid (%,w/v) |
0% |
0.61±0.01 |
0.56±0.02a |
0.85±0.10a |
0.83±0.11a |
0.75±0.11a |
0.77±0.03a |
| 2% |
0.53±0.01a |
0.84±0.10a |
0.92±0.04b |
0.78±0.04a |
0.76±0.01a |
| 3% |
0.54±0.00a |
0.79±0.01a |
0.93±0.00b |
0.78±0.00a |
0.76±0.01a |
| 5% |
0.66±0.09 |
0.98±0.09b |
0.87±0.01ab |
0.78±0.01a |
0.74±0.04a |
| 1% |
0.54±0.01a |
1.07±0.02b |
0.92±0.01b |
0.75±0.01a |
0.71±0.04a |
| pH |
0% |
3.95±0.01 |
4.13±0.14ab |
3.90±0.07ab |
3.71±0.11ab |
3.68±0.11b |
3.60±0.11a |
| 1% |
3.84±0.13a |
3.84±0.02ab |
3.71±0.13ab |
3.56±0.12a |
3.65±0.12ab |
| 2% |
4.36±0.22b |
3.72±0.03a |
3.59±0.07a |
3.49±0.04a |
3.66±0.04ab |
| 3% |
4.08±0.25ab |
3.74±0.02a |
3.80±0.04b |
3.58±0.04a |
3.72±0.04b |
| 5% |
4.00±0.06a |
4.05±0.24b |
3.67±0.11ab |
3.54±0.02a |
3.73±0.02b |
Download Excel Table
MBA 포도주의 알코올 및 휘발산 함량
송이줄기를 농도별로 첨가해 제조한 MBA 포도주의 품 질을 측정한 결과를 Table 2에 나타내었다. 알코올 도수는 9.8~10.0%를 나타내었고, 통계적으로 유의적인 차이는 없 었다. 송이줄기를 첨가한 MBA 포도주의 휘발산 함량은 82.5~90.6 mg/L 범위 내에 있었으며, 5% 송이줄기를 첨가 한 포도주의 휘발산 함량이 0%, 1% 송이줄기를 첨가한 와인보다 낮았다. 포도주의 휘발산은 대부분 초산에 의한 것으로 초산은 일반적으로 효모발효 과정에서 아세트알데 히드 산화를 통해 생성되거나, 초산균의 오염에 의해 포도 주의 발효나 저장 중에 포도주에 생성된다. 일반적으로 포 도주에서 초산의 함량은 0.4~0.5 g/L을 초과하지 않아야 하며(17-19), 그 이상의 함량에서는 포도주의 품질에 나쁜 영향을 미치는 것으로 보고되고 있다. 따라서 포도주에 휘 발산 함량이 많다는 것은 발효나 숙성 중에 이상발효가 진행되었다는 것을 간접적으로 알 수 있는 지표가 된다(20). Pastorkova 등(21)은 와인을 변질시키는 효모와 acetic acid bacteria에 대한 grape phenolics의 성장저해효과에 관한 연 구에서 다양한 phenolic compounds (phenolic acids, stilbenes, flavonoids) 그룹에서 stilbenes 계열은 pterostilbene, resveratrol이, flavonoids에서는 luteolin이 강력한 저해효과 를 나타내었고, phenolic acids에서는 myricetin, p-coumaric, ferulic acids가 선택적 저해효과를 나타낸다고 하였다. 본 실험에서 송이줄기가 첨가된 MBA 포도주의 phenolic 성분 을 HPLC로 분석한 결과(Table 3) resveratrol뿐 아니라 다양 한 폴리페놀 성분이 검출되었으며, 송이줄기 첨가 농도가 증가할수록 phenolic 성분의 함량도 증가하였다. 이들 phenolic 성분의 존재는 포도주의 변패 미생물의 성장에도 충분히 저해효과를 나타낼 것으로 사료된다.
Table 2.
Quality character istics of wine supplemented with Muscat Bailey A grape fruit stem
| Sample (%) |
Total acid (%) |
pH |
Red color |
Total anthocyanin (mg/L) |
Total pholyphenol (mg/L) |
Tannin (mg/L) |
Alcohol (%,v/v) |
Volatile acid (mg/L) |
| 0% |
0.78±0.06b1) |
3.84±0.06b |
0.80±0.02a |
786±6.39a |
831±6.35ab |
1121±53.07a |
10.0±0.00a |
90.6±1.60b |
| 1% |
0.74±0.02a |
3.61±0.03a |
0.80±0.01a |
767±11.61a |
828±4.17a |
1217±11.48a |
10.0±0.00a |
90.1±1.10b |
| 2% |
0.73±0.00a |
3.73±0.06ab |
0.87±0.02a |
790±7.73a |
882±10.9bc |
1431±7.17b |
9.9±0.10a |
83.9±3.10a |
| 3% |
0.72±0.01a |
3.67±0.06ab |
0.87±0.04a |
789±11.75a |
895±5.81c |
1626±87.50c |
9.8±0.00a |
83.8±1.40a |
| 5% |
0.72±0.00a |
3.74±0.16ab |
0.85±0.01a |
816±22.11a |
905±24.7c |
1763±14.34c |
10.0±0.00a |
82.5±1.10a |
Download Excel Table
Table 3.
Gallic acid, catechin, ferulic acid, and resveratrol contents during the fermentation of must supplemented with Muscat Bailey A fruit stem, and of wine
| Compounds |
Fermentation days |
Wine |
| 0 |
1 |
4 |
6 |
8 |
10 |
| 0% |
ND1) |
0.33±0.04a2) |
0.30±0.05a |
1.73±0.00a |
1.77±0.16a |
2.32±0.22a |
1.96±0.13a |
| 1% |
ND |
0.25±0.02a |
0.31±0.01a |
2.05±0.10ab |
1.66±0.17a |
2.31±0.06a |
2.11±0.09a |
| 2% |
ND |
0.36±0.07a |
0.45±0.02ab |
2.32±0.17b |
2.09±0.22ab |
2.97±0.04b |
2.66±0.19b |
| 3% |
ND |
0.33±0.02a |
0.58±0.02b |
2.87±0.01c |
2.38±0.38ab |
3.07±0.03b |
2.91±0.09bc |
| 5% |
ND |
0.62±0.09b |
0.64±0.13b |
2.81±0.07c |
2.77±0.25b |
3.28±0.24b |
3.37±0.07c |
| 0% |
ND |
ND |
ND |
4.29±0.09a |
4.81±0.50a |
8.16±0.38a |
8.68±0.52ab |
| 1% |
ND |
ND |
ND |
5.34±0.33b |
5.38±0.20a |
10.27±0.13ab |
9.60±0.52ab |
| 2% |
ND |
ND |
ND |
5.47±0.07b |
9.13±2.20a |
14.22±0.08b |
7.65±0.00a |
| 3% |
ND |
ND |
ND |
7.11±0.38c |
9.52±1.86a |
15.58±0.71b |
10.89±0.00bc |
| 5% |
ND |
ND |
2.79±0.34 |
8.01±1.35c |
17.68±0.75b |
23.08±3.07c |
13.41±1.44c |
| 0% |
ND |
0.37±0.06a |
0.62±0.16a |
1.26±0.04a |
1.33±0.05a |
1.51±0.28a |
0.91±0.12a |
| 1% |
ND |
0.42±0.01a |
0.72±0.33a |
1.41±0.06a |
1.12±0.05a |
1.19±0.00a |
0.97±0.11a |
| 2% |
ND |
0.45±0.02a |
0.73±0.41a |
1.28±0.02a |
1.38±0.12a |
1.49±0.04a |
1.04±0.04a |
| 3% |
ND |
0.44±0.04a |
0.56±0.06a |
1.48±0.09a |
1.29±0.16a |
1.51±0.02a |
1.10±0.04a |
| 5% |
ND |
0.40±0.06a |
0.61±0.07a |
1.45±0.14a |
1.66±0.05a |
1.59±0.03a |
1.16±0.04a |
| 0% |
ND |
ND |
ND |
ND |
0.76±0.19a |
1.38±0.19a |
0.23±0.02a |
| 1% |
ND |
ND |
ND |
ND |
0.97±0.32a |
1.35±0.19a |
0.61±0.09a |
| 2% |
ND |
ND |
ND |
0.62±0.13a |
1.41±0.05ab |
2.62±0.36b |
1.77±0.26b |
| 3% |
ND |
ND |
ND |
1.37±0.04b |
2.26±0.36b |
2.87±0.16b |
2.06±0.12b |
| 5% |
ND |
ND |
ND |
1.38±0.03b |
3.33±0.29c |
3.27±0.42b |
3.06±0.08c |
Download Excel Table
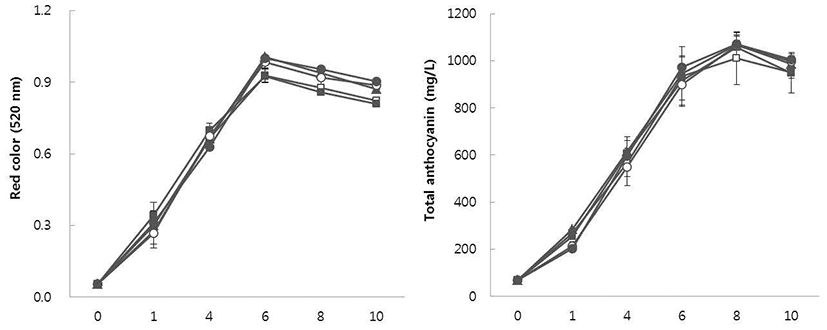
MBA 발효액 및 포도주의 적색도 및 총안토시아닌 함량
포도주의 적색도와 안토시아닌 함량은 품질을 평가하는 중요한 요소로서 적포도주의 경우 적당한 농도의 붉은 색상 이 요구된다. 또한 적색도는 육안으로 보이는 색깔의 진하 기를 나타내는 것으로 포도주에 함유되어 있는 안토시아닌 의 함량에 좌우된다. 적포도주에 보여지는 실제 색은 다양 한 종류의 안토시아닌과 상이한 색의 특성을 가진 안토시아 닌 관련 색소의 결합에 의한 결과이다(22). 송이줄기를 농도 별 처리한 MBA 발효액의 발효 중 적색도와 총안토시아닌 의 변화를 살펴본 결과는 Fig. 1과 같다. 발효 중 발효액의 초기 적색도는 0.05(520 nm)에서 발효과정을 거치며 발효 6일에 0.93~1.00의 값을 나타내다 이후 감소하는 경향을 보였으며, 발효액의 총안토시아닌 함량은(Fig. 1) 모든 처리 에서 발효 8일까지 증가(1,012~1,069 mg/L)하다가 10일 이후 감소하는 경향을 보였다. 포도주에서 적색도는(Table 2) 0.80~0.87(520 nm)의 값을 나타내었고, 포도주의 총안토 시아닌 함량은(Table 2) 발효액의 발효 단계일 때보다 낮은 함량을 보였으며, 처리별 비교에서는 유의적인 차이는 없 지만 평균값으로 송이줄기 5%를 첨가한 포도주가 800~ 832 mg/L로 가장 높았다. 발효 중 발효액이나 포도주의 안토시아닌 함량은 발효와 숙성과정 중 산화되거나 단백 질, 펙틴질과 결합하여 침전되어 제거되기 때문에 총안토 시아닌 함량이 감소하지만 숙성 중 폴리페놀류와 결합에 의해 안정화되면서 적색을 오래 유지할 수 있게 된다 (23,24). 일반적으로 한국산 포도주는 외국산 포도주에 비 해 적색도나 안토시아닌 함량이 낮다. Chang 등(25)의 외국 산 포도주와 한국산 포도주의 품질 비교 연구를 보면 외국 산 포도주의 적색도는 보통 0.6~1.3(520 nm)의 값을 나타 내고, 총안토시아닌 함량은 200~600 mg/L를 나타내지만 한국산 포도주의 경우 적색도가 0.6(520nm) 미만의 값을 나타내는 포도주가 많았다. 그러나 개량머루로 제조한 포 도주나 블렌딩한 경우 1,000 mg/L 이상의 총안토시아닌 함량을 나타내는 경우도 있다. 본 실험에서는 MBA 포도를 양조를 위한 목적으로 착과량을 조절한 후 포도주를 제조하 였기에 적색도나 총안토시아닌 함량이 일반 포도주에 비해 높게 나타났다. 포도주의 적색을 강화하기 위한 Bautista- Ortin 등(24)의 보고에 따르면, 포도주의 적색을 안정시키기 위해서는 maceration 시간 및 폴리페놀 함량이 중요하다 고 보고하였다. Maceration 시간과 관련된 실험에서는 적당 한 maceration 시간은 포도주에 색이 충분히 추출되게 하여 포도주의 색 강화와 안정성에 필요하며, 폴리페놀함량과 관련된 실험에서는 높은 폴리페놀 함량이 포도주의 색을 숙성·저장 중 안정적으로 유지시켜 준다고 보고하였다. Sun 등(26)은 stem-contact 및 non-stem-contact wine의 phenolic 성분에 관한 연구에서 stem-contact wine이 procyanidin 함량이나 총폴리페놀 함량이 높지만 적색도와 총안토시아닌 함량은 낮다고 보고하였다. 그러나 본 실험 에서는 농도별 송이줄기 첨가에 따른 유의적인 차이는 없지 만 5% 송이줄기를 첨가한 포도주의 총안토시아닌 평균 함량이 높은 것은 폴리페놀 함량이 다른 처리에 비해 높으 므로 폴리페놀에 의해 포도주의 색이 안정적으로 유지되었 기 때문이라 사료된다.
Fig. 1.
Changes in the red color , and total anthocyanin contents dur ing the fermentation of must supplemented with Muscat Bailey A grape fruit stem. □, no added stem; ■, added of 1% stem; ▲, added of 2% stem; ◯, added of 3% stem; ●, added of 5% stem.
Download Original Figure
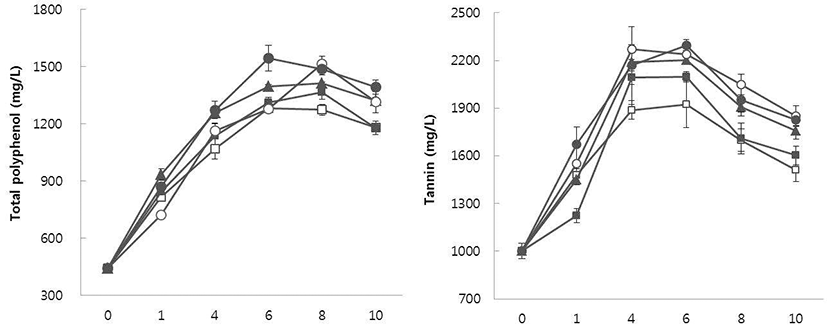
MBA 발효액 및 포도주의 총폴리페놀 및 탄닌 함량
송이줄기를 농도별 처리한 MBA 발효액의 총폴리페놀 및 탄닌 함량은 Fig. 2에 나타내었다. 발효 중 총폴리페놀 및 탄닌 함량은 발효 6일에서 8일까지 증가하는 경향을 보이다 10일 이후 감소하였다. MBA 포도주의 총폴리페놀 함량은 Table 2에서와 같이 1% 송이줄기 첨가 포도주가 무처리 포도주와 유의적인 차이는 없지만 최저 함량인 828 mg/L를, 5% 송이줄기를 처리한 포도주에서 최고 함량인 905 mg/L을 나타내었다. 포도주의 탄닌 함량은(Table 2) 저장 중 중합체의 형성이나 침전 등으로 인해 발효 완료 시 발효액에 존재하는 탄닌 함량보다 감소하였으나, 송이 줄기 첨가량이 증가할수록 탄닌 함량도 유의적으로 증가하 는 경향을 보였다.
Fig. 2.
Changes in the total polyphenol and tannin contents dur ing the fermentation of must supplemented with Muscat Bailey A grape fruit stem. □, no added stem; ■, added of 1% stem; ▲, added of 2% stem; ◯, added of 3% stem; ●, added of 5% stem.
Download Original Figure
포도 품종, 포도주 제조 기술은 포도주의 페놀 화합물의 농도에 상당히 영향을 미칠 수 있다. Kantz 등(27)은 stem-contact 발효에 의해 만들어진 포도주가 stem-contact 없이 발효된 포도주보다 훨씬 높은 고분자 페놀이 포함되어 있다고 보고하였고, Auw 등(28)은 일부 적포도주와 주스의 페놀 성분과 색에 관한 다양한 가공처리(immediate press, hot press, skin fermentation)의 효과를 검증했을 때 과즙을 즉시 착즙한 포도주와 주스의 페놀 화합물(phenolic acids, catechins, dimeric procyanidins)이 가장 낮은 반면 skin fermentation 포도주가 hot press 포도주나 주스보다 페놀화 합물의 함량이 대부분 높다고 보고하였다.
MBA 발효액 및 포도주의 생리활성 물질
농도별 송이줄기를 첨가한 MBA 발효액 및 포도주의 생리활성 물질을 HPLC로 측정한 결과는 Table 3과 같이 gallic acid, catechin, ferulic acid, trans-resveratrol이 측정되 었다. 특히 catechin(8.16~23.08 mg/L) 함량이 다른 생리활 성 물질보다 높았으며 gallic acid(2.32~3.28 mg/L), transresveratrol( 1.38~3.27 mg/L) 및 ferulic acid(1.51~1.59 mg/L) 순서로 함량이 높았다. Apostolou 등(29)은 다양한 Vitis vinifera 포도 품종의 줄기에 존재하는 폴리페놀 성분 과 함량을 분석한 결과 본 실험과 유사하게 catechin 함량이 가장 높고 다음으로 gallic acid, trans-resveratrol 및 ferulic acid 함량이 높은 순으로 나타났다. 발효 중 발효액의 생리 활성 물질은 발효가 진행될수록 발효액 내로 많이 추출되었 고, 송이줄기 첨가량이 많을수록 함량이 높아지는 것으로 나타났다. 포도주에서 생리활성 물질의 함량은 발효 완료 시 발효액에서 보다 낮은 함량을 나타내었는데 이는 발효 중 포도주에 존재하는 단백질, 펙틴질 등의 물질과 결합에 의해 침전되었거나, 또는 중합체 등의 형성으로 함량이 낮 아진 것으로 사료된다.
MBA포도의 송이줄기에는 다른 품종에 비해 레스베라 트롤 함량이 월등히 많은데(11), 레스베라트롤은 식물 조직 에서 coumaroyl-CoA와 malonyl-CoA로부터 stilbene synthase 에 의해 합성되며, 산화와 중합 과정을 거치면서 viniferin으 로 전환되는데 레스베라트롤은 미생물에 대한 독성이 강하 지 않은 반면 viniferin은 실질적인 항균 활성을 가진다고 보고하였다(30). Stilbene synthase에 의해 합성된 레스베라 트롤을 기본 모체로 하여 이에 배당체화(glycosylation), 수 산화(hydroxylation), 메톡시화(methoxylation) 또는 중합 등 의 유도체화 반응이 가해져 합성되는 stilbene 화합물은 식 물에서 수십 종류가 발견되었다(31). Stilbene 화합물의 생 물 활성은 부분적으로는 항산화 활성에 기인하는데(32), 레스베라트롤의 배당체 또는 수산화 유도체는 레스베라트 롤 그 자체보다 강한 항산화 활성을 나타낼 뿐만 아니라 (32,33), 당 또는 수산기의 결합에 의해 안정성이나 체내 이동성이 더욱 증대되는 것으로 알려져 있다(32,34). 본 실 험에서 송이줄기의 첨가량이 증가할수록 포도주에 존재하 는 레스베라트롤의 함량도 증가하였기에 다른 종류의 폴리 페놀과 더불어 포도주의 항산화 활성에 크게 기여하리라 판단된다.
Ferulic acid는 식물의 세포벽에 풍부하게 존재하는 성분 으로 포도의 과피, 종자 및 줄기에서 다양하게 검출되며, 식물의 세포벽을 형성하는 리그닌의 전구체로서 매우 강한 항산화 작용이 있으며, 그 효과는 활성산소의 독성으로부 터 생체를 방어하는 super oxide dismutase(SOD)와 같은 것으로 알려져 있다(35). Ferulic acid와 관련된 생리활성 실험에서 Cheng 등(35)은 신체의 퇴행성 과정과 관련된 nucleus pulposus(NP) 세포를 과산화수소로 유도된 산화스 트레스 하에서 NP세포를 손상시킨 후 손상된 NP세포에 ferulic acid가 미치는 영향을 조사한 결과 ferulic acid를 500 μM 처리 시 세포의 기능이 일부 회복되었다고 보고하였다. 특히 활성산소종에 의해 발생하는 질병을 막기 위해 일반적 으로 비타민 C나 비타민 E 등의 항산화제가 많이 사용되지 만 이들은 장기간 치료에는 비교적 불안정하나, ferulic acid 는 장기간 치료에도 안정하며 강한 항산화력을 갖고 있다고 보고하였다(35).
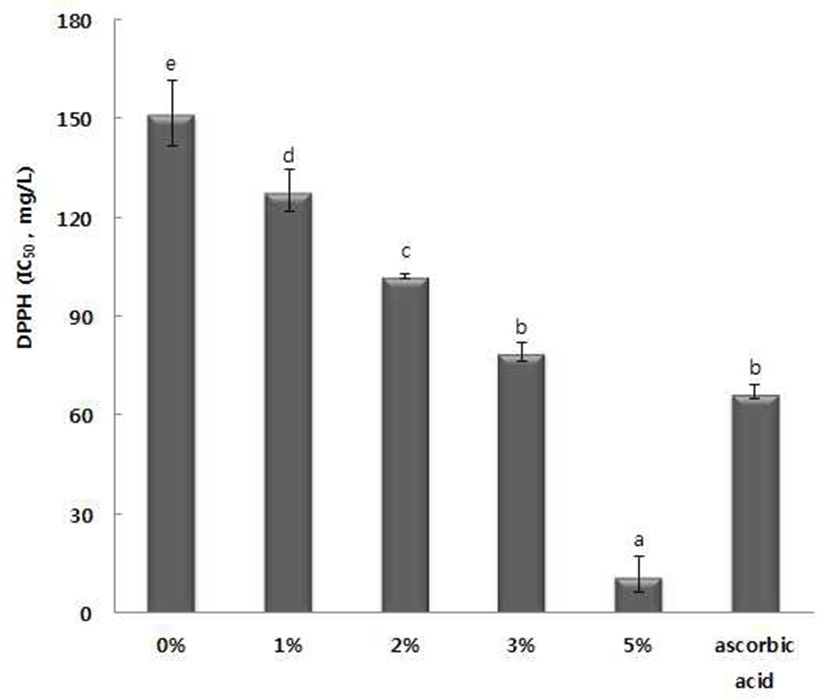
MBA 포도주의 항산화활성 측정
송이줄기를 첨가한 포도주의 항산화활성은 DPPH IC50 (DPPH radical 용액을 약 50% 감소시키는 산화방지제 농도) 으로 나타내었고 ascorbic acid가 DPPH radical 용액을 50% 감소시키는 농도와 비교하였다(Fig. 3). 포도주에서 IC50 값 은 송이줄기를 첨가하지 않은 포도주에서 152 mg/L를, 1, 2, 3 및 5%를 첨가한 포도주는 각각 128, 102, 79, 12 mg/L의 DPPH IC50 소거활성을 나타내었다. 특히 5% 송이줄기를 첨가한 포도주는 ascorbic acid의 IC50 값인 67 mg/L의 농도 보다 낮은 농도에서 강한 항산화활성을 보였다. Cabrera 등(36)은 Campbell Early 포도주스 제조 시 포도씨와 줄기를 첨가한 실험에서 씨와 줄기를 혼합 첨가한 주스의 총폴리페 놀, 총안토시아닌, 총플라보노이드 함량 및 항산화활성이 높으며, 관능검사 결과에서는 처리별 맛의 차이가 없다고 보고하였다. Chang 등(37)은 발효전 포도 발효액을 온도별 (50~70°C) 열처리한 포도주의 폴리페놀 함량과 항산화활 성을 측정하였을 때 70°C열처리한 포도주의 폴리페놀 함량 과 항산화활성이 가장 높다고 보고하였다. Atanackovic 등 (38)의 연구에서도 포도 품종별(Merlot, Cabernet Sauvignon, Pinot Noir, Prokupac) 다양한 전처리(60°C에서 1시간 열처 리 또는 80°C에서 3분 열처리 후 발효처리, 과즙을 30% 또는 50% 제거 후 발효처리)를 한 포도주의 폴리페놀 함량 과 항산화활성을 측정한 결과 대부분의 품종에서 60°C에서 1시간 열처리 후 발효한 포도주의 폴리페놀 함량과 항산화 활성이 높은 것으로 나타났다. 일반적으로 포도로 만들어 진 한국산 포도주는 외국산 포도주에 비해 폴리페놀 함량이 낮다고 보고되고 있는데(25), 포도주 제조 시 버려지는 송이 줄기를 포도주 발효 시 이용한다면 폴리페놀 함량을 증가시 킬 by-product로 충분히 이용가능하리라 사료된다.
Fig. 3.
Electron donating ability (EDA) values of wine supplemented with Muscat Bailey A grape fruit stem.
Download Original Figure
현재까지 천연물로부터 분리된 항산화제로 가장 잘 알려 진 화합물은 flavonoid류이며, 이외에 축합형 탄닌류에 속하 는 catechin, epicatechin, epicatechine gallate, phenylpropanoid 류의 ateoside, poliumoside, bradioside, triterpen류의 lupeol, celastrol 등이 보고되어 있다(39). 포도에서 카테킨, 레스베 라트롤 등과 같은 주요 항산화 성분은 비가식부위에 많은 함량이 존재하므로 이를 포도주 가공에 이용했을 때 다양한 폴리페놀 성분이 함유된 고기능성 포도 가공품을 제조할 수 있다. 이는 최근 국민의 생활수준 향상으로 식품의 소비 구조가 단순한 형태의 식품 소비가 아닌 건강기능성 식품에 대한 수요에 부합할 수 있는 가공이용 방법이 될 것으로 사료된다.
요 약
이전 연구에서 포도 품종별 및 부위별 생리활성 물질을 분석한 결과 MBA 품종의 송이줄기 부위에서 transresveratrol 함량이 다른 품종에 비해 수십배 높았다. 이를 바탕으로 포도주 제조 시 버려지는 비가식 부위인 송이줄기 를 농도별로 첨가해 발효 중 발효액 및 포도주의 폴리페놀 함량을 조사하였다. 송이줄기 첨가량에 따른 발효액의 발 효 중 적색도, 총안토시안 함량, 총폴리페놀 및 탄닌 함량은 발효후기로 갈수록 송이줄기 첨가에 따라 유의적으로 증가 하였고, 포도주에서도 같은 경향을 보였다. 반면 포도주의 휘발산 함량은 송이줄기 첨가량이 증가할수록 감소하는 경향을 보였다. 발효액 및 포도주의 폴리페놀 성분을 분석 한 결과 catechin(8.16~23.08 mg/L)함량이 가장 높았으며 gallic acid(2.32~3.28 mg/L), trans-resveratrol(1.38~3.27 mg/L)및 ferulic acid(1.51~1.59 mg/L) 순서로 함량이 높았 다. MBA 포도주의 항산화활성을 DPPH IC50로 측정한 결과 송이줄기 함량에 비례해 활성이 증가하였으며, 송이줄기 5% 첨가한 포도주(12 mg/L)는 ascorbic acid의 DPPH IC50 (67 mg/L)보다 낮은 농도에서 높은 항산화활성을 나타내었 다.
감사의 글
본 연구는 농촌진흥청 기관고유사업(No. PJ00854302)의 지원을 받아 수행되었다.
REFERENCES
Scalbert A, Williamson G. Dietary intake and bioavailability of polyphenols. American Soc Nutrition. 2000; 130:2073-2085


Bautista-Ortín AB, Fernández-Fernandez JI, López-Roca JM, Gómez-Plaza E. The effects of enological practices in anthocyanins, phenolic compounds and wine colour and their dependence on grape characteristics. J Food Comp Anal. 2007; 20:546-552.

Bub A, Watzl B, Blockhaus M, Briviba K, Liegibel U, Muller H, Pool-Zobel BL, Rechkemmer G. Fruit juice consumption modulates antioxidative status, immune status, and DNA damage. J Nutr Biochem. 2003; 14:90-98


Gomez-Cordoves MC, Gonzalez-Sanjose ML. Interpretation of color variables during the aging of red wines : relationship with families of phenolic compounds. J Agric Food Chem. 1995; 43:557-561


Park YK, Park E, Kim JS, Kang MH. Daily grapejuice consumption reduces oxidative DNA damage and plasma free radicla levels in healthy Koreans. Mutat Res. 2003; 529:77-86.

Lugasi A, Hovari J. Antioxidant properties of commercial alcoholic and nonalcoholic beverages. Nahr Food. 2003; 47:79-86


Anastasiadi M, Chorianopoulos NG, Nychas GJE, Haroutounian SA. Antilisterial activities of polyphenol rich extracts of grapes and vinification byproducts. J Agric Food Chem. 2009; 57:457-463


Careri M, Corradini C, Elviri L, Nicoletti I, Zagnoni I. Liquid chromatography-electrospray tandem mass spectrometry of cis-resveratrol and trans-resveratrol : development, validation, and application of the method to red wine, grape, and winemaking byproducts. J Agric Food Chem. 2004; 52:6868-6874.

Neuza P, Vanda P, Marques JC, Camara JS. Quantification of polyphenols with potential antioxidant properties in wines using reverse phase HPLC. J Sep Sci. 2008; 31:2189-2198.

Goldberg DM, Yan J, Diamandis EP, Karumanchiri A, Soleas G, Waterhouse AL. A global survey of trans-resveratrol concentrations in commercial wines. American J Enol Viticult. 1995; 46:159-165.

Chang EH, Jeong SM, Park KS, Lim BS. Contents of phenolic compounds and trans-resveratrol in different parts of Korean new grape cultivars. Korean J Food Sci Technol. 2013; 45:708-713


Koh JS. Laboratory manual for food analysis. 1998; Jeju University Press. p. 31-33.

Mazza G, Fukumoto L, Delaquis P, Girard B, Ewert B. Anthocyanins, phenolics and color of cabernet franc, merlot, and pinot noir wines from british columbia. J Agric Food Chem. 1999; 47:4009-4017


Folin O, Ciocalteu V. On tyrosine and tryptophane determination in proteins. J Bio Chem. 1927; 27:625-650.

Blois MS. Antioxidant determination by the use of a stable free radical. Nature. 1958; 181:1199-1201


Chang EH, Jeong ST, Jeong SM, Roh JH, Park KS, Park SJ, Chio JU. Deacidification effect of Campbell Early must via carbonic maceration : effect of enzyme activity associated with malic-acid metabolism. Korean J Food Preserv. 2011; 18:795-802


Drysdale GS, Fleet GH. Acetic acid bacteria in some Australian wines. Food Tech Australia. 1985; 37:17-20.

Eglinton J, Henschke P. The occurrence of volatile acidity in Australian wines. Australian New Zealand Grapegrower Winemaker. 1999; 426:7-12.

Eglinton J, Henschke P. Restarting incomplete fermentations : the effect of high concentrations of acetic acid. Australian J Grape Wine Res. 1999; 5:71-78


Chang EH, Jeong ST, Park KS, Yun HK, Roh JH, Jang HI, Choi JU. Effect on wine quality of pre-treatment of grapes prior to alcohol fermentation. Korean J Food Preserv. 2008; 15:824-831.

Pastorkova E, Zakova T, Landa P, Novakova J, Vadlejch J, Kokoska L. Growth inhibitory effect of grape phenolics against wine spoilage yeasts and acetic acid bacteria. Inter J Food Microbi. 2013; 161:209-213


Rentzsch M, Quast P, Hillebrand S, Mehnert J, Winterhalter P. Isolation and identification of 5-carboxy-pyranoanthocyanins in beverages from cherry (Prunus cerasus L.). Innovat Food Sci Emerg Tech. 2007; 8:333-338


GR FenwickCL CurlNM GriffithsPK HeaneyKR Price Bitter principles in food plants. In: Rouseff RL, editor. Bitterness in Foods and Beverages, Developments in Food Science. Amsterdam, Nederland: Elsevier Science Publishers. 1990; p. 205-250.

Bautista-Ortin AB, Fernandez-Fernandez JI, Lopez-Roca JM, Gomez-Plaza E. The effects of enological practices in anthocyanins, phenolic compounds and wine colour and their dependence on grape characteristics. J Food Comp Anal. 2007; 20:546-552.

Chang EH, Jeong ST, Park KS, Yun HK, Roh JH, Jang HI, Choi JU. Characteristics of domestic and imported red wines. Korean J Food Preserv. 2008; 15:203-208.

Sun B, Spranger I, Roque-do-Vale F, Leandro C, Belchior P. Effect of different winemaking technologies on phenolic composition in tinta miuda red wines. J Agric Food Chem. 2001; 49:5809-5816


Kantz K, Singleton VL. Isolation and determination of polymeric polyphenols in wines using Sephadex LH-20. American J Enol Vitic. 1991; 42:309-315.

Auw JM, Blanco V, O'keefe SF, Sims CA. Effect of processing on the phenolics and color of Cabernet Sauvignon, Chambourcin and Noble wines and juices. American J Enol Vitic. 1996; 47:279-286.

Apostolou A, Stagos D, Galitsiou E, Spyrou A, Haroutounian S, Portesis N, Trizoglou I, Hayes AW, Tsatsakis AM, Kouretas D. Assessment of polyphenolic content, antioxidant activity, protection against ROS-induced DNA damage and anticancer activity of Vitis vinifera stem extracts. Food Chem Toxicol. 2013; 61:60-68


Pezet R, Gindro K, Viret O, Spring JL. Glycosylation and oxidative dimerization of resveratrol are respectively associated to sensitivity and resistance of grapevine cultivars to downy mildew. Physiol Mol Plant Pathol. 2004; 65:297-303


Chong J, Poutaraud A, Hugueney P. Metabolism and roles of stilbenes in plants. Plant Sci. 2009; 77:143-155.

Fabris S, Momo F, Ravagnan G, Stevanato R. Antioxidant properties of resveratrol and piceid on lipid peroxidation in micelles and monolamellar liposomes. Biophys Chem. 2008; 135:76-83


Lorenz P, Roychowdhury S, Engelmann M, Wolf G, Horn TFW. Oxyresveratrol and resveratrol are potent antioxidants and free radical scavengers : effect on nitrosative and oxidative stress derived from microglial cells. Nitric Oxide. 2003; 9:64-76


Regev-Shoshani G, Shoseyov O, Bilkis I, Kerem Z. Glycosylation of resveratrol protects it from enzymic oxidation. Biochem J. 2003; 374:157-163


Cheng YH, Yang SH, Yang KC, Chen MP, Lin FH. The effects of ferulic acid on nucleus pulposus cells under hydrogen peroxide-induced oxidative stress. Proc Biochem. 2011; 46:1670-1677


Cabrera SG, Lee YR, Kim ST, Moon KD. Influence of additions of seeds and stems on the properties of processed Campbell grape juice. Korean J Food Preserv. 2007; 14:256-262.

Chang EH, Jeong ST, Roh JH, Jeong SM, Lee HC, Choi JU. Wine quality properties with reference to the temperature of grape-must prior to fermentation. Korean J Food Preserv. 2010; 17:608-615.

Atanackovic M, Petrovic A, Jovic S, Gojkovic-Bukarica L, Bursac M, Cvejic J. Influence of winemaking techniques on the resveratrol content, total phenolic content and antioxidant potential of red wines. Food Chem. 2012; 131:513-518.

Lacopini P, Baldi M, Storchi P, Sebastiani I. Catechin, epicatechin, quercetin, rutin and resveratrol in red grape : content in vitro antioxidant activity and interactions. J Food Comp Anal. 2008; 21:589-598.